星細胞系腫瘍 astrocytic tumor
二つに分類されていて,これを用いて治療方法が決まります,
クリックすると詳しい説明に飛びます,そちらを読んだ方がいいかもしれません
星細胞腫 IDH変異型 astrocytoma IDH mutant グレード2,3,4
膠芽腫 IDH野生型 glioblastoma GBM グレード4
星の細胞?
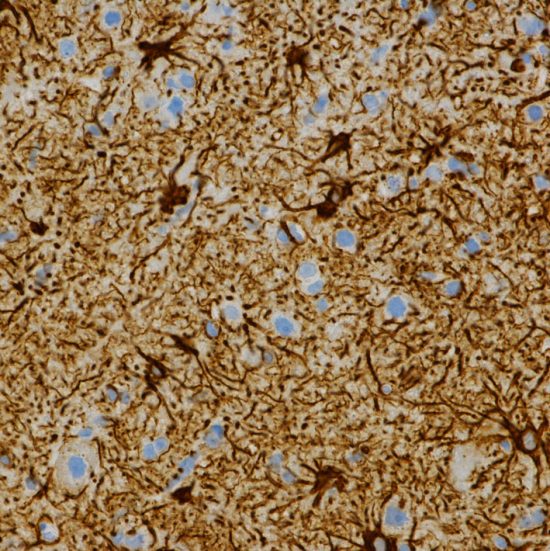
星細胞腫をGFAP染色したものです。星細胞は脳の神経細胞を支える役割をします。周囲に突起を伸ばした腫瘍細胞(濃い茶色)が,光のを放つキラキラ星のように見えます。
大まかなこと
- 星細胞系腫瘍は,神経膠腫(グリオーマ)を代表する腫瘍で脳腫瘍の約20%です
- 良性と言えるものはほとんどなく,ほぼ全てが悪性腫瘍です
- 脳の主要な構成細胞である星細胞 アストログリアから発生します
- 小児には悪性度の低いもの,高齢者には悪性度の高いものが多いです
- 膠芽腫 グレード4 は最も悪性度の高い腫瘍で,とくに高齢者の大脳半球にできます
- 退形成性星細胞腫は,悪性度でも腫瘍発生学的にもびまん性星細胞腫と膠芽腫との中間に位置します
- グレード2のびまん性星細胞腫では,10年間観察してもほとんど大きくならないという良性の経過をたどるものが稀にあります
- グレードの高い腫瘍は進行がとても早いのでどんどん症状が悪くなります
- さまざまな増大速度を示すのでそれを予想することは容易なことではありません
- 手術後3年の時点での生存割合は,退形成性性星細胞腫 グレード3の患者さんで60%程度、膠芽腫 グレード4では20%程度とされています,10年生存割合はもっと低くなります
- びまん性星細胞腫 グレード2と退形成性星細胞腫 グレード3は完全に治ることがあります
- 病理組織を見てもグレード2と3、3と4の区別ははっきりしないこともありまから,その時は,グレード2か3くらいと表現することもあります
- 脳のどこからでも発生してどの年齢にもみられますが、成人では大脳半球に多くて幼小児では脳幹部に出ることがあります
- 強い浸潤性格を示して,周囲の脳にしみ込むように発育しますからやっかいなものです
- 片方の大脳半球にとどまらず,反対側の半球や脳幹部にまでしみ込む様に広範に広がることも多いです
- 脳室の壁に沿って浸潤したり,くも膜下腔へ播種転移(ばらまかれるように広がる)したりすることもあります
- ですから星細胞系腫瘍は,開頭手術で取りきれず,手術だけでは治らないことがほとんどです
- 悪いことばかりではなくて,浸潤して広がる性質をあまり持たない限局性の星細胞腫があり,このタイプは手術できちんと取れて,治ってしまうという嬉しいものです
- だから,発見されたばかりの小さな星細胞腫は手術で全摘出をめざしましょう
- 一般的な癌との大きな違いは,星細胞系腫瘍が脳から他の臓器へ転移しないことです
- 毛様細胞性星細胞腫(グレード1)は全く違うものですから、この仲間に入りません
- また,霧がかかったように脳全体に広がるような広範囲なものをグリオマトーシス (グレード4)といいこれも2022年時点では仲間に入りません
夏目敦至が相談にのります(ここをクリック)
グリオーマについてメールで相談できます。相談フォームをクリックして開いてください。
症状
- 局所症状:腫瘍によって脳の一部が壊されたり脳が圧迫されたりしてでる運動麻痺(脱力)、感覚障害(しびれ),失語症(うまく話せない),視野障害(みずらい)、知能(おかしなことを言う,言葉数が少ない)や記憶力の低下(物忘れ),性格変化などさまざまです
- 症候性てんかん:けいれん発作も多いです,体の一部がケイレンしたりしびれたりします
- 頭蓋内圧亢進症状:大きな腫瘍が出す症状で、頭痛、吐き気、嘔吐,意識障害などです
- 水頭症と腫瘍内出血による急な意識障害や症状の悪化もあり得ます
診断
- 診断はMRIを使います
- カテーテルを用いる脳血管撮影DSAはほとんどの場合必要ありませんし,合併症もある検査なのでたとえ手術を前提としても行わないことの方が多いです
- 病理組織診断がとても難しい腫瘍ですから,脳腫瘍の診断に詳しい病理医(あるいは脳外科医)の協力も欠かせません
- IDH遺伝子変異で予後(治るかどうか)がかなり違いますから,それは必ず見ます
- 2025年時点で,IDHが野生型のびまん性星細胞腫は,膠芽腫グレード4として治療をすることが多いです(かなり異論はあります)
手術は3とおりの考え方からしっかり選ぶ
1. 生検術 biopsy
腫瘍をほんのちょっと採取して病理確定診断することです,でも定位脳手術あるいは内視鏡手術でとれた腫瘍が小さすぎると,病理診断を間違うことがしばしばあります,安全に行えるのであれば,生検術といえども小さな開頭手術にしたほうがいいでしょう,遺伝子診断も必要な時代になりました
2. 可及的切除術 maximal-safe resection
減荷手術 bulk-reduction surgery
大きな腫瘍を開頭手術で症状が出ない程度にできるだけ無理しない程度に切除する,maximal safe resectionといいます,退形成性星細胞腫と膠芽腫はほとんどこの手術になります
3. 積極的摘出術 radical resection surgery
完全摘出 complete resection あるいは肉眼的な全摘出 gross total removal で,手術だけの治癒をめざします,でも現実的には取り切れるケースは,びまん性星細胞腫 IDH-mutantの一部で限局性のものだけです
病理診断と治療の選択に用いるグレードとは
基本的なグレードは光顕所見での組織像で決めます
2022年時点での星細胞腫の分類はグレード4が加えられます
星細胞腫グレード2か3
IDH mutant, nuclear ATRX lost, CDKN2A/B retained
(古い分類では,びまん性星細胞腫グレード2と退形成性星細胞腫グレード3です)
星細胞腫グレード4 IDH変異型 (グレード 4)
IDH mutant, nuclear ATRX lost, CDKN2A/B homozygously deleted
組織学的にはグレード2に相当する所見があります
H3.3 G34-mutant diffuse hemispheric glioma (グレード 4)
膠芽腫 グレード4
IDH wild type, nuclear ATRX retained, typical histology
IDH wild type, including histologically lower grade with TERT promotor mutation or EGFR amplification or +7/-10 copy number changes
びまん性半球性グリオーマ グレード4 H3.3 G34変異型
IDH wild type, nuclear ATRX lost, H3.3 G34 mutant, age<50
IDH mutant 組織学的にグレードが低くても,グレード4のようなもの
IDH mutant, amplification events involving CDK4 and MYC, along with mutations in PIK3R1
IDH-wild typeのびまん性星細胞腫は?
- 遺伝子診断でIDH wild-type (IDH遺伝子に変異がない野生型)と診断されたdiffuse astrocytomaでは,組織診断でグレード2であっても「原則的には」グレード4 膠芽腫として治療をします
- しかし,MRIで慎重に経過を見る必要があります
- 特に,シークエンスではなく,免疫組織染色でR132をみただけでは,2割程度のIDH1変異が見落とされています
- IDH wild-type diffuse astrocytomaでも予後がとても良いものもあり区別できないからWHOは,a broad range of clinical coursesと記載しています。臨床経過から慎重に判断します
- グリオマトーシス gliomatosis (grade 4)という非常に広範囲に浸潤する腫瘍となることがあります
- IDH-mutant astrocytoma; homozygous deletion of CDKN2A/B locus (WHO grade4)はIDH変異型ですが,膠芽腫と同じ臨床像を示します
- H3.3 G34-mutant diffuse hemispheric glioma (WHO grade 4)は小児から若い成人に発生する広範囲な星細胞系腫瘍でグレード4です
手術後の治療の考え方
- 高齢者の膠芽腫はあまりにも予後が悪いので,手術を含めて一切の治療をしない方がいいこともあります(緩和ケアを選ぶ)
- 治療はグレードによって違いますから下の方を読んで下さい
- グレード3と4では放射線治療が欠かせませんから,放射線治療計画をみすえて手術計画を立てます
- 放射線治療ではサイバーナイフなどの宣伝がたくさんありますが,照射装置の違いによっての生存率のちがいは証明されていませんので,惑わされないようにしましょう
- 放射線による脳障害を避けるために,それぞれの腫瘍が周囲に広がる範囲(浸潤領域)を踏まえて,放射線をあてる領域(照射野)を決めることができるようになってきました
- 腫瘍が浸潤していないとはっきり解る部分の脳には余分な放射線を当てないという考え方で,IMRTなどの方法を用いて立体的な治療計画をたてる方法ですが,残念ながらどこでもできる方法ではありません
- 化学療法(制がん剤)はテモゾロマイド(テモダール)を使います
- 分子標的治療薬 ベバシズマブ(アバスチン)はグレード3と4の腫瘍に使用できます
- 澤村は日本でのテモダールとアバスチンの最初の治験に参加しましたo(^o^)o
びまん性星細胞腫(星細胞腫グレード2)詳しくはここをクリック
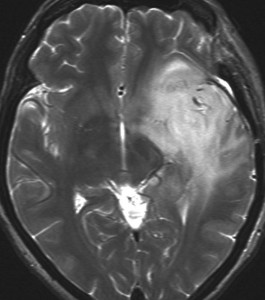
ぼーっと白くみえるのが星細胞腫です。この腫瘍はグレード2の腫瘍でした。実際にはこのMRIで白くにじんで映って見える領域より,腫瘍はさらに広い範囲に浸潤して広がっています。すごく大きいのですが,これでも無症状です。びまん性星細胞腫は脳の中にしみ込むように発育するので治療が難しいのです。手術でこれを全部とることはできません。浸潤性グリオーマ infiltrative gliomaの典型例です。
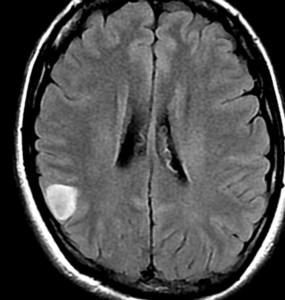
でも逆に,かなり限局性で正常脳との境界がはっきりしていて,手術で完全摘出できるびまん性星細胞腫もあります。上の例とは,病理診断が同じとは思えないくらいです。こういうのを限局性グリオーマ localized gliomaといいます。
両者ともにIDH1変異のある例でした。IDH変異型 びまん性星細胞腫 グレード2といってもかなり臨床像と治療法,予後に異なりがあります。
びまん性星細胞腫の大まかなこと
- まず治療をするべきかどうかを考えます
- 何年も経過を見てもほとんど大きくならないものもあります(実例はここをクリック)
- 診断だけをはっきりさせたい時は,生検術(腫瘍をちょびっと採る)をします
- 限局性で完全摘出できるものは,頑張って完全摘出します,それで完治することがあります
- 欧米の大きな臨床研究では,星細胞腫(グレード2)に対しての放射線治療の有効性ははっきりしませんでした
- 現在では,手術後に腫瘍が増大したとき(再燃)に45-50グレイくらいの放射線治療をするべきだと考えられています
- 残念ながら,化学療法(制がん剤)で有効性を証明されたものはありませんし,テモゾロマイドも同様です
- ですから一般的な治療は,もしできれば全部摘出する
- 手術で腫瘍が残れば経過観察で様子を見る
- 残った腫瘍が大きくなりそうな場合、45-50グレイくらいの放射線治療をするとなります
- しかし,手術で残った腫瘍が明らかに大きくなるのがわかる(強く予想される)ときもありますので,この時には,しかたがないので手術後に放射線治療に移ります
- 放射線治療がとても広い領域に必要となる場合には,放射線治療後にゆっくりですが知能(認知機能)の低下が生じることがあります
- びまん性星細胞腫は長期生存も期待できますから,放射線治療を受ける前に副作用をしっかり聞きましょう
- 病理診断でIDH1という遺伝子の変異があると治る可能性が高いとされています。
びまん性星細胞腫の例をもっと見たい人はここをクリック
退形成性星細胞腫(星細胞腫グレード3)詳しくはここをクリック
膠芽腫(グレード4)詳しくはここをクリック
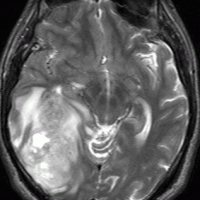
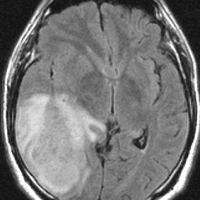
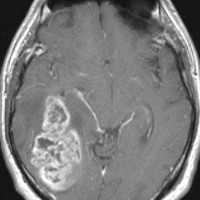
左から、T2強調画像,MRIのFLAIRフレア像,ガドリニウム増強像です。
- フレアとT2で白くぼーっとみえるところは腫瘍のある場所です。腫瘍周辺の脳浮腫も白く映ることがあります。グレード4の膠芽腫では,ガドリニウムという造影剤を使うと右側の写真のように,腫瘍の内部が白く強く増強されます。グレード3ではガドリニウムで増強されないものもあります。びまん性星細胞腫と同様に,実際にはこのMRIで映って見える領域より腫瘍は広い範囲に浸潤して広がっていると考えなければなりません。
- 放射線治療(分割照射)が欠かせない腫瘍ですから,手術後は,病理診断を手早くして放射線治療を計画します。ぐずぐずしていると手術後にまたすぐ腫瘍が大きくなってしまうこともあります。放射線治療にも施設によって技術の差がありますから,その点もしっかり考えます。また後遺症を少なくするためには余分な放射線を当てないということも大切ですが,IMRTなどの放射線治療計画をできるところは多くはありません。
- グレード3と4の星細胞系腫瘍には,手術でできる限り摘出した後に,放射線治療とテモゾロマイド化学療法(制がん剤テモダール)を用いるのが世界の標準治療です。
- 特に,手術で最大限に腫瘍を摘出できたときに治る確率は高くなりますが、脳を腫瘍と一緒に取ることになりますのでひどい後遺症を残すような手術はしません。またどのような手術手段(ナビゲーションや覚醒下手術や術中MRI)を用いても,膠芽腫が完全摘出できるということは絶対にあり得ません。
- 放射線治療は,50-60グレイくらいの線量が必要ですが、腫瘍の広がりと部位によっては腫瘍の増殖は抑制されても知能の低下などの放射線障害が出ることがあります。しかし,放射線治療をしないと長期生存は期待できません。
- テモゾロマイド(テモダール)という薬剤が使用されます。テモダールは放射線治療中に飲んで,入院治療が終ってからも外来で続けて飲む薬です。
- 退形成性星細胞腫グレード3での5年生存割合は40%程度です。また,膠芽腫グレード4の場合の平均的な生存期間は,残念ながら手術・放射線化学療法をしても15-20ヶ月くらいです。でも実際に5年以上長期生存しておられる患者さんもいますから,希望を持って適切な治療を受けましょう。
ここから下は専門医向け
星細胞系腫瘍の古いWHO分類 2016年時点
Diffuse astrocytoma (grade II), IDH mutant びまん性星細胞腫 IDH変異あり
Gemistocytic astrocytoma, IDH mutant
Diffuse astrocytoma IDH wild-type
Diffuse astrocytoma, NOS びまん性星細胞腫
Anaplastic astrocytoma (grade III), IDH mutant 退形成性星細胞腫 IDH変異あり
Anaplastic astrocytoma, IDH wild-type
Anaplastic astrocytoma, NOS 退形成性星細胞腫
Glioblastoma (grade IV), IDH wild-type 膠芽腫 IDH変異なし
Giant cell glioblastoma (grade IV) 巨細胞性膠芽腫
Gliosarcoma (grade IV) 膠肉腫
Epithelioid glioblastoma (grade IV) 類上皮性膠芽腫
Glioblastoma, IDH mutant 膠芽腫 IDH変異あり
Glioblastoma, NOS 膠芽腫
———————————————————————————————————
星細胞腫瘍という名前は付いているのですが,pilocytic astrocytoma, pyromyxoid astrocytoma, subependymal giant cell astrocytoma, pleomorphic xanthoastrocytomaは,遺伝学的にも臨床的にも全く異なるものです。臨床医はこれらをastrocytoma, anaplastic astrocytoma, glioblastomaとは別個の腫瘍群であると考えます。
- 毛様細胞性星細胞腫 pilocytic astrocytoma (WHO grade 1)
- 上衣下巨細胞性星細胞腫 subependymal giant cell astrocytoma (WHO grade 1)
- 多型黄色星細胞腫 pleomorphic xanthoastrocytoma (WHO grade 2, 3)
granular cell astrocytoma 顆粒細胞星細胞腫(ここをクリック)
極めて稀な高悪制度の星細胞系グリオーマです,別ページにあります
IDH-mutant astrocytoma
homozygous deletion of CDKN2A/B locus (WHO grade 4)
- 2016年分類では,IDH変異型の膠芽腫と呼ばれたものです
- 膠芽腫と同じ治療がなされますが,予後は極めて不良です
- Shirahata M: Novel, improved grading system(s) for IDH-mutant astrocytic gliomas. Acta Neuropathol 2018
- Brat DJ: cIMPACT-NOW update 5: recommended grading criteria and terminologies for IDH-mutant astrocytomas. Acta Neuropathol 2020
テモゾロマイドの基本的な論文
New England Journal of Medicineというとても権威の高い雑誌に膠芽腫へのテモダールの効果が発表されました。Stupp R, et al. : Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med. 2005, 352: 987-996, Hegi M, et al.: MGMT gene silencing and benefit from temozolomide in glioblastoma. N Engl J Med. 2005, 352: 997-1003
ヨーロッパとカナダで行われた臨床試験の結果です。573人の膠芽腫の患者さんは放射線治療(60グレイ)のみと放射線治療(60グレイ)とテモゾロマイドを併用する群に振り分けられて治療されました。テモゾロマイドはまず75mg/m2の量を放射線治療中に毎日飲むという方法で投与されています。それから150-200mg/m2(5日間服用,28日周期)を1コースとして6コースまで追加します。追跡期間中央値28ヶ月の時点での全生存期間中央値は,放射線治療単独群が12.1ヶ月であったのに対して,テモゾロマイドを併用した群では14.6ヶ月でした。ちょっと寂しいのですが,テモゾロマイドを併用すると2.5ヶ月の生存期間の延長が得られています。放射線とテモゾロマイドの併用群での2年生存割合は26.5%で,放射線治療単独群では10.4%でした。副作用としては7%の患者さんにグレード3-4の血液毒性が見られていますが,これはとても軽いものと評価できます。
膠芽腫の腫瘍細胞の中にMGMTという遺伝子があります。この遺伝子は化学療法の効果を消してしまう働きをするということで知られていました。MGMTという遺伝子のプロモーターの部分にメチル化がある膠芽腫をもつ患者さんの方が生命予後がよいことが判りました。プロモーターのメチル化がある膠芽腫に,放射線治療とテモゾロマイドを使った治療をすると,全生存期間の中央値は21.7ヶ月であったとのことです。ところがメチル化がないとテモゾロマイドを追加してもはっきりした効果がないようであるとも書かれています。この事実は,メチル化を調べることによってテモゾロマイドを投与した方が良いかどうかがあらかじめ判るということを示しています。
この2つの論文は,グレード3と4の星細胞系腫瘍(退形成性星細胞腫と膠芽腫)に対して,放射線治療とテモゾロマイドの併用が世界的な標準的治療として用いられるようになるというインパクトを与えました。グレード3の治療はグレード4に準じるのでそうなっているようです。もちろんテモゾロマイドの服用で得られる効果は大きなものではなくて,この2つの腫瘍型の死亡率がとても高いという事実を覆すものではありません。しかし,この30年くらいの間にほとんど何の進歩もなかった悪性星細胞腫の化学療法に大きな転機をもたらした臨床研究には違いありません。メチル化があるかないかを調べる方法は難しいし,メチル化がないからといってテモダールにかわる化学療法があるわけではないので,この遺伝子発現による治療法の選択がされるのはまだ将来のことになります。
分子標的治療薬
1995年くらいから,悪性神経膠腫(グリオーマ細胞)が成長するために必用とする分子(サイトカインなどのタンパク質や受容体)がたくさん知られてきました。今までは実験室の中でのお話でしたが,今はたくさんの薬(化学療法剤や抗体)が実際の患者さんに使用されています。臨床試験もありますが,ほとんどは欧米でのお話であり,日本では治験も始まっていません。
たとえばVEGFという腫瘍血管内皮細胞増殖因子の働きを抑えるアバスチン (avastin, ベバシズマブ, bevacizumab) という抗体です。分子標的治療の最も大きな問題は,新たに開発される薬剤の値段がとんでもなく高いことです。テモダールでも高額で使えない患者さんがいるのに,どうなるか想像がつかないくらいの医療費がかかる治療法となるでしょう。
星細胞系腫瘍では,腫瘍細胞がEGFR(上皮細胞成長因子受容体)というのをもっていると成長が早くなることがわかっています。このEGFRを抑えることで,腫瘍の増大を妨げようとする治療法の試みがあります。たくさんの治験 cetuximab, panitumumab, matuzumab, MDX-447, nimotuzumab, mAb806, erlotinib, gefitinib, EKB-569, lapatinib (GW572016), PKI-166, canertinib (CI-1033) がされましたが,2018年の段階では,はっきり有効性が確かめられてこれは使えるぞという印象のものはありません。一部で国外治験に参加できるようですがあまりお勧めできないものです。
IDH変異のある星細胞腫には,期待の新薬が登場しました。2023年に,変異型IDH阻害剤,ボラシデニブ vorasidenib(飲み薬)の臨床第3相試験の結果が発表され,無増悪生存期間の延長が証明されました,2025年には日本でも臨床使用されています
文献
ボラシデニブの臨床試験追加報告
2024年末に米国脳腫瘍学会SNOで発表がありました。INDIGOという第3相試験の追加です。ボラシデニブの追加効果として,投与すると患者さんがてんかん発作を生じる確率が下がるそうです。また腫瘍が小さくなるという効果もやはりはっきり見えることが多いとの結果です。
ボラシデニブ vorasidenibは,グレード2の星細胞腫と乏突起膠腫の無増悪生存期間を延長する:臨床第3相試験の結果
Mellinghoff IK: Vorasidenib in IDH1- or IDH2-mutant low-Grade glioma. New Engl J Med 2023
vorasidenibは、変異型IDH1/2酵素の作用を阻害する経口薬で、腫瘍の2-ヒドロキシグルタル酸(2-HG)を90%以上低下させます。経口薬ですが脳内移行がよい薬剤です。術後の残存腫瘍あるいは再燃 168例にvorasidenib (40 mg once daily) が投与されました。観察期間中央値14.2ヶ月の時点で,7割の患者さんがvorasidenibあるいはプラセボを継続服用していました。PFS中央値は,vorasidenibで27.7ヶ月,プラセボで11.1ヶ月でした。グレード3以上の有害事象は22.8%でみられ,ALTの上昇が目立ったそうです。有害事象による中止は3.6%でした。
DNAメチレーションプロファイルによるびまん性グリオーマの群別
Ceccarelli MMolecular Profiling Reveals Biologically Discrete Subsets and Pathways of Progression in DiffuseGlioma.Cell. 2016
IDH野生型びまん性グリオーマ IDH-wild-type diffuse glioma は,びまん性星細胞腫 grade II や退形成性星細胞腫 grade III だけではなく,毛様細胞性星細胞腫や膠芽腫にのこともあり得ます。でも,多くは膠芽腫となるそうです。
どうしたら治せるか将来の方向は?
Osswald M, et al.: Brain tumour cells interconnect to a functional and resistant network. Nature 528:93-98, 2015
Nature誌への報告です。星細胞系腫瘍の最大の特徴は浸潤増殖能 diffusely infiltrative growth です。腫瘍化した星細胞はとても長い細胞膜突起を伸ばしています。この特有の長いマイクロチューブを使って腫瘍細胞はネットワークを形成して,増殖して浸潤して,遠く離れた腫瘍細胞間でも相互に連絡します。マイクロチューブで連結された細胞は,放射線治療による細胞死に抵抗して細胞修復する能力を有しています。neuronal growth-associated protein 43という蛋白がマイクロチューブの形成と機能制御,浸潤,増殖,細胞間連絡,放射線抵抗性に重要な役割を担っていることが解ったという結論です。星細胞とは異なり乏突起膠細胞系腫瘍ではこのメカニズムがありません。このマイクロチューブを標的とした治療開発が期待されます。
IDH遺伝子変異がある退形成性星細胞腫の予後が良い
Yan H, et al.: DIH1 and IDH2 mutations in gliomas. N Engl J Med 360: 765-773, 2009
IDH (isocitrate dehydrogenase)という酵素の遺伝子,IDH1 (amino acid 132) とIDH2 (aminoacid R172) が多くのグリオーマで変異を生じているという論文です。グレード2とグレード3の星細胞腫,乏突起膠腫で70%くらいにある遺伝子変異であり,グレード4の膠芽腫ではグレードの低い星細胞腫から悪性化したsecondary glioblastomaのみに見られます。 IDH変異のある退形成性星細胞腫38例では生存期間中央値が65ヶ月,IDH変異のない(wild type)もの14例では20ヶ月とかなり大きな開きがありました。
退形成性星細胞腫の予後予測因子として注目するべき結果です。逆に遺伝子変異のないものでは膠芽腫と同じくらいの悪性度になりますから,将来的には星細胞系腫瘍のグレードを決めるのに使用されるのかもしれません。Duke大学が中心となった研究成果ですが,本当にこれほど大きな差があるのかどうか確認されるためにはまだ時間がかかるでしょう。
手術による完全摘出 ? が膠芽腫の生存期間を延ばす
Stummer W, et al. Extent of resection and survival in glioblastoma multiforme: identification of and adjustment for bias. Neurosurgery 62: 1025-1034, 2008, Pichlmeier U, et al. Resection and survival in glioblastoma multiforme: an RTOG recursive partitioning analysis of ALA study patients. Neuro Oncol 10: 1025-1034, 2008 (同じグループからの2つの論文です)
手術前のMRIでガドリニウム増強される部分の腫瘍がほぼ摘出できるであろうと考えられた243人の膠芽腫の患者さんが対象です。122人の患者さんで完全摘出(ガドリニウムの入る白い部分だけです)がなされて生存期間中央値は16.7ヶ月,121人の患者さんでは不完全摘出で11.8ヶ月でした。著者はOxford Center EBMのレベル2bの精度で, ガドリニウム増強される部分の膠芽腫の完全摘出が,生存期間を延長するとしています。また,RTOG-RPA(年齢,KPS(一般状態),神経症状,認知機能の評価から計算される分類)のクラス4と5の患者さんでは,完全摘出が生存期間を明らかに延長するとしています。
悪性神経膠腫の治療は,できる限りたくさんの腫瘍を切除する (cytoreductive surgery, bulk-reduction surgery) という開頭手術から始まります。でも膠芽腫をどのくらいの程度摘出したら生存期間がはっきり伸びるかということには科学的な結論がありませんでした。これらの論文ではガドリニウムで増強される部分の病変を確実に切除すると,生存期間が5ヶ月程延ばせるかもしれないという事実を示してます。
とても注意して読まなければならない論文です。おそらく結論が拡大解釈されて歩き回る可能性があるからです。利益を得られた患者さんは膠芽腫RTOG-RPAクラス4か5で,手術前のMRIから完全摘出(ガドリニウム増強部分のみ)ができるであろうと予測され,重篤な症状を出さないでそれができるという条件をもっているということです。この条件を満たした人のみにこの結論が適応され得るのです。この条件を満たす膠芽腫の患者さんは多いとはいえません。ですから,悪性神経膠腫は手術で全摘出できればより生存期間が伸びる,という大まかな言葉に入れ替えられることを恐れます。
本来,膠芽腫という腫瘍はガドリニウム増強される白い部分よりはるかに広く浸潤してるものです。腫瘍外科学で使用される完全摘出 complete removal という言葉は腫瘍のすべてが取り除かれると言うことなので,正しい意味では使用されていません。また生存期間の数ヶ月の延長はあるのでしょうが,治癒(治る)という意味では有意差は証明されていないのです。
KPS(一般状態)の悪い患者さんの生存期間が短いということもはっきりした事実です。膠芽腫の手術で最も大切なことは,治る見込みがとても低いからこそ,生存の質を落とさないような治療が必要であることです。できる限りたくさん摘出するといっても,患者さんの状態(麻痺や認知機能)を悪くするような手術はしてはなりません。真の意味での,膠芽腫の完全摘出は不可能なのですから。
グリベック Gleevec, imatinib について
Reardon DA , et al. : Phase II study of imatinib mesylate plus hydroxyurea in adult with recurrent glioblastoma multiforme. J Clin Oncol 23: 9359-9368, 2005
デューク大学が行った臨床試験の報告です。放射線治療とテモゾロマイドを使って,さらに再発してしまった膠芽腫の患者さん33人にグリベックが使われました。グリベック400mg(一日1回)とハイドレア500mg(一日2回)を飲む治療です。てんかんを止める薬を服用しているとグリベックの効果が低下するので,そのような患者さんはグリベック500mgを一日2回飲みました。この治療は外来でできますし,副作用は比較的軽い骨髄抑制(白血球や血小板の数が減る)です。脳の浮腫が悪化するかもしれないことも知られています。
結果は,3人(9%)の患者さんで腫瘍が縮小し,14人(42%)の患者さんで腫瘍の大きくなるのが一時的に止まりました。27%の患者さんで6ヶ月間は腫瘍が進行することを止めることができました。生存率の中央値は49週間と書かれていますから,半分の患者さんが1年くらいは生存したということになります。
これは再発の膠芽腫の治療としてはとても良い成績なのです。でも注意しなければならないことがあります。それは,対象となった患者さんの年齢(中央値)が52歳と若いことと症状が比較的軽い患者さんであったことです。この対象群では成績は少し良くなるのが普通です。
その後の大きな臨床試験では期待された効果はなかったようです。
放射性物質をつけた抗テナシン・モノクロナール抗体について
Reardon DA et al.: Salvage Radioimmunotherapy with Murine Iodine-131-Labeled Antitenascin Monoclonal Antibody 81C6 for patients with recurrent primary and metastatic malignant brain tumors: phase II study results. J Clin Oncol 24: 115-122, 2006
悪性神経膠腫はtenascin テナシン という組織間質蛋白をもっていてそれが81C6というモノクローナル抗体で認識されるということはずいぶん前から知られていました。その抗体に放射性ヨードをくっつけて,再発脳腫瘍を手術してその摘出腔の中に抗体をいれて治療をしようというものです。この治療の後で抗がん剤が維持療法として追加されています。Duke大学で再発した43人の悪性脳腫瘍の患者さんでの成績です。膠芽腫(グレード4)の患者さんで1年生存割合は63%,グレード3の患者さんで59%,生存期間中央値はそれぞれ64週と99週という,ちょっと驚くような良い成績です。
2006年の脳腫瘍の国際学会で会った時,この研究の中心になっているBigner先生はとても期待をもっていると話していました。今後は第2層試験や第3層試験が計画されていくとのことでした。
erlotinib Tarcevaタルセバについて
Cloughesy A et al.: J Clin Oncol, 2005 ASCO Annual Meeting Proceedings. Vol 23, No. 16S, Part I of II (June 1 Supplement), 2005: 1507
再発膠芽腫の41人の患者さんに使用して8.4%に腫瘍の縮小 (CR+PR) があったと報告されました。悪性神経膠腫(特に膠芽腫)はEGFRという受容体を細胞表面にもっていることがあります。それを介して腫瘍の増殖が旺盛になるのです。EGFR遺伝子の増幅,EGFR蛋白の産生が多い,pPKB?Aktのレベルが低いなどの膠芽腫では,erlotinibが有効かもしれないという推測があります。でも蛋白や遺伝子解析をしても臨床的効果にはあまりはっきりした差が出ていません。erlotinibは肺がん(非小細胞性)の領域で広く研究されている分子標的治療に使われる制癌剤です。肺がんに有名なgefitinib (イレッサ)も同様な考え方で使われる制癌剤です。
星細胞系腫瘍でのはっきりした臨床研究成果はまだ出ていません。
CPT-11 irinotecanについて
イリノテカンはカンプトとトポテシンという商品名の制癌剤です
Prados MD, et al: A phase 2 trial of irinotecan (CPT-11) in patients with recurrent malignant gliomas: a North American Brain Tumor Consortium study. Neuro-oncol 8: 189-193, 2006
51人の再発した膠芽腫あるいは退形成性星細胞腫の患者さんに使用されました。350mg/m2(てんかんの薬を飲んでいる人は750mg/m2)を3週間に一度静脈内投与するものです。下痢と骨髄抑制が有害事象でした。この使用方法で用いた限りではCPT-11は有効でなかったという結論です。
サリドマイドとアバスチンについて
サリドマイド (thalidomide) やアバスチン (avastin, bevacizumab) は悪性脳腫瘍が血管を作るのを妨げて腫瘍が大きくなるのを防ごうという目的で使われる制癌剤です。サリドマイドはもともと睡眠薬として使われていた薬で,IGFとかいろいろなサイトカインを抑制して腫瘍の血管が増えるのを防ぎます。アバスチンはVEGF(血管内皮細胞増殖因子)という物質の働きを抑える抗体(普通の薬とはちょっと違うもの)です。
両者ともにまだ信頼性のある臨床研究の結果はありません。患者さん個人がネットで購入して使われているというお話も聞きますがこれらの薬剤が単独で再発した悪性神経膠腫に有効とは思えませんので注意して下さい。
重要な豆知識(generous local field)
浸潤性グリオーマの放射線治療には画像で腫瘍が見える部位より,だいたい20 mmくらい外側までカバーするような局所放射線治療がなされます。これをgenerous local fieldといいますが,適切な日本語を思いつきません。1980年にHochberg先生が有名な論文を書いたことにはじまります。それまでは全脳照射40グレイという治療がanaplastic astrocytomaとglioblastomaには用いられていました。しかし,これらの悪性神経膠腫の再燃 relapseは腫瘍の存在部位から20 mm以内で起こるので,全脳照射は必要ないと論じたのです。
逆に怖いことには,この論文と有名なWalker先生の論文以来,局所照射の考え方に際立った進歩がないことです。現在は3次元原体照射(強度変調放射線治療など)が可能な時代です。明らかにそこには腫瘍浸潤はないと考えられる正常脳へは照射を避ける技術があるのにエビデンスがないからと言うことで使用されない矛盾があります。
Hochberg FH, Pruitt A. Assumptions in the radiotherapy of glioblastoma. Neurology 30: 907-11, 1980


