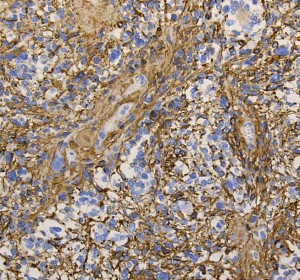
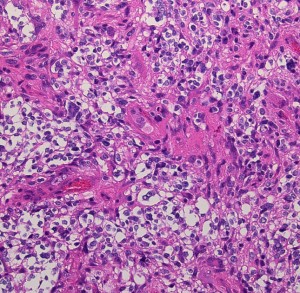
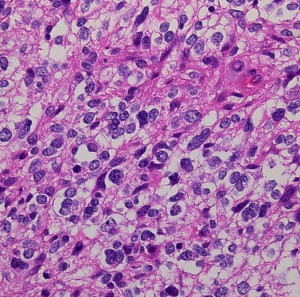
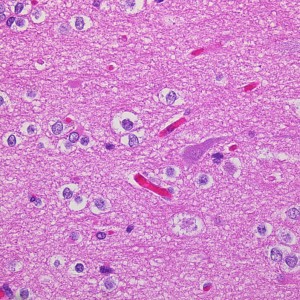
膠芽腫(こうがしゅ)IDH野生型
WHO グレード4の悪性腫瘍
- グリオブラストーマ,業界用語でグリブラといいます
- 英語では GBM (glioblastoma multiforme) ジービーエムといいます
- 脳の神経細胞を支える神経膠細胞(星細胞,未分化グリア)が腫瘍化したものです
- IDHという遺伝子には変異がない野生型 wild type です
- 大脳に発生して、周囲の脳に滲み込むように広がります(浸潤)
- 成人グリオーマ の40%くらいと頻度が高く,最も悪性の腫瘍です
- 悪性脳腫瘍の中で最も頻度の高い腫瘍です(頭蓋内腫瘍の10%弱)
- ですから,世界中で注目をあびて研究されています
- 小児ではとてもまれで,高齢者になるほど頻度が高いです
- 多くの患者さんは60歳以上です
- 2021年現在でも,5年生存割合は10%ほどです
- 平均余命は2年くらいだと考えてください
- 進行が早いのでMRIで見つかってから2週間くらいで倍くらいの大きさになってしまうこともあります
まずMRIで診断です
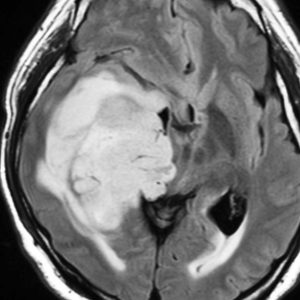
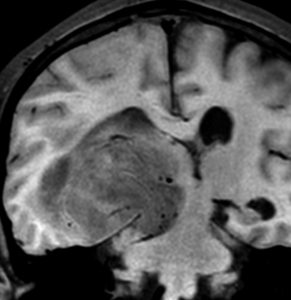
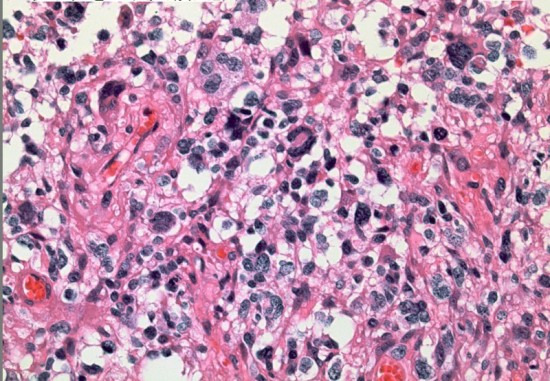
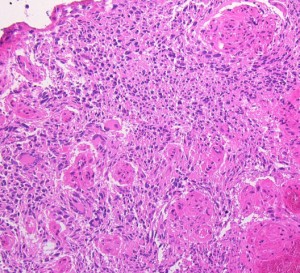
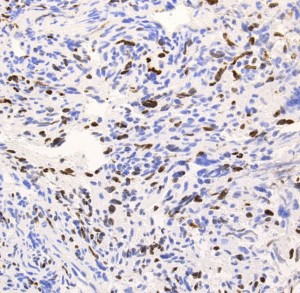
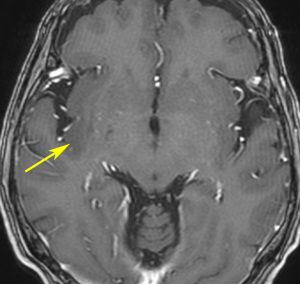
右側頭葉島の病変です。1年間の経過ではっきり増大したので,無症状でしたが生検術を行いました。病理組織では,異型グリアの増殖はありましたが,核分裂蔵,血管内皮の増生や壊死は明らかではありませんでした。しかし,遺伝子診断ではIDH1/2 野生型,ATRX retained,TERT promotor野生型,1p/19q共欠失なしでした。膠芽腫という確定病理診断です。
標準治療を加えましたが,数ヶ月後に急激な増大を呈しました。グレード4の臨床像です。MRI画像よりも病理組織像よりも,遺伝子診断の方がより性格に予後を示す例です。
病理組織像を見たら次に遺伝子診断をして確定病理診断とします
別ページに詳しく書いていますから,ここをクリック
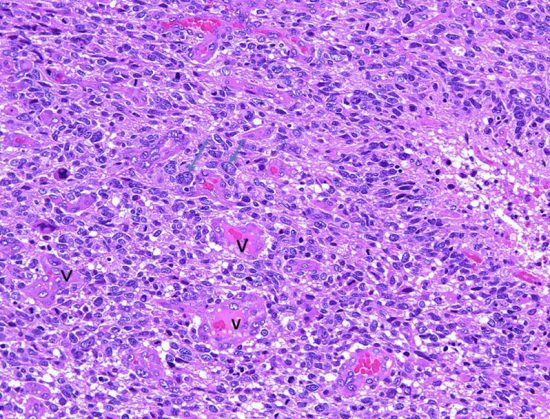
これは普通の病理組織診断です。これだけで膠芽腫という診断はつきます,
2022年時点での病理学での定義と臨床
- 組織学的には,びまん性の星細胞系グリオーマであり,血管内皮増生と壊死が特徴です
- IDHとH3遺伝子には変異がありません 野生型 wild typeといいます
- 特異的な遺伝子異常として,TERT promoter mutation, EGFR gene amplification and/or a +7/–10 cytogenetic signatureがみられます
- 組織診断で低悪性度びまん性星細胞腫でも,IDH wild typeでかつ,TERT promoter mutation, EGFR gene amplification, +7/–10 copy number changes のどれか一つがあれば,膠芽腫グレード4と診断します
- 組織診断が膠芽腫であってもIDHに変異があれば,星細胞系腫瘍グレード4に分類され,病理診断は膠芽腫としません (IDH-mutant astrocytoma, WHO grade 4, Homozygous deletion of CDKN2A/B locus)が,治療方法は膠芽腫と同じなので臨床医にとっては同じことになります
- 臨床的には,とにかく従来の病理組織診断で膠芽腫であれば膠芽腫です
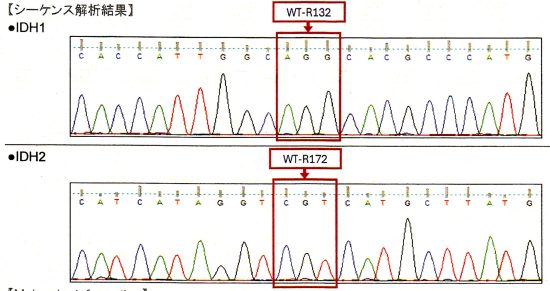
シーケンス検査の結果です,IDH遺伝子とIDH2遺伝子に変異 mutationはないので,野生型とwild typoe いいます。これで星細胞腫との鑑別が確実となります。通常の病院では,免疫組織染色という手段で野生型かどうかをみるのですが誤診の確率が低くはないので,シーケンス検査が必要です。ちなみにこの例ではさらに似たようなMRIと病理所見を示す高悪性度グリオーマを鑑別するために調べたところ,BRAF v600 wild type, H3F 3A K27 wild type, HIST H3B K27 wild type, MGMT score 0でした。
世界標準治療は,
開頭手術で可能な限り摘出して,病理診断が確定したら,放射線治療(30回分割で60グレイの局所照射)とテモゾロマイド(テモゾロミド,テモダール)化学療法を行って,退院後に外来でテモゾロマイド(月に5日間)を維持療法として追加することです
- 手術でガドリニウム増強される部分が95%以上 (70%以上という意見もある) 切除できると生存期間がのびるというのが定説です
- それ以下だと,摘出度と生命予後の関係ははっきりしない考えられます
- 右の側頭葉にできた膠芽腫は手術摘出度があがりますから,視床にできた膠芽腫よりも生存期間が長いです
- ですから,膠芽腫が発生した場所で,生命予後が大きく変わります
- 患者さんの年齢が高い(高齢者)ほど悪性の経過をだどります(予後が悪いと言います)
- 再発したときには様々な治療法が提案されていますが,これが良いと標準化された治療方法はありません
- 再発(正確には再燃 relapse といいます)すると余命は1年以内くらいです
- 余命に関係する遺伝子は,MGMTメチレーションとIDH変異なのですが,それが解っても治療法が変わるというわけではありません
- もう一つ,症例が多い病院 (high-volume hospital 年間23例以上の膠芽腫)で治療すると予後が良いことが知られていますが,日本にはそういう施設はありません
- 初発の患者さんはオプチューンという装置を使うことができます
- 高齢者や状態の悪い患者さんでは手術も何もしないで緩和ケアを選ぶこともあります
診断:MRIでの特徴
- 診断はMRI検査をします,それだけで十分です
- ガドリニウム造影剤で腫瘍の周辺が白く造影されます
- いびつな形になるのが特徴です
- しかし,ほんとうの腫瘍の広がりは,T2強調あるいはFLAIR(フレア)という画像で,白く滲むように写る部分すべてです
- 手術でガドリニウム増強される部分が全部取れると,お医者さんは全摘出できたといいますが,それは間違いです
- FLAIR画像で白く見える部分が全て取れてはじめて,画像上での全摘出と言えます
- それでもなお,隠れた腫瘍細胞は周囲に滲み込んで残っています
- カテーテルを用いる脳血管撮影はあまり役に立ちません,お金もかかりますし脳梗塞などの合併症もある侵襲的な検査です
- 入院検査の予定を立てているうちに増大してしまって,手がつけられなくなるような進行の早い腫瘍です
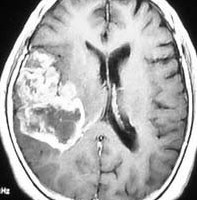
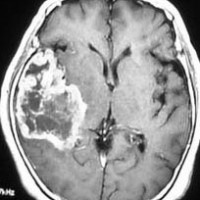
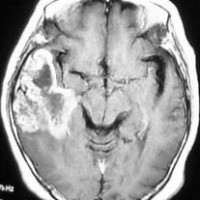
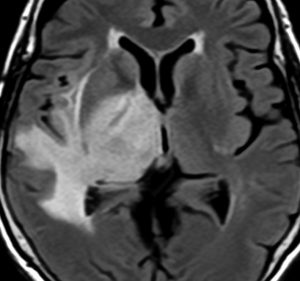
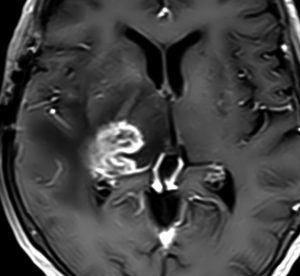
典型的な膠芽腫のガドリニウム増強画像です。右の側頭葉から発生したために目立った症状が無く,この大きさで発症しました。何となくボッとしていると言うのが訴えでした。腫瘍の周囲がガドリニウムで白く増強されて,内部は壊死で低信号(黒っぽい)になっています。
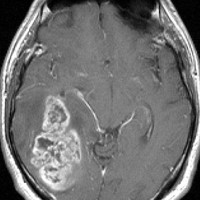
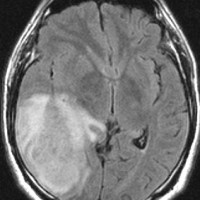
左がガドリニウム増強像で,手術ではこの部分が取れれば全摘出といわれるのですが,実際は右側のフレア画像で白っぽく見える所には腫瘍が滲み込んでいます。この部分を全て摘出してはじめて,画像上の全摘出といいます。全摘出は無理でしょう。
2021年時点で科学的に推奨度の高い治療方針:標準治療 Stuppレジメン
- 初発膠芽腫では開頭手術で症状を悪化させないように可能な限り摘出する
- 手術後に放射線治療 (60グレイ/30-33分割/6週間)をする
- 放射線治療開始と同時にテモゾロマイド (75mg/m2)の投与を開始する
- 放射線治療終了後テモゾロマイド (100-200mg/m2)の投与を6コース行う
治療に対する有効性のエビデンスレベルの高いものは,放射線治療,手術摘出,テモゾロマイド化学療法の順です。これは2005年からは世界標準治療となっています。
おそらく日本で広く行われるかもしれない治療法(初回治療のみ)
高度の悪性度を有する腫瘍であり,最大限の抵抗をするために,次のような治療法が導入されています
- 膠芽腫と画像診断されたら,できる限り早く開頭手術で可能な限り摘出します。進行が早い病気なのでここを急がないと意味がありません。
- 手術中に迅速病理診断をして,悪性神経膠腫の診断が得られれば,腫瘍を摘出してしっかり止血した後に,ギリアデルを腫瘍摘出腔に貼りつけます。最大8枚(1枚あたりBCNU 7.7mg含有)です。
- 病理確定診断を急ぎます。同時に患者さんの手術からの回復を急ぎます。また同時に放射線治療計画を行います。これは3週間以内に終えます。
- IDH遺伝子変異があってもなくても同じ治療になるので分子診断は待ちません。
- 放射線治療 (60Gy, 1.8-2Gy/day, 10Gy/week, generous local field)の開始と同時に,テモダール (75mg/m2/everyday,経口)を投与します。
- その後に,テモゾロミド (100-200mg/m2/every 4 weeks),経口投与)を6コースあるいはさらに長期に投与します。
- これらを終えてなお状態の良い患者さんではオプチューンを装着するかどうか?を考えます
ここで大切なこと
- ギリアデルの効果の臨床試験のエビデンスレベルはかなり低いです
- 2014年にアバスチンは膠芽腫の生存期間を延長しないということが逆に証明されました。2019年時点では,膠芽腫の初期治療にアバスチンを使用しない方がよいとされています。
- オプチューンを装着することに利点があると推測されるのは,診断後4ヶ月ほどが過ぎてある程度状態の良い患者さんのみで,用いることが標準治療ではありません。2017年 ヨーロッパのガイドラインは推奨しませんが,2017年 米国のNCCNはオプチューンを加えることをカテゴリー1の治療法として推奨しています。日本脳腫瘍学会ガイドラインでは,推奨グレードB(使用できるなら行うよう勧められる)としています。
これが日本でできる限界の治療手段でしょう。
オプチューンについて(ここをクリック)
世界中で,すごくたくさんの新しい治療薬が開発中ですから,膠芽腫をコントロールできる薬が出現する可能性は高いです
重要情報
アバスチンは膠芽腫の生存期間を延長しない(臨床第3相試験)
Gilbert MR, et al.: A randomized trial of bevacizmab for newly diagnosed glioblastoma. N Engl J Med 370: 699-708, 2014
AVAglio アバグリオ という国際共同研究です。Stuppレジメンにアバスチン(ベバシズマブ)を上乗せする併用治療です。60グレイ(1日あたり2Gy照射を6週間)の放射線治療中に、テモダール(1日あたり75mg/m2)連日投与、アバスチンを2週間間隔で10 mg/kg投与しました。その後は,3週間隔でアバスチンの投与を12サイクル継続しました。637人の患者さんが治療され,アバスチン使用群の無増悪生存期間 PFSは10.7ヶ月,使用しない場合は7.3ヶ月で有意差がありました。全生存期間中央値 OSは,アバスチン使用群で15.7ヶ月,使用しない場合は16.1ヶ月であり,これには有意な差はありませんでした。ここでも病勢の進行はある程度抑えられるけれども,生存期間の延長は得られないという最終成績です。さらにアバスチンを使用した群で,計画時に期待した効果は得られなかった,観察期間の延長とともに症状の悪化・生存の質 QOL の悪化・認知機能の悪化があったとの追記がありました。無増悪生存期間の延長は,アバスチンにスードプログレッションを抑制する見かけの効果があるためであって,真の抗腫瘍効果 true effect ではないという論評もあります。
Chinot OL, et al.: Bebacizmab plus radiotherapy-temozolomide for newly diagnosed gliomblastoma. N Engl J Med 370: 709-722, 2014
ヨーロッパからのもの(RTOG 0825)で,921人の膠芽腫の患者さんを対象としてアバグリオと同様の試験がされました。アバスチン使用群の無増悪生存期間 PFSは10.6ヶ月,使用しない場合は6.2ヶ月で有意差がありました。2年生存割合 2-year OSは,アバスチン使用群で33.9%,使用しない場合は30.1%であり,これには有意な差はありませんでした。アバスチンを使用したほうが,のQOLとPSの維持ができたけれども,副作用(有害事象)が多かったという結果です。アバスチンを使用しても生存期間の延長がないという結論でした。
ACNUとインターフェロン-β
ニドラン(ACNU)は1970年代から,インターフェロン-βは1980年代から日本国に認可されて数十年に亘って使用されてきました。でもこれらの薬剤が膠芽腫に有効であるというエビデンスレベルの高い科学的根拠がありません。ですから,世界では日本だけで膠芽腫に対して “有効であると信じられている” 治療薬と言っていいでしょう。こんなところでもガラパゴス化している日本と言えます。有効かどうか改めて実証するか,それともこれらの薬剤を保険診療から外すかしないと,日本の脳腫瘍学は世界に信用されなくなります。
オプチューンの評価
テモゾロマイドで初発膠芽腫の生存期間 OSが15ヶ月となったという驚きは,2005年のものでした。2015年「オプチューンを使用するとOSが20ヶ月にも伸びる!」,すごく驚きませんか?
オプチューンの臨床研究に登録された患者さんは,診断からランダム化まで3.8ヶ月かかっています。手術,病理,放射線化学療法に時間が費やされいているからです。この期間にすでに30%の患者さんで悪化 progressionがあり,これら予後の特に悪い早期増悪 early progressionを呈する膠芽腫患者さんが,登録時点で省かれているからです。
夏目敦至が相談にのります(ここをクリック)
膠芽腫についてメールで相談できます。相談フォームをクリックして開いてください。
膠芽腫の手術
膠芽腫は手術だけで治すことができない腫瘍です,手術の役割は,延命が数週間あるいは数ヶ月であるということに注意して読んでください,重い症状を出すような手術は避けます
手術の基本的考え方
減荷手術 cytoreduction surgery, bulk-reduction surgeryと言います。病理診断と時を稼ぐための手術です。膠芽腫を手術で治すという考えはしません。
開頭手術を受けたほうがいい患者さんの基準(エビデンスクラス I,推奨度 A)
70歳未満の患者さんであり,かつKPS 70以上(介助を受けないで自分の身の回りことができる)という条件があれば,開頭手術が可能であって大きな障害を出さないという条件下で,開頭手術による腫瘍摘出を受けた方がいいとされます。
摘出割合 EOR extent of resection
何%摘出できたかということです。かつてはガドリニウム造影剤で白くなる(増強される)ところを評価していましたが,2020年時点ではMRIのT2/フレア強調画像というのをみて,体積計算します。50%とか95%とか表現します。100%はあり得ないので,お医者さんから全部取れたといわれたときには,信じません。
およそ全ての腫瘍が摘出できた時にのみ生存期間の延長が得られる
大規模な臨床研究の結果,膠芽腫は手術で70-98%くらい摘出できると生命予後が伸びるとされてきました。別な言い方をすれば,腫瘍のかなりの部分が摘出できないと手術の意義は無いということでもあります。2017年,ヨーロッパのEANOガイドラインでは,Although some studies reported gradual improvement in outcome with increasing extent of resection, only gross total resection might be associated with improved outcome.と書かれてあります。たくさん取れた方がいいという報告もあるけれど,結果的に予後を良くできるのは大方全部の腫瘍がとれた時だけであろうということです。古くからのゆるぎないコンセンサスのあるところでは,95%以上の摘出で予後が改善するとの考え方が標準的です。
膠芽腫は可能な限り多くの量を摘出するという方針で良いのか?
手術でたくさん取れた方が生存期間が延びるか?
さまざまな大学で,MRI画像のガドリニウム増強される(白く写る)部分を,どの程度摘出できていると生存期間が延びるかが調査されました。2019年では,T2/FLAIRで高信号(白く映る)の部分をどの程度摘出できるかとの評価に変わっています。
- Molinaro AM: Association of Maximal Extent of Resection of Contrast-Enhanced and Non-Contrast-EnhancedTumor With Survival Within Molecular Subgroups of Patients With Newly Diagnosed Glioblastoma. JAMA Oncol. 2020
若い年齢層でガドリニウム増強される部分 CEと造影されない高信号部分 NCEをかなり積極的に摘出した場合,IDHがwild typeでも全生存期間 OSは37ヶ月に達しました。一方,NSEを残せば16.5ヶ月でした。37ヶ月というのは mutant typeの生存期間に匹敵します。またMGMTメチレーションの有無でこの生存期間に変わりはありませんでした。しかし,高齢者ではこの差はなく,逆にCE部分の積極的摘出のみで生存期間の延長があります,しかし中央値は12ヶ月にすぎません。 - Ellingson BM, et al.: Validation of post-operative residual contrast enhancing tumor volume as an independent prognostic factor for overall survival in newly diagnosed glioblastoma. Neuro Oncol. 2018
UCLAからの報告です。手術摘出度 EOR が予後に大きな関わりを持つことを強調しています。しかし一方で,12cc以上の腫瘍体積を残すようだと手術する利点がない。つまり直径2.5cmほどの腫瘍が残るならそれ以上のリスクを犯す手術する必要はないかもしれません。 - Brown TJ, et al. Association of the extent of resection with survival in glioblastoma: a systematic review and meta-analysis. JAMA Oncol. 2016
STRよりGTRの方が有意にOS, PFSを延長するそうです。meta-analysisなのでFLAIR画像の病変切除率を反映しているとは思えません。 - Kotrotsou A, et al. Multi-center study finds postoperative residual non-enhancing compo-nent of glioblastoma as a new determinant of patient outcome. J Neurooncol. 2018
ガドリニウム増強されない病変が,手術後にどの程度残存しているかで生存割合が変わるとのことです。別な言葉で言えば,FLAIR高信号領域の広い大きなGBMは生命予後が不良ということです。 - Marko NF, et al.: Extent of resection of glioblastoma revisited: personalized survival modeling facilitates more accurate survival prediction and supports a maximum-safe-resection approach to surgery. J Clin Oncol, 2014
MDアンダーソン癌センターの報告です。accelerated failure time (AFT) modelingという予後解析方法が用いられました。結論として,80%だの95%だのという値 threshhold を持って手術が有用かどうかの議論ではなく,a maximum safe resection? (安全に摘出できるだけとる)という手術戦略に意義があるとしました。手術の前に,個々の患者さんの余命を予測する目的で,このモデルを使うためには患者さんが術後の放射線化学療法を望むかどうかの情報が必要です。要するに「できるだけとる」というオーソドックスな考え方に権威を与えたともいえるでしょう。一方で,この論文の結論が手術の好きな脳外科医の間で広まると,危険な感じがしますが。 - Grabowski MM, et al.: Residual tumor volume versus extent of resection: predictors of survival after surgery for glioblastoma. J Neurosurg, 2014
クリーブランド大学からの報告です。手術後のガドリニウム増強される腫瘍の量が2cc以下であれば余命が長いということです。旧来の摘出率で言えば98%摘出できた時です。 - Chaichana KL et al.: Establishing percent resection and residual volume thresholds affecting survival and recurrence for patients with newly diagnosed intracranial glioblastoma. Neuro Oncol. 2014
ジョンズホプキンズ大学からの報告です。70%摘出あるいは5cc以下の残存腫瘍であった時,生存期間の延長があるとしました。 - Beiko J: IDH1 mutant malignant astrocytomas are more amenable to surgical resection and have a survival benefit associated with maximal surgical resection. Neuro Oncol 2014
グレード3以上の星細胞系腫瘍335例で,IDH変異のある例では93%で全摘出(ガドリニウム増強される部分)ができましたが,IDH変異のない例では67%しかできなかったということです。IDH変異のない例では増強されない病変を追加切除しても予後の有意な改善はありませんでした。
- Kreth FW, et al. Gross total but not incomplete resection of glioblastoma prolongs survival in the era of radiochemotherapy. Ann Oncol 2013
ミュンヘン大学からの報告です。ほぼ全摘 GTRを受けた患者さんでのみ予後が改善され,開頭部分摘出 incomplete resection の価値には疑問が残るとしています。 - Sanai N, et al.: An extent of resection threshold for newly diagnosed glioblastomas. J Neurosurg, 2011
サンフランシスコ大学からの論文です。8割程度 (78%) 以上が摘出できると生存期間が延びると報告されています。
40%摘出しても70%摘出しても,膠芽腫の予後はほとんど変わらないということは真実です。だから,手術は無理をしない。もう一点,そもそも手術で摘出しやすい場所の膠芽腫は浅く表面で,手術できない膠芽腫は脳の深部にあるので,手術摘出できるかどうかは,手術の装置や技術で大差はなく,腫瘍の発生部位ですでに決まっているのです。
膠芽腫の放射線治療
- 放射線治療をすることによって,生命予後がおよそ2倍に伸びます
- かつては術後3週以内に放射線治療を開始した方がいいと考えられましたが,遺伝子診断などに時間を費やして,術後5週目くらいで開始しても予後に変わりはないとされています
- でも,術前に急速な増大傾向を示した膠芽腫に,術後放射線治療が遅れると症状が一気に増悪することがあります
- 60グレイを1日あたり1·8–2·0グレイで照射します
- 1週間に5回ですから,1日2グレイで治療には6週間くらいかかります
- 1日1.8グレイはさらに治療期間が延びるのであまり使用されません
- 70歳以上の状態の良い患者さんで線量を絞りたい時には,50グレイ(1·8グレイ/日)でも効果はあります
- MRIで腫瘍があると判断される部分より,全周 2cmくらい幅広く放射線を当てます(generous local field)
- IMRT 強度変調放射線治療という方法で,正常脳の被曝を避けるための複雑な照射計画がされる傾向にあります
- 初期治療においての,ガンマナイフ(放射線外科治療)やサイバーナイフ(定位放射線治療)は有効ではありません
高齢者の膠芽腫
- もともと膠芽腫は高齢者に多い悪性腫瘍です,半数くらいが65歳以上に発生します
- 高齢者膠芽腫の余命は若い患者さんよりさらに短くなります
- 2012年Lancet Oncologyの報告で手術放射線治療を受けても平均余命は8ヶ月から10ヶ月程度です,2017年のNew Eng Medの報告で7ヶ月から9ヶ月です
- ですから,高齢者には無理な治療をしないという考え方も広がっています
- 例えば,75歳以上の膠芽腫患者さんには開頭手術をしないという選択肢などです
- KPSが60%以下の状態の悪い患者さんは,予後がとても短いので手術を含めた積極的な治療を控えるのも選択肢です
- その場合には,緩和ケアを選んでなるべくつらい思いをしないように介護しましょう
- 高齢者には,25グレイを5分割して1週間(40グレイを15分割して3週間,あるいは34グレイを10分割2週間)で終えるという短期間放射線治療 short course radiation therapy が勧められます
- この場合は,副作用を考えてテモダールも積極的には使用しません
- とくにMGMTメチレーションのない高齢者の患者さんにはテモダールを使用しません
- でも逆に,病理診断でMGMTメチレーションがある患者さんでは放射線治療をしないでテモゾロマイド(5日間投与)を12ヶ月投与しますが,それと放射線単独治療の成績は変わらないとされています
- 逆のことも言えます,高齢者でも全身状態が非常に良くて,症状がとても軽くて,腫瘍が摘出しやすい部位にあり,MGMTメチレーションがあるときには,若年成人と同様に,通常の60グレイ照射とテモダール治療をした方がよいかもしれません(かなり限られた例です)
- 状態のとても良い方で,ガドリニウム増強部分をほぼ手術摘出できて,放射線化学療法ができての生存期間は,12ヶ月ほどです (JAMA Oncol 2020),かなり頑張れる高齢者で1年の余命ということでしょう
予後
- 2020年時点の生存期間中央値は,IDH野生型の普通の膠芽腫で1.2年,少数のIDH変異型では3.6年くらいです。
- 全部の膠芽腫を合わせるともっと生存期間は短いです,なぜなら論文で報告されるのは臨床試験の結果だからです
- 第3相臨床試験にさえ入れない状態の悪い膠芽腫の患者さんは5割くらいいます
- ですから,診断時に緩和ケアを選ぶべき患者さんはとても多いです
小さな疑問いろいろ
テモゾロマイドはいつまで続けるのか
- 結論は,2021年時点で不明です
- 世界標準治療では放射線治療後に6コース(約6ヶ月)となっています
- 7コース以上継続できても生命予後は改善しないとされています
- しかし,MGMTメチレーションのある膠芽腫では,12コースまで続けるべきだとの意見は強いです
- でも,日本では現実的に,可能であれば24コースまで継続されることが多いでしょう
- なぜなら,保険診療でも制限されていませんし,止めると急な腫瘍再燃が生じることがままあるからです
まれなIDH変異のある膠芽腫の治療はどうする
- ほとんどの膠芽腫は野生型で,IDH1とIDH2遺伝子に変異がありません
- しかし組織像で膠芽腫に見えても,10%弱に変異 mutation があるとされます
- 変異型はグレード2あるいはグレード3のastrocytic tumorから悪性度が増すことが多いので,secondary glioblastomaともいわれますが,astrocytoma WHO grade 4というのが正確です
- 野生型よりはやや長い臨床経過をたどり,長期生存できることがあります
- IDH変異型は,IDH-mutantのastrocytoma grade 3 星細胞腫グレード3と同じ方針で治療されるようになってきています
- 2021年の時点で,IDH-mutant glioblastomaは,IDH-mutant astrocytoma grade 4と呼称されます
- しかし,IDHの遺伝子検査結果が100%正しいわけではありません
- かつてIDH-mutant 膠芽腫は,単に膠芽腫として治療されてきましたが,10年生存がほぼ0%であったことを考えれば,今までどおり膠芽腫として治療を続けるべきであるという意見も強いです
生存期間が長い膠芽腫患者さんの条件
予後因子と言います。 2011年のInt J Radiat Oncol Biol Phys論文では,年齢,術前の全身状態 PS,手術摘出度,神経症状(機能)の4つです。要するに,若くて元気で,症状も軽くて腫瘍が発見されて,手術でかなりの腫瘍が摘出できれば予後が良いということです。逆に,高齢で全身状態が悪くて症状も重くて,手術でほとんど摘出できない膠芽腫の患者さんの余命はかなり短い(RPA class Vで7ヶ月)と言えます。当たり前と言えば当たり前のような^-^; 下のほうに書いてある,腫瘍のIDHとMDMT遺伝子によっても生命予後が変わります。
10年以上生存する患者さんはいないのか?
答えは,「います」。超長期生存報告の条件でもっとも重要なのは腫瘍の部位で,右前頭葉や側頭葉の先端部とか,腫瘍を周りの正常脳を含めてかなり広範囲に手術摘出できるものとされています。2013年に東京の国立がんセンター病院から,24歳で発症して21年間生存している膠芽腫患者さんの報告があり,最長生存例の一人とのことです。Fukushima S, et al.: A case of more than 20 years survival with glioblastoma—-. Neuropathology 2013
再発(再燃)を考える ;緩和ケアも選択肢です
- 2015年の第3相試験の報告でも無増悪生存期間 PFS は4-7ヶ月ほどですから,半数以上の患者さんは放射線治療が終了して1年以内で再燃します
- 膠芽腫の10年生存割合は0%に近いです
- ですから,初期治療が成功してもいつか再発すると考えなければなりません
- 再発すると平均的な余命(生存期間中央値)は1年以内です
- 再発に対する治療法は確立されていません
- 医師からは,開頭手術,さまざまな種類の抗がん剤(化学療法),ロムスチン CCNU,ニドラン,アバスチン,インターフェロン,サイバーナイフ,ガンマナイフなどの定位放射線治療,ウィルス療法,免疫治療(ワクチン療法)などなどが勧められるかもしれません
- もう一度,放射線治療をする(再照射)ことができる再発もあります
- 再手術を行うことはあまりないと考えてください
- 科学的根拠は別として,実際の臨床の場では,再発腫瘍がMRIでみて境界が明瞭で,摘出すれば症状の寛解が得られることが期待できるケースでは,「まれに」手術摘出が行われます
- 米国では,多くの患者さんが新たな薬剤の臨床試験 clinical trial に参加しますが,日本では難しいです
- 治験というのは新しい薬剤(化学療法)などが,膠芽腫の再発に有効かどうかわからないので患者さんで試験をするという意味です
- 「新しい」ということと「有効」だということは異なるので気をつけてください
- 例えば最近かなり期待されたオプジーボは,2017年に再発膠芽腫には有効性がないことが第3相試験でわかりました
- まず,これ以上さらに追加治療するかどうか,それとも緩和ケアを選ぶのかを考えましょう
- 膠芽腫は高齢者に多く,初期治療では手術と60グレイの放射線治療,さらに再発腫瘍によって,認知症(高次脳機能障害)になっていることが多いですから,どうしたらよいか本人には判断できないことも多いです
- アバスチンを使用すると一時的な症状の寛解を得られることがあります,でも生存期間の延長はないとされています
- MGMTのメチレーションがある例ではテモダールの再投与 rechallengeをします
- 他の化学療法としてはニトロソウレアが用いられることが多いです,ニドラン,ロムスチンなどです
- でもこれらの追加治療の成功率は低いです,ロムスチンの6ヶ月PFSで15-25%くらいです
- 行うとしても身体や生活,大きな金銭的な負担にならないようにします
再発したらまた手術することによって生命予後がのびるか?
- 2017年時点でもさまざまな意見がありますが標準的な指針はありません
- はっきりした利点が見えないときは原則的には再手術はしません
- 欧米では,手術は再発膠芽腫の患者さんの20-30%で行われています
- 日本では再発膠芽腫に対する手術の頻度が高すぎるかもしれません
- 「症状を悪化させない」という条件下で大部分の容積の腫瘍摘出ができて,数カ月以上の有意な生活が期待できるときに考慮します
- ガドリニウム増強される腫瘍病変が全摘出できると判断される時にのみ行います
Suchorska B, et al.: Complete resection of contrast-enhancing tumor volume is associated with improved survival in recurrent glioblastoma-results from the DIRECTOR trial. Neuro Oncol 2016
膠芽腫の初回再発で手術が行われた71例の解析です。ガドリニウム増強される病変が完全摘出された患者さん(N = 40) とできなかった患者さん (N = 19) では,再発後の生存期間PRS (post-recurrence survivalが,それぞれ12.9ヶ月と6.5ヶ月で有意差があり,生存の質も良かったとされています。逆に,不完全摘出で終わった患者さんのPRSが手術を受けなかった患者さんより短かったということです。
再発したらまた放射線治療をするのか
- 原則として再照射は行いませんが,できることもあります
- 理由は,効果が得られないことがほとんどだからです
- 「稀に」小さなターゲットを制御することで予後が期待できるときには,放射線外科治療 SRS (single dose 15-20Gy) を選択することがあります
- 少分割定位放射線治療では30-36Gy (5-6Gy/day)が用いられることがあります
- いずれも,再照射した部位には高率に脳壊死が生じます
再発した時に新薬を試すことができるか?
膠芽腫に対する臨床試験(治験)というのが世界中で常に行われています。薬剤の毒性を調べる様な第1相試験から,効果の確実性を確かめる第3相試験まであります。
National Brain Tumor Siciety
National Cancer Institute
というような患者さん向けの臨床試験情報を提供しているページを見ると,常に最新の治療法開発の治験情報が載っています。
残念ながら日本語での情報提供はありませんし,日本独自のものはなくて欧米が中心です。
この50年間で数百を超える治療法が提案されましたが,実際に患者さんの生存期間が延長できると証明された薬剤は,テモゾロマイドだけでした。ですから,あまりお金をかけたり遠方へ行って大切な時間を使ってしまうことはお勧めできません。

これから下はかなり専門家のための知識です
WHO 2016年 膠芽腫の分類 すべてグレード4です
Glioblastoma, IDH wild-type IDH変異のない膠芽腫
Giant cell glioblastoma 巨細胞性膠芽腫
Gliosarcoma 膠肉腫
Epithelioid glioblastoma 類上皮膠芽腫
Glioblastoma, IDH mutant IDH変異のある膠芽腫(星細胞腫)
Glioblastoma (遺伝子診断がされてない組織診断だけのもの)
これらの異型で治療方法はおなじですが,IDH変異のある膠芽腫のみは,グレード3(退形成性星細胞腫)として治療する方向にあります。また2021年においては,IDH-mutant astrocytoma grade 4と呼称されます。
膠芽腫の病理(別ページにあるのでここをクリック)
治療後の評価と再発
- 治療抵抗性で放射線治療も効かずに進行悪化してしまう例もあります
- しかし,多くの患者さんで,テモゾロマイドと放射線治療で一時的な寛解期が得られます
- テモゾロマイドが標準治療となってから,治療後12週以内に生じるスード・プログレッションが問題となりました
- ガドリニウム増強される病変が増大して脳浮腫も一見悪化するのですがまた寛解します
- 2016年時点で,スード・プログレッションと再発(再燃)を正確に見分ける検査法はありません
- 現実的には頻回にMRI検査をして再燃かどうかを見分けます
- アバスチンの投与で腫瘍が一時的に縮小することも真の評価にはつながりません
- 学術的な治療効果はRANO criteria を用います
- T1 Gd, MRI T2/FLAIR, 新病変の有無,ステロイドの量,臨床症状で評価するもので,単純ではありません
- 膠芽腫では complete responce CRという結果はありません
- 実際には専門家でも評価は難しく,アバスチンを投与するとMRIで膠芽腫病変が小さくなって浮腫も引いて良くなっているという所見は一時的効果であるかもしれないこと,テモダールと放射線治療をして3ヶ月以内に著名な病変拡大があってもスード・プログレッションかもしれないのでアバスチン投与して我慢するということが大切です
primary (de novo) glioblastomaとsecondary glioblastoma
- 膠芽腫には2種類あります
- 9割くらいの膠芽腫は,主として高齢者に発生するプライマリータイプ (デ・ノボタイプ)です
- de novoとは,いきなり癌が発生することを意味します
- 残りの10%くらいの膠芽腫は,低悪制度のびまん性星細胞腫(グレード2)か退形成性細胞腫(グレード3)から悪性化して生じるので,これをセカンダリータイプといいます。
- 星細胞腫の悪性転化 transformationともいいますが,実際には多いものではありません
- セカンダリータイプの年齢層は若いです
- セカンダリータイプは,前頭葉に多くて,組織像で壊死の量が少ない,グレード2の星細胞腫が混じっているという特徴があります
- セカンダリータイプではIDH1という遺伝子の変異が見られます
- セカンダリータイプの方が治療が有効で予後が良いことが知られています
- 予後が良いといっても,星細胞腫に対して放射線治療を行った後に生じたセカンダリータイプ GBM の生命予後は長くはありません
IDH wildtype プライマリー
膠芽腫のほとんど90%くらいはこれです。年齢中央値62歳くらいで,突然発生します。数ヶ月前にMRI正常だったのにというタイプです。男性に多くて,テント上に発生します。ガーランド形状(Garland shape; 腫瘍の周囲が縁取りされるようにガドリニウム増強される)を示して,腫瘍内部の壊死が大きいです。手術放射線化学療法をしての生存期間中央値は15ヶ月です。TERT promotor変異が72%,EGFR増幅が35%,PTEN変異が24%にみられます。
IDH mutant セカンダリー
10%くらいで,星細胞腫 grade II or III が悪性化するものです。年齢中央値は44歳と若い。手術放射線化学療法ができて1,中央値 31ヶ月くらいの生存期間です。画像では,前頭葉に多くみられ腫瘍内壊死は少なめ。TP 53変異が81%,ATRX変異が71%と高率です。
40歳くらいの成人に発生したもので,この大きさですが局所症状はなく頭痛のみです。組織診断では,コアは膠芽腫ですが,周囲はグレード2のびまん性星細胞腫の診断でした。全摘出と放射線治療で4年間無症状でした。これは古い例なのですが,現在では膠芽腫に分類されないものなのでしょう。
セカンダリー・グリオブラストーマ: secondary glioblastoma(グリオーマの悪性転化)の実例はここをクリック
giant cell glioblastoma 巨細胞性膠芽腫 WHO grade 4
まれに小児もみられるもので,de novoで発生します。病理組織で多核巨細胞がたくさんみえるものです。TP53変異,AURKB発現がありますが,EGFR増幅が稀です。MRI画像では,境界が明瞭で皮質下にあり,転移性脳腫瘍の画像ににています。通常の膠芽腫よりは,少しだけ生命予後が良いとされています。giosarcomaと同様に全摘できることが多いからです。
Gliosarcoma 膠肉腫と Epithelioid glioblastoma 類表皮性膠芽腫 WHO grade 4
小児から若年成人にも発生する膠芽腫で,de novoです。膠芽腫の variantなのですが,MRI画像をみると膠芽腫ではないように見えてしまって,手術後に膠芽腫だったのかと思うことがしばしばです。理由は腫瘍の境界が明瞭でくりんと見えるからです (sharp demarcation)。いわゆるPNETみたいに見えます。脳表に発生した時には,硬膜に接して硬膜血管を引き込んで悪性髄膜腫に見えたりします。完全摘出できるチャンスがあるものです。
glioblastoma with primitive neuronal component WHO grade 4
glioblastoma with PNET-like componentとして報告されていた例です。神経細胞系への分化を示す未分化な細胞がみられます。大きな特徴は,髄液播種する可能性がとても高いということです。臨床的にはPNETのようなものです。
分子マーカー
IDH1/2 : 生命予後をある程度予想することができます,診断基準ですから必ず調べます,膠芽腫では変異はありません
nuclear ATRX : 欠失があれば星細胞系腫瘍 astrocytic lineage tumor と診断できます
1p/19q:退形成性乏突起膠腫との鑑別に必須です
MGMT promotor methylation : 治療反応性が予測できますから一部の試験で治療法選択に応用されています,特に高齢者ではテモゾロマイドを使用するかどうかの指標にします
EGFR, EGFRvIII:膠芽腫の半数くらいで増幅しています
TERT:promoter mutationが膠芽腫の7割ほどで見られます,しかし,ほとんどの乏突起膠腫にも変異があります
+7/–10 cytogenetic signature:膠芽腫のマーカーといえます
p53
PTEN mutation or deletion
PDGFR
PIK3CA
以下の分子マーカーが注目されて臨床試験の中で調べられています,要するに基礎研究のターゲットですが,2021年時点で、これらが解ったからといって患者さんに役に立つという訳ではありません。臨床的な観点からは,MGMT statusをみることが有用であると考える研究者はごく一部といえます。「MGMT methylationくらいは病理診断の時にみておいてもいいかな?」くらいです。
Proneural type
Neural type
Classical type
Mesenchymal type
遺伝子変異発現をもとに予後と治療効果をみるために細分類されたものです。proneural typeとmesenchymal typeではIDH1 wild-typeである前者の方が治療反応性がよいとされます。2023年の時点ではこれが分かったいっても患者さんに役に立つ新たな治療法はありません。
文献情報
65歳以上の初発膠芽腫に対する少分割・短期間陽子線治療の効果
Vora S: Short-course hypofractionated proton beam therapy, incorporating 18F-DOPA PET and contrast-enhanced MRI targeting, for patients aged 65 years and older with newly diagnosed glioblastoma: a single-arm phase 2 trial. Lancet Oncol 2024
Mayoクリニックで行われた臨床第2相試験です。放射線治療のターゲットは, 18F-DOPA PET とガドリニウムで増強される部分に絞って決められました。陽子線が使用され,5回から10回の少分割で照射されています。65例の患者さんが登録され,1年生存率は56%,生存期間中央値は13.1ヶ月でした。過去の臨床第3相試験の生存期間6-9ヶ月と比較すればとても良い成績で,治療後の生活の質も良好であると報告者は結論しています。ですが,症例数もとても少なく生存期間の延長も無作為試験ではないし短いので,結論は不明です。
手術による摘出度と予後の新分類
Karschnia P: Prognostic validation of a new classification system for extent of resection in glioblastoma: A report of the RANO resect group. Neuro Oncol 2023
RANOグループからの報告です。744例の膠芽腫が手術摘出を受けて,術後に放射線治療とテモゾロマイドの標準治療が加えられました。
Class 1: “supramaximal CE resection” extensive resection of non-CE tumor (≤5 cm3 residual non-CE tumor)
Class 2: maximal CE resection
Class 3: submaximal CE resection
Class 4: biospy
CEとはガドリニウム増強される部分です。さらに,T2/FLAIRの高信号部分を5cc以下まで摘出すると,”supramaximal CE resection”と呼び,最大の手術治療効果(予後の延長)が得られるということです。
survivinの臨床第2相試験の結果が有望
Ahluwalia MS: Phase IIa Study of SurVaxM Plus Adjuvant Temozolomide for Newly Diagnosed Glioblastoma. J Clin Oncol 2022
膠芽腫が強く発言しているsurivivinというタンパクに対する補助免疫療法です。63人の初発膠芽腫患者さんに対する臨床第2相試験です。テモゾロマイド,放射線治療に加えて,ペプチドワクチンSurVaxM (500μg once every 2 weeks)がsargramostim (GMCSF)が皮下投与されました。テモゾロマイドとSurVaxMは腫瘍再燃が生じるまで継続されました。6ヶ月無増悪生存割合は95% (60例)PFS中央値は11ヶ月,生存期間中央値は25.9ヶ月でした。
臨床試験に入れない患者さんが想像より多い
Real-world validity of randomized controlled phase III trials in newly diagnosed glioblastoma: to whom do the results of the trials apply? Neuro-Oncology Advances, 2021
かねてから言われていたことで,ノルウェーからの報告です。膠芽腫の生命予後とか治療評価は,臨床第3相試験の結果で記載されることが多いです。でもそもそも,その臨床試験に登録可能な eligible 患者さんは,5割に満たないそうです。ですから現実的には,診断時に緩和ケアを選ぶべき患者さんはとても多いです。また膠芽腫の予後を考える場合みるデータは膠芽腫としては状態の良い患者さんをみていると考えます。
6コース以上のテモゾロマイド維持療法に有効性はない
Balana, C: A phase II randomized, multicenter, open-label trial of continuing adjuvant temozolomide beyond six cycles in pati ents with glioblastoma (GEINO 14-01). Neuro Oncol 2020
GBM 159例で無作為試験されました。temozolomideを6コース以上継続しても,PFSとOSに延長はなかったとのことです。有害事象がますだけなので6コースで止めるべきとの結論です。
若い年齢層では非造影部分の積極的摘出が生存期間を延長する
Molinaro AM: Association of Maximal Extent of Resection of Contrast-Enhanced and Non-Contrast-EnhancedTumor With Survival Within Molecular Subgroups of Patients With Newly Diagnosed Glioblastoma. JAMA Oncol. 2020
UCSF, Mayo, Cleavelandからの報告です。
若い年齢層の膠芽腫でガドリニウム増強される部分 CEと造影されない高信号部分 NCEを積極的に摘出した場合,IDHがwild typeでも全生存期間 OSは37ヶ月に達しました。一方,NSEを残せば16.5ヶ月でした。37ヶ月というのは mutant typeの生存期間に匹敵します。またMGMTメチレーションの有無でこの生存期間に変わりはありませんでした。
しかし,高齢者ではこの差はなく,逆にCE部分の積極的摘出のみで生存期間の延長があります,しかし中央値は12ヶ月にすぎません。
術後5週間くらいで放射線治療を開始しても生命予後は悪くはならない
Optimal Timing of Chemoradiotherapy After Surgical Resection of Glioblastoma: Stratification by Validated Prognostic Classification. Cancer 2020
2018年のNeuroOncolの論文と同じような結論です。30,414人の膠芽腫の患者さんが解析されました。今までは術後3週間くらいには放射線治療を開始すべきだと考えられていましたが,そうではなくて,術後1−3週以内に放射線治療が開始された方が,若干予後が悪かったという逆の結論でした。術後5週間過ぎくらいに放射線治療を開始しても,生存期間の短縮はないということです。でも,これにはバイアスがあります,術後放射線治療を急ぐ時にはprogressionが急な患者さんが多く含まれることです。予後が悪そうな膠芽腫患者さんが術後早期放射線治療により多く含まれている可能性があります。早く開始できる時には早くした方がいいのでしょう。
ロムスチン CCNU とテモゾロマイドの併用
Herrlinger U: Lomustine-temozolomide combination therapy versus standard temozolomide therapy in patients with newly diagnosed glioblastoma with methylated MGMT promoter (CeTeG/NOA-09): a randomised, open-label, phase 3 trial. Lancet. 2019
ドイツからの報告です。MGMT promotorメチレーションがありKPS70%以上の初発膠芽腫129人が無作為に,放射線治療後に,TMZかTMZ/CCNUの化学療法を受けました。生存期間中央値はテモゾロマイドで31ヶ月,ロムスチンを加えると48ヶ月と有意に延長しました。かなり良い成績であり,ロムスチンを加えたことによる副作用も高度のものはありません。
「解説」これが新たな標準治療になるのかは,もう少し大規模な臨床第3相試験の結果を待たなければなりません。ロムスチンは欧米では使用できますが日本では使用ができません。また2018年から薬価が50倍もの高値になってしまいました。
キイトルーダ:新たな免疫治療
Cloughesy TF, et al.: Neoadjuvant anti-PD-1 immunotherapy promotes a survival benefit with intratumoral and systemicimmune responses in recurrent glioblastoma. Nat Med. 2019
キイトルーダ (Keytruda)は,ペムブロリズマブ(Pembrolizumab)という抗体で,PD-1阻害剤といわれます。日本でも保険収載され「がん化学療法後に増悪した進行・再発の高頻度マイクロサテライト不安定性(MSI-High)を有する固形癌(標準的な治療が困難な場合に限る)」に使用許可があります。
35人の再発膠芽腫への投与報告がネイチャーに発表されました。手術で摘出できる膠芽腫があるということが条件です。無作為に患者さんが分けられ,手術前にキイトルーダ (neoadjuvant pembrolizumab) を投与した患者さんで有意な全生存期間の延長(中央値で417日)があったとのことです。摘出した腫瘍内では,upregulation of T cell– and interferon-γ-related gene expressionがあり,downregulation of cell-cycle-related gene expression が見られました。抗腫瘍活性をもつT細胞系の免疫賦活と腫瘍増殖の抑制があったらしいとの結果です。
「解説」腫瘍組織と末梢血内で生じた現象はそうなのかもしれません。しかし,本当に膠芽腫の患者さんの生命予後を改善できるかどうかはまだ不明です。
術後の放射線治療が若干遅れても治療成績に影響はない
Short Delay in Initiation of Radiotherapy for Patients With Glioblastoma-Effect of Concurrent Chemotherapy: A Secondary Analysis From the NRG Oncology/Radiation Therapy Oncology Group Database. NeuroOncol 2018
今まで,放射線治療は手術後できる限り早く開始した方が良いといわれてきました。膠芽腫の患者さん1,395人の後方視的解析で,手術後4週間をすぎて遅めに,放射線とテモゾロマイド治療が行われた患者さんの生存期間は,4週間未満に治療開始された群と比較して差がありませんでした。
治療の後の復職
Stamoni D, et al.: Returning to work after multimodal treatment in glioblastoma patients. Nurusurg Focus 2018
フランスからの報告です。就労可能年齢(平均48歳)の膠芽腫の患者さん125人の予後追跡です。治療後に21人 (18%) の患者さんが働けていましたが,ほとんどはパートタイムでした。
インターフェロンは有効ではない
Wakabayashi T, et al,: JCOG0911 INTEGRA study: a randomized screening phase II trial of interferonβ plus temozolomide in comparison with temozolomide alone for newly diagnosed glioblastoma. J Neurooncol 2018
名古屋大学が中心となって長く日本で行われた試験の結果です。インターフェロンの上乗せ効果はありませんでした。
再発種膠芽腫にロムスチンと併用するとわずかながらPFSの延長がある
Wick W, et al.: Lomustine and Bevacizumab in Progressive Glioblastoma. N Engl J Med. 2017
Phase III EORTC 26101の結果報告です。膠芽腫の再発にロムスチン CCNU単独とアバスチンの併用が試験されました。ロムスチン単独のPFSは1.5ヶ月,ロムスチンとアバスチンを使用すると4.2ヶ月という結果です。
わずかな無増悪生存期間の延長です。この結果を持って米国では再発膠芽腫への使用が認可されました,しかし,これはCCNUとの併用なので,日本ではできない治療です。
テモゾロマイドを7コース以上継続しても生存期間の延長は得られない
Blumenthal D, Gorila T, Gilbert MR, et al. Is more better? The impact of extended adjuvant temozolomide in newly-diagnosed glioblastoma: a secondary analysis of EORTC and NRG Oncology/ RTOG. Neuro Oncol 2017
過去に行われた大規模試験で膠芽腫2214例が解析されました。6コースのテモゾロマイド維持療法の時点で無増悪であった624例のうち,291例で維持テモゾロマイドが継続さえれ,333例では中断されました。テモゾロマイド継続例で生存期間の延長があるという事実はなかったとのことです。結論としては,膠芽腫の初発例ではテモゾロマイドは6コースで打ち切るということです。しかしこの中で,MGMTメチレーションがある群ではやや無増悪生存期間が長いとのことです。
Gramatzki D, et al. Limited role for extended maintenance temozolomide for newly diagnosed glioblastoma. Neurology 2017
142人の患者さんのうち61人でテモゾロマイドが7コース以上投与されました。7コース以上の投与で,無増悪生存期間も全生存期間も伸びなかったという結論です。MGMTメチレーションのある患者さんでもテモゾロマイドの長期投与の効果は認められないとしています。
2017年のこの2つの大きな論文は,テモゾロマイドの7コース以上の投与を否定しました。しかし,MGMTメチレーションのある例では現実的に12コース以上の投与が行われることが多いでしょう。状態が良くテモゾロマイドを問題なく服用している膠芽腫の患者さんでテモゾロマイドを中断すると,急激な腫瘍増悪をみることが経験的にあるということを脳腫瘍の専門家は知っているからです。
ABT414の臨床試験
Reardon DA, et al.: Efficacy and safety results of ABT-414 in combination with radiation and temozolomide in newly diagnosed glioblastoma. Neuro Oncol, 2016
一部の膠芽腫は変異型EGFRというタンパクを発現しています。それにくっつく抗体 ABT-806に腫瘍細胞の分裂を阻害するMMAFという抗がん剤をくっつけて,静脈内から投与する治療法で,MMAF-antibody-conjugatesといいます。2017年5月時点で,米国では第2相試験があり,再発したグレードIIIとIVの悪性神経膠腫への第1相治験は日本でも行われています。参加条件は変異型EGFR増幅がある膠芽腫であることが病理学的に証明できる患者さんで,テモダールを併用します。
再発膠芽腫にオプジーボ Opdivo (nivolumab)は有効ではない
2017年に,注目の再発膠芽腫に対するOpdivo (nivolumab,PD-1 checkpoint抑制剤)の第3相試験 CheckMate-143の結果がわかりました。生存期間の延長は得られませんでした。
高齢者でもテモゾロマイドを加えると生存期間の延長がある
Perry JR, et al.: Short-Course Radiation plus Temozolomide in Elderly Patients with Glioblastoma. N Engl J Med 2017; 376:1027-1037
65歳あるいは70歳以上の高齢者には短期間で放射線治療を行うというのが一般的です。65歳以上の562人の患者さん(年齢中央値73歳)に,40グレイ15分割の放射線治療のみ,放射線治療にテモゾロマイドを加える第3相試験が行われました。全生存期間中央値は放射線単独で7.6ヶ月,テモゾロマイドを加えると9.3ヶ月でした。無増悪生存期間はそれぞれ5.3ヶ月と3.9ヶ月です。MGMTメチレーションのある患者さんでは,テモゾロマイド併用で13.5ヶ月です。
「解説」よくよく考えると,放射線治療をしてテモゾロマイドを加えても,腫瘍が再燃しないまでの期間は5ヶ月にしかなりません。通常のオンコロジーの概念からは,緩和ケアというのが選択肢として有力となるはずで,これらの治療をするかどうかということが治療開始の前に検討されなければなりません。
テモゾロマイドが効かない膠芽腫にアバスチンとイリノテカン?
Herrlinger U, et al.: Bevacizumab Plus Irinotecan Versus Temozolomide in Newly Diagnosed O6-Methylguanine-DNA Methyltransferase Nonmethylated Glioblastoma: The Randomized GLARIUS Trial. J Clin Oncol 2016
ヨーロッパからの報告です。MGMT非メチル化の膠芽腫はテモゾロマイドに抵抗性である事が知られています。そのような患者さん182人で,アバスチン (10 mg/kg every 2 weeks)とイリノテカン併用 (維持療法 125 mg/m2 every 2 weeks) と放射線治療,あるいはテモゾロマイドと放射線治療の治療成績が比較されました。6ヶ月無増悪生存割合PFSはそれぞれ79%と43%でした。PFS中央値は,9.7ヶ月と6.0ヶ月です。MGMTのメチル化がないテモゾロマイド抵抗性の膠芽腫には,アバスチンとイリノテカンの組み合わせの方が腫瘍進行を抑制する力が強いという報告です。しかしやはり,全生存割合は16.6ヶ月と17.5ヶ月であり有意差がありませんでした。またQOLを変えることもできませんでした。MGMT非メチル化を証明してイリノテカンを使用しても延命はできないし生存の質も改善しないということです。
IDH-1の変異のない膠芽腫にはアバスチンの有効性がある
Sandmann, T, et al. Patients with proneural glioblastoma may derive overall survival benefit from the addition of bevacizumab to first-line radiotherapy and temozolomide: retrospective analysis of the AVAglio trial. J Clin Oncol. 2015
膠芽腫を間葉系 (mesenchymal type)と前神経 (proneural type)に分けた場合,proneural IDH1 wild-typeの初期治療ではアバスチンを使用すると全生存期間 OS が延長する (17.1ヶ月 vs プラセボ 12.8ヶ月) という結果です。僅かな差なのかもしれませんが。
状態が悪いあるいは高齢者の膠芽腫には短期間の放射線治療が適切
Roa W, et al.: International Atomic Energy Agency Randomized Phase III Study of Radiation Therapy in Elderly and/or Frail Patients With Newly Diagnosed Glioblastoma Multiforme. J Clin Oncol. 2015
無作為第3相試験です。状態があまりよくないあるいは65歳以上の患者さん(frail = age ≥ 50 years and KPS of 50% to 70%; elderly and frail = age ≥ 65 years and KPS of 50% to 70%; elderly = age ≥ 65 years and KPS of 80% to 100%)に,25グレイ5日間あるいは40グレイ15日間の放射線治療が行われました。両者の間にOSもPFSもQOLも有意差はありませんでした。対象となる患者さんには治療期間短縮のために放射線治療を1週間で終えるという結論です。
バルガンシクロビル
Söderberg-Nauclér, et al.: Survival in Patients with Glioblastoma Receiving Valganciclovir. N Engl J Med 369: 985-986, 2013
カロリンスカ大学からの報告では,ほぼ全ての膠芽腫 99% にサイトメガロウィルス CMVの感染の痕跡 CMV atigen があるそうです。強い感染がみられる膠芽腫の生存期間中央値は13ヶ月,弱い感染例では33ヶ月です。サイトメガロウィルスの治療薬である Valganciclovir(バルガン,抗ウィルス薬)を膠芽腫の患者さんに投与したら,生存期間中央値が25ヶ月であったと報告されました。非常に権威ある科学誌にびっくりするほどすばらしい治療成績が発表されたと言えます。
ですが,すぐに反論がありました。Hellstrand Kらは,CMV antigenが検出されたとしても,ほぼ全ての膠芽腫でCMVがreplicateしていないと言います。ValganciclovirはCMVのreplecateを阻害する薬剤ですから,replecateがないとすれば効かないはずです??
CMVは膠芽腫の発生原因ではありませんが,増殖を促すような何かの働き (possible oncomodulatory role)をしているのではないかと推定されています。Valganciclovirの臨床的な有用性は確認されないままです。
再発に対するロムスチン CCNU の効果
Batchelor TT, et al. Phase III randomized trial comparing the efficacy of cediranib as monotherapy, and in combination with lomustine, versus lomustine alone in patients with recurrent glioblastoma. J Clin Oncol 2013
VEGFR-1,2,3に対する経口阻害剤cediranibとCCNU(ロムスチン)の併用効果を試した第3相試験です。再発膠芽腫325例の大規模試験です。cediranibの有効性はありませんでした。ロムスチン投与による6ヶ月PFSは15-25%と評価されています。5人に一人くらいの患者さんがロムスチンによって数ヶ月の寛解延長があるのかもしれません。
60歳以上の膠芽腫患者さんへの治療
Maimstrom A, et al.: Temozolomide versus standard 6-week radiotherapy versus hypofractionated radiotherapy in patients with glioblastoma: Nordic randomized, phase 3 trial. Lancet Oncol 13; Epub, 2012
ヨーロッパでの共同研究です。60歳以上の膠芽腫患者さん291人が,テモダール単独治療(200mg/m2, days 1-5 of every 28 days) ,低分割照射(34 Gy in 3.4 Gy fractions over 2 weeks), 標準的照射 (60 Gy in 2 Gy fractions over 6 weeks)のいずれかの治療を受けました。それぞれの生存期間は8.3ヶ月,7.5ヶ月,6ヶ月でした。70歳以上に限っても同様の傾向であったということです。MGMT promotor methylationがあった患者さんで特にテモダールの有効性は良好でした。結論として,特に70歳以上の患者さんでは標準的な60グレイの放射線治療をするべきでないとしています。その方が余命が有意に短くなるからです。この論文のインパクトは大きいと言えます。
病理診断でMGMTメチレーションがある高齢者はテモダール治療
そうでなければ34グレイ10分割を標準的な治療オプションとするべき
かもしれません。
65歳以上の膠芽腫患者さんの治療:MGMTメチレーションで選択する
Wick W, et al.: Temozolomide chemotherapy alone versus radiotherapy alone for malignant astrocytoma in the elderly: the NOA-08 randomized, phase 3 trial. Lancet Oncol 13; 707-715, 2012
65歳以上の患者さん(膠芽腫と退形成性星細胞腫)373人が,テモダール単独治療(100mg/m2, days 1-7/week, 1 week off cycles) あるいは放射線治療単独治療(60Gy/30fr)を受けました。テモゾロマイド群の全生存期間は8.6ヶ月,放射線治療群の患者さんは9.6ヶ月でした。骨髄抑制などの副作用はテモダール群で明らかに多かったと記載されています。著者は,MGMTメチレーションがあれば,テモゾロマイド単独治療は放射線治療に劣るものではないと結論しています。MGMTメチレーションのある高齢の患者さんでは,放射線治療をしないでテモゾロマイド(5日間投与)を12ヶ月投与しますが,それと放射線治療の成績は変わらないということを報告した論文です。
再発膠芽腫の再手術ははっきりした利益が予想される時だけに行う
Clarke JL, et al.: Is surgery at progression a prognostic marker for improved 6-month progression-free survival or overall survival for patients with recurrent glioblastoma? Neuro Oncol 13: 2011
北米で1998年から2008年に治療された758人の再発膠芽腫の患者さんが統計学的に解析されました。結果として,再発の時に腫瘍の摘出術を受けても受けなくても,6ヶ月無増悪生存割合と全生存割合は変わりませんでした。再手術をすることによって腫瘍の制御も延命も得られないという結論です。
「解説」再発した膠芽腫に再開頭手術をする意義は低いということです。日本では再発膠芽腫に対する手術の頻度が高すぎるかもしれないので警告として捉えるべきでしょう。しかし,全ての患者さんに再手術は無効というわけではありません。中には再発した腫瘍の大部分が安全に摘出できて,その再手術をすることによって化学療法を加える時間的余裕ができることもあります。 でも,再手術は患者さんにとって明らかに利益があると予想できた時のみに行なうべきことです。その後2014年,同じ雑誌にイタリアのNava F.が764例の解析結果を発表しましたが,再発に対する再手術は生存に寄与しなかったと結論しています。
再発膠芽腫へアバスチンの効果
Friedman HS, et al. Bevacizumab alone and in combination with irinotecan in recurrent glioblastoma. J Clin Oncol 27:4733–40, 2009
2009年Friedmanらによって,再発の膠芽腫にアバスチンを単独で使用した場合に,6ヶ月無増悪生存割合が42.6%であると報告されました。これは,直接的な腫瘍増殖抑制のみならず,放射線治療後のpseudoprogressionの改善という画像所見を含んだ評価 (pseudoresponse) でしょうし,良すぎる成績です。しかし,再発した膠芽腫の臨床的増悪をアバスチンが一定期間抑えるというのは明らかな事実となりました。
その後の報告を鑑みて,患者さん側からは再発の膠芽腫にアバスチンを単独で使用した場合には,4割くらいの確率(4/10くらいの患者さん)で数ヶ月間は進行を抑制できるかもしれないと考えてください。
小児の膠芽腫は別ページにあるのでここをクリック
20年以上 生存したという患者さんからの手紙
超長期生存者がいるかどうかということが学会で議論になります。2000年頃に脳腫瘍学会で10年以上生存している患者さんを調査したことがありますが,結局見つかりませんでした。病理診断を見直したら実は膠芽腫ではなかったとかです。
下の病理写真は,ある患者さんから私に送られたものです。20代で前頭葉の膠芽腫になってから21年経って生存しておられるということです。2度の開頭術と放射線治療と化学療法(複数回)を受けておられます。患者さんに病理診断が間違っているのではないかと返事をしたら,下にある画像を送ってくださいました。病理診断は,一見したところは多形膠芽腫 グリブラに間違いありませんでした。でも,ーーー
(下の画像は患者さんの許可を得て掲載させていただきました)
bizarre! 異様な細胞が混在しています。核多型が目立ち,多核巨細胞も混じる典型的な膠芽腫の像です。下の左の画像は血管内皮の肥厚 endovascular proliferationがあり,下の右のKi-67染色では核濃染像が多く核分裂能が高いことを示します。しかし,——
左のGFAP染色では一部の細胞が染色されません,右のHE染色では豊富な血管増殖の間に空砲 perinuclear halo を有した細胞増殖が見られます。さらに,–
腫瘍の部分像として明らかに乏突起膠腫が混在しています。また,どの部分をみても壊死 necrosisがありませんでした。
従って,当時の診断では,この腫瘍の形態病理診断は,退形成性乏突起星細胞腫 anaplastic oligoastrocytoma WHO grade III となります。2018年時点では,もしiDH変異があったと仮定すると,secondary glioblastoma (IDH-mutated glioblastoma)とされるかもしれません。
まめ知識(術後に放射線治療をしないと)
時は1978年,私が脳神経外科医になろうかなと迷っていた頃に遡ります。Anderson AP先生が,108人の膠芽腫の患者さんを,手術だけの群,手術と放射線で治療する群に分けました。1年後に放射線治療を受けた患者さんの19%が生存していましたが,受けなかった患者さんは全員が亡くなっていました。(Acta Radiol Oncol Radiat Phys Biol. 17: 475-484, 1978)
当時は手術して放射線治療しても1年間生き延びられなかったということです。また,手術後に放射線治療ができない時には,膠芽腫の開頭手術にほとんど意味がないということを明らかにした歴史的な論文です。
まめ知識(BCNUと放射線治療の効果)
Walker MD, et al.: Evaluation of BCNU and/or radiotherapy in the treatment of anaplastic gliomas. A cooperative clinical trial. J Neurosurg 49: 333-343, 1978
Walker MD, et al.: Randomized comparisons of radiotherapy and nitrosoureas for the treatment of malignant glioma after surgery. N Engl J Med. 303: 1323-1329, 1980
1970年から80年代にかけて,Walker博士がグリオーマの補助療法の研究で世界をリードしていました。 大規模無作為臨床試験 prospective randomized studyという統計学を応用する科学的な研究です。この頃の日本では,研究の概念さえも理解されていませんでした (o_o ;)
BCNU カルムスチンという抗がん剤が有効であろうという仮説のもとになされた研究でしたが,結果的にBCNUの有効性は統計学的には証明されませんでした。論文中ではBCNUが有効かもしれないという結論の書き方で,BCNUがこの後も長きにわたり使用されることになります。一方で,放射線治療は統計学的に有意な有効性を示しました。
1980年代の後半に,同様の研究を米国でしていたLevin博士がヨーロッパで公演した時に,”Chemotherapy is useless for glioma.” 「グリオーマに化学療法は役に立たない」と発言したのを聞いて驚いたことがあります。
まめ知識(発生要因は?)
- 米国で,10万人あたり3人の発生率です
- 白人には黒人の2倍くらいの発生するとされます,アジア系は白人より少し低い
- 男性は女性の1.5倍くらいの発生率です
- 高齢者に多いので,老年人口の増加によって発生数が増えます
- リスク因子は,脳への放射線治療以外には知られていません
- 環境因子は無関係です
- 遺伝素因は,Lynch症候群 (MSH2, MLH1, MSH6, and PMS2) とLi-Fraumeni症候群 (TP53)です
- ですから,母子,親子で遺伝するとは考えません
まめ知識(放射線誘発膠芽腫 radiation-induced gliblastoma)
- 放射線を浴びると様々なガンが発生することは知られています
- 膠芽腫も被曝 ionizing radiaiton によって発生しうる腫瘍です
- でも比較的大きな線量で,30グレイ以上が誘発線量とされます
- 放射線治療後,数年後から30年くらい後で発生します
- 小児脳腫瘍の放射線治療後の2次がんとして膠芽腫は多いものです
- 遺伝子異常は通常の膠芽腫と変わりませんし,治療法も同じです
- しかし,予後は通常の膠芽腫より悪いものです,なぜならすでに放射線治療がされた患者さんに発生するので,十分な再照射ができないことが多かったり,発生部位が脳幹部であったりするからです
将来のことですが,膠芽腫を治すためのキーワード
膠芽腫 GBM の最大の特徴は,腫瘍細胞の高い浸潤能 invasion です
- 私の師匠にあたるDr. Nicolas de Triboletは,GBMは全脳の病気であるといいました。彼が言わんとしていることは,GBMを局所の腫瘍として捉えてはいけないということです。簡単に言えば,MRI画像でみえるところを摘出も決して治る病気ではないということです。
- そのとおりで,世界中で精一杯の開頭手術による腫瘍摘出術が行われるのですが,GBMの10年生存割合はほぼ0%です。残念ながら現時点では治癒ということは期待できない悪性腫瘍です。
- 逆に, どのような無理な手術をしても治癒ということがないのであれば,腫瘍をできるだけたくさん取った方が治る確率が上がるという,脳外科医の説明は正しくないということになります。手術は寛解を得る手段に過ぎないのです。多くの脳外科医の先生がこの点を勘違いしています surgery is palliative, never curative !
- 局所放射線治療も手術摘出も中性子捕捉療法 BNCTもギリアデルも光線力学療法 PDTも,全脳に有効であるという治療法ではありませんから,決してGBMを治す治療法とはならないのです。
- また他のがん腫と比較すれば,膠芽腫は転移せず緩徐増大性でG0/1期の細胞割合が高いものですから,抗腫瘍薬に求められるものは高い血中濃度ではなく,効果持続性です。
- GBMを治すということを期待するのであれば,やはり何かの薬剤の登場を待つしかないのでしょうが,それはピル(経口薬)でしょう く(^.^)ノ
文献
- Asklund T, et al.: Brain tumors in Sweden: data from a population-based registry 1999–2012. Acta Oncol 2015
- Blumenthal D, et al. Is more better? The impact of extended adjuvant temozolomide in newly-diagnosed glioblastoma: a secondary analysis of EORTC and NRG Oncology/ RTOG. Neuro Oncol 2017
- Chaichana KL et al.: Establishing percent resection and residual volume thresholds affecting survival and recurrence for patients with newly diagnosed intracranial glioblastoma. Neuro Oncol. 2014
- Chinot OL, et al.: Bebacizmab plus radiotherapy-temozolomide for newly diagnosed gliomblastoma. N Engl J Med 370: 709-722, 2014
- Clarke JL, et al.: Is surgery at progression a prognostic marker for improved 6-month progression-free survival or overall survival for patients with recurrent glioblastoma? Neuro Oncol. 13:1118-1124, 2011
- Ellingson BM, et al.: Validation of post-operative residual contrast enhancing tumor volume as an independent prognostic factor for overall survival in newly diagnosed glioblastoma. Neuro Oncol. 2018
- Fukushima S, et al.: A case of more than 20 years survival with glioblastoma, and development of cavernous angioma as a delayed complication of radiotherapy. Neuropathology 33, 2013
- Gilbert MR, et al.: A randomized trial of bevacizmab for newly diagnosed glioblastoma. N Engl J Med 370: 699-708, 2014
- Gilles FH, et al.: Limitations of the World Health Organization classification of childhood supratentorial astrocytic tumors. Children Brain Tumor Consortium. Cancer 88: 1477-1483, 2000
- Gramatzki D, et al. Limited role for extended maintenance temozolomide for newly diagnosed glioblastoma. Neurology 2017
- Herrlinger U, et al.: Bevacizumab Plus Irinotecan Versus Temozolomide in Newly Diagnosed O6-Methylguanine-DNA Methyltransferase Nonmethylated Glioblastoma: The Randomized GLARIUS Trial. J Clin Oncol 2016 [Epub]
- Hou LC, Veeravagu A, Hsu AR, Tse VC. Recurrent glioblastoma multiforme: a review of natural history and management options. Neurosurg Focus2006;20:E5.
- Jaeckle KA, et al.: Correlation of enzyme-inducing anticonvulsant use with outcome of patients with glioblastoma. Neurology. 73: 1207-1213, 2009
- Karremann M, et al.: Pediatric giant cell glioblastoma: New insights into a rare tumor entity. Neuro-Oncol 11: 323-329, 2009
- Karsy M, et al.: A practical review of prognostic correlations of molecular biomarkers in glioblastoma. Neurosurgical Focus 3: Page E4, 2015
- Keime-Guibert et al.: Radiotherapy for glioblastoma in the elderly. N Engl J Med 356: 1527–1535, 2007
- Kreth FW, et al. Gross total but not incomplete resection of glioblastoma prolongs survival in the era of radiochemotherapy. Ann Oncol 2013
- Lai A, et al.: Phase II study of bevacizumab plus temozolomide during and after radiation therapy for patients with newly diagnosed glioblastoma multiforme. J Clin Oncol 29: 142-148, 2011
- Li J, et al.: Validation and simplification of the Radiation Therapy Oncology Group recursive partitioning analysis classification for glioblastoma. Int J Radiat Oncol Biol Phys 81:623-30, 2011
- Louis DN, et al.: The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathologica 131: 803-820, 2016
- Marko NF, et al.: Extent of resection of glioblastoma revisited: personalized survival modeling facilitates more accurate survival prediction and supports a maximum-safe-resection approach to surgery. J Clin Oncol 32:774-782, 2014
- Nava F, et al.: Survival effect of first- and second-line treatments for patients with primary glioblastoma: a cohort study from a prospective registry, 1997-2010. Neuro Oncol 16, 2014
- Ohgaki H. Epidemiology of brain tumors. Methods Mol Biol 472: 323–42, 2009
- Parsons DW, et al. An integrated genomic analysis of human glioblastoma
- Perry JR, et al.: Short-Course Radiation plus Temozolomide in Elderly Patients with Glioblastoma. N Engl J Med 2017; 376:1027-1037
multiforme. Science 321: 1807-1812, 2008 - Roa W, et al.: International Atomic Energy Agency Randomized Phase III Study of Radiation Therapy in Elderly and/or Frail Patients With Newly Diagnosed Glioblastoma Multiforme. J Clin Oncol. 2015
- Robinson GW, et al.: Complete clinical regression of a BRAF V600E-mutant pediatric glioblastoma multiforme after BRAF inhibitor therapy. BMC Cancer. 2014
- Sanders RP, et al.: High-grade astrocytoma in very young children. Pediatr Blood Cancer 49: 888-93, 2007
- Sanai N, et al.: An extent of resection threshold for newly diagnosed glioblastomas. J Neurosurg 115:3-8, 2011
- Schuster J, et al.: A phase II, multicenter trial of rindopepimut (CDX-110) in newly diagnosed glioblastoma: the ACT III study. Neuro Oncol: 2015 Jan [Epub]
- Stupp R, Hegi ME, Mason WP, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial. Lancet Oncol 2009;10:459–66
- Verhaak RG, et al.: Integrated genomic analysis identifies clinically relevant subtypes of glioblastoma characterized by abnormalities in PDGFRA, IDH1, EGFR, and NF1. Cancer Cell 17:98-110, 2010
- Wakabayashi T, et al,: JCOG0911 INTEGRA study: a randomized screening phase II trial of interferonβ plus temozolomide in comparison with temozolomide alone for newly diagnosed glioblastoma. J Neurooncol 2018
- Walker MD, et al.: Evaluation of BCNU and/or radiotherapy in the treatment of anaplastic gliomas. A cooperative clinical trial. J Neurosurg 49: 333-343, 1978
- Walker MD, et al.: Randomized comparisons of radiotherapy and nitrosoureas for the treatment of malignant glioma after surgery. N Engl J Med. 303: 1323-1329, 1980

 sい
sい