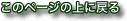松果体腫瘍 pineal tumor
山本哲哉も記載しています
松果体腫瘍に関して,横浜市立大学の山本哲哉先生が御相談にのります,相談したい方はここをクリックしてください
山本 哲哉(やまもと てつや)
横浜市立大学附属病院 脳神経外科 診療科部長
横浜市立大学 脳神経外科 主任教授
松果体とは
- 脳の真ん中、深いところにある小さな組織です
- 松果体は,睡眠のパターンを調節するメラトニン(ホルモン)を作っています
- 真の機能は謎の内分泌器官です
おおまかなこと
- 松果体腫瘍をなぜ特別扱いするというと、診断と手術と治療が難しい腫瘍だからです
- いろいろなものがありますが,ジャーミノーマ(クリック),混合性胚細胞腫瘍(クリック),松果体実質腫瘍(下記)が多いです
- 脳ドックなどで偶然に発見されることも多くなりました
- 無症状の腫瘍は治療をする必要がないこともまれにあるので,治療(手術)を勧められた場合には慎重に判断してください
- 中脳水道という髄液の出口が閉じて,閉塞性水頭症になるために ,頭痛と嘔吐という症状がでます
- 特に,早朝の頭痛 morning headache が松果体腫瘍の水頭症に特徴的です
- 中脳を後ろから圧迫するので目の動きが悪くなって(眼球運動障害),物が2つにみえる(複視)という症状も多いです
- 開頭手術をしなければならない腫瘍とそうでない腫瘍があります
- とても頻度が高い松果体のう胞という良性の腫瘍(水がたまった袋状のもの)は治療をする必要がありません
- 松果体のう胞を手術しなければならないといわれたらまずセカンドオピニオンを聞きに他の病院へいきましょう
- もっとも頻度が高いジャーミノーマは、内視鏡による生検術を行ないますが,開頭手術の必要はありません
- 悪性松果体腫瘍には,悪性胚細胞腫瘍(胎児性癌,卵黄嚢腫,悪性奇形腫),PPTID, 松果体芽腫などがありますが,これらの一部は手術をしないでまず放射線化学療法をして小さくしてから,開頭手術で全摘出した方が治る確率が高いことがあります
- ですから,松果体腫瘍の開頭手術はとても少なくなりました
- まず開頭して全摘出を目指すということになるのは,グレード 1の松果体細胞腫か成熟奇形腫を疑った時だけでしょう
- 開頭手術はむずかしいし,術前の検査から開頭が必要かどうかの判断もむずかしいので,治療経験の多い脳外科の先生を捜した方が安全です
- おそらく私は,松果体腫瘍というものを治療が必要なものだけでも200例以上はみてきたと思いますが,治療方法の選択は複雑でここには書ききれないことがたくさんあります
とにかく最初のMRI診断が大切、それで治療の方向性が決まります
松果体腫瘍と松果体部腫瘍の違い
- 松果体腫瘍とは松果体から発生する腫瘍に限定されます
- 松果体部腫瘍とは,松果体に発生する腫瘍と,松果体近傍に発生し松果体を侵す腫瘍の双方を含みます
- 視床枕から発生したグリオーマ 、大脳鎌テント接合部から発生した髄膜腫、四丘体槽の類表皮のう胞などは,真の松果体腫瘍ではありません
- このページでは、松果体から発生する腫瘍だけを記述します
ジャーミノーマ germinoma は別ページなのでここをクリック
胚細胞腫瘍 germ cell tumors は別ページなのでここをクリック
奇形腫 teratoma は別ページなのでここをクリック
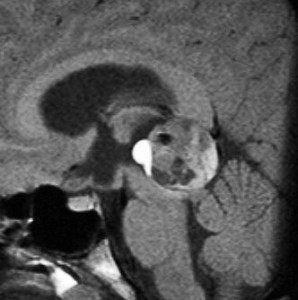
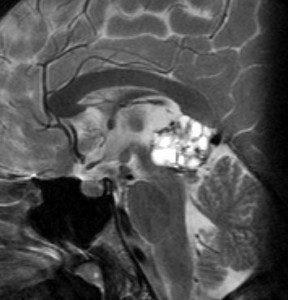
14歳の男の子です。このMRI画像はどう見ても松果体奇形腫 mature or immature teratoma 以外には考えられません。左の写真で脂肪腫が混じっていることが解ります。AFP 130 ng/ml, HCG-beta 30 mIUでしたから,ICE化学療法と放射線治療 (全脳室 25.2グレイ/15分割と局所28.8グレイ,1回線量1.8グレイ)をして少し小さくして(右の写真)から開頭手術しました。全摘出して病理診断は成熟奇形腫でしたが,治療前にはおそらくもっと未熟な部分が混じっていたと考えられます。
脳神経外科手術
- 病理診断のための生検術は内視鏡で行います
- 開頭手術で腫瘍を全部摘出する時には、経テント法 OTA occipital transtentorial approach で行います(高度の専門家向けに別ページに書いてありますのでここをクリック)
松果体腫瘍の2021年WHO分類
1, pineocytoma (WHO grade I)
2. pineal parenchymal tumor of intermediate differentiation (WHO grade II or III)
3. pineoblastoma (WHO grade IV)
4. Papillary tumors of the pineal region (グレード 2, 3)
5. Desmoplastic myxoid tumor of the pineal region, SMARKB1-mutant
松果体実質腫瘍 pineal parenchymal tumors
- 松果体実質腫瘍はとても珍しくて、大きな大学病院でも数年に1例くらいという頻度です
- ですから、この腫瘍に詳しい医師というのはほとんどいないと考えて下さい
- 松果体芽腫は小児の腫瘍です
松果体実質腫瘍には主な3つの腫瘍があります
-
- 松果体細胞腫 グレード1
- 中間型松果体実質腫瘍 PPTID グレード2か3
- 松果体芽腫 グレード4
松果体細胞腫 pineocytoma WHO grade 1
- 若い成人に多い良性腫瘍です
- 水頭症で発症しますから,頭痛と嘔吐が主症状です
- でも最近は無症状で偶然MRIでみつかるものが多くなってきました
- MRIでは楕円形に見えて,境界がはっきりしています
- のう胞性(中に液体が入っている)のものも充実性のものもあります
- 手術で全摘出すれば治癒します
- 放射線治療は有効なのですが、30-40%で再発(再燃)する可能性があります
- ガンマナイフなどの放射線外科治療でも20%ほどは再燃します
- 再燃すると再手術ですが、癒着のために全摘出できず、治る見込みは低いです
- 逆に言えば,初回手術全摘しないと治らないので何としても摘出します
- でも手術は簡単ではありません
- 特に,眼球運動障害(複視,2重に見える)という後遺症を出さないことが大切です
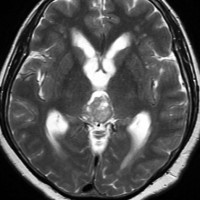
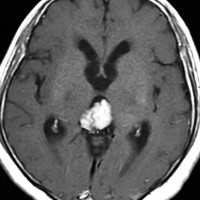
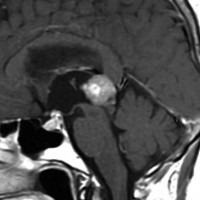
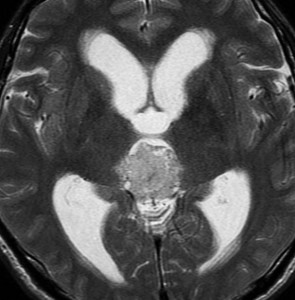
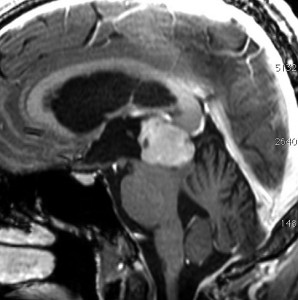
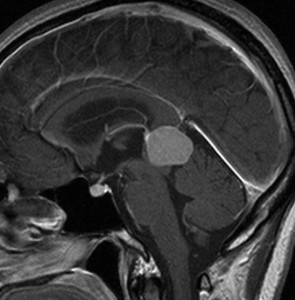
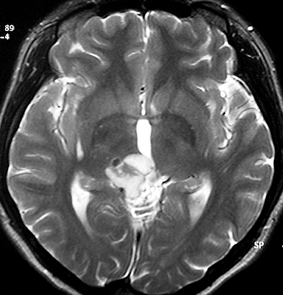
成人女性の松果体細胞腫で充実性腫瘍です。中脳水道が閉塞して軽度の水頭症(頭の中に髄液が溜まる)になってきています。多少凹凸がありますがだいたい楕円形。
もし無症状で見つかったら
松果体腫瘍の手術リスクは高いので,簡単には手術を勧めることができません。でも中脳水道の狭窄がはっきりしていて閉塞の恐れがある時には手術摘出をしたほうがいいでしょう。私も過去に、患者さんに手術を強く勧められないために経過観察して,つらい思いをしたことがあります。中脳水道が急に閉塞すると,急性水頭症となりひどい頭痛から意識障害になって,1日もたないで突然呼吸が停止するということがあります。無症状で何年も経過して,急激な死に至る例があるのです。
松果体細胞腫の例をもっと見たい方はここをクリックして下さい
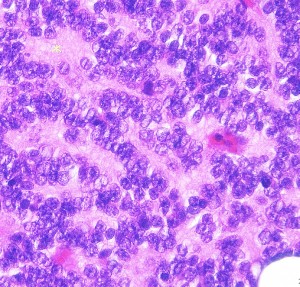
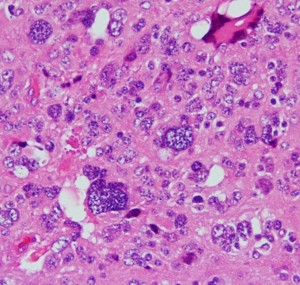
松果体細胞腫の病理所見
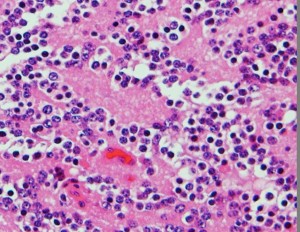
Pineocytomatous rosettes with nucleus-free spaces mature neoplastic pineocytes.
腫瘍細胞核の配列で核がない隙間ができています。この中には腫瘍細胞の突起が細かいネットワークを作っています。
核は染色質に富んでいますが,染色質の分布は不整です。松果体実質腫瘍に共通するものですが,synaptophysinとneuron-specific enolaseが陽性です。
松果体細胞腫のある文献
Deshmukh VR: Diagnosis and management of pineocytomas. Neurosurgery 2004 (米国の大きな脳外科施設からの報告です)
1990年以降に治療された9例の松果体細胞腫の治療結果です。平均年齢は44歳です。3例で全摘出,6例で部分摘出か生検術がされました。3例で残存腫瘍の再発があり,再手術になりました。1例で第4脳室の下端(ovex)に転移再発がありました。再発までの期間は3.5年であったとのことです。再発あるいは術後の残存腫瘍のために,ガンマナイフなどの放射線外科治療を受けた7症例では,腫瘍の大きさが変わらないか少し縮小したという結果です。
解説:9例中で3例しか全摘出できていません。この有名な施設でも松果体細胞腫の全摘出の率はとても低いです。また,全摘できた2例にも術後に放射線治療がされていて,必要なかったのではないかと思われます。ちなみに,澤村の松果体腫瘍開頭手術70例程の経験の中で,7例 (10%) が松果体細胞腫でした。全例で全摘出できていて,術後に新たな複視などの後遺症は出ていません。また術後放射線治療を1例もしませんでしたが,幸い再発例は経験していません。やはり基本的には手術で全摘出するということでしょう。でも一般的には難しいし、リスクは高いです。放射線治療は有効なのですが、放射線治療後再発例の報告例も多いです。
中間型松果体実質腫瘍 PPTID グレード 2か3
pineal parenchyma tumor of intermediate differentiation WHO grade 2 – 3
- 全ての年齢層に発生します(平均30代後半)
- グレード2かグレード3で,やや悪性という腫瘍です
- 水頭症で頭痛,嘔吐,眼が上の方を向かない(パリノー症候)という症状がでたり,ものが二重に見えたり(複視)で発症します
- 楕円形というよりはややボコボコした形に見えます
- 松果体細胞腫との違いは病理診断ではじめて解ることも多いです
- 病理所見では核の異型性 nuclear atypia というのがあります
- 核分裂能はMIB-1染色で評価しますが,3-10%くらいです,この値が高い方がグレード3です
- グレード2であれば局所放射線治療,グレード3で松果体芽腫に近いような病理像があれば脳脊髄照射が必要です
- 現在では治療成績は良くて長期生存できるのですが,病理所見での悪性度でかなりの開きがあります
成人男性が早朝の頭痛で発症しました。閉塞性水頭症になっているので第3脳室開窓術が行なわれてから紹介されてきました。開頭手術で全摘出して,病理が PPTID グレード3でしたので,脳脊髄照射 24Gy/12fr と腫瘍局所照射 54Gy/27fr をしました。
中間型松果体実質腫瘍 PPTID の症例をもっと見たい方はここをクリック
大事なこと
中間型松果体実質腫瘍は悪性度がある腫瘍で,グレード2か3とされ,松果体実質腫瘍のおよそ20%を占めます。5年生存割合は40-70%程度とされていますが,グレード2か3かはっきりしない場合もあり,病理像で悪性度を判定して慎重に放射線や化学療法のintensity(強さ)を患者さんごとに決める必要があります。MIB-1染色率が高いものは播種、局所再発が高いという傾向があります。病理所見で確実に松果体芽腫といえる部分像がある場合 (pineocytoma/pineoblastoma)には,グレード4として治療します。
中間型松果体実質腫瘍 PPTID の病理
Sheets or large lobules of uniform cells with moderate nulear atypia and low to moderate mitotic activity, transitions from rosette-bearing areas to diffuse, sheetlike growth, 2 > mitoses (10HPFs), 3-10% MIB-1.
松果体芽腫と松果体細胞腫の中間に位置する病理像です。松果体細胞腫より細胞密度が高く,軽度から中等度の核異型があり,分裂能が中等度に高いとされます。左の写真のように,松果体細胞腫に似たrosetteを作りながらも細胞密度が高くびまん性に細胞核が集積する部分も見られたり,右の写真のように「ごく一部」に巨細胞が見られたり核異型を伴う細胞が出現します。Homer Wright rosetteやganglion cellの出現もあります。グレード2とグレード3を分ける基準ははっきりしていませんが,分裂能を基準にすることが多いです。MIB-1が 3 to 10%すから,8%くらいだとグレード3となるかもしれません。また腫瘍の大部分が松果体細胞腫の所見で,一部に上記のような所見のあるものはグレード2とします。注意しなければならないのは,グレード2と3の定義は非常にfazzyであることです。これによって局所照射か脳脊髄照射を選択することはとても危険なのですが (・・?)
中間型松果体実質腫瘍 PPTID の予後
2016年WHOの分類によると,この腫瘍はグレード2か3かのあいまいなところに分類されますから予後にはかなり幅があり,5年生存割合は30-74%程度とされています。Jouvetの論文では,グレード3に入る予後が悪い因子として,核分裂像が多い (mitotic index > 6 per HPFs, MIB-1とは違うので注意!), 壊死の存在,neurofilament protein陰性などをあげています。しかし、この定義に従うと中間型と松果体芽腫との鑑別がかなり難しいものとなり,現実的にはこのようなグレード3の腫瘍は,松果体芽腫と同様な治療が必要となります。
松果体芽腫 pineoblastoma WHO grade 4
- 非常に悪性度が高い未分化胎児性腫瘍です
- 0歳から4歳の小児に多い腫瘍で、年齢中央値は5歳くらい
- 若年成人の例もあります
- 網膜芽細胞腫に合併するのものは,腫瘍抑制遺伝子 RB1 or DICER1の変異によって発生します
- 大多数の他のものは,PB-miRNA1, PB-miRNA2, PB-RB1, PB-MYC/FOXR2
- この内。PB-RB1, PB-MYC/FOXR2変異を有する幼い子供の生命予後が特に悪いです
- 非常に早く増大します,進行が早いので治療を急がなければなりません
- 急速に閉塞性水頭症になるので傾眠などの意識障害で発症する患者さんもいます
- MRI画像では不整形の形をしていて,周囲に足を伸ばす様に伸展しています
- 脳組織の中にも浸潤して入っていきます
- 髄液播種と言って,脳と脊髄の表面に広く転移する性質を持っています
- 手術で完全に摘出することはできません
- 手術摘出した方が予後が良いと言われていますがはっきりしていません
- 手術後には強力な放射線治療と化学療法が必要です
- 化学療法はシスプラチンを基剤とする併用化学療法を使います
- 放射線治療は脳脊髄照射と局所照射が必要です
- 松果体部には54-60グレイくらいの線量を使用します
- 乳幼児と成人例ではかなり生命予後が違います、成人では治る確率は高いとも言えます
- 4歳未満の小児の予後は不良で、2020年時点で5年生存割合は10-20%程度です
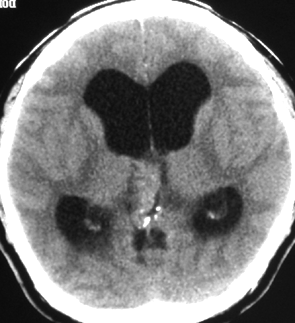

成人男性の松果体芽腫です。左のCTでは白く見える石灰化があります。水頭症があって頭痛と嘔吐で発症しました。右のMRIでは腫瘍の形が丸くなくて周囲の脳に浸潤したり脳室の壁などにべっとり広がっているように見えます。悪性腫瘍の特徴的な像で,開頭手術をしても摘出できないことが判ります。松果体芽腫は悪性度が高くて(WHOグレード4),脊髄などに播種転移したりしますし,手術だけでは治りません。
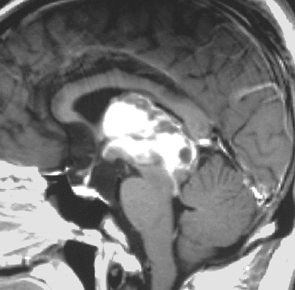
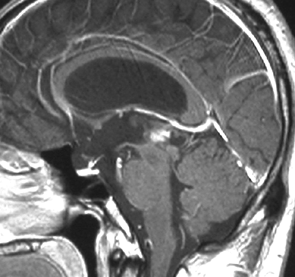
腫瘍は定位脳手術で生検をしました。水頭症に対しては内視鏡で第3脳室開窓術を行なって症状を改善しました。左のMRIで水頭症が良くなっているのが判ると思います。それから,全脳脊髄に30グレイの放射線治療をして腫瘍局所には24グレイの照射を追加しました。同時にICE化学療法というのを6コースしました。右のMRIでは治療が終わって小さく固まった残存腫瘍が見えます。この残存腫瘍は第3脳室の壁にくっついていて摘出するリスクがとても高いと思いましたので,そのままずーっと10年間様子を見ていますが再発していません。でも,残存腫瘍がなんとか取れる時は徹底的に取ってしまった方が再発率は少ないといえます。
松果体芽腫の治療
- まず、乳幼児と青年成人例では治療成績が全く異なる腫瘍だということを認識します
- 全ての症例で水頭症を合併するので,内視鏡による第3脳室開窓術と生検術を行なって、症状の改善と病理診断を確定します
- この腫瘍は出血性ですから内視鏡生検時の出血のリスクは低くはありません
- 大きなものではCTガイドの定位脳手術も選択肢としてあげられます
- 診断時の開頭腫瘍摘出術は,脳組織への浸潤性格により全摘出ができないことと、出血のリスクが高いのでお勧めできません
- でも転移のない年長児あるいは成人例であれば、最初からmaximal safe resectionあるいは全摘出を目指したほうがいいという意見もあります
- 播種性格を有する胎児性腫瘍ですから、開頭手術で細胞を髄液の中にばら撒いてしまうという、手術誘発播種のリスクがあります
- 澤村は生検診断の直後に,化学療法を1コース使用して化学療法反応性を確かめてから,放射線治療へ移行していました
- 多剤併用化学療法が著効する例もあります
- 放射線治療は必須です
- 全脳脊髄照射と腫瘍への追加局所照射を原則とします。腫瘍線量は54Gyから60Gyです
- 4歳未満では脳脊髄照射ができないので、大量化学療法と局所商社での治療が提案されています
- 年長児と成人では、生検術後には,化学療法を1コース行って化学療法の効果を確認した後で,局所照射,続いて全脳脊髄照射,さらに追加の化学療法を行うのが良いのかもしれません
- 腫瘍の増大あるいは播種増悪は早いので,治療の開始と継続には時間的な余裕はありません
- 当然のことながら乳幼児では,脳脊髄照射の是非は症例毎に検討されるべきで,両親との合意のもとに,線量や照射野を逐一選択しなければなりません
- 放射線化学療法の後でさらに腫瘍が残っていれば、それを摘出してしまったほうが再発割合が減るという意見があります (second look surgery)
松果体腫瘍と間違えやすい腫瘍
松果体部のグリオーマ
 若い女性にできた松果体部の毛様細胞性星細胞腫です。手術で全摘出しただけで治りました。この腫瘍は正確には松果体腫瘍ではありません。右の視床というところから発生して,松果体部に伸びて大きくなり一見松果体腫瘍にみえるものです。ですから正確には視床腫瘍なのです。じっくり注意してみれば判ります。
若い女性にできた松果体部の毛様細胞性星細胞腫です。手術で全摘出しただけで治りました。この腫瘍は正確には松果体腫瘍ではありません。右の視床というところから発生して,松果体部に伸びて大きくなり一見松果体腫瘍にみえるものです。ですから正確には視床腫瘍なのです。じっくり注意してみれば判ります。
松果体部の髄膜腫(大脳鎌テント接合部髄膜腫)
30代の女性ですから,松果体細胞腫に見えます。でも,これは大脳鎌テント接合部から発生した髄膜腫です。
中脳水道狭窄も軽度の閉塞性水頭症もあり,松果体腫瘍と区別は難しいと思ってしまうものですが,鑑別できます。また手術は松果体細胞腫より簡単です。
(ここをクリックするともっと詳しく見れます)
PTPR papillary tumor of the pineal region WHO grade 2 or 3
- とても稀な成人(平均32歳)の腫瘍で,グレード2か3です
- 起源は,ependymal cells of the subcommissural organ と推定されています
- 成人女性での報告例が多いです
- 大きな腫瘍で閉塞性水頭症となり,頭痛で発症します
- 比較的に境界明瞭な松果体部腫瘍です
- 画像は松果体細胞腫 WHO grade 1とほとんど見分けがつきません
- 手術摘出だけでは再発率が高く,ごくまれに播種することもあるようです
- 臨床像は上衣腫と類似するようで,悪性腫瘍と捉えた方がよいでしょう
- 治療は摘出術と術後の局所放射線治療が必要とされます
- 5年生存割合は70%ほどとされています
- 病理像は以下のように記述されています
- Microscopically, these neoplasms demonstrated diffuse cellular proliferation with large areas demonstrating papillary features and well-formed glands. The cellular structures demonstrate cells that have a moderate amount of eosinophilic cytoplasm and mildly nonuniform round-to-oval nuclei with a prominent basophilic nucleolus. Signet ring cells may be present. Moderate mitotic figures were notable. Immunohistochemical studies demonstrated dramatic immunoreaction in the PTPR neoplastic cells against cytokeratin, S-100 protein, NSE, and vimentin, whereas the PTPR neoplastic cells were not immunoreactive for synaptophysin and had variable staining for EMA. Among the more common differential diagnoses to consider is papillary ependymoma. The cellular structure of PTPR shows them to be less papillary than CPP but significantly more differentiated than would be expected for choroid plexus carcinoma.. 病理診断で転移性腺癌と誤診されることがあるようです。
- Dagnew E, et al.: Papillary tumors of the pineal region: case report. Neurosurgery 60: 953-955, 2007
- Kern M. et al.: Papillary tumor of the pineal region – a new pathological entity. Clin Neuropathol 25: 185-192, 2006
Desmoplastic myxoid tumor of the pineal region, SMARKB1-mutant
- 思春期から成人にみられる腫瘍です,中央値は40代くらい
- 松果体に発生します
- 組織構築はdesmoplasiaと粘液状変性を特徴とし,spindle cellと類上皮様細胞がみられます
- 組織像からは未分化な脊索腫のようみも見えるものです
- INI1欠失とSMARKB-1遺伝子変異があります
- MIB-1染色率は3%程度と低く,増殖は遅いので良性の経過をたどるものもあります
- 治癒するものから激しい増殖を示すものまであり多数例での長期予後は判然としません,Thomasは7例中3例が亡くなったと報告しています
1. Thomas C: Desmoplastic myxoid tumor, SMARCB1-mutant: clinical, histopathological and molecular characterization of a pineal region tumor encountered in adolescents and adults. Acta Neuropathol, 2020
trilateral retinoblastoma
- 乳幼児に発生する腫瘍です
- 両眼(片側のこともあり)に網膜芽細胞腫 retinoblastomaができて,なおかつ頭の中心部(松果体か鞍上部)に胎児性腫瘍ができる悪性の疾患です
- 多くは神経芽細胞腫 neuroblastic tumor (松果体芽腫 pineoblastoma ) を合併します
- 通常は網膜芽細胞腫が発見されて,その後(数ヶ月とか数年とか)に松果体腫瘍ができます
- 両側の網膜芽細胞腫の5%ほどに、松果体芽腫が発生します
- 松果体腫瘍がないかどうかを調べて,小さいうちに早めに発見して治療すれば治ることもあります
- 高率に髄液播種転移します
- 治療は,放射線治療が使用できない例では,大量化学療法と末梢血幹細胞移植です
- 5年生存割合は40%ほどです
- でも大きな松果体芽腫になってしまうと5年生存割合は10%以下です
松果体腫瘍の手術法の変遷
- この100年間に様々な外科手術法が開発され発展しました
- 20世紀初頭、Dandyはparietal parasagittal transcallosal approachを用い,Van Wagenenはtransventricular approachを報告ましたが,彼らの時代においての手術死亡率は,非常に高いものでした
- 1920年にKrauseは,infratentorial supracerebellar approachを用いて,3手術成功例を発表し、Steinが1970年代にこの手法を確立させたことで有名です
- 1960年代になり,Poppenがsuboccipital approachを開発し,その後Jamiesonが現在汎用されているoccipital interhemispheric transtentorial approachにまで発展させました
- この経テント法 OTA occipital interhemispheric transtentorial approachが,現在は標準的な手術到達法です
松果体腫瘍に関して,横浜市立大学の山本哲哉が御相談にのります,メールを送りたい方はここをクリックしてください
文献情報
中間型松果体実質腫瘍の治療成績
Pineal Parenchymal Tumors of Intermediate Differentiation: A long-Term Follow-Up Study in Helsinki Neurosurgery. World Neurosurg 2019
ノルウェーからの報告です。15例が、積極的な手術摘出と病理所見に応じた放射線治療 (9例)で治療されました。10年ほどの追跡期間で生存割合は57%であったとのことです。
松果体実質腫瘍への放射線治療
Kumer N: Role of radiotherapy in residual pineal parenchymal tumors. Clin Neurol Neurusurg 2018
2006年から16年に、松果体実質腫瘍14例に手術後放射線治療 45-54Gy が加えられました。12例では3D-conformalです。8例がグレード1の消化体細胞腫、4例がPPTID、2例がグレード4の松果体芽腫でした。脳脊髄照射は2例に行われました。3例の消化体細胞腫と2例の松果体芽腫で再発があり、2例の松果体細胞腫と2例の松果体芽腫が死亡しました。
「解説」摘出すれば治るグレード 1の松果体細胞腫に放射線治療依存の治療をして、2例を失っています。逆に、松果体細胞腫 pineocytomaは、3D-conformal RTでは高率に再燃するということが言えます。手術で全摘出するべき腫瘍です。
Evaluation of age-dependent treatment strategies for children and young adults with pineoblastoma: analysis of pooled European Society for Paediatric Oncology (SIOP-E) and US Head Start data. Neuro Oncol 2017
ヨーロッパと米州で治療を受けた153例の報告です。年齢中央値は4.9歳です。4歳未満57例の5年生存割合 PFS/OSは、10%強程度と極めて不良でした。9割が死亡に至ったということです。脳脊髄照射あるいは、大量化学療法と局所照射を受けた時に生存し得たようです。4歳以上で播種がない場合の5年生存割合は70%程度、播種があった場合で50%ほどでした。この年齢層ではほとんどが脳脊髄照射と化学療法を受けています。放射線化学療法の順序にインパクトはなく、大量化学療法のインパクトも低かったとの結論です。4歳以下では、大量化学療法と局所照射が提案されるとしています。
PPTIDはsmall-cell typeとlarge-cell typeに分類される
Histopathologic review of pineal parenchymal tumors identifies novel morphologic subtypes and prognostic factors for outcome. Neuro Oncol 2017
UCSFから松果体実質腫瘍70例の総括報告です。結論として、PPTIDは、組織学的に2つのタイプに分類されるとのことです。small-cell morphologic subtypeと large-cell morphologic subtypeです。大きな細胞で構築されるPPTIDの予後は悪いようです。
St. Jude子供病院での松果体芽腫:年長児では初発時に全摘出した方が良い
Pineoblastoma-The Experience at St. Jude Children’s Research Hospital. Neurosurgery 2017
1997年から2015年までに41例の松果体芽腫が治療されました。年齢中央値は5.5歳で、追跡期間中央値34ヶ月です。19例が中央値11ヶ月で再発して、18例が亡くなりました。再発例の年齢中央値は2.7歳で幼い例に多く、診断時に播種転移がすでにあった例であったそうです。5歳以上で播種がない例では、初発時に全摘出もしくはnear-total resectionができていた場合に、再発死亡例はなかったとのことです。初回治療で全摘出した方が良い maximal tumor resection should be the goal との結論でした。
松果体腫瘍へのガンマナイフ 放射線外科治療 SRSの治療成績
Histology-Stratified Tumor Control and Patient Survival After Stereotactic Radiosurgery for Pineal Region Tumors: A Report From the International Gamma Knife Research Foundation. World Neurosurg. 2017
1989年から2014年に70例がSRS治療されました。pineocytoma (26例), pineoblastoma (13例), pineal parenchymal tumor of intermediate differentiation (7例), papillary tumor of the pineal region (6例)を含みます。松果体細胞腫で20年制御割合 control rateは81%、PPTIDで5年制御割合は50%、松果体芽腫で27%でした。この治療成績はかなり悪いと言わざるを得ません。
松果体芽腫の5年生存割合は70%ほど?
Clinical outcomes and patterns of failure in pineoblastoma: a 30-year, single-institution retrospective review. World Neurosurg 2014
MDアンダーソン病院からの報告です。1982年から2012年までに31例の松果体芽腫が治療されていて、年齢中央値は18歳でした。21例で外科摘出が行われ、全摘出は9例でした。放射線治療は30例で、分割照射16例、陽子線照射13例、放射線外科治療1例でした。脳脊髄は36グレイ、腫瘍局所は54グレイが用いられています。化学療法の時期は様々であり、照射前10例、照射中10例、照射後22例です。全生存期間中央値は8.7年で、5年生存割合は70%ほどです。播種を伴う例で治療が難しく、脳脊髄照射は必要であると結論しています。
「解説」この報告の年齢中央値はとても高いです。もしかするとPPTIDが混在しているので長期生存率が高いのかもしれません。
小児の松果体芽腫への放射線化学療法
Hinkes BG et al. Childhood pineoblastoma: experience from the prospective multicenter trials HIT-SKK87, HIT-SKK92 and HIT91. J Neurooncol 2007
ドイツを中心にしてされた臨床研究で11人の子供たちが治療されました。3歳未満は5人で,3歳以上は6人です。3歳以上の6人では,手術の後に全脳脊髄の放射線治療と化学療法がされて,5人で腫瘍が消失して,中央値8年の段階で5人が生存していました。しかし,3歳未満の5人では中央値1年くらいで全員が死亡しています。3歳未満では,播種があったこと,手術で全部取れなかったこと,幼いので放射線治療ができなかったことが死亡の原因かもしれないと書かれています。また3歳未満の小さな子供にできる松果体芽腫は悪性度が高いのではないかと想像されています。
解説:松果体芽腫は,脳に浸潤して癒着するので手術で全部取れないことが多いです。ですから手術で診断がついたらすぐに,全部の脳と脊髄を含めた放射線治療と化学療法を開始する必要があるでしょう。一方,小さな子供には全脳脊髄照射ができないので,内視鏡での生検術で病理診断がついたら,化学療法をすぐに開始して,播種がない時には松果体腫瘍に対する局所照射も同時に併用するべきでしょう。化学療法だけでは治らないでしょうし,子供であっても松果体局所のみであれば放射線による認知障害も受け入れられる程度かもしれません。
Trilateral retinoblastomaに合併した松果体芽腫の化学療法
Dunkel IJ, et al.: Trilateral retinoblastoma: potentially curable with intensive chemotherapy. Pediatr Blood Cancer 54: 384-387, 2010
この論文に化学療法の有効であった例が記載されています。Induction chemotherapy generally included vincristine, cisplatin or carboplatin, cyclophosphamide, and etoposide. Hematopoietic stem cells typically were harvested after the first or second cycle of induction chemotherapy, usually from peripheral blood. High-dose chemotherapy regimens were thiotepa-based (n = 7) or melphalan and cyclophosphamide (n = 3).
この治療で13人のうちの5人が放射線治療を受けることなく無増悪長期生存していたとのことです。でも生存者の5人のうち4人は播種がない患児でした。
松果体実質腫瘍の予後因子
Fauchon F, et al.: Pineal parenchymal tumors: clinicopathological study of 76 cases. Int J Radiat Oncol Biol Phys. 46:959-968, 2000
19例の松果体細胞腫,28例の中間型 PPTID,29例の松果体芽腫の追跡報告です。 著者らの分類では,grade Iは11例,grade IIは27例,grade IIIは20例,grade IVは18例だったとのことです。積極的な外科切除は44例でされていますが,周術期に9例が死亡しています。44人が放射線治療を受け,15人が化学療法を受けています。観察期間中央値85ヶ月で41人(54%)が生存しています。治療後の再燃は26人にみられました。予後の良かった因子として,年齢が20歳以上,腫瘍の径が25mm未満,組織学的に悪性度が低い(low grade)であったとのことです。
松果体実質腫瘍の予後因子
Jouvet A, et al.: Pineal parenchymal tumors: a correlation of histological features with prognosis in 66 cases. Brain Pathol 10: 49-60, 2000
66例の松果体実質腫瘍の調査です。松果体細胞腫が11例,中間型が39例,松果体芽腫が16例です。予後が悪い因子として,核分裂像が多い (mitotic index > 6 per HPFs, MIB-1とは違うので注意!), 壊死の存在,neurofilamane protein陰性などをあげています。

松果体周囲の静脈洞
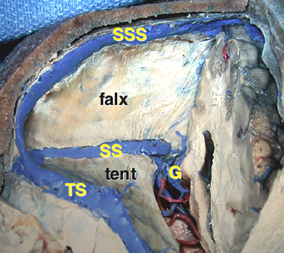
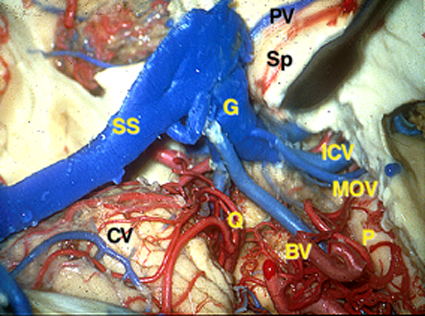
Overview of the pineal region through the right occipital area. The occipital lobes, the falx, the tentorium, and the arachnoid membranes have been removed. BV = basal vein of Rosenthal, CV = cerebellar vermis, G = great vein of Galen, ICV = internal cerebral vein, MOV = medial occipital vein, P = pulvinar, PV = pericallosal vein, Q = quadrigeminal plate, S = splenium, SS = straight sinus, TS = transverse sinus
文献
- Allen JC, Kim JH, Packer RJ: Neoadjuvant chemotherapy for newly diagnosed germ-cell tumors of the central nervous system. J Neurosurg 67: 65-70, 1987
- Allen JC, DaRosso RC, Donahue B, Nirenberg A: A phase II trial of preirradiation carboplatin in newly diagnosed germinoma of the central nervous system. Cancer : 940-944, 1994
- Aoyama H, Shirato H, Ikeda J, Fujieda K, Miyasaka K, Sawamura Y: Induction chemotherapy followed by low-dose involved-field radiotherapy for intracranial germ cell tumors. J Clin Oncol 20: 857-865, 2002
- Balmaceda C, Heller G, Rosenblum M, Diez B, Villablanca JG, Kellie S, Maher P, Vlamis V, Walker RW, Leibel S, Finlay JL (1996) Chemotherapy without irradiation – A novel approach for newly diagnosed CNS germ cell tumors: results of an international cooperative trial. J Clin Oncol 14: 2908-2915.
- Bamberg M, Kortmann RD, Calaminus G, Becker G, Meisner C, Harms D, Gobel U: Radiation therapy for intracranial germinoma: results of the German cooperative prospective trials MAKEI 83/86/89. J Clin Oncol 17:2585-2592, 1999
- Bayens YC, Helle PA, Van Putten WL, Mali SP (1992) Orchidectomy followed by radiotherapy in 176 stage I and II testicular seminoma patients: benefits of a 10-year follow-up study. Radiother Oncol 25: 97-102.
- Calaminus G, Bamberg M, Baranzelli MC, Benoit Y, di Montezemolo LC, Fossati-Bellani F, Jurgens H, Kuhl HJ, Lenard HG, Curto ML : Intracranial germ cell tumors: a comprehensive update of the European data. Neuropediatrics 25: 26-32, 1994
- Chang SM, Lillis-Hearne PK, Larson DA, Wara WM, Bollen AW, Prados MD: Pineoblastoma in adults. Neurosurgery 37: 383-390, 1995
- Chiechi MV, Smirniotopoulos JG, Mena H (1995) Pineal parenchymal tumors: CT and MR features. J Comput Assist Tomogr 19: 509-171
- D’Andrea AD, Packer RJ, Rorke LB, Bilaniuk LT, Sutton LN, Bruce DA, Schut L (1987) Pineocytomas of childhood. A reappraisal of natural history and response to therapy. Cancer 59: 1353-1357
- Fauchon F, Jouvet A, Paquis P, Saint-Pierre G, Mottolese C, Ben Hassel M, Chauveinc L, Sichez JP, Philippon J, Schlienger M, Bouffet E: Parenchymal pineal tumors: a clinicopathological study of 76 cases. Int J Radiat Oncol Biol Phys. 2000 Mar 1;46(4):959-68
- Jakacki RI, Zeltzer PM, Boyett JM, Albright AL, Allen JC, Geyer JR, Rorke LB, Stanley P, Stevens KR, Wisoff J, et al.: Survival and prognostic factors following radiation and/or chemotherapy for primitive neuroectodermal tumors of the pineal region in infants and children: a report of the Childrens Cancer Group. J Clin Oncol 13: 1377-1383, 1995
- Jouvet A, Saint-Pierre G, Fauchon F, Privat K, Bouffet E, Ruchoux MM, Chauveinc L, Fevre-Montange M: Pineal parenchymal tumors: a correlation of histological features with prognosis in 66 cases. Brain Pathol. 2000 Jan;10(1):49-60
- Kochi M, Itoyama Y, Shiraishi S, Kitamura I, Marubayashi T, Ushio Y: Successful treatment of intracranial nongerminomatous malignant germ cell tumors by administering neoadjuvant chemotherapy and radiotherapy before excision of residual tumors. J Neurosurg 99: 106-114, 2003
- Lutterbach J, Fauchon F, Schild SE, Chang SM, nstecher A, Volk B, Ostertag C, Momm F, Jouvet A: Malignant pineal parenchymal tumors in adult patients: patterns of care and prognostic factors. Neurosurgery 51: 44-55, 2002
- Sawamura Y, de Tribolet N, Ishii N, Abe H (1997) Surgical management of primary intracranial germinomas: diagnostic surgery or radical Resection ? J Neurosurg 87: 262-266
- Sawamura Y, Ikeda J, Shirato H, Tada M, Abe H (1998) Germ cell tumors of the central nervous system: treatment consideration based on 111 cases and their long-term clinical outcomes. Eur J Cancer 34: 104-110
- Sawamura Y, de Tribolet N: Neurosurgical management of pineal tumors. Adv Tech Stand Neurosurg 27: 1-22, 2001
- Schild SE, Scheithauer BW, Schomberg PJ, Hook CC, Kelly PJ, Frick L, Robinow JS, Buskirk SJ: Pineal parenchymal tumors. Clinical, pathologic, and therapeutic aspects. Cancer 72: 870-880, 1993
- The Committee of Brain Tumor Registry of Japan (BTRJ): Brain Tumor Registry of Japan (BTRJ 1969-1996), 11th edition, Neurol-Med Chir 43: 29, 2003 (suppl)