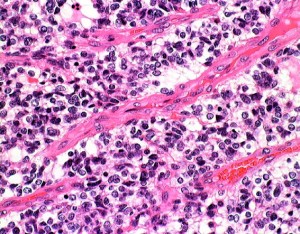
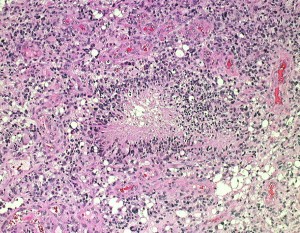
乏突起膠腫 oligodendroglioma、乏突起膠細胞系腫瘍 oligodendroglial tumors
- 乏突起膠腫(ぼうとっきこうしゅ)は,グリオーマ(神経膠腫)と呼ばれる脳腫瘍の一種です
- 業界用語でまとめてオリゴといいます
- オリゴには,グレード2(悪性度が低い)とグレード3(悪性度が高い)があります
- 「完全に治る確率が高いグリオーマ」です,期待をもってきちんとした治療を受けましょう
- 脳を作る乏突起膠細胞から発生すると考えられていましたが異論もあります
- 主として成人の大脳から発生する腫瘍ですが小児にも稀ではありません
- CTで石灰化(石灰の固まりが白く映る)があると腫瘍はゆっくり大きくなると判断されます
- グレード2では,てんかん発作(けいれん)で発症することが多いです
- グレード2では,10年以上かけてゆっくり大きくなるものがあります
- ですから,腫瘍が見つかっても慌てて開頭手術をしない
- グレード3だと,数週間のうちに激しく増大することがあります
- 浸潤性に脳にしみ込むように発育するので大きくなると摘出できなくなります
- 病理診断がむずかしい腫瘍ですから脳腫瘍に詳しい病理医の協力が必要です
- 一般に,星細胞 アストロサイトの部分像が少ない方が予後が良いです
- 悪性度にはいろいろありますが,どのようなオリゴでも大きくなって脳を広範に侵せば命が危ない疾患なので,良性腫瘍とは考えない方がいいでしょう
- 治療は,手術摘出,放射線治療,化学療法(テモゾロマイド)が有効ですから組み合わせます
- でも,治療法の選択はとても複雑です
- 化学療法だけで治すことはできないと考えたほうがいいでしょう
- ついに2023年,いままで有効な治療薬がなかった星細胞腫グレード2に,ボラシデニブ vorasidenib(ボラニゴ Voranigo)という経口薬が登場しました ヾ(^▽^)ノ
- 日本では,2024年12月末ボラシデニブの承認申請がされました
- 放射線治療は,範囲を絞って低線量にすることをめざします
- 2022年,生存期間中央値はグレード2でもグレード3でも14年を超えます。
- 星細胞系腫瘍(星細胞腫と膠芽腫)より治る期待は大きいです
症状
- ゆっくり増殖する腫瘍で,急激な神経症状の悪化を見ることは少ないです
- 症候性てんかん(症候性局在関連てんかん SLRE,けいれん発作)で発症するのが60−80%くらいです
- 緩徐進行性の視野障害,半身の感覚障害や麻痺,認知機能低下もあります
- 頭痛や嘔吐などはまれですが,まれに,腫瘍内出血を生じて急性発症します
- MRIが汎用されなかった時代では,診断までの症状の継続期間は,中央値で3年,平均値で4年と非常に長いとされていました
診断 CT
- 診断のためにはCTとMRIが必須です
- CTでは,石灰化やのう胞を伴う境界不鮮明な低吸収域(黒っぽく見える)として捉えられます
- 特に石灰化は星細胞系腫瘍との鑑別診断に非常に重要な所見です
- 脳石 brain stoneといわれる岩のような大きな塊の石灰化もあります
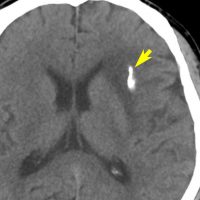
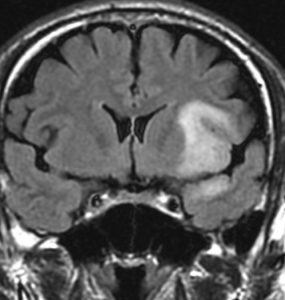
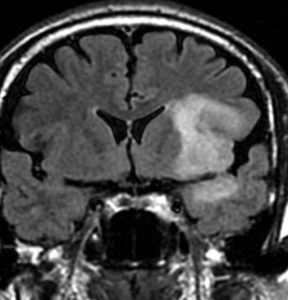
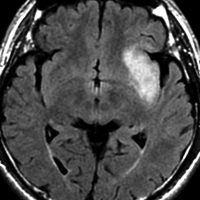
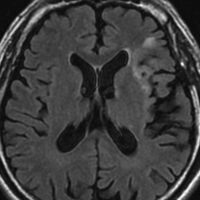
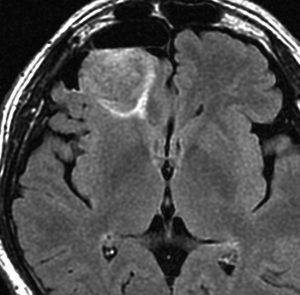
CTで白く見えるのが石灰化です。周りの少し黒っぽいところは乏突起膠腫です。CTでは腫瘍の全体像は見れませんからMRIが必要です。
診断 MRI
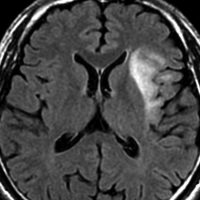
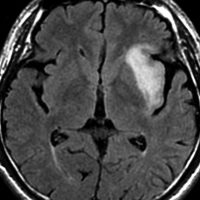
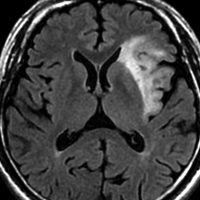
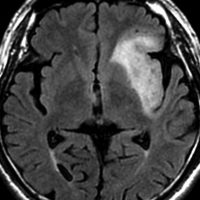
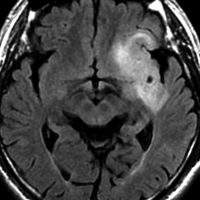
- MRI-T1強調画像では低信号となり,T2強調画像とフレア画像では高信号域となります
- グリオーマの中では,T2強調画像での腫瘍内部のコントラストが強く,石灰化の部分は強い低信号域として,のう胞は均一な強い高信号域となります
- 周囲脳組織浮腫あるいは腫瘍浸潤部は淡い高信号域として描出されます
- 脳浮腫を伴うものはグレード3の可能性が高いです
- ガドリニウムによる造影では,悪性度が高くなるにつれて部分的な増強像が増えます
- 脳血管撮影 DSAは不要です
MRI画像ではびまん性星細胞腫と区別がつかないものがあります
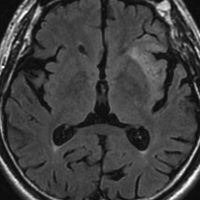
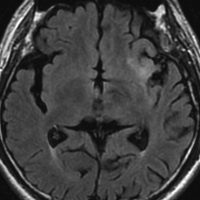
左は脳ドックで発見された時のMRIです。壮年男性で無症状でしたので経過観察をしました。fronto-insulo-temporal gliomaと呼ばれる腫瘍で,びまん性星細胞腫と区別がつきません。右は無治療で6年後の画像です。ごくわずかに増大していますが,患者さんは相変わらず無症状で普通に働いています。このように数年間経過を見ても問題ない例もありますし,逆に数ヶ月で顕著な増大傾向を示すものもあります。発見されたらまずは,MRIを2ヶ月くらいで繰り返してどのくらいの速さで進行するかどうかをみるのが大切です。
2つの病理診断があって治療法が異なります WHO 2021
1. 乏突起膠腫 グレード 2
2. 乏突起膠腫 グレード 3
-
-
- 病理診断では,IDH遺伝子変異と第1染色体/第19染色体の欠失を必ず調べます
- 2022年時点では,FISHという診断法が最も汎用されています
- 2016年 WHO分類から,IDH mutationと1p/19q codeletion がないとオリゴと言わないことになりました
- 2016年分類では,乏突起星細胞腫 グレード 2 OA oligoastrocytomaと退形成性乏突起星細胞腫 グレード 3 AOA anaplastic oligoastrocytomaが削除されました
- さらに2021年,退形成性乏突起膠腫 グレード3 anaplastic oligodendroglioma の病名が削除されました
- 免疫組織染色で明らかなloss of nuclear ATRX expressionがあれば,星細胞系腫瘍です
- 乏突起膠腫のグレード2とグレード3は,病理組織像で決定されます
- このページでは,あえて乏突起星細胞腫や退形成性乏突起膠腫の記述を残します
- 海外文献にも新たな2021年WHO分類に即した臨床データが無いから,その情報もわからないと治療法の選択に困るからです
- しばらくこの混乱が続きます
-
手術
- 生活に困るような症状を出す危険のある無理な手術はしません
- 脳深部にあるか摘出すると後遺症が出てしまうようなものでは,病理組織診断のためだけの生検術が選択されます
- 完全摘出すれば治るので,症状を出さないで全部取れると判断すれば積極的に摘出します
- 腫瘍のかなりの部分が摘出できると判断した場合には,症状を出さない程度の無理のない開頭摘出術をします
- びまん性星細胞腫との大きな違いは,限局性のオリゴは手術で完全摘出できるチャンスがあり,手術だけで治る例があるということです
- グレード3であっても「完全摘出 complete / supratotal resection」できれば,手術だけで治癒します
化学療法
- 局所放射線治療が有効です
- 薬は,テモゾロマイドが最も汎用されます
- ヨーロッパで標準治療となっている PCV化学療法(プロカルバジン,ロムスチン,ビンクリスチン)は,日本では使用できません
- 中心となる薬剤ロムスチン(CCNU)が保険診療認可されていないからです
- 高価な薬となり,米国でも2021年に保険診療での認可が取り消されました
- 2023年に,ボラシデニブ vorasidenib(飲み薬)の臨床第3相試験の結果が発表され,無増悪生存期間の延長が証明されました,米国で認可され。もうすぐ日本でも使用できるようになるのでしょう
- ボラシデニブの登場で,おそらく化学療法のガイドラインが変わります
- ニドランをロムスチンの代わりに使うPAV化学療法の有効性は全く証明されていません
ボラシデニブの使い方
ボラシデニブを投与すると変異型のIDH1/2遺伝子の働きを抑えて,腫瘍細胞内の2-HGが減少します。そうすると腫瘍細胞お増殖能が低くなって腫瘍増大を抑制します。
臨床の場では,経口投与でボラシデニブ40mgを毎日一回,決まった同じ時間に服用します。毎朝の朝食後とか,夕食後とかです。噛まずに飲み込みます。
対象は,12歳以上,グレード2の星細胞腫か乏突起膠腫,IDH1/2変異があること,手術後で生検術でも部分摘出でも全摘出でも投与できます。日本では,日本セルヴィエが2024年12月24日、抗がん剤・ボラシデニブクエン酸水和物について、IDH1又はIDH2遺伝子変異陽性の神経膠腫を対象疾患に承認申請しました。
ボラシデニブの副作用(有害事象)
倦怠感,疲労感,頭痛,嘔気,下痢,筋肉痛(骨格筋痛),関節痛,便秘,風邪などの感染症,稀にてんかん発作
血液検査では,ALT, AST, γ-GTP, ALP, ビリルビン上昇,好中球減少です。臓器障害では肝障害がもっとも頻度が高いです。
ひどい倦怠感が日常生活の障害となりますが,体力をなくさない程度に運動して,また大事な仕事のために休憩をとってというバランスが大切になります。
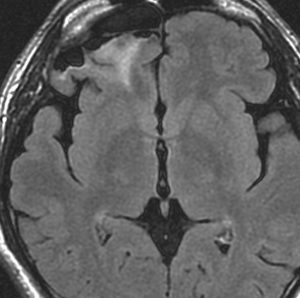
2010年無症状の時の画像です。こんなのを手術で摘出したら認知機能が落ちて人格が変わります。だから経過観察しました。
2015年のテモゾロマイドを開始する前の画像です。2014年にちょびっと生検術をして1p/19q欠失,IDH変異はわかっていました。2015年に全般発作を起こしたので治療を開始しました。テモゾロマイドを 2年 24コース続けました。乏突起膠腫は大きくなる時,てんかんを生じることが多いです。
2020年の画像です。腫瘍はかなり小さくなって再燃(再発)していません。てんかんも抑制されて発作はありません。無症状です。
この例は,手術も放射線治療もしないで,乏突起膠腫が10年以上,制御できることを示しています。また,テモゾロマイド治療でてんかん発作が少なくなることも有名な事実です。
でも,現実はこんなに甘くない? 2025年時点で,治癒を目指すなら低線量放射線治療を加えるべきと考えられています。
放射線治療
グレード2と3では大きな違いがあるので,下の方を読んでください
てんかん発作の治療は別ページにあるのでここをクリック
乏突起膠腫グレード2では,テモゾロマイドの投与によって,症候性てんかん発作が軽減することはよく知られています。また手術でも放射線治療でも化学療法でも,乏突起膠腫に有効な治療がなされれば,てんかん発作は消失するか抑制されます。逆に,乏突起膠腫が再発/再燃する時には,てんかん発作が生じます。
予後
- 過去の試験によれば1p/19q欠失があるもので,
- グレード2の生存期間中央値は,14年以上とされます
- グレード3の生存期間中央値は,14年以上とされます
- まれですが,homozygous deletion of CDKN2A at 9p21のあるものの予後は不良です
グレード2のオリゴ 乏突起膠腫
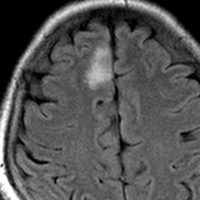
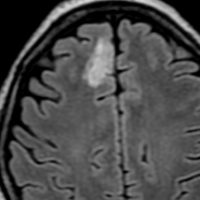
平均的な増大速度を示した乏突起膠腫グレード2です。左が無症状で発見された時,右が3年後で,ごくわずかに増大しています。開頭手術で摘出しました。
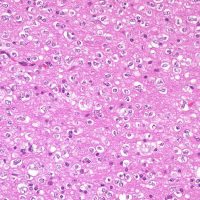
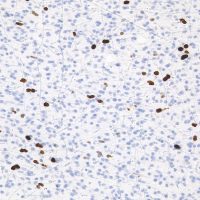
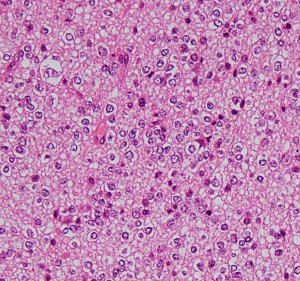
HE染色では細胞核の周りが抜けるような典型的なhalo(左側の写真)があります。1p/19q欠失があり,MIB染色率(右側)は4%でした。
- 数年単位でゆっくり大きくなるものが多いです
- 分化度の高いグレード2のオリゴは20-30年もかかってゆっくり大きくなって症状を出すものもあります
- なかには,20年観察してもほとんど増大しないものがあります,グレード1と言ってもよいようなオリゴです
- 十年以上におよぶ「てんかん」を有する高齢者で,石灰化を伴う乏突起膠腫が疑われたら,抗けいれん剤の投与のみで経過をみてもよいです
- ただし,グレード2と考えられる,腫瘍が大きくない,周囲の脳を圧迫していないという条件下です
- ゆっくりとはいえ,大きくなってくる腫瘍なので,若い人では積極的に治療を考えます
- 治療は手術で完全摘出できれば治ります
- 「かなり確実に」完全摘出できれば,放射線治療や化学療法をしないで経過観察します
- しかし,残念ながら完全摘出できる頻度は高くありません
- グレード2は予後が良いので症状を悪化させてまでは無理に摘出しません
- 40歳以下の患者さんで,てんかん発作しか症状がない患者さんでは,手術後に少し腫瘍が残っても放射線化学療法しないでまず経過を見るという意見があります
- でも残念ながらほとんどの場合で残った腫瘍は増大して広がっていきます
- ヨーロッパではPCV化学療法が第一選択ですが,日本では使用できません
- 手術後に,テモゾロマイド単独治療で数年以上腫瘍制御ができることがわかってきました
- でもこれはある程度,腫瘍の進行を遅らせるという効果の評価においてです
- 放射線治療を加えないテモゾロマイド単独治療は,腫瘍を治す力はないのかもしれません
- テモゾロマイド単独ですと,治療後数年の長期を見れば再燃することが多いからです
- でも若い患者さんで,「治癒 true cure」を目指すのであれば,手術後に残った腫瘍には50 (45-54) グレイ程度の局所放射線治療とテモダール化学療法をします
- 2024年,臨床第3相試験の結果で,初期治療で放射線治療50.4Gy18分割にテモゾロマイドを加えた方が10年生存割合が40%から70%まで上昇すると報告されました
- テモゾロマイドの最適投与期間に関してもはっきりしたデータはありません
- テモゾロマイドはアルキル化剤なので発癌性を有しています,長期投与すると白血病などを生じることもある化学療法剤です
- 長期生存や治癒ということを目指す場合には,低線量放射線治療とテモゾロマイドを併用したほうが良いです
- 治る期待がもてるグリオーマです
手術できない大きなグレード3でも治る期待がある
覚醒下手術などの積極的な手術をしてはいけない
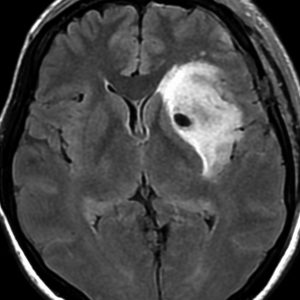
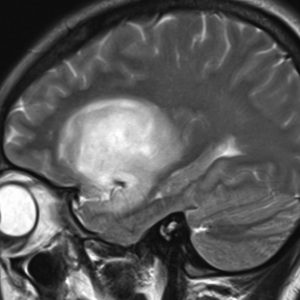
若い女性の左前頭葉から島回,側頭葉を侵す腫瘍で,てんかん発作で発症し,開頭生検 biopsy しました。
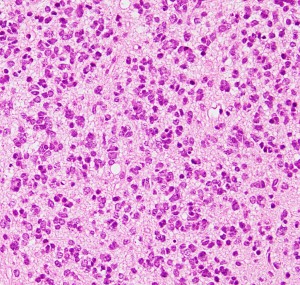
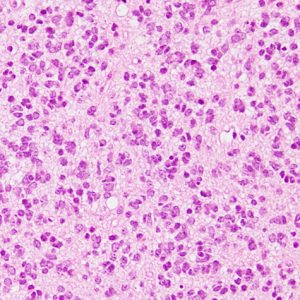
一部で,細胞密度が高く,核の腫大とクロマチンの増量,核間距離の短縮があり,核分裂像が認められ,MIB-1染色率が10%です。組織学的には退形成性乏突起膠腫グレード3とされました。
IDH変異あり,1P/19q欠失あり,ATRX変異なしです。
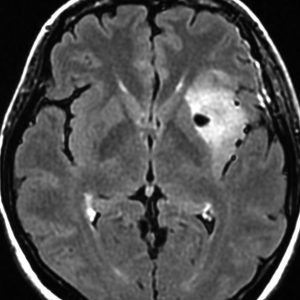
乏突起膠細胞系グリオーマなので,放射線治療の高線量領域はあまり広くとりません。
IMRT Simultaneous Integrated Boost (SIB)で,FLAIR高信号の領域に54グレイ27分割,周囲仮定浸潤領域 generous local areaに46グレイを照射しました。
テモゾロマイド75mg/m2を併用しています。
左の画像は放射線治療直後のMRIですが,すでに腫瘍の縮小がみられます。
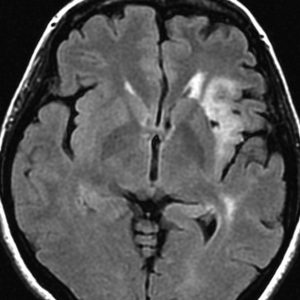
テモゾロマイドの維持療法は,24コース 2年間行い,それ以降は無治療としました。
照射後7年の画像です。腫瘍は縮小したまま,患者さんは無症状で経過しています。
グレード3のオリゴ 退形成性乏突起膠腫
- 悪性度のやや高いものです
- 2015年までは,第1染色体と第19染色体の欠失( 1p/19q codeletion) が大部分の腫瘍細胞に認められる場合には,生存期間は大幅に延びるとされました
- 2016年にWHO組織診断が変わったので20年単位の長期予後は世界の誰にもわからなくなりました
- グレード3の5年生存割合は75%くらいです
- グレード3のオリゴ全体の平均余命は10年以上でしょう
- 治ってしまって30年生存している患者さんもいます
- 1ヶ月くらいでびっくりするくらい広がってしまうものもあり、乏突起膠腫グレード3といっても千差万別ですから,治療選択の判断は急いでください
- 手術でできるだけ多く取った方が治る確率が増しますが,無理はしない
- 40歳以下の若い患者さんで,手術で「もし確実に」完全摘出できれば,放射線化学療法をしないで経過観察もできます
- しかし,遺伝子検査でhomozygous CDKN2A/B deletionがあるものは経過観察できず,すぐに60グレイの放射線治療をします
- 術後には放射線治療と化学療法をします
- グレード3のオリゴには放射線治療に,PCV化学療法(プロカルバジン、ロムスチン,ビンクリスチン)を加えると生存期間が延長できます
- 1p/19q欠失がありPCV化学療法を用いると,生存期間中央値は14年を越えるとされます
- 日本ではロムスチン CCNU が使えないのでニドラン ACNU を替わりに使用(PAV療法)しますが、科学的に有効性は証明されていません,使用する根拠がありません
- ロムスチンは個人輸入で入手できますが高価で手が出ません
- 2021年現在,PCV療法よりも,テモゾロマイドを使用する傾向が世界的に一般的です
- PCVよりテモゾロマイドの方が副作用が少なくて使いやすいのが一番大きな現実的理由です
- でも実は,PCVとテモゾロマイドの真の優劣は2022年でも決着がついていません
- 日本でのグレード3のオリゴの標準治療は,局所放射線治療とテモゾロマイド化学療法と言えます
- 化学療法は見た目も有効で腫瘍が小さくなることが多いのですが,完全に消えたりはしませんし,かなり頻度で再発(再燃)します
- 認知機能低下を避けるために,放射線治療をしないでテモゾロマイド単独治療をするという選択肢がありますが,生存期間が短くなる恐れがあります
- とても注意しなければならないのは,化学療法だけで治癒することはかなり少ないということを知っておくことです
- 手術だけできる病院で治療できる疾患ではありませんから,乏突起膠腫などのグリオーマと予想された時には少なくとも放射線治療ができる病院で治療を受けましょう
- 放射線治療はサイバーナイフなどの定位少分割放射線治療よりは従来の多分割照射を使うべきです
- 大きな腫瘍の場合,放射線障害を少なくするためにはIMRTという照射方法が優れています
- グレード3への放射線の量は59.4グレイというのが多いのですが,放射線による脳障害もかなり強く出ます
- 認知機能を保つためにグレード3には54グレイ程度を使用したほうがいいでしょう
再発した時
右前頭葉の乏突起膠腫グレード2です。46グレイとテモゾロマイドの治療で落ち着いていました。右側は初回治療後12年目の再発です。
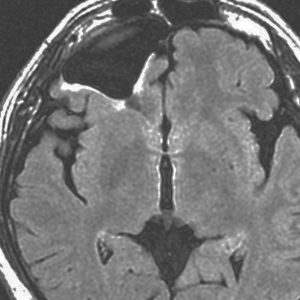
とても限局性の再発でしたので,開頭手術で全摘出 supratotal resection しました。
オリゴには,浸潤性ではなくて,表面的で限局性の再発も多いです。でも多少は浸潤しているので,再度の再発の可能性は残ります。
乏突起膠腫の症例と病理は別ページにあります(ここをクリック)

ここから下は専門医向け
組織診断と遺伝子タイプが矛盾したらどうするか?
- 組織診断で乏突起膠腫とされても,遺伝子診断で IDH, ATRX, TP53変異があり,かつ1p/19q欠失がなかったら
- この診断は,びまん性星細胞腫 diffuse astrocytoma, IDH-mutantとなります
- the genotype trumps the histological diagnosisだそうです
- trumpというのは奥の手を出して勝つという意味です
- 光鏡病理でオリゴでも,最終診断は,びまん性星細胞腫となるのです
- 小児の乏突起膠腫で,IDH mutationがなく1p/19q codeletionがあるのは,oliogodendroglioma, NOSです
2016年WHO分類(古いけど重要な変更点)
- 2007年に刊行されたWHOの新分類では,mixed gliomas(混合性神経膠腫)は廃止され,oligoastrocytic tumors(乏突起星細胞系腫瘍)と記載されました
- anaplastic oligoastrocytomaに壊死像を含む腫瘍に関しては,glioblastomaの範疇に入ることとなり, glioblastoma with oligodendroglioma component WHO grade 4と記述しました
- Millerらの報告によれば,215例のanaplastic oligoastrocytomaの中には33%に壊死像が見られ,生存期間中央値は壊死があるもので23ヶ月,壊死がないものでは87ヶ月でした。この結果に基づいてWHO分類は,この腫瘍をoligoastrocytoma grade IVとはせずに,glioblastoma with oligodendroglial componentとしてastrocytic tumorに含めました
- 極めて煩雑で注意しなければならないことは,anaplastic oligodendrogliomaは壊死像を含んでも生命予後は悪くはならないのでそのままgrade 3とされたことです
- これらの病理組織診断は,患者さんの生命予後予想と治療のintensityの選択に直結するため極めて重要でした
- しかし,従来より乏突起膠腫系腫瘍と星細胞系腫瘍の鑑別診断には大きな混乱が生じて,実際の臨床の場においてこれらの病理診断が正確に判定できるかどうかは疑問が残りました
- いずれにしても,乏突起膠腫の像を含む浸潤性神経膠腫は,病理像によって予後にあまりに大きな差異がある腫瘍群であることを認識して,病理診断には慎重に対処しなければなりません
- 2016年からは,1p/19q欠失をもって乏突起膠腫系腫瘍と診断されました
- でも,グレード(悪制度)は,旧来の組織診断で決定されるので,病理組織診断の変遷をしることは今だに重要です。
生検術の結果判断が難しい
同じ患者さんからの2カ所の病理標本です。左は乏突起膠腫グレード2と診断できますし,右は退形成性星細胞腫グレード3と診断できます。光顕診断では,両方合わせて,退形成性乏突起星細胞腫グレード3となります。ちなみに,olig2 強陽性,MIB-1 9%,1p/19q codeletionがありました。遺伝子診断を加えると退形成性乏突起膠腫となります。乏突起膠細胞系腫瘍では,術中迅速病理診断や定位脳生検術での診断は誤診を招くことが多くて危険です。
dual genotype oligoastrocytoma
乏突起膠腫と星細胞腫が本当に混じる乏突起星細胞腫があるか
IDH mutant gliomaに, TP53/ATRX-mutant, 1p/19q-intactのastrocytomaとATRX-wildtype, 1p/19q-codeleted のoligodendrogliomaが混じるものが稀にあります
病理診断の変遷
- 古くはKernohanの分類 (Kernohan 1949)
- Daumas-Duportの分類 (Daumas-Duport 1989)
- 1979年WHO分類 (Zulch 1979) は,組織学的な悪性度をgrade 1~4に分けて議論されたました
- かつて側脳室内乏突起膠腫とされたものは,神経細胞起源の中枢性神経細胞腫 (central neurocytoma)です
- 2007年WHO分類は,grade 2とgrade 3に分類しgrade 4は削除されました
- さらに2016年WHO分類では,第1染色体短腕と第19染色体長腕の決失 (1p/19q codeletion) の有無で診断されます
- この時,乏突起星細胞腫が削除されました
グレード2と3の違い
- 2022年時点で,グレード2と3の違いは,光顕組織診断によります
- 所見としては,increased cellularity, marked atypia, greater mitotic activity ≥2.5 mitoses/mm2, microvascular proliferation, and necrosis with or without palisading
- それでもグレード判断に迷ったら,MIB-1 index (Ki-67 immunostaining) と臨床像(経過が早いとかMRIでの悪性像とか)を参考としますが,境界は茫漠としたものでボーダーラインケースも多いです
- ブレード 3の腫瘍の大部分の組織像がグレード 2であるという例は多く,グレード 2として長く存在した乏突起膠細胞系腫瘍が悪性化するという事実を示唆しています
部分像だけでは星細胞系腫瘍と見分けはつかない
この部分のみを一見するとanaplastic astrocytomaです。しかし,他の大部分がoligoastrocytomaであり,かつての組織診断ではanaplastic oligoastrocytoma AOA WHO grade IIIです。
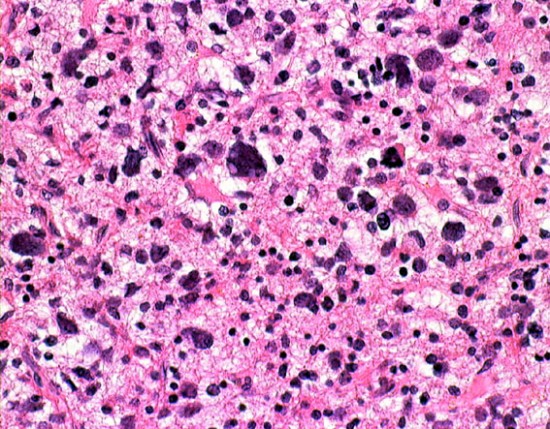
左側の病理像はanaplastic oligodendroglioma AO あるいはoligodendroglioma ODです。しかし,右の画像の様にpseudopallisading (necrosis)を示す部分があり,WHO grade 4と診断したくなるのですが,oligodendrglioma grade 3 ではnecrosisが混在してもgrade 3としてよいのです。
乏突起膠細胞系腫瘍の疫学
欧米からの報告では,乏突起膠腫と乏突起星細胞腫をあわせても,原発性脳腫瘍の内で4~5%程度の比較的まれな腫瘍とされます。Norwayでの25年間にわたる調査(1953年~1977年)では,208例の乏突起膠腫が登録され,原発性脳腫瘍のうち4.2%を占めたと報告されました。2009年のDenmarkからの報告では、人口10万に対して0.4例ほどの発生率であり、男女差はありません。
乏突起膠腫の年齢分布は20~50歳代に多く,40歳代にピークがある成人の腫瘍です。悪性型は中高年層に多い傾向があります。男女比はほぼ同数です。発生部位は前頭葉,側頭葉,頭頂葉,後頭葉と大脳半球の表層部に多く,特に前頭葉に好発します。きわめて稀には間脳や脳幹部,小脳あるいは脊髄にみられます。星細胞腫系腫瘍と異なり,一側大脳半球にとどまるものが多いです。乏突起膠細胞系腫瘍の髄液播種は他のグリオーマと異なりきわめて稀です。Norwayからの報告では,208例中の2例に髄液播種が認められたとのことです。中枢神経系外への転移は例外的なものです。
手術
病理組織像で認められる特性として,周辺脳組織とくに周辺皮質内の神経細胞周囲,血管周囲,軟膜下へと浸潤性格を示します。しかし,乏突起膠腫の浸潤能は星細胞腫よりは低く,高分化型のものでは限局性で時に全摘出も可能です。高分化型の乏突起膠腫は本来予後が良好な腫瘍であり,また一方,退形成乏突起膠腫では術後の放射線化学療法も有効ですから,いずれにしても神経脱落症状をきたすような無理な手術はしません。
腫瘍は,正常脳組織よりやや弾性があるが柔らかく出血に乏しいです。さまざまな大きさの石灰化を含むために,硬くざらざらとした部分や,ゴムのように粘り気が強い部分もあります。肉眼的には腫瘍中深部では灰白色から薄い褐色調を呈し,壊死や腫瘍内出血をみることはまれです。腫瘍の境界部では白質に近い白色となり正常脳組織との判別ができません。
可能であれば肉眼的に全摘出したほうが生命予後は明らかに良いです。Mayo Clinicでの81症例の分析では,全摘出された症例の生存期間中央値が12.6年であり,術後残存腫瘍のあった症例では4.9年でした。Norwayの170症例の解析では,全摘出が行われた症例の生存割合は有意に良好であったとされます。
てんかん発作で発症した例では,術前の神経脱落症状がないので特に注意を要します。いわゆるてんかんの外科のごとく,腫瘍組織の摘出とともに,術中の脳波モニターを併用して,てんかん焦点の除去を主目的とする手術になることがあります。しかし一方で,高分化型腫瘍では腫瘍のみを摘出することによっててんかん発作の消失を期待し得るという報告や,腫瘍の摘出のみにとどめて周囲の正常脳追加切除を加えないほうが成績がよいとの報告があります。まずは,病変切除 lesionectomyを優先して,初回手術ではてんかん抑制を主目的とした広汎切除は避けます。現実的に,lesionectomyのみでてんかん発作のコントロールが十分可能となるケースがほとんどです。
化学療法
乏突起膠腫は化学療法感受性が高い神経膠腫で,CCNU, BCNU, ACNU, procarbazine, carboplatin, vincristine, cisplatin, etoposide, melphalan, 5-fluorouracil, temozolomideなどが用いられてきました。現在用いられる化学療法は以下のもので,別ページに詳しく書いてあります。
PCV化学療法(クリック)
CCNU ロムスチン (100-130 mg/m2 day 1,経口投与)
VCR 硫酸ビンクリスチン (1.4 mg/m2 day 8 and day29,静注)
PCZ 塩酸プロカルバジンカプセル (60-75 mg/m2 days 8-21連日,経口投与)
文献情報
グレード2グリオーマの放射線治療にテモゾロマイドを併用した方が良い
Schiff D: LTBK-07. PROGRESSION-FREE AND OVERALL SURVIVAL RESULTS OF ECOG-ACRIN E3F05: A PHASE 3 INTERGROUP TRIAL OF RADIATION ± TEMOZOLOMIDE FOR GRADE II GLIOMAS. Neuro Oncol 2024
2024年末のSNOで報告されたとても重要な発表です。臨床第3相無作為E3FO5 trialの継続結果です。172名の低悪性度グリオーマの患者さんを治療後に10年以上経過観察した結果です。初期治療で放射線治療50.4Gyとテモゾロマイドの併用を行なった患者さんでは10年生存割合が70%に対して,併用しなかった群では47%でした。テモゾロマイドの併用がグレード2グリオーマで有効であるという貴重な報告です。もちろん,テモゾロマイドの有害事象や経済的身体的な負担はあるのですが,この生存割合の差はとても大きなものです。
Dr Schiffは重要な結果を含むと続けます。なんと,乏突起膠腫と星細胞腫で生存期間の延長が同程度であったというのです。普通はどう考えても,乏突起膠腫の方がはるかに良い成績のはずですが?
ボラシデニブはてんかん発作の頻度も下げる
Rosa K: Vorasidenib Shows Consistent Efficacy With Manageable Safety in IDH1/2-Mutant Diffuse Glioma. 2024 Nov, SNO, Houston
ボラシデニブ vorasidenib (Voranigo)のINDIGO試験の追加報告です。対象はIDH1/2-mutated diffuse glioma(星細胞腫と乏突起膠腫が入ります)。服用した群でてんかん発作の発症率が低かったそうです。また服用群で腫瘍の体積が減少したのに対し,プラセボ群では腫瘍体積が増大しました。2023年3月の3回目の中間解析では,ボラシデニブ群のPFS中央値はさらに延びてまだ評価できず,プラセボ群では11.4ヶ月でした。明らかな有意差が認められました。
ボラシデニブ vorasidenibは,グレード2の星細胞腫と乏突起膠腫の無増悪生存期間を延長する:臨床第3相試験の結果
Mellinghoff IK: Vorasidenib in IDH1- or IDH2-mutant low-Grade glioma. New Engl J Med 2023
vorasidenibは、変異型IDH1/2酵素の作用を阻害する経口薬で、腫瘍の2-ヒドロキシグルタル酸(2-HG)を90%以上低下させます。経口薬ですが脳内移行がよい薬剤です。術後の残存腫瘍あるいは再燃 168例にvorasidenib (40 mg once daily) が投与されました。観察期間中央値14.2ヶ月の時点で,7割の患者さんがvorasidenibあるいはプラセボを継続服用していました。PFS中央値は,vorasidenibで27.7ヶ月,プラセボで11.1ヶ月でした。グレード3以上の有害事象は22.8%でみられ,ALTの上昇が目立ったそうです。有害事象による中止は3.6%でした。
初期治療としての放射線治療とPCV化学療法は有効性が高い
Joint Final Report of EORTC 26951 and RTOG 9402: Phase III Trials With Procarbazine, Lomustine, and Vincristine Chemotherapy for Anaplastic Oligodendroglial Tumors. J Clin Oncol 2022
ヨーロッパの共同研究で何度も発表されてきたものの最終報告というのみです。結論は変わっていません。組織診断が退形成性乏突起膠腫グレード3で治療を受け追跡期間中央値は18-19ヶ月。生存期間中央値は放射線治療のみで2.6年,PCVを加えて3.5年でした。14年生存割合は13%と25%,20年生存割合は10%と17%でした。この研究が開始された30年ほど前には1p19q codeletion 共欠失が乏突起膠腫の診断基準に入っていません。codelがある現在の乏突起膠腫グレード3に限って評価を行うと,それぞれ9.3年,26%,14%,PCVで14年,51%,37%となります。
化学療法と局所放射線治療を乏突起膠腫グレード3にきちんと行うと,現在では14年以上の生存期間中央値が期待できるということです。テモゾロマイドとの優劣はついていません。
放射線量は高線量か低線量か
Final report from Intergroup NCCTG 86-72-51 (Alliance): a phase III randomized clinical trial of high-dose versus low-dose radiation for adult low-grade glioma. Neuro Oncol 2020
NCCTG-86-72-51の最終報告です。1986年から1994年まで203人のlow-grade glioma (diffuse astroytoma, oilgodendroglioma, oligoastrocytoma) の患者さんが無作為に,50.4Gy (28分割) あるいは 64.8Gy (36分割) の放射線治療を受けました。25年に及ぶ追跡調査の結果です。無増悪生存期間は5.2年,全生存期間は8.4年でした。追跡期間中央値は17.2年で,33人の患者さんが最終観察時点で生存していました。高線量照射は15年全生存割合も無増悪生存割合も改善しませんでした。全生存期間は,腫瘍が5cm未満かつbaseline MMSE27点以上,もしくは全摘出 GTRできた場合に良好でした。無増悪生存期間は,星細胞腫より乏突起膠腫の方が良く,5cm未満,MMSE 27以上,全摘出できた例で良好でした。baseline MMSEが正常であった患者さんでは,7年後に1例 (5%) で有意なMMSEの低下がありました。
「結論」高線量照射に利点はありません。MMSEで見る限り,放射線治療後の認知機能はstable (あまり落ちないとでも訳しましょうか)でした。
CDKN2A共欠失は高悪性度グリオーマのの予後不良因子
CDKN2A homozygous deletion is a strong adverse prognosis factor in diffuse malignant IDH-mutant gliomas. Neuro Oncol 2019
IDH変異があるグレード3か4の高悪性度グリオーマ911例でCDKN2A cyclin-dependent kinase inhibitor 2Aの欠失が調べられました。組織診断で言えば,膠芽腫IDHmutant 216例,退形成性星細胞腫 212例,退形成性乏突起膠腫 483例です。それぞれの組織型において,CDKN2Aがあると予後 PFS, OS が有意に悪いとの結論です。加えて病理所見で微小血管増殖像 microvascular proliferationがあると予後が悪いとしています。
膠芽腫はともかく,退形成性星細胞腫と退形成性乏突起膠腫には予後の大きく違う群がありました。その予後判別の目安となる遺伝子異常と捉えられます。
放射線壊死は乏突起膠腫で生じやすい,特に54グレイ以上を用いた時
Ahmad H: Oligodendroglioma confers higher risk of radiation necrosis. J Neurooncol. 2019
319例の乏突起膠腫とびまん性星細胞腫で,放射線壊死 radiation necrosis の頻度が比較されました。乏突起膠腫では21.3%に放射線壊死が生じたのに対し,びまん性星細胞腫では6.9%でした。乏突起膠腫に対して,54グレイを超える線量を用いると31%,54グレイ以下では14%で放射線壊死が発生するということです。8割で照射後24ヶ月以内に放射線壊死が生じたそうです。
「解説」テモゾロマイドの併用の有無が正確に検討されていません。でも長期予後を考えた時,グレード2の乏突起膠腫に54グレイを超える線量は用いない方がいいのでしょう。
手術後にテモゾロマイド単独治療を行うべきである
Rudà R: Efficacy of initial temozolomide for high-risk low grade gliomas in a phase II AINO (Italian Association for Neuro-Oncology) study: a post-hoc analysis within molecular subgroups of WHO 2016. J Neurooncol. 2019
イタリアでの後方視的解析結果です。乏突起膠腫グレード2へのテモゾロマイド単独後療法の奏功割合は76%,症候性てんかん発作の消失は72%,患者さんはテモゾロマイド単独治療を受けた67%の患者さんは追跡期間中央値9.3年で再発 recurrenceしなかったとのことです。
「解説」この話が本当ならPCVの出る幕はなさそうです。
化学療法単独がグレード2乏突起膠腫の治療選択肢となるか?
Franceschi E: Postsurgical Approaches in Low-Grade Oligodendroglioma: Is Chemotherapy Alone Still an Option? Oncologist. 2019
イタリアからの報告であまりレベルの高いものではありません。でも2019年時点で多くの神経腫瘍医の考えともいえるでしょう。乏突起膠腫 (IDH mutant, 1p/19q codel)93人の患者さんの解析です。無増悪生存期間中央値 PFS は,手術後すぐに放射線治療を受けた26人で114ヶ月,受けなかった67人で47ヶ月でした。テモゾロマイド単独では無増悪生存期間の延長はないと結論されています。PFS延長のみならず,治癒希望という観点からは放射線治療を加えることが要求されます。
放射線治療の後でPCV化学療法を行う: RTOG 9802(10年以上の経過を見た場合)
Buckner JC, et al: Radiation plus Procarbazine, CCNU, and Vincristine in Low-Grade Glioma. N Engl J Med. 2016
1998年から2002年の間にグレード2のびまん性星細胞腫あるいは乏突起膠腫の251人の患者さんが治療されました。追跡期間中央値 12年という気の遠くなるほどの長い観察結果です。18歳から39歳で生検術あるいは部分摘出 subtotal resectionを受けた患者さん,あるいはどのような手術結果でも40歳以上の患者さんに,放射線治療の後でPCV維持化学療法が加えられました。放射線単独では全生存期間は7.8年,PCVを加えると13.3年という大きな差が出ました。10年無増悪生存割合はそれぞれ21%と51%で,全生存割合だと40%と60%です。乏突起膠腫の組織型で無増悪生存も全生存割合も高かったとのことです。追跡期間中央値12年で55%の患者さんが亡くなりました。
「解説」とても権威の高い雑誌に発表された治療成績です。この大規模臨床試験は1998年に開始されており,かなりの乏突起膠腫の混在があります。びまん性星細胞腫 1p/19q non-deletedで真であるかどうか,謎のままでしょう。でも乏突起膠腫においては真の結果と言えます。治療後にPCVを継続するのは,患者さんにはとても負担が大きいとも言えます。
テモゾロマイドと放射線治療のどちらを選択するか
Wick W, et al.: Long-term analysis of the NOA-04 randomized phase III trial of sequential radiochemotherapy of anaplastic glioma with PCV or temozolomide. Neuro Oncol 2016
グレード3のグリオーマ(主として退形成性星細胞腫,退形成性乏突起膠腫)318例が,放射線治療のみ,PCV化学療法,テモゾロマイド化学療法の3群に分類されて治療を受けました。この研究では,化学療法を単独効果をみていますので,first lineで放射線化学療法は行われていません。観察期間中央値9.5年の段階で,放射線治療単独と化学療法単独群に差はありませんでした TTF (4.6 y vs 4.4 y), PFS (2.5 y vs 2.7 y), and OS (8 y vs 6.5 y)。テモゾロマイドとPCVの間には若干の差があって,CIMP-codelつまり,IDH mutationと1p/19 co-deletionのある退形成性乏突起膠腫では,PCV の有効性が高かったとされていますが少数比較です。
テモゾロマイドと放射線治療のどちらが QOL 生存の質が良いか
Baumert BG: Temozolomide chemotherapy versus radiotherapy in high-risk low-grade glioma (EORTC 22033-26033): a randomised, open-label, phase 3 intergroup study. Lancet Oncol, 2016
Reijneveld JC: Health-related quality of life in patients with high-risk low-grade glioma (EORTC 22033-26033): a randomised, open-label, phase 3 intergroup study. Lancet Oncol, 2016
477人のグレードIIグリオーマ (astrocytoma, oligoastrocytoma, or oligodendroglioma)の患者さんを対象とした臨床第3相試験です。治療を行った基準は予後が悪そうに思える例で,40歳以上,進行性病巣,腫瘍サイズが5cm以上,正中を超える病変,神経症状があったという基準です。無作為に,放射線治療 (conformal radiotherapy; up to 50.4 Gy; 28 doses of 1.8 Gy once daily) あるいはテモゾロマイド化学療法 (75 mg/m2 for 21 days, every 28 days, maximum of 12 cycles)がなされました。
PFS 無増悪生存期間は,テモゾロマイド群で39ヶ月,放射線で46ヶ月と有意差はありませんでした。また,生存の質 health-related quality of life (HRQOL)にも差はありませんでした。有害事象は全般的にテモゾロマイド治療群で多いです。
ただし,IDH変異があり1p/19q欠失がないもの(いわゆるびまん性星細胞腫)では放射線治療のPFSがテモゾロマイドよりも長かったということです。IDH変異があり1p/19q欠失があるもの(乏突起膠腫)とIDH変異がないものでは両群の間に差はありませんでした。
退形成性乏突起膠腫 グレード3を遺伝子診断で見直してみたら
Dubbink HJ, et al.: Molecular classification of anaplastic oligodendroglioma using next-generation sequencing: a report of the prospective randomized EORTC Brain Tumor Group 26951 phase III trial. Neuro Oncol 18:388-400, 2015
EORTC臨床第3相試験を再分析したものです。グレード3オリゴ AO, AOAと診断されて臨床試験された126例を遺伝子解析で見直したら,20例が IDH mutation, “astrocytoma“,49例が1p/19q codeletion, “oligodendroglioma”,55例が7+/10q- or TERTmut and 1p/19q intact, “glioblastoma”だったというのです。なんのこっちゃ!! これでは過去のオリゴの治療成績が意味不明になります。
PCV化学療法が有効か否かはやはりMGMTメチレーションで決まるそうです。
乏突起膠腫とてんかん
Kerkhof M: Seizures in oligodendroglial tumors. CNS Oncol 2015
乏突起膠細胞系腫瘍の70-90%にてんかんが生じます。また,てんかん発症した例は長期予後が良い傾向があります。腫瘍摘出や放射線治療で3分の2の患者さんでてんかん発作が止まり,化学療法では50%ほどでてんかん発作が改善します。レベチラセタムもしくはバルプロ酸の単独投与が乏突起膠腫の部分てんかんを抑制することは証明されています。しかし,40%ほどで抗てんかん薬治療中に薬剤抵抗性のてんかんが生じる可能性があります。
IDH1変異があるとアルキル化剤が有効
Cairncross JG, et al.: Benefit from procarbazine, lomustine, and vincristine in oligodendroglial tumors is associated with mutation of IDH. J Clin Oncol 32: 783-790, 2014
RTOG 9402からの報告です。1p/19q欠失が無くても長期生存する例が知られていました。その長期生存例でIDH1変異がみられました。放射線とアルキル化剤を用いた化学療法を行えば,1p/19q欠失とIDH1変異があるグレード3オリゴの全生存期間は14.7年に及んだということです。
分子マーカーと予後
Minniti G, et al.: Chemoradiation for anaplastic oligodendrogliomas: clinical outcomes and prognostic value of molecular markers. J Neurooncol 116: 275-282, 2014
グレード3オリゴ (AO, AOA)の報告です。84人の患者が,放射線治療とテモゾロマイド化学療法で治療され,生存期間中央値は56ヶ月,無増悪生存期間は45か月でした。Chromosome 1p/19q codeletion 57 %, IDH1 mutation 63 %, MGMT promoter methylation 74 %であったそうです。第1/第19染色体欠失が無かった例の生存期間中央値は34ヶ月,欠失があった例では追跡機間より長く長期になったとのことです。IDH1変異例でも生存期間は長かったのですが,MGMTのデータは予後と明らかな関係ありませんでした。
解説:1p/19q codeletion 染色体異常があると治癒も期待できると考えられるデータです。
分子マーカーと予後
Gorlia T, Delattre JY, Brandes AA, et al. New clinical, pathological and molecular prognostic models and calculators in patients with locally diagnosed anaplastic oligodendroglioma or oligoastrocytoma. A prognostic factor analysis of European Organisation for Research and Treatment of Cancer Brain Tumour Group Study 26951. Eur J Cancer 2013
EORTCに登録されてた368例のグレード3オリゴ OA, AOAの解析です。予後が良い患者さんとは,若い,手術で全摘出されている,前頭葉発生,PS 一般状態が良い,壊死や血管内皮肥厚がない,1p/19q欠失,IDH変異でした。後に,手術摘出割合が高いと生命予後が良いという根拠によく引用される論文です。
放射線治療にPCV化学療法を加えた方が治る確率が高い
van den Bent MJ, et al.: Adjuvant procarbazine, lomustine, and vincristine chemotherapy in newly diagnosed anaplastic oligodendroglioma: long-term follow-up of EORTC brain tumor group study 26951. J Clin Oncol 31:344-350, 2013
グレード3オリゴ (AO, AOA) に対して,59.4グレイの放射線治療にPCV化学療法6コースの上乗せ効果があるかどうかをみた臨床第3相試験です。368人の患者さんが治療され,追跡機間中央値は140ヶ月でした。生存期間中央値は,放射線単独では30.6ヶ月,放射線とPCVでは42.3ヶ月で有意な差がありました。1p/19q coleletionがあった患者さん80人の生存期間中央値は,放射線単独では112ヶ月,放射線とPCVでは7年以上で有意な差がありました。IDH1変異があった例でも生存期間が長かったそうです。
解説:グレード3オリゴには化学療法を加えた方が良いことが明白となりました。1p/19q欠失があるグレード3のオリゴの生命予後は短くとも7年以上ということになり,治癒が期待される腫瘍であると言えます。一方で,その欠失が無い例での生命予後は数年以内と推定されます。とても大きな違いです。
1p/19q欠失がある例にはPCV化学療法が有効
Cairncross G, et al.: Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: long-term results of RTOG 9402. J Clin Oncol 31: 337-343, 2013
グレード3オリゴ (AO, AOA)291人の患者さんが,放射線治療単独あるいはPCV化学療法と放射線で治療を受けました。生存期間中央値は4.6年と4.7年で差がありませんでした。しかし,1p/19q lossのある患者さんでは,放射線単独で7.3年,PCV放射線で14.7年でした。
解説:上記のRTOGの報告とはかなりの矛盾があります。1p/19q欠失がないと放射線化学療法を行っても生存期間中央値は2年半ほどでほとんどの患者さんが亡くなります。逆に欠失 codeletionがあれば,治癒が期待できるほどの長期生存例が多いと言えます。ものすごく大きな差です。
グレード3の治療の最近のトレンド
Panageas KS, et al.: Initial treatment patterns over time for anaplastic oligodendroglial tumors. Neuro Oncol 14:761-767, 2012
米国の脳腫瘍の専門家の間での2012年におけるトレンド調査です。化学療法単独治療では,テモゾロマイド87%に対して,PCVが2%と完全にひっくり返りました。1p/19q欠失がある患者さんでは,放射線治療をしないでテモゾロマイド単独治療をすることが多くなっています。1p/19q欠失がない患者さんでは,放射線治療とテモゾロマイドの併用治療がなされています。
解説:ある治療方法が計画されて,臨床研究を終えて結果が論文になるには,グレード3のオリゴで10年,グレード2のオリゴで20年かかります。私たちがエビデンスとして珍重している事実は,十数年前に計画された”最新治療”なのです。トレンドの治療はエビデンスに基づいていないのですが,多くの脳腫瘍の専門家が今現在行っている治療法です。
PCV化学療法は低悪性度グレード2にも有効か
Shaw EG, et al.: Randomized trial of radiation therapy plus procarbazine, lomustine, and vincristine chemotherapy for supratentorial adult low-grade glioma: initial results of RTOG 9802. J Clin Oncol 30: 3065-3070, 2012
251人のグレード2グリオーマの患者さんでPCVが有効かどうかをみた研究です。PCVが有効との結論ですが,この研究はびまん性星細胞腫が混じっているので結論の数字は役に立ちません。グレード2乏突起膠細胞系腫瘍にPCV化学療法が有効であると言えます。
IGS-9 subtypeの退形成性乏突起膠腫系腫瘍にはPCV化学療法の有効性が高い
Erdem-Erasian L, et al.: Intrinsic Molecular Subtypes of Glioma Are Prognostic and Predict Benefit From Adjuvant Procarbazine, Lomustine, and Vincristine Chemotherapy in Combination With Other Prognostic Factors in Anaplastic Oligodendroglial Brain Tumors. J Clin Oncol 44: 1444, 2012
グレード3のオリゴを研究したものです。 IGS-9 (1p/19qの欠失率が非常に高くIDH1変異がある)というタイプでは,放射線治療単独での全生存期間が5.5年で,放射線治療とPCV化学療法を加えた群での生存期間が12.8年でした。
解説:1p/19qの欠失率が非常に高くIDH1変異があるAO/AOAでは,PCV化学療法を選択するべきだという高いエビデンスが示されました。逆に,このタイプではないとPCV化学療法の有効性は著しく低くなります。また,59.4グレイというきつい放射線治療が併用されていますから,PCV単独ではこの成績は出ません。
グレード3オリゴの生存期間はPCV化学療法で延長できる
van den Bent MJ, et al: Adjuvant Procarbazine, Lomustine, and Vincristine Chemotherapy in Newly Diagnosed Anaplastic Oligodendroglioma: Long-Term Follow-Up of EORTC Brain Tumor Group Study 26951. J Clin Oncol. 2012 Oct
368人のグレード3オリゴ(AOとAOA)の患者さんが治療され,観察期間中央値は140ヶ月でした。放射線治療とPCV化学療法で治療された患者さんの生存期間中央値 OSは42.3ヶ月,放射線治療単独では30.6ヶ月でした。1p/19q欠失のある患者さんだけを抽出するとPCV化学療法群の生存期間中央値は10年を超えるでしょう。IDH変異のある例でもこの治療法の有効性は高いそうです。
解説:下の方に書いてある2006年の論文の結論を覆すヨーロッパ(EORTC)からの報告です。PCV化学療法を行う根拠が担保されました。PCV 6コースと局所分割照射 59.4グレイ(1.8グレイ/日)を使用するのですが,これはかなりきつい治療で,放射線障害による認知機能低下がでる例がかなりあります。生き残ったときの生存の質ADLを考えれば,なかなか選択しづらい治療方法です。
1p/19q欠失があるグレード3オリゴの初期治療にテモゾロマイドだけ使う
Mikkelsen T, et. al.: Temozolomide single-agent chemotherapy for newly diagnosed anaplastic oligodendroglioma. J Neurooncol 92: 57-63, 2009
退形成性乏突起膠腫AOの初期治療で,1p/19q欠失がある腫瘍の36人の患者さんはテモゾロマイド段独治療,1p/19q欠失のない12人の患者さんはテモゾロマイドと放射線治療を受けました。1p/19q欠失のあった患者さんでのPFS無増悪期間中央値は29ヶ月,1p/19q欠失がなく放射線治療も受けた患者さんのPFS無増悪生存期間中央値は14ヶ月でした。1p/19q欠失のある患者さんでは,テモゾロマイド単独初期治療が可能かもしれないとしています。
解説:この論文の結果解釈は乱暴です。1p/19q codeletionがあるAOの患者さんの長期生命予後はもともと良いです。ですが,10年単位でみれば結果的には,多くの患者さんが再燃死亡します。治る可能性のある退形成性乏突起膠腫の初期治療で,放射線治療を省くというのは現時点では行き過ぎです。治癒(真の長期生存)を求めるなら初期治療は受け入れられるだけの治療をしなければなりません。
グレード3のグリオーマではIDH変異の有無が予後に最も関連する
Wick W, et al. NOA-04 randomized phase III trial of sequential radiochemotherapy of anaplastic glioma with procarbazine, lomustine, and vincristine or temozolomide. J Clin Oncol 2009
2009年の中間解析で,2016年に最終報告が出ています。1p/19q欠損,MGMTメチレーションよりも,IDHの変異の有無の方が治療効果に大きな影響があるとしています。2018年時点では,そもそもIDHの変異がないと退形成性乏突起膠腫 AO といわなくなりました。AOでは手術後の放射線治療と化学療法が同等の効果を示すと結論していますが,2018年時点では否定的です。
退形成性乏突起膠腫に大量化学療法を行なう
Mohile NA , et. al.: A phase II study of intensified chemotherapy alone as initial treatment for newly diagnosed anaplastic oligodendroglioma: an interim analysis. J Neurooncol 89: 187-193, 2008
退形成性乏突起膠腫AOの初期治療で,用量の多いプロカルバジン,ロムスチン,ビンクリスチン(I-PCV)化学療法が行なわれて,反応のあった患者さんにはさらにAPBPCRによる大量化学療法(ブサルファン,チオテーパ)が加えられました。15人の患者さんで化学療法反応性があり,14人がAPBPCRを受けました。有害事象では,肝臓のVODで1人が亡くなっています。無増悪生存期間は36ヶ月以上でした。
解説:この臨床試験は中断されました。先行治療と前治療の副作用が強すぎるためでした。現在はI-PCVをテモゾロマイドに変更して同じ試験が継続されているとのことです。放射線治療をいきなり全くなくすというのはちょっと冒険過ぎます。
テモゾロマイドを放射線治療の前に使用する
Vogelbaum, et. al.: Phase II trial of pre-irradiation and concurrent temozolomide in patients with newly diagnosed anaplastic oligodendrogliomas and mixed anaplastic oligoastrocytomas: RTOG BR0131. Neuro Oncol 2008
150mg/m2/dayのテモゾロマイドを7日間連続で服用して7日間休むという化学療法 (dose dense therapy) を6コースまで続けます。それから放射線治療とテモゾロマイドの治療を開始します。グレード3乏突起膠腫系腫瘍AO/AOAの39人の患者さんが治療を受けました。最初のテモゾロマイドの奏功率は32%で,腫瘍が消失した(CR?)のは6%で,かなり小さくなった(PR)のが26%で,腫瘍が大きくなってしまった(PD)のが10%でした。生存期間などについてははっきりした結果はありません。1p/19q lossのあった患者さんでは放射線前のテモゾロマイドの期間に1例も増悪例がなかったことが強調されています。
解説:いつものことですがグリオーマでのCRの定義が問題です。この論文の著者はT2/FLAIRでの完全な腫瘍消失をCRと厳しく定義したのでCRが2例(6%)しかなかったと書いていますが,ほんとうにそんなことがあるのでしょうか。部分摘出したグリオーマがT2/FLAIR画像で完全消失することはまずあり得ませんし,何らかの痕跡は残るはずなのです。放射線治療前テモゾロマイド強化療法の意義は,放射線照射野を越えて浸潤する腫瘍細胞に対しての強くて早い時期の化学療法を可能にすることであると書かれています。しかし,本当にそうでしょうか,放射線治療中と治療後のテモゾロマイド維持療法ではいけないのでしょうか。放射線治療は1日1.8Gyで59.4Gyまでなされていますが,この厳しい照射線量を減じることは可能かどうか知りたいところです。
退形成性乏突起膠腫に対して米国の専門家の推奨する治療法
Abrey LE , et. al.: Survey of treatment recommendations for anaplastic oligodendroglioma. Neuro Oncol 9: 314-318, 2007
2006年に米国の神経腫瘍医にアンケート調査を行った結果です。染色体検査の結果が治療法の選択に極めて強い結果を与えているということでした。1p/19q欠失の有る無しで推奨する治療が変わっているようです。興味あることに,米国ではこの検査料金は患者さんに請求されるのですが医師がその料金を知りませんでした。最も多く用いられていた治療法は,テモゾロマイドと放射線治療の併用 concurrentと,その後のテモゾロマイド維持療法でした。1p/19q欠失のある患者さんへは42%の医師が放射線治療をせずに化学療法(大部分はテモゾロマイド)を勧めていました。
1p/19q欠失があるグレード3オリゴにはテモゾロマイドの有効性が高い
Brandes AA, et. al.: Correlations between O6-methylguanine DNA methyltransferase promoter methylation status, 1p and 19q deletions, and response to temozolomide in anaplastic and recurrent oligodendroglioma: a prospective GICNO study. J Clin Oncol 24: 4746-3138, 2006
標準的な放射線治療の後で再発したグレード3の退形成性乏突起膠腫AOと退形成性乏突起星細胞腫AOAの67人の患者さんににテモゾロマイドが投与されました。奏功割合は46% (17 CR, 14 PR)と非常に高いものでした。AOでは62%,AOAでは25%でしたから,星細胞腫の成分を含まない組織の方がテモゾロマイドの有効性は明らかに高い (p=0.003) 結果でした。生存期間中央値は31ヶ月,治療後3年での生存割合は43%です。組織検査で第1染色体単腕 1pと第19染色体長腕 19qの欠失があった腫瘍の奏効割合,無増悪生存期間,全生存期間は,そうでない腫瘍よりも明らかに良好な結果だとされています。しかし,MGMTメチル化とテモゾロマイドの有効性の関連ははっきりしませんでした。1p/19q allelic lossはpredictive and prognostic factorであると結論づけています。
解説:テモゾロマイド単剤で使用しても,再発したグレード3の乏突起膠腫系腫瘍にかなり有効であるという報告です。特に,1p/19q allelic lossがあるAOには大きな期待をもてます。しかし逆に,1p/19q lossがないAOAの患者さんはテモゾロマイドの単独投与では厳しい結果に終わっています。 生存期間が伸びるといっても大部分の患者さんは死亡しますから,再発をさせないような初期治療が重要だということには変わりはありません。
テモゾロマイドがグレード2の乏突起膠細胞系腫瘍の初期治療に効果がある
Hoang-Xuan K, et al.: Temozolomide as initial treatment for adults with low-grade oligodendrogliomas or oligoastrocytomas and correlation with chromosome 1p deletions. J Clin Oncol 22: 3133-3138, 2006
フランスからの報告です。手術で病理が確かめられた66例の乏突起膠腫と乏突起星細胞腫の患者さんに,初期治療として放射線治療をせずにテモダールが投与されました。200mg/m2を5日間使う方法です。およそ11コースの化学療法がされているので1年くらいの投与期間です。51%の患者さんでけいれん発作などの症状が改善したそうです。部分的に腫瘍が縮小したのは31%の患者さん (PR 17%, MR 14%) で,61%では大きさが変わらなかったのですが,腫瘍が大きくなってしまったのは8% のみでした。 腫瘍が小さくなるのに12ヶ月くらいかかったとのことです。第1染色体単腕に欠失のある腫瘍の方がテモゾロマイドによく反応したと書かれています。
解説:テモゾロマイドは確かに乏突起膠細胞形の腫瘍に有効で腫瘍は小さくなるのですが,それで生存期間が延長できるかどうかはまだはっきりしていません。現在進行中の臨床試験は,グレード3の乏突起膠細胞系腫瘍に対して,放射線治療のみ,テモゾロマイドのみ,放射線とテモゾロマイドの併用を軸としたものです。この結果が発表されるにはまだ時間がかかります。
PCV化学療法は再燃までの期間を延長するが長期生存率を改善しない
Cairncross G, et al.: Phase III trial of chemotherapy plus radiotherapy compared with radiotherapy alone for pure and mixed anaplastic oligodendroglioma: Intergroup Radiation Therapy Oncology Group Trial 9402. J Clin Oncol 24: 2689-2690, 2006
RTOGというグループが行った大規模臨床試験の結果です。グレード3の退形成性乏突起膠腫と退形成性乏突起星細胞腫の289人の患者さんが治療を受けました。半分の患者さんは手術後の放射線治療のみ,残りの半分は放射線治療の後で6コースのPCV(プロカルバジン、ロムスチン,ビンクリスチン)化学療法を受けました。放射線治療のみの患者さんにもし病気の悪化があった場合には化学療法が加えられています。
初期治療後に腫瘍がまた大きくなるまでの期間は,PCV化学療法をした群で2.6年,放射線治療のみの群で1.7年となり,PCV 化学療法の方が良かったのです。しかし,生存期間中央値はPCVの群が4.9年,放射線のみの群が4.7年と差がありませんでした。PCV化学療法を受けた65%の患者さんでCTCグレード3から4の化学療法の副作用が生じました。1pと19qの欠失は46%の患者さんでみられて,その生存期間中央値は7年でした。一方,染色体異常がなかった患者さんの生存期間は2.8年でした。でも1p lossがある患者さんが PCV化学療法を受けてもその生存期間が伸びるという事実はありませんでした。逆に化学療法の有害事象が目立ったと書かれています。
解説:PCV化学療法は有効なのでしょうが,初期治療で放射線治療に加えて行っても生存期間を延ばす効果はないようです。ですから初期治療でPCV化学療法を使用する根拠はないと言えそうです。
PCV化学療法は有効ではあるが長期生存率を改善しない
van den Bent et al.: Adjuvant procarbazine, lomustine, and vincristine improves progression-free survival but not overall survival in newly diagnosed anaplastic oligodendrogilomas and oligoastrocytomas: a randomized European Organization for Research and Treatment of Cancer phalse III trial. J Clin Oncol 24: 2715-2722, 2006
欧州で行われた大規模臨床試験です。グレード3の退形成性乏突起膠腫と退形成性乏突起星細胞腫の368人の患者さんが治療を受けました。半分の患者さんは59.4グレイの放射線治療のみ,残りの半分は同じ放射線治療の後で6コースのPCV化学療法を受けました。観察期間中央値5年の時点で,59%の患者さんが死亡していました。PCV化学療法を受けた38%の患者さんで副作用のために化学療法が中断されています。放射線治療のみの患者さんは再発した時に化学療法を受けています。
生存期間の中央値では,PCVをした群が40.3ヶ月,放射線治療のみが30.5ヶ月です。治療後から再発までの期間はPCVを加えた方が長かったのですが,5年生存割合にはっきりした差がなかったと結論されています。1pと19qの欠失は25%の患者さんにみられこの遺伝子異常を有する腫瘍の患者さんの生存割合は高いのですが,PCV化学療法をしたかしなかったかの差はなかったとのことです。
解説:PCV化学療法を放射線治療に加えてもこの腫瘍が治る確率には差がないでしょうというのが結論ででした。だとするとPCV化学療法を初期治療で6コースすることにはあまり意味がないのではないかと捉えられます。
グレード2オリゴに,なぜ60グレイを用いないのか
Karim AB, et al.: A randomized trial on dose-response in radiation therapy of low-grade cerebral glioma: European Organization for Research and Treatment of Cancer (EORTC) Study 22844. Int J Radiat Oncol Biol Phys 36, 1996
古い文献なのですが,ヨーロッパで低悪性度グリオーマ LGG 343例で前向き試験がなされました。 45 Gy (5 weeks) もしくは59.4 Gy (6.6 weeks)の照射がされましたが,74ヶ月の追跡期間で,全生存割合 OS にも無増悪生存割合 (PFS 47% vs. 50%) にも有意な差はありませんでした。
メモ(染色体異常の有無で治療効果が変わる)
乏突膠細胞系腫瘍は遺伝子の異常で発生します。第1染色体の短腕と第19染色体の長腕に遺伝子異常があることがわかってきました。特に第1染色体短腕の欠失(1p loss)がある腫瘍では,化学療法や放射線治療が有効なことが多いとの定説があります。ですから,治療の前に1p lossと19q lossを調べようとの試みがなされています。ようやく一般臨床的に調べられるところまでは来ましたが,検査にはちょっと時間がかかります。これでわかることは,1p/19q lossがある腫瘍の患者さんは化学療法で受ける利益が大きくて、そうでない患者さんの腫瘍には化学療法が効きづらいとなります。でも何れにしても,2015年時点で,手術後の残存腫瘍に対しては大多数の施設でテモゾロマイド化学療法を用います。ですから,これがわかったからといってどのように今ある治療法が変わるかと言うと??現時点では私には想像はつきません。欧米からの報告では,乏突起膠腫と乏突起星細胞腫をあわせても,原発性脳腫瘍の内で4~5%程度の比較的まれな腫瘍とされます。Norwayでの25年間にわたる調査(1953年~1977年)では,208例の乏突起膠腫が登録され,原発性脳腫瘍のうち4.2%を占めたと報告されました。2009年のDenmarkからの報告では、人口10万に対して0.4例ほどの発生率であり、男女差はありません。
乏突起膠腫の年齢分布は20~50歳代に多く,40歳代にピークがある成人の腫瘍です。悪性型は中高年層に多い傾向があります。男女比はほぼ同数です。発生部位は前頭葉,側頭葉,頭頂葉,後頭葉と大脳半球の表層部に多く,特に前頭葉に好発します。きわめて稀には間脳や脳幹部,小脳あるいは脊髄にみられます。星細胞腫系腫瘍と異なり,一側大脳半球にとどまるものが多いです。乏突起膠細胞系腫瘍の髄液播種は他のグリオーマと異なりきわめて稀です。Norwayからの報告では,208例中の2例に髄液播種が認められたとのことです。中枢神経系外への転移は例外的なものです。
文献
- Abrey LE , et. al.: Survey of treatment recommendations for anaplastic oligodendroglioma. Neuro Oncol 9: 314-318, 2007
- Brandes AA, et. al.: Correlations between O6-methylguanine DNA methyltransferase promoter methylation status, 1p and 19q deletions, and response to temozolomide in anaplastic and recurrent oligodendroglioma: a prospective GICNO study. J Clin Oncol 24: 4746-3138, 2006
- Buckner JC, et al.: Radiation plus Procarbazine, CCNU, and Vincristine in Low-Grade Glioma. N Engl J Med 2016
- Cairncross G, et al.: Phase III trial of chemotherapy plus radiotherapy compared with radiotherapy alone for pure and mixed anaplastic oligodendroglioma: Intergroup Radiation Therapy Oncology Group Trial 9402. J Clin Oncol 24: 2689-2690, 2006
- Cairncross G, et al.: Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: long-term results of RTOG 9402. J Clin Oncol 31: 337-343, 2013
- Cairncross JG, et al.: Benefit from procarbazine, lomustine, and vincristine in oligodendroglial tumors is associated with mutation of IDH. J Clin Oncol 32: 783-790, 2014
- Dubbink HJ, et al.: Molecular classification of anaplastic oligodendroglioma using next-generation sequencing: a report of the prospective randomized EORTC Brain Tumor Group 26951 phase III trial. Neuro Oncol 18:388-400, 2015
- Erdem-Erasian L, et al.: Intrinsic Molecular Subtypes of Glioma Are Prognostic and Predict Benefit From Adjuvant Procarbazine, Lomustine, and Vincristine Chemotherapy in Combination With Other Prognostic Factors in Anaplastic Oligodendroglial Brain Tumors. J Clin Oncol 44: 1444, 2012
- Gorlia T, et al. New clinical, pathological and molecular prognostic models and calculators in patients with locally diagnosed anaplastic oligodendroglioma or oligoastrocytoma. A prognostic factor analysis of European Organisation for Research and Treatment of Cancer Brain Tumour Group Study 26951. Eur J Cancer 2013
- Hoang-Xuan K, et al.: Temozolomide as initial treatment for adults with low-grade oligodendrogliomas or oligoastrocytomas and correlation with chromosome 1p deletions. J Clin Oncol 22: 3133-3138, 2006
- Mikkelsen T, et. al.: Temozolomide single-agent chemotherapy for newly diagnosed anaplastic oligodendroglioma. J Neurooncol 92: 57-63, 2009
- Miller CR, et al.: A significance of necrosis in grading of oligodendroglial neoplasms: a clinicopathlogic and genetic study of newly diagnosed high-grade gliomas. J Clin Oncol 24: 5419-5426, 2006
- Minniti G, et al.: Chemoradiation for anaplastic oligodendrogliomas: clinical outcomes and prognostic value of molecular markers. J Neurooncol 116: 275-282, 2014
- Mohile NA , et. al.: A phase II study of intensified chemotherapy alone as initial treatment for newly diagnosed anaplastic oligodendroglioma: an interim analysis. J Neurooncol 89: 187-193, 2008
- Nielsen MS, et al.: Incidence of and survival from oligodendroglioma in Denmark, 1943-2002. Neuro-Oncol 11: 311-317, 2009
- Shaw EG, et al.: Randomized trial of radiation therapy plus procarbazine, lomustine, and vincristine chemotherapy for supratentorial adult low-grade glioma: initial results of RTOG 9802. J Clin Oncol 30: 3065-3070, 2012
- van den Bent et al.: Adjuvant procarbazine, lomustine, and vincristine improves progression-free survival but not overall survival in newly diagnosed anaplastic oligodendrogilomas and oligoastrocytomas: a randomized European Organization for Research and Treatment of Cancer phalse III trial. J Clin Oncol 24: 2715-2722, 2006
- van den Bent MJ, et al: Adjuvant Procarbazine, Lomustine, and Vincristine Chemotherapy in Newly Diagnosed Anaplastic Oligodendroglioma: Long-Term Follow-Up of EORTC Brain Tumor Group Study 26951. J Clin Oncol. 2012 Oct
- van den Bent MJ, et al.: Adjuvant procarbazine, lomustine, and vincristine chemotherapy in newly diagnosed anaplastic oligodendroglioma: long-term follow-up of EORTC brain tumor group study 26951. J Clin Oncol 31:344-350, 2014
- Vogelbaum, et. al.: Phase II trial of pre-irradiation and concurrent temozolomide in patients with newly diagnosed anaplastic oligodendrogliomas and mixed anaplastic oligoastrocytomas: RTOG BR0131. Neuro Oncol 2008 (Epub)
- Wick W, et al. NOA-04 randomized phase III trial of sequential radiochemotherapy of anaplastic glioma with procarbazine, lomustine, and vincristine or temozolomide. J Clin Oncol 2009
では私なら,グレード3のオリゴにどういう治療をするか
- そもそも1p/19q欠失がないとオリゴと言わないのですが,それは別にして,組織診断でNOSを含めた治療選択を考えます
- 2016年までの情報をふまえても,1p/19q欠失やIDH変異があってもなくても,結局は手術と放射線治療と化学療法をします
- オリゴは長期生存が期待できるので,つらい後遺症を残すような無理な手術はしません
- 日本でのグレード3への放射線治療は,60グレイ(1日線量2グレイ)ですが,これは治る期待のある患者さんには明らかに強すぎでしょう
- 治療後に長期生存した患者さんを見ていると,認知機能の低下で社会復帰できなくなることも多いです
- ヨーロッパの1日線量は1.8グレイですからそれに準じるべきです
- また,60グレイというのは膠芽腫に使用される線量ですから,長期生存を期待するグレード3の場合には,50-54グレイ程(1日線量1.8グレイ,27-30分割)が適切かもしれません
- この20年間くらいはそうして治療してきましたし,いまでもこの考えは変わりません
- 不要な部分に放射線障害を避けるために,大きな腫瘍の場合の照射方法はIMRTを使用します
- 保険診療で使えて副作用も軽い,放射線治療とテモゾロマイドの併用が日本の現状では最も適切だと考えています
- 1p/19q欠失がある例で化学療法が有効だからといって,欠失がない例で化学療法を使用しないかというと,使用します
- ですから2016年時点では,1p/19q欠失があるかなしかで化学療法の選択肢は変わりません
- 1p/19q欠失がある例で,テモゾロマイド化学療法単独治療のトレンドがあります
- この治療の危険性はある程度の期間は腫瘍進行が抑えられるのですが,ほとんどの例でブレイクが生じて結果的に放射線治療となります
- グレード3で治癒というものを目指すのであれば,初期治療で放射線治療とテモゾロマイドを併用した方が治る確率が高いのです
- 放射線障害がかなり大きくなると判断される広範囲進展腫瘍例でかつ1p/19q欠失あれば,テモゾロマイド単独初期治療を選択するのもよいでしょうし,線量を落としてboostの範囲 margin を絞ります
- ガドリニウム増強される部分と壊死が多く,1p/19q欠失がなく,増殖速度が速いと考えられる退形成性乏突起星細胞腫AOA NOS ではアバスチンを併用した方がいいかもしれません
- こういうのはオリゴといっても膠芽腫に近い性格を有します