肺移植後の長期フォロー
2025.02.23
肺移植は多くの末期呼吸不全の患者さんにとって、生きる希望となる医療です。2014年に肺移植認定施設となった当院は、2015年4月第1例目の肺移植を実施し、2025年2月23日までに合計230件の肺移植を実施(生体肺移植30件、脳死肺移植200件)、ここ最近では国内最多の肺移植を実施しています。また5年生存率は約75%と、世界水準(約55%:国際心肺移植学会レジストリデータ)と比べて良好で、国内平均と同等の結果を得ています(1、2)。
しかし肺移植後の生存率は、心臓・肝臓など他臓器の移植と比べると厳しい数字になっています(国内の移植後5年生存率:心臓、93.1%;肝臓、83.4%;日本臓器移植ネットワーク公表データから)。
肺移植によって繋いだ命をいかに大切にして日々を過ごしていただくか、肺移植を受けられた患者さんにとっても、ご家族にとっても、肺移植を実施する私たちにとっても、非常に重要な問題です。東京大学肺移植プログラムでは、既に非常に多くの肺移植患者さんのフォローアップを行っていますが、今後ますます増えるであろう肺移植後患者さんが、どの病院で診てもらっても充実した健康的な生活を送れるよう、取り組みを進めています。このコラムでは、なぜ肺移植「後」が難しいのか、そしてどのような解決策があるのかを、できるだけわかりやすく解説します。
肺移植「後」の難しさはどこから来るのか?
肺移植は手術そのもののリスクもさることながら、移植後の管理にも様々な困難が伴います。他の多くの移植臓器(心臓・肝臓・腎臓など)と大きく異なるのは、外界に曝された臓器であるという肺の特徴です。肺は空気の通り道である気管・気管支を通じて常に外界に曝されています。そこからは、空気中の微生物(細菌、ウイルス、カビ)に加えて、口の中や消化管(食道・胃など)からの消化液や細菌の流れ込み、あるいは様々な空気中の汚染物質が侵入してきます(大気汚染も肺移植後の肺機能に大きな影響があることが、最近トロント大学との共同研究で明らかになりました(3))。
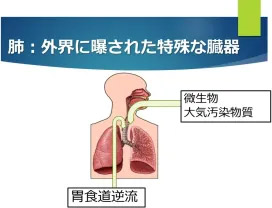
肺移植後は移植された肺を体が拒絶しないよう、生涯にわたって免疫抑制剤を飲む必要があります。通常は、ネオーラル(cyclosporine)またはタクロリムス(tacrolimus, FK506)、セルセプト(myocofenorate mofetil: MMF)、ステロイド(predonine) の3種類の免疫抑制剤を服用していただき、患者さんの状態によって投与量の変更や薬剤の変更を行います。一般的に肺移植後に必要となる免疫抑制剤の量は他の臓器移植よりも多く必要であることが知られており、他の臓器よりも拒絶反応が起きやすいことの現れです。一方、免疫抑制剤を多く使うことで体の免疫力が落ちるため、感染症などにもかかりやすくなります。つまり、肺移植後は拒絶されやすく感染もしやすい状態となるのです。
なぜ肺は拒絶されやすいのか?
そもそもなぜ肺が拒絶されやすいかといえば、前述のとおり肺は外界に曝された臓器であり、体に侵入してくる様々な外敵と戦うための高度な免疫系を進化の過程で発達させてきたことと関係がありそうです(4)。そして皮肉なことに、肺移植後はその強力な肺の免疫力を押さえるために使わざるを得ない免疫抑制剤が、外界と通じている肺の特性と相まって、さらに感染症にかかりやすい状況をつくってしまうのです。実際、肺移植後慢性期の、移植手術を乗り越えた患者さんの命を危険にさらす最大の原因は肺移植後の慢性拒絶であり、次いで呼吸器感染を中心とした感染症があげられます(1)。肺移植後の患者さんは生涯にわたって、拒絶と感染の間の微妙なバランスを取り続けなければなりません。そればかりか、感染症や、その他の肺への刺激(胃食道逆流による消化液の流れ込みや大気汚染など)が肺の免疫を刺激し、慢性拒絶のきっかけとなることもわかってきました。これまで「慢性拒絶」と呼ばれてきたものは、単純な拒絶だけでなく、様々な因子が引き金となって移植された肺の機能を低下させることから、専門家の間ではあえて慢性拒絶とは呼ばず、慢性移植肺機能不全(chronic lung allograft dysfunction: CLAD(クラッドと読みます)) という呼び方が国際的には定着しつつあります。ここではわかりやすいよう、あえて慢性拒絶という呼び名を使っています。慢性拒絶・CLADの発症率は、肺移植後5年で50%に及ぶとされています(1)。
慢性拒絶になるとどうなるのか?
肺移植後の慢性拒絶(CLAD)は従来、末梢気道の炎症・線維化と狭窄を中心とする閉塞性細気管支炎(bronchiolitis obliterans: BO)であると言われてきました。BO自体は肺組織を生検でとってきて顕微鏡でみたときの診断(病理診断)であり、現実には肺移植後の生検は危険性を伴い診断率も低いことから、呼吸機能、特に1秒量(FEV1.0、1秒間に吐き出せる息の量)の低下をもって、bronchiolitis obliterans syndrome (BOS:「ボス」と読みます)と診断されてきました。
こうした呼吸機能の低下に加え、BOSの症状は一般的には息切れ、場合により咳や痰、発熱を伴うこともあります。多くの場合は残念ながら不可逆的な変化、つまり一度落ちてしまった呼吸機能は多くの場合元に戻らず、進行すれば在宅での酸素が必要になることもあります。BOSに対する有効な予防法や治療法は確立していませんが、その原因の除去(拒絶に対する免疫抑制、感染症の治療、逆流性食道炎の治療、炎症全般に対する低用量マクロライド系抗生物質投与など)はBOSの予防と、BOSを発症したあとでも、その病状進行の抑制に意義があると考えられています。
2010年、Satoらは(現在当科診療科長の佐藤のことですが)カナダ・トロント大学・トロント総合病院で、BOSとされていた患者の約1/3~1/4は、気道主体の病変よりも末梢肺の病変が中心であり、呼吸機能的にはBOSに特徴的な閉塞性障害ではなく、むしろ拘束性障害を来すことを見出し、BOSとは異なるタイプの慢性拒絶として Restrictive Allograft Syndrome (RAS:「ラス」と読みます)と命名しました(5)。RASはBOSと比べると進行が速く予後不良であることがわかりました(5)。
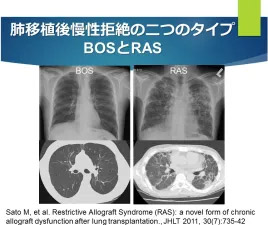
残念ながらRASもまた、有効な治療法・予防法が確立されているわけではありませんが、RASの発見でみえてきたのは、従来はBOSとして一緒にされていた慢性拒絶が多様な病態の集まりであり、進行がとくに早いRASを除くと、純粋なBOS-とくに移植から2年以上たって発症したBOSは比較的予後がよいということでした(6)。
ここで我々にとっても肺移植患者さんにとっても重要な点が2点あります。
- BOSの場合はあわてず、慎重に免疫抑制剤の調整や感染症管理を行うこと。拒絶だと慌てて大量の免疫抑制剤を投与し、感染症で命を落とす患者さんが多いこと、免疫抑制の増強はBOSにはそれほど有効でないことが多いことから、患者さんのQOLを維持して無理のない治療を進めることが重要であろうと考えられます。呼吸機能の低下が続く場合には、年齢等によっては再移植を検討することもあります。いずれも専門的な判断が必要となります。
- 予後不良な慢性拒絶であるRASの病態解明と治療法の研究を進めること。免疫抑制の維持が不十分である場合、RASとなる可能性が高いという印象があります。その意味では、慢性拒絶発症前の微妙な免疫抑制剤のコントロールができているかどうかがカギになります。またRASはしばしばウイルス等の感染に続発することが知られており、最近ではCOVID-19に続発するRASを報告し(7)、臨床上注意が必要と考えています。
日本における肺移植後の慢性期管理をリードする
ここまで見てきたように、肺移植後の慢性期管理で特に重要なのは、医師と患者・家族がともに肺移植後という特殊な状態とおこりうる事態についての高い知識と意識をもち、こまめに連絡をとって慢性拒絶や感染などの変調のきざし、治療のタイミングを見逃さないことです。
とくに長期生存中の患者さんが増えるにつれ、その管理はますます重要かつ煩雑になってきております。このような状況を解決する方法として、当院では肺移植後の患者さんの状況を遠隔でもリアルタイムで確認できるシステム『Lt-followup』を開発しました。
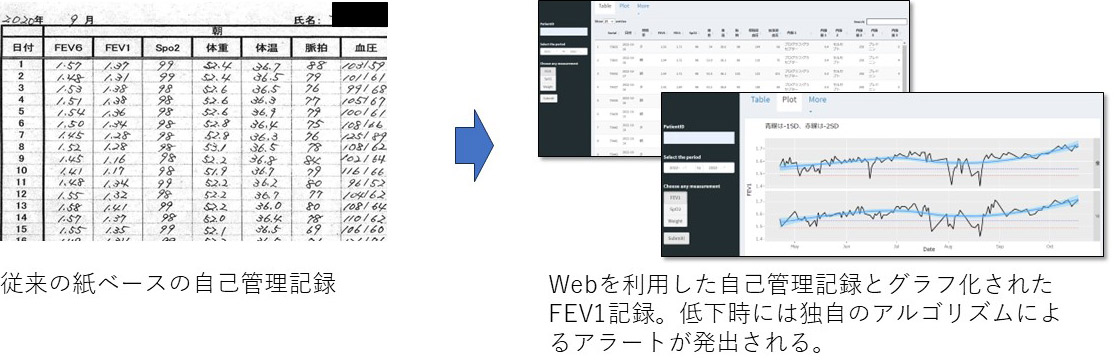
従来、肺移植後の患者さんは退院後、自宅で毎日呼吸機能検査やバイタルサイン測定をおこない、キードラッグである免疫抑制剤の内服状況とあわせて紙ベースの自己管理表に記載し、定期受診時に提出していました(下図左側)。しかし、このやり方では、定期受診時にしか医療者がデータを確認できず、それ以外のタイミングでの異常の検知は患者さんの自己申告に依存していました。また、デジタル化されていないデータの全体像は把握が困難でした。つまり、収集している患者さんの生体情報が十分生かせていませんでした。
2020年のLt-followup導入以来、必要に応じて患者さんの呼吸機能(特に重要なFEV1)の経時的変化をグラフに表すことで視覚化して確認し(下図右側)、FEV1低下時には独自のアルゴリズムに基づきアラートをだすなどして、患者さんの状態変化をいち早く発見・対応することができるようになりました。
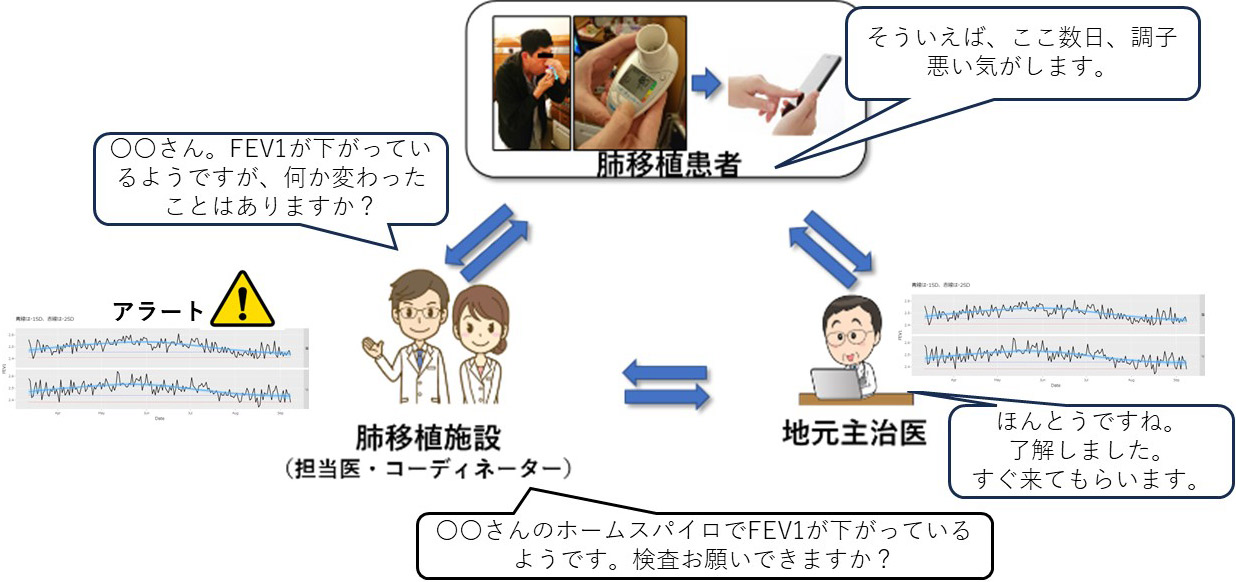
また、東大病院への通院が難しく地元病院で主に経過観察いただいている遠隔地の患者さんについても、2023年より一部地域の医療機関と、本システムの情報を共有し、リアルタイムでの連携を可能にするバージョンアップを行いました。
さらに2024年、本システムを国内の肺移植施設で広く使用できるようにし、また同時に機械学習を取り入れて診療に役立てるため、科学研究費基盤研究B(「肺移植後の在宅呼吸機能モニタリング・解析と予測モデル開発:多施設共同研究(24K02533)」;研究代表者、佐藤雅昭)を取得し、国内の全肺移植施設においてLt-Followupの使用が始まりつつあります。
また移植後の管理が難しく煩雑であることは肺に限った問題ではなく、2025年度から東京大学に開設する寄付講座「次世代臓器移植開発推進講座」の研究部門では、上記の多施設共同研究を進めながら本システムのアップデートをさらに促進し、将来的には肺以外の臓器移植にも応用可能な、AIによる診療補助システムを開発すべく、研究を進めていく予定です。このような活動を通じて肺移植の長期予後の改善に貢献できればと考えています。
参考文献
- Singh TP, Cherikh WS, Hsich E, et al.; International Society for Heart and Lung Transplantation. Graft survival in primary thoracic organ transplant recipients: A special report from the International Thoracic Organ Transplant Registry of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant. 2023;42(10):1321-1333.
- Oishi H, Okada Y, Sato M, et al. Prognostic factors for lung transplant recipients focusing on age and gender: the Japanese lung transplantation report 2022. Surg Today. 2023;53(10):1188-1198.
- Bhinder S, Chen H, Sato M, et al. Air pollution and the development of posttransplant chronic lung allograft dysfunction. Am J Transplant. 2014;14(12):2749-57.
- Sato M. Chronic lung allograft dysfunction after lung transplantation: the moving target. Gen Thorac Cardiovasc Surg. 2013;61(2):67-78.
- Sato M, Waddell TK, Wagnetz U, et al. Restrictive allograft syndrome (RAS): a novel form of chronic lung allograft dysfunction. J Heart Lung Transplant. 2011;30(7):735-42.
- Sato M, Ohmori-Matsuda K, Saito T, et al. Time-dependent changes in the risk of death in pure bronchiolitis obliterans syndrome (BOS). J Heart Lung Transplant. 2013;32(5):484-91.
- Ohizumi Y, Kurokawa R, Amemiya S, Ito T, Sato M, Abe O. Restrictive Allograft Syndrome After COVID-19 Pneumonia: A Case Report. Cureus. 2024;16(2):e54583.


