肺がんが疑われたら
2014.10.17
はじめに
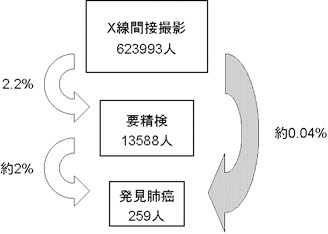
また近年ヘリカルCTの普及により、従来のレントゲンでは指摘することが出来ない小型・早期肺癌が見つかる機会が増えています。ここでは『肺に「かげ」がある』と言われた、すなわち肺癌が疑われ精密検査を要するといわれた患者さんが専門機関を受診した際にどのような検査が必要となるのか、その方法および診断手順について解説します。
Published: 2014.10.16 Last Updated: 2015.03.16
精密検査の方法
問診
咳、痰、血痰、発熱、呼吸困難、胸痛などの症状の有無をお伺いします。
またこれまでに患った病気、内服されているお薬、お仕事の内容についてお伺いします。
たばこを吸っている方は禁煙しましょう。
Published: 2014.10.16 Last Updated: 2014.11.21
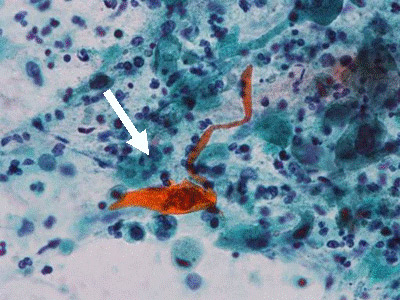
喀痰検査(細胞診・培養検査)
痰あるいは血痰がでる場合、それを採取して検査に提出します。
肺癌における喀痰細胞診の検出感度は約40%にすぎませんが、体への負担が軽く簡便である利点があります(文献1-3)。
感染症が疑われる場合には培養検査(一般細菌ならびに抗酸菌培養)を行います。
仮に結核菌が検出された場合、結核予防法に従った対応が必要となります。
腫瘍マーカー
癌の種類によっては血液中の腫瘍マーカーが高値を示すことがあります。
肺癌で一般的に用いられている腫瘍マーカーにはCEA, SCC, CYFRA, ProGRP, NSEなどがあります。
腫瘍マーカーの値は診断の補助になりますが、進行した癌であっても腫瘍マーカーの上昇が見られない症例があります。
逆に健常者であっても腫瘍マーカーが異常値を示すこともあります。
腫瘍マーカーの値の解釈は他の検査結果とあわせて行う必要があるといえます。
Published: 2014.10.16 Last Updated: 2014.11.21
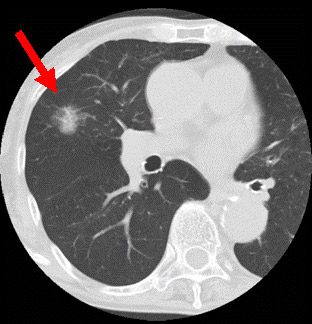
CT検査
現在用いられているヘリカルCTは一回の息止めで肺全体を撮影することができます。また高分解能CTでは病変部位を1-3ミリの厚みで撮影し病変の大きさ、性質を詳細に描出することができ、病変の質的な診断に有用です。造影剤を用いることで腫瘤の性質をより詳細に診断することができます。またリンパ節が腫れていないかを明瞭に診断できるようになります。造影剤を用いることでアレルギー症状がでることがありますので造影剤を使用する前にあらかじめ問診をして確認しています。腎臓の悪い方には造影剤を用いることは控えています。
CT検査は従来のレントゲン検査と比べてはるかに多くの情報を与えてくれますが、このことは逆にCTを撮影することで思いがけない小さな結節を発見する機会が増えます。5mm以下の病変については質的な診断を行うことは困難です(文献4)。
CTで分かることはあくまで病変の性状であり、確定診断のためには以下に記すような方法で病変の一部分を取ってきて顕微鏡検査を行う必要があります。
Published: 2014.10.16 Last Updated: 2015.03.16
PET検査
CT検査では病変の良悪性の診断が困難である場合、あるいは肺癌であった場合の病気の広がり診断(病期診断)にはPET検査が用いられます。
PETはPositron Emission Tomography(ポジトロン断層撮影法)の略になります。
通常FDGと呼ばれるブトウ糖に似た放射性同位元素の注射後に撮影を行います。
糖尿病のある方は検査に当たり注意が必要です。
PET検査は悪性病変の診断に高い感度(97%)と中等度の特異度(78%)をもっています(文献5)。
ただし1cm以下の病変やある種の肺癌(カルチノイド、上皮内腺癌)では陰性になってしまうこと、また肉芽腫の一部は陽性になってしまう点に注意が必要です。
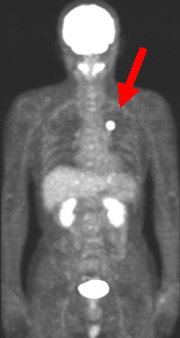
その他、脳、腎臓、膀胱等にも取り込みを認めますが、これらは生理的な集積です。
リンパ節や遠隔臓器への集積はありません。手術が施行され、肺癌と診断されました。
Published: 2014.10.16 Last Updated: 2014.11.21
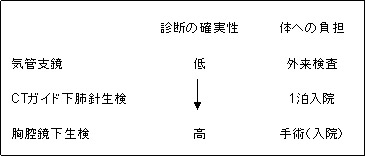
肺癌が疑われる場合の診断方法
肺癌が疑われる場合、きちんと診断をつけることが大事です。
検査方法には気管支鏡、CTガイド下肺針生検、胸腔鏡下生検などがあります。
それぞれの検査方法は病変の部位や大きさなどに応じて使い分けられます。
Published: 2014.10.16 Last Updated: 2014.11.21
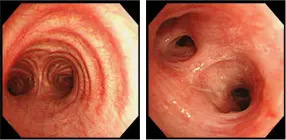
気管支鏡検査
のどの麻酔を行ったのち、空気の通り道に気管支鏡(カメラ)を挿入して観察します。
気管支鏡で観察できるのは太い空気の通り道に限られます。
このため肺の外側に存在する病変から検査に必要な検体を採取するためにはレントゲン透視を用いて病変の位置を確認します。
検査の主たる合併症は気胸と出血で両者を合わせた頻度は2-6%です(文献6-8)。
気管支鏡検査の感度は40-80%です(文献6)。
一般的には小さな病変、肺野の末梢に存在する病変では確定診断は困難になります。

Published: 2014.10.16 Last Updated: 2014.11.21
CTガイド下肺針生検
CTを用いて位置決めをした後、局所麻酔下に体の表面から針を刺して病変の一部を採取します。
合併症として気胸(15-25%)と出血(2-6%)があります。
またまれに空気塞栓、腫瘍播種(癌細胞をばらまいてしまう)といった合併症がみられます。
検査は入院して行います。
特別な合併症がなければ検査翌日に退院となります。
気胸の程度によっては胸腔ドレーンを挿入する処置が必要となります。
この場合入院日数は長くなります。
CTガイド下針生検の適応は、気管支鏡検査が困難と予想される病変や、気管支鏡検査で診断が得られなかった病変などになります。
検査の感度は86%、特異度は98%程度です(文献9)。
すなわち、診断精度は気管支鏡より高いといえますが、偽陰性(正しい診断が得られない)となる可能性は残ります。
この写真では、うつ伏せの姿勢で背中側から針を挿入しています。

Published: 2014.10.16 Last Updated: 2015.03.16
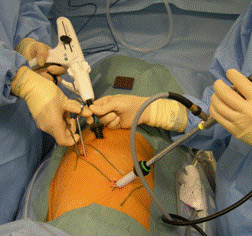
胸腔鏡下生検
ほぼ100%の感度、特異度があります。
全身麻酔を必要とします。
したがって他の検査では診断が得られない患者さん、肺癌が強く疑われる患者さんが対象となります。
胸に3箇所小さな切開(1-2cm)を行って胸腔鏡と呼ばれるカメラを用いて操作します。
迅速病理診断を併用して手術中に診断結果を知ることができます。
診断結果が肺癌(非小細胞肺癌)であった場合、胸腔鏡下生検にひきつづき根治的な手術を行うことが可能です。
すなわち胸腔鏡下生検は診断と治療を兼ねています。
治療は入院して行います。
生検のみであれば手術後数日で退院可能です。
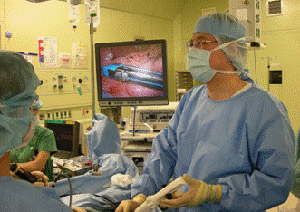
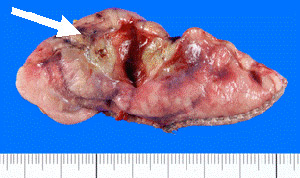
引き続き肺葉切除、リンパ節郭清が施行されました。
比較読影
毎年検診を受けている方あるいは以前胸部レントゲン写真を撮影した事のある方は可能であれば以前のレントゲン写真を持参してください。
今回異常を指摘されたレントゲンと以前の写真を比べてみることで病気の性質をより詳しく知ることができます。
例えば数年前から異常を指摘されており、以前から病変の形、大きさに変化が見られない場合は肺癌である可能性は低いと考えられます。
一方、以前のレントゲン写真では認められないものの今回初めて異常を指摘された新出の病変については精査が必要になります。
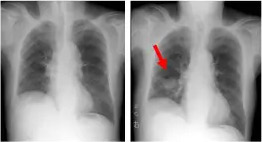
以前の胸部レントゲン写真(左上)では同部位には陰影を認めていません。
手術が施行され、扁平上皮癌と診断されました。
Published: 2014.10.16 Last Updated: 2014.11.21
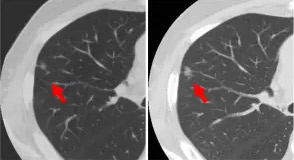
経過観察
気管支鏡やCTガイド下針生検では確定診断をつけることが困難であると判断された場合、CTを用いた経過観察が行われることがあります。
次回のCT検査までの期間は腫瘤の性質によって異なります。
おおむね1-3ヵ月後に再検査を行い、変化がみられなければ3-6ヶ月毎の経過観察を行うことが一般的です。
経過中、陰影が消失した場合には炎症性腫瘤(すなわち良性)であったと考えられます。
逆に陰影の増大が見られた場合には精密検査が必要になります。
Published: 2014.10.16 Last Updated: 2014.11.21
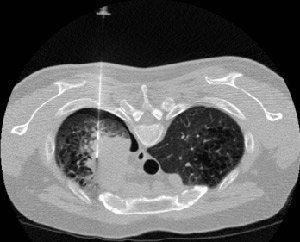
肺癌のCT所見
胸部レントゲンで異常を指摘された方にはCT検査を行います。
「肺癌を疑う」CT所見には、大きさ・部位・辺縁の性状(けば立ちやひきつれ)・濃度(周囲の淡いスリガラス)などがあります。
これらの所見を総合して、『肺癌の可能性がどの位であるか』をお伝えします。
肺癌のCT画像
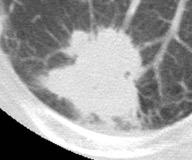
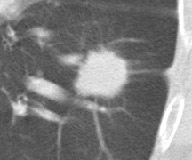
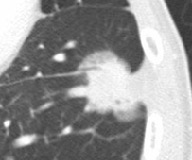
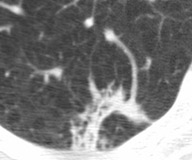
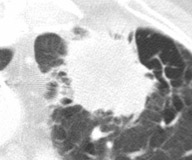
(比較)良性腫瘍のCT画像

Published: 2014.10.16 Last Updated: 2014.11.21
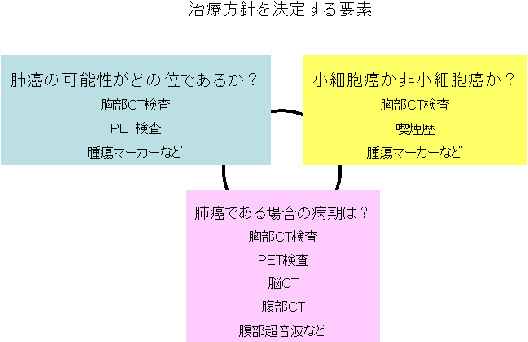
肺癌が強く疑われる場合の診療手順
肺癌が強く疑われる場合には、診断と並行して病気の広がり・進行度(病期)を調べることが重要です。
肺癌の8割以上を占める非小細胞肺癌(腺癌・扁平上皮癌・大細胞癌)では病期に応じて治療方針が異なるためです。
肺癌の病期を調べる検査には胸部CTのほか、脳CTやPET検査、腹部超音波、腹部CTなどがあります。
Published: 2014.10.16 Last Updated: 2015.03.16
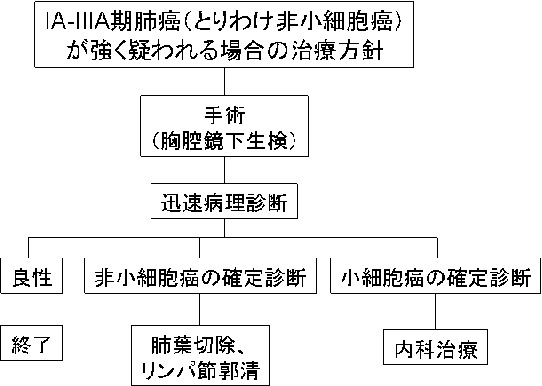
IA-IIIA期肺癌(とりわけ非小細胞癌)が強く疑われる場合の治療方針
IA-IIIA期非小細胞肺癌が強く疑われる場合には胸腔鏡下生検をお勧めします。
胸腔鏡下生検により確実な診断が可能です。
また段階的に気管支鏡やCTガイド下肺針生検を行うよりも診断結果が得られるまでの期間が短縮できるため、肺癌であった場合迅速な治療開始が可能となります。
迅速病理検査を行うことにより手術中に診断をつけることができます。
このため、1回の手術で診断と治療を兼ねることができます。
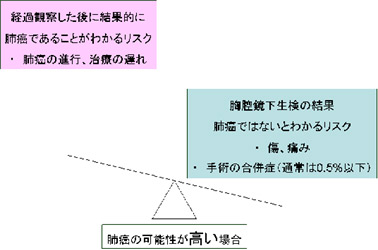
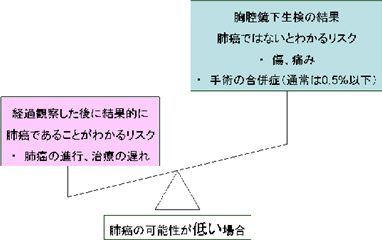
診断・検査のメリット・デメリット
これまでの説明をまとめると下記のようになります。
胸腔鏡下生検は安全で確実な診断方法であり、CT所見から肺癌の可能性が高い場合にはお勧めします。
仮に検査の結果が肺癌ではなかった場合でも、「肺癌ではなかった」という確実な診断は患者さんの大きな安心になります。
一方肺癌の可能性が低い場合には、注意深い経過観察を行い、CT所見の経時的な変化をみることになります。
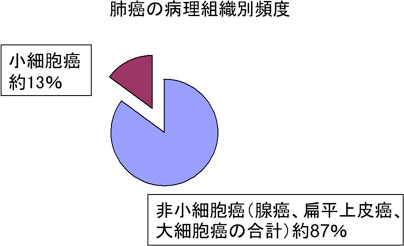
補足1)肺癌の病理
肺癌の病理診断は大きく
- 腺癌
- 扁平上皮癌
- 大細胞癌
- 小細胞癌
の4つの組織型に分類されます。
小細胞癌は肺癌全体の13%を占めます。
小細胞癌は進行が早く、また放射線や化学療法に対する感受性(効き目)が高いことから、ほとんどの症例では手術以外の内科的な治療が行われます。
一方、腺癌、扁平上皮癌、大細胞癌は合わせて非小細胞肺癌と呼ばれます。
IA期からIIIA期の一部までの非小細胞肺癌では手術適応となります。
Published: 2014.10.16 Last Updated: 2014.11.21
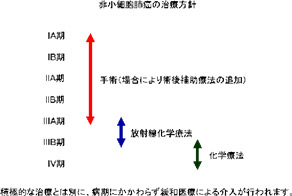
補足2)肺癌の治療
2013年人口動態統計によると日本国内で約37万6,000人の方が悪性腫瘍により亡くなられています。うち肺癌による死亡は約73,000人であり、悪性腫瘍による死亡の第1位となっています。肺癌患者さん全体の5年生存率は16%程度と不良です(文献 11)。
肺癌は症状なく進行し、発見された際には脳・骨・肝臓・副腎などへの遠隔転移を伴っているためです。このような患者さんは肺癌全体の約39%に及びます(文献12)。遠隔転移を伴う肺癌の病期はIV期であり、化学療法(抗癌剤)の適応となりますが、治療成績は不良です。
肺癌の治療は手術、放射線治療、化学療法があり、病理診断と病期(癌の進行度)に応じて決定されます。小細胞癌と診断された場合、手術が行われることはほとんどありません。病気の広がりに応じて放射線化学療法(放射線治療と抗癌剤治療を組み合わせた治療)または化学療法が適応となります。
非小細胞肺癌の治療は病期に応じて手術、放射線治療、化学療法が適応となります。非小細胞癌と診断された症例のうち、手術が適応となるのはIA期からIIIA期の一部までです。これは肺癌と診断される患者さんの約29%です(文献13)。すなわち、肺癌と診断されても手術適応とならない患者さんのほうが多いのが現状です。
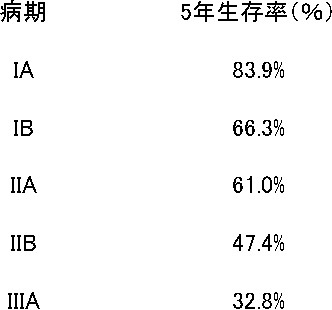
補足3)肺癌の手術治療成績
肺癌と診断され、手術が行われた患者さん全体の5年生存率は69.6%です(文献14)。すなわち、手術が行われた場合、5人に3人は治るといえます。
肺癌の手術成績は病期によって異なります。病期には術前検査(CTやPET検査)から得られる情報に基づいて決定される術前病期と手術後の顕微鏡検査に基づいて決定される病理病期があります。手術が行われた場合、病理病期は最終的な病期であり、肺癌の予後や手術後の追加治療(術後補助療法)を決定する上で極めて重要です。
残念ながら手術を行ってもすべての患者さんの肺癌がなおるわけではありません。手術後に再発した肺癌の予後は1年以内であり、治癒を期待することはできません(文献15)。このため手術後に頻回に検査を行い、早期に再発を発見する明確な根拠はないと考えられています。肺癌手術後の適切な外来通院の期間については定説がないのが現状ですが、術後2年間は3か月毎、それ以降は6か月毎のフォローアップが推奨されています(文献16)。
肺癌術後に新たな肺癌が見つかることがあります。これを異時性肺癌と呼びます。異時性肺癌とは手術が行われた肺癌は治癒している状態で、初回の癌とは異なる別個の肺癌ができることを意味しており、再発とは異なります。異時性肺癌の頻度は1年あたり1-2%です(文献17)。異時性肺癌は再発ではありませんので、病期ならびに患者さんの全身状態に基づいて治療方針が決定されます。
Published: 2014.10.16 Last Updated: 2015.03.16
Q & A
- Q1
- 症状がないのに診断や治療を受ける必要がありますか?
- A
- 患者さんの中には健康診断で肺癌を発見される場合があります。
初期の肺癌では症状がないことがあります。
逆に症状が出てから発見された肺癌の治療成績は不良です(文献14)。
ですので、症状がなくても肺癌の疑いがある場合には診断や治療を受けることをお勧めします。

Published: 2014.10.16 Last Updated: 2014.11.21
- Q2
- 症状が無いのですが放置した場合どうなりますか?
- A
- 健康診断で発見された肺癌を放置した場合、余命は約2年です(文献15)。
適切な治療により、肺癌の治癒や延命効果を期待することが出来ます。

Published: 2014.10.16 Last Updated: 2014.11.21
- Q3
- 喫煙をやめるようにいわれたのですが
- A
- 喫煙は肺癌の危険因子です(文献16, 17)。
たばこを吸う人が肺癌になる危険率は、たばこを吸わない人の10-20倍と報告されています。
喫煙開始年齢が若いほど、また喫煙量が多いほど肺癌リスクは高くなります(文献18)。
一方、禁煙をすることで肺癌リスクは低下し、禁煙年齢が低いほど、その効果が大きいとされています。
肺癌以外にも、喫煙は肺癌以外にも肺気腫などの病気の原因となります。
またあなたが喫煙をすることで、周りの方に健康被害を及ぼす恐れがあります。
ですので、喫煙をやめる努力をするのが望ましいのです。
喫煙をやめることが難しい方には、禁煙外来があります。
詳細は担当医にご相談ください。
Published: 2014.10.16 Last Updated: 2014.11.21
- Q4
- たばこをすわないのに肺癌にかかることがあるのでしょうか?
- A
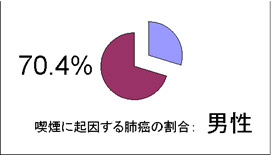
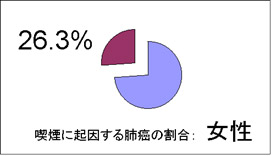
- 肺癌患者さんのうち男性では70.4%、女性では26.3%が、本人の喫煙に起因すると推定されています(文献19)。
このことは逆に男性患者の29.6%、女性患者の73.7%の方は、本人の喫煙に関係なく肺癌に罹患されていることを示しています。
ただし、本人がたばこを吸わない場合でも、周りに喫煙される方がいて、その煙を吸い込んでしまう環境(受動喫煙)は危険因子の一つになります。
一方、たばこと関連なく肺癌に罹患される患者さんもいらっしゃいます。
現在、肺癌の危険因子に関する多くの疫学研究や基礎研究が行われており、今後の原因究明が望まれます。
Published: 2014.10.16 Last Updated: 2014.11.21
- Q5
- 仕事が忙しいので3ヵ月後に検査を受けたいが大丈夫でしょうか?
- A
- 癌の進行速度は個々の患者さん毎に異なりますが、肺癌であると診断されている症例、肺癌が強く疑われる症例については早期の診断と治療をお勧めします。
時間経過とともに癌の進行、リンパ節や遠隔臓器への転移のリスクが高くなるためです。
外来通院や入院にあたり日程の調整は担当医とご相談ください。
またお仕事をお休みする際に会社に提出する書類(診断書など)については個別に対応させていただきます。
Published: 2014.10.16 Last Updated: 2014.11.21
- Q6
- 気管支鏡検査を行うよう言われましたが必要ですか?
- A
- 現在用いられているヘリカルCTは非常に精度が高いため、肺野の状態を詳細に診断することができます。
ただし中心型早期肺癌(扁平上皮癌)の診断にはむしろ喀痰細胞診や気管支鏡検査が用いられます。
血痰が出る方、喀痰細胞診で異常を指摘された患者さんのうちCT検査にて肺野に異常が認められない方には、気管支鏡検査をお勧めします。
一方、肺野末梢に存在するIA-IIIA期非小細胞肺癌が強く疑われる場合、胸腔鏡下生検により確実な診断が可能です。
また迅速病理検査を行うことにより手術中に診断をつけることができます。
このため、気管支鏡検査を省略して、1回の手術(胸腔鏡下検査)で診断と治療を兼ねることができます。
気管支鏡検査以外の方法としてCTガイド下肺針生検があります。
病変の部位・大きさにより両検査の診断率、起こりえる合併症の頻度は異なります。
Published: 2014.10.16 Last Updated: 2014.11.21
- Q7
- 「肺癌疑い」といわれて手術を勧められました。
レントゲンで異常があるといわれて専門機関を受診しました。
CT検査を撮影したところ、「肺癌疑い」といわれて手術を勧められました。
まだ肺癌かどうかわからない状況ではたして手術は必要なのでしょうか?
- A
- 肺野に異常を指摘された場合、CTを用いた精密検査が必要です。
撮影されたCTは放射線科医による読影が行われ、CT所見から強く肺癌が疑われる場合があります。
肺癌が疑われる場合、確定診断に先立ち肺癌に準じて病期診断が行われることがあります。
病期診断にはPET検査、脳CT(MRI)、骨シンチ、腹部超音波、腹部CTなどがあります。
これらの検査の結果に基づき、肺癌であった場合の病期(すなわち進行具合)が決定されます。
仮に肺癌であった場合、病理診断ならびに病期によって治療方針が異なります。
IA期からIIIA期の一部までの非小細胞肺癌は手術の適応となります。
このため気管支鏡・CTガイド下肺針生検によって非小細胞肺癌の確定診断が得られ、手術適応と考えられる場合には手術(肺葉切除、リンパ節郭清)が行われます。
一方、CT所見から強く肺癌が疑われるにもかかわらず、気管支鏡・CTガイド下肺針生検で確定診断が得られなかった場合、確定診断をつけるために胸腔鏡下生検をお勧めします。
胸腔鏡下生検は全身麻酔下に行われる手術です。
すなわち気管支鏡・CTガイド下肺針生検の結果にかかわらず、CT所見からIA期からIIIA期の非小細胞肺癌が強く疑われる場合、手術適応となります(“肺癌のCT所見”参照)。
このため気管支鏡・CTガイド下肺針生検を省略して、胸腔鏡下生検が選択されます。
なお、肺癌診療ガイドラインでは「一部の手術例を除き, 組織もしくは細胞診断は治療開始前に行うように勧められる。その方法としては, 経気管支生検, 経皮生検, 胸腔鏡下生検, 開胸生検などがあり、患者の状況と施設の状況から適切な方法を用いるべきである」となっています(文献20)。
手術前に確定診断が得られていない症例では、胸腔鏡下生検と術中の迅速病理診断の結果に基づき、肺癌手術が行なわれます(Q8参照)。
Published: 2014.10.16 Last Updated: 2014.11.21
- Q8
- 胸腔鏡下生検とはどのような手術なのでしょうか
CT所見から肺癌が強く疑われるために胸腔鏡下生検を勧められました。
迅速病理診断の結果によっては、肺葉切除とリンパ節郭清を行うといわれました。
胸腔鏡下生検とはどのような手術なのでしょうか?
- A
- 胸腔鏡下生検は全身麻酔下に行われる手術です。
手術前には呼吸機能検査、心電図検査、採血による腎・肝機能の評価などが必要です。
肺癌が強く疑われるとはいっても確定診断が得られているわけではないので、胸腔鏡下生検にあたり体の負担はなるべく軽く済むように心がけています。
肺癌の手術では通常15cmほどの皮膚切開を行いますが、胸腔鏡下生検では1-2cmの皮膚切開を3ヵ所に行います。
筋肉は切らずに温存します。
手術は胸腔鏡と呼ばれる内視鏡装置を用いて大型のテレビ画面を見ながら操作をします。
腫瘤の位置を確認後、腫瘤と周囲の肺を含めて部分切除を行います。
切り取られる肺の容量は少ないので、呼吸機能に与える影響はほとんどありません。
切り取った肺は袋に入れて回収して、迅速病理診断に提出されます。
迅速病理診断の結果が出るまで30分ほど要します。
胸腔鏡下生検のみであれば手術時間は2時間以内に終了します。
迅速病理診断の結果が非小細胞肺癌であれば肺癌の標準的な手術として、ひきつづき肺葉切除とリンパ節郭清が行われます。
胸腔鏡下生検に伴う合併症の頻度は極めて低いですが、手術前に担当医から説明を受け十分に理解していただきたいと思います。
Published: 2014.10.16 Last Updated: 2014.11.21
- Q9
- 経過観察と言われました。腫瘤を放置しておいてよいのでしょうか?
気管支鏡を行いましたが診断がつかなかったため、経過観察をしましょうといわれました。
腫瘤があるにもかかわらず放置しておいてよいのでしょうか?
- A
- 指摘された肺野の陰影に対しては、CTやPET検査を用いて腫瘤の質的な診断を行います。
これらの結果は強く肺癌を疑う場合から、良性と考えられる場合まであります。
最終的には腫瘤の一部分を採取して病理検査を行わなければ確定診断はつきません。
気管支鏡やCTガイド下肺針生検を行った場合でも確実に診断が得られる可能性が低い場合、検査に伴う合併症が危惧される場合にはこれらの検査は行われません。
また胸腔鏡下生検は安全な手術とはいえ、体にとっては負担となります。
ですから発見された全ての腫瘤に対して行われるわけではありません。
通常、胸腔鏡下生検は肺癌が強く疑われる場合に適応となります。
しかし肺の奥深い場所に存在する場合、部分切除は困難です。
このため胸腔鏡下生検はメリットとデメリットとを比較してよりメリットの大きい場合にのみ施行されます。
肺癌の可能性が低いと考えられる場合、胸腔鏡下生検が困難な場合には経過観察が行われる場合があります(「肺癌が強く疑われる場合の診療手順」参照)。
経過観察が行われた際、経過中に陰影の増大が見られた場合は肺癌が疑われます。
ただし経過観察が行われた場合でも、始めの段階で強く肺癌を疑うことは困難であったということをご理解ください。
経過観察にあたっては検査と経過観察のメリットとデメリットを十分に理解される事が大事です。
ご不明な点は担当医にお問い合わせください。
Published: 2014.10.16 Last Updated: 2021.03.12
- Q10
- 「転移性肺腫瘍」は肺癌とは異なるのでしょうか?
2年前に大腸癌の手術をしました。
今回レントゲンを撮影したところ、肺に異常があると言われ、「転移性肺腫瘍の疑い」があると言われました。
「転移性肺腫瘍」は肺癌とは異なるのでしょうか?
- A
- 肺にできる悪性腫瘍には原発性肺癌と転移性肺腫瘍があります。
原発性肺癌とは、肺から発生した癌、すなわち肺組織が何らかの原因で癌化した結果できた癌です。
通常肺癌といえば、原発性肺癌のことをさします。
一方、転移性肺腫瘍も肺の悪性腫瘍でありますが、他部位に発生した癌が遠隔転移をし、肺内で増殖した腫瘍のことを意味します。
他部位に発生した癌が血液の流れに乗って癌細胞が全身をめぐり、その一部が肺に着床し、増殖した結果です。
それゆえ、転移性肺腫瘍は癌が全身に広がっている状態ということができます。
転移性肺腫瘍であっても、条件を満たすことで外科切除の適応となります。
また癌腫によっては転移性肺腫瘍の外科切除により良好な治療成績が得られています。
原発性肺癌では肺葉切除とリンパ節郭清が標準術式でありますが、転移性肺腫瘍では肺部分切除術が行われます。
転移性肺腫瘍は、もともとの癌の発生部位により性格が異なります。
大腸癌の転移性肺腫瘍の場合は、肺に存在する病変であっても腫瘍は大腸癌の性質をもっています。
それゆえ、抗癌剤治療がおこなわれる場合、大腸癌で用いられる薬の組み合わせが選択されます。
転移性肺腫瘍の治療は呼吸器外科医のみならず、原発臓器の治療担当医との協力が不可欠です。

- Q11
- 肺癌の手術(肺葉切除、リンパ節郭清)は危険ですか?
- A
- 胸腔鏡下生検に伴う合併症の頻度は極めて低く、安全な手術であるといえます。
一方、胸腔鏡下生検により肺癌(非小細胞肺癌)と診断された症例に対しては標準外科治療(肺葉切除、リンパ節郭清)を行います。
肺癌手術によって術後30日以内にお亡くなりになる割合(死亡率)は、2011年1年間の日本国内集計では0.3%と報告されています(文献21)。
また合併症の頻度は患者さんごとに異なります。
あらかじめ担当医から十分な説明を受けましょう。
Published: 2014.10.16 Last Updated: 2014.11.21
- Q12
- 肺癌の手術は痛い?全身麻酔ですか?
- A
- 診断を目的とした胸腔鏡下生検では体の負担を軽くするために、3箇所の小さな切開(1-2cm)で手術を行います。手術は全身麻酔下に行います。
術中迅速診断にて肺癌(非小細胞肺癌)と診断された場合、標準外科治療として肺葉切除、リンパ節郭清を合わせて行います。東京大学医学部附属病院ではIA期非小細胞肺癌ならびに大半のIB期非小細胞肺癌に対して胸腔鏡下に手術を行っています。
開胸手術の場合であっても、麻酔をはじめとした疼痛コントロールの進歩により、ほとんどの方は手術翌日には病棟を歩行することが可能です。
一方、高齢者や合併症を有する患者では耐術性の観点から系統的なリンパ節郭清を控える必要があります。
また近年CTを用いた肺癌検診で発見される小型・早期肺癌の場合、リンパ節への転移は稀です。
東京大学医学部附属病院ではこれらの症例に対して積極的に胸腔鏡下肺葉切除を行っております。

Published: 2014.10.16 Last Updated: 2015.03.16
- Q13
- 手術以外の治療はできないのでしょうか?
- A
- 肺癌診療ガイドラインでは
- 臨床病期 IまたはII期非小細胞肺癌で外科切除可能な患者に対する術式は、肺葉以上の切除を行うよう勧められる(グレードA)
- 臨床病期 I期非小細胞肺癌で外科切除が可能であるが肺葉以上の切除が不可能な患者には、縮小切除(区域切除または楔状切除)を行うことを考慮してもよい(グレードC1)」(手術適応(臨床病期 I-II 期)
- 医学的な理由で手術できないI/II期非小細胞肺癌には、根治的放射線治療の適応があり、行うように勧められる(B)。(I・II期に対する放射線療法)
心肺機能が著しく低下しており、手術に耐えることができないと考えられる患者さん、あるいは手術適応であるにもかかわらず、手術を希望されない患者さんに対する代替治療としては放射線治療があります。
近年、I期非小細胞肺癌に対しては、定位放射線照射(いわゆるピンポイント照射)や粒子線治療(陽子線、炭素線)など、より高い線量を照射する治療方法が開発されています。
しかしながら、これらの放射線治療が従来の外科治療より優れているかどうかは不明であり、標準的な肺癌治療法としてはお勧めしていません。
放射線治療に関する詳しい説明を希望される場合は、放射線治療医を紹介させていただきます。
Published: 2014.10.16 Last Updated: 2014.11.21
- Q14
- 免疫療法でなおせないでしょうか?巷の抗癌剤(アガリクスとか丸山ワクチンとかその他もろもろ)はどうなのでしょうか?
- A
- 雑誌ではアガリスクやプロポリスなどの健康食品が、癌の治療に有効であると宣伝されています。これらの宣伝は販売促進を目的とした誇大な広告であり、癌患者さんを狙った悪質なセールスと本質的には違いがありません。これらの製品が本当に癌の治療に有効であるかどうかの検証はなされていません。またこれらの健康食品を服用されることで、肝機能異常がみられることがあります。
癌に効くといわれる民間治療のほとんどは効果ばかりでなく安全性も不明です。
現時点では癌に対する免疫療法は、実験的な医療の範疇で行われるべきです。この実験的な医療のことを臨床試験と呼んでいます。臨床試験は新しい癌治療が本当に安全であるのか、有効であるのか、また標準的な治療と比較して優れているのかどうかを科学的に検証する方法です。
なお、現在東京大学医学部附属病院では先進医療として非小細胞肺癌に対する手術後に再発した方や、化学療法治療抵抗性の方に対して免疫療法を行っています。 詳細につきましては東京大学医学部附属病院にお問い合わせください。
Published: 2014.10.16 Last Updated: 2015.03.16
文献
- MacDougall B, Weinerman B. The value of sputum cytology. J Gen Intern Med 1992;7:11-3.
- Gledhill A, Bates C, Henderson D, DaCosta P, Thomas G. Sputum cytology: a limited role. J Clin Pathol 1997;50:566-8
- Sing A, Freudenberg N, Kortsik C, Wertzel H, Klosa B, Hasse J. Comparison of the sensitivity of sputum and brush cytology in the diagnosis of lung carcinomas. Acta Cytol 1997;4:399-408.
- Henschke CI, Yankelevitz DF, Naidich DP, McCauley DI, McGuinness G, Libby DM et al. CT screening for lung cancer: suspiciousness of nodules according to size on baseline scans. Radiology 2004;231:164-8.
- Gould MK, Maclean CC, Kuschner WG, Rydzak CE, Owens DK. Accuracy of positron emission tomography for diagnosis of pulmonary nodules and mass lesions: a meta-analysis. JAMA 2001;285:914-24.
- The American Thoracic Society and The European Respiratory Society. Pretreatment evaluation of non-small-cell lung cancer. Am J Respir Crit Care Med 1997;156:320-32.
- Bogot NR, Shaham D. Semi-invasive and invasive procedures for the diagnosis and staging of lung cancer. II. Bronchoscopic and surgical procedures. Radiol Clin North Am 2000;38:535-44.
- Milman N, Faurschou P, Munch EP, Grode G. Transbronchial lung biopsy through the fibre optic bronchoscope. Results and complications in 452 examinations. Respir Med 1994;88:749-53.
- Lacasse Y, Wong E, Guyatt GH, Cook DJ. Transthoracic needle aspiration biopsy for the diagnosis of localised pulmonary lesions: a meta-analysis. Thorax 1999;54:884-93.
- Govindan R, Page N, Morgensztern D, Read W, Tierney R, Vlahiotis A, Spitznagel EL, Piccirillo J. Changing epidemiology of small-cell lung cancer in the United States over the last 30 years: analysis of the surveillance, epidemiologic, and end results database. J Clin Oncol 2006;24:4539-44.
- Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin 2009;59:225-49.
- Morgensztern D, Ng SH, Gao F, Govindan R. Trends in stage distribution for patients with non-small cell lung cancer: a National Cancer Database survey. J Thorac Oncol 2010;5:29-33.
- Little AG, Rusch VW, Bonner JA, Gaspar LE, Green MR, Webb WR, Stewart AK. Patterns of surgical care of lung cancer patients. Ann Thorac Surg 2005;80:2051-6.
- Sawabata N, Miyaoka E, Asamura H, Nakanishi Y, Eguchi K, Mori M, Nomori H, Fujii Y, Okumura M, Yokoi K; Japanese Joint Committee for Lung Cancer Registration. Japanese lung cancer registry study of 11,663 surgical cases in 2004: demographic and prognosis changes over decade J Thorac Oncol 2011;6:1229-35.
- Sobue T, Suzuki T, Matsuda M, Kuroishi T, Ikeda S, Naruke T. Department of Field Research, Center for Adult Diseases, Osaka, Japan. Survival for clinical stage I lung cancer not surgically treated. Comparison between screen-detected and symptom-detected cases. The Japanese Lung Cancer Screening Research Group. Cancer 1992;69:685-92.
- Villeneuve PJ, Mao Y. Lifetime probability of developing lung cancer, by smoking status. Can J Public Health 1994;85:385-8.
- Halpern MT, Gillespie BW, Warner KE. Patterns of absolute risk of lung cancer mortality in former smokers. J Natl Cancer Inst 1993;85:457-64.
- Lam S, Lam B, Petty TL. Early detection for lung cancer. New tools for casefinding. Can Fam Physician 2001;47:537-44.
- Sobue T, Suzuki T, Fujimoto I, Matsuda M, Doi O, Mori T, Furuse K, Fukuoka M, Yasumitsu T, Kuwahara O, et al. Case-control study for lung cancer and cigarette smoking in Osaka, Japan: comparison with the results from Western Europe. Jpn J Cancer Res 1994;85:464-73.
- 日本肺癌学会編 肺癌診療ガイドライン(最新版)
https://www.haigan.gr.jp/modules/guideline/index.php?content_id=3(アクセス日:2014年11月20日) - Amano J, Kuwano H, Yokomise H. Thoracic and cardiovascular surgery in Japan during 2011: Annual report by The Japanese Association for Thoracic Surgery. Gen Thorac Cardiovasc Surg 2013;61:578-607.
Published: 2014.10.16 Last Updated: 2015.03.16
リンク
- 東大病院ホームページ
- Minds(マインズ)ガイドラインセンター
- 肺がん情報提供のホームページ エルねっと
- 独立行政法人国立がん研究センター
- 公益財団法人 がん研究会
Published: 2015.03.30 Last Updated: 2015.03.30


