びまん性橋膠腫 DIPG(脳幹グリオーマ,脳幹部神経膠腫,脳幹グリオーマ)
脳幹部グリオーマというのは正確な診断名ではありません
- 脳幹グリオーマには,さまざまなものがあります
- 脳幹部にはどんなグリオーマでもできますし,それぞれで治療方法が異なります
- 脳幹グリオーマの中のいったい何を予想しているのかを聞いてから治療を受けて下さい
- もっとも有名なのは,びまん性橋膠腫 DIPG で下の方に詳しく書いてあります
- でも他に,毛様細胞性星細胞腫,神経節細胞腫,神経節膠腫,退形成性神経節膠腫,上衣腫,退形成性上衣腫,びまん性星細胞腫,退形成性星細胞腫,膠芽腫,乏突起膠腫,乏突起星細胞腫,退形成性乏突起膠腫,退形成性乏突起星細腫,AT/RT,PNET,上衣芽腫,びまん性膠肉腫などのグリオーマができます
- 頻度で順番をつけると,びまん性橋膠腫,毛様細胞性星細胞腫,びまん性星細胞腫,退形成性星細胞腫の順になります
- これらの腫瘍の診断や治療方法はそれぞれ別ページに書いてあります
- 良性ですが治療選択が難しいものに,毛様細胞性星細胞腫があります
- 神経節細胞腫グレード1,過誤腫(形成異常,異所性灰白質)など治療しなくてもよいものもあります
- 上衣腫や髄芽腫や脈絡叢乳頭腫は,脳幹部に癒着しますが脳幹腫瘍ではありません
- 小児の高度悪性グリオーマとして,胎児性腫瘍のAT/RT,PNETがあります
- 中脳視蓋グリオーマというのは非常に特殊なタイプの脳幹グリオーマです
- 思春期以降や成人の脳幹部神経膠腫は,以下に書いてあることは当てはまりませんので読まないで下さい
2025年8月6日米国で びまん性正中グリオーマに対してdordaviprone (ONC201) の使用が認可されました
商品名 モデイソ Modeyso
1歳以上でH3K27変異があり,再発の患者さんに対してのみです,週に一回,1カプセルを飲みます
DIPGの患者さんは除外されています
びまん性内在性橋膠腫 (橋グリオーマ)
diffuse intrinsic pontine glioma, DIPG
びまん性正中グリオーマ
diffuse midline glioma H3K27M mutant
- 同じ遺伝子の異常で生じるので,2016年からびまん性正中グリオーマ diffuse midline glima DMGと呼ぶことになりました
- でもDIPGとDMGはずいぶん違った臨床像を示します
- 脳幹部内部に発生する予後不良の小児腫瘍です
- 小児脳腫瘍の10%くらいです
- 小児では3歳から7歳くらいの幼児に多いのですが,まれに若年成人にもみられます
- 脳幹部は脳の中でも最も重要な部位とされ,大脳からの神経線維が集中して走る部位ですし,呼吸中枢や意識の中枢があります
- 脳幹部は上の方から順に中脳,橋,延髄と呼ばれます
- ほとんどの例は橋 pons に発生するので,橋グリオーマ pontine glioma とも呼ばれます
- もし万一,生検術がされた場合,脳幹部神経膠腫の病理組織は星細胞系腫瘍です
- 星細胞系腫瘍とは,星細胞腫グレード1−4,膠芽腫をいいます
- 末期になるとほとんどが膠芽腫の病理所見を呈します(剖検報告)
- 80%くらいの例でhistone H3のK27M遺伝子に変異があります
症状
- 初期症状は,片方の目が内側による内斜視 (esotropia, 外転神経麻痺)が多いです
- 次いで,ふらついて歩くのが不安定になること(失調性歩行)です
- 3ヶ月くらいでゆっくり進行して気づかれるものから、3週間くらいで急激にひどい症状になるものまであります
- 逆に3ヶ月以上かかってゆっくり進行している脳神経麻痺や失調症状では,びまん性橋膠腫以外のものも考えなければなりません
- 顔がゆがむ(顔面神経麻痺)や眼の位置がおかしい(眼球運動障害)などの脳神経症状もでますが,小児は自分から症状を訴えることが少ないです
- 水頭症になると,頭痛や嘔吐がでます
MRI画像診断
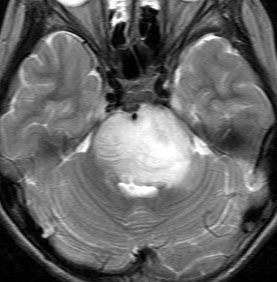
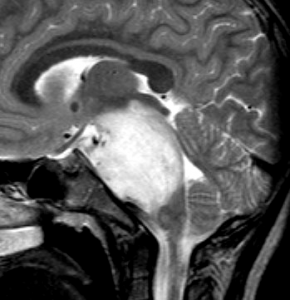
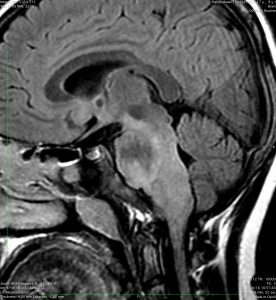
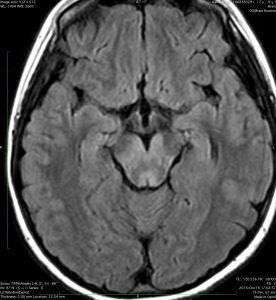
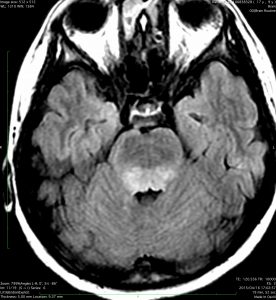
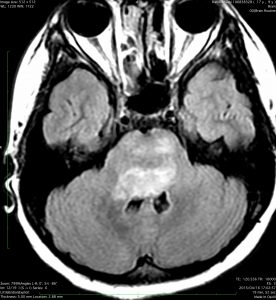
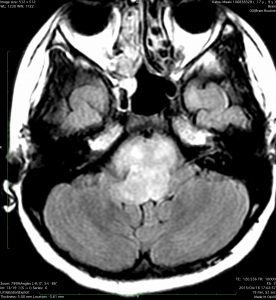
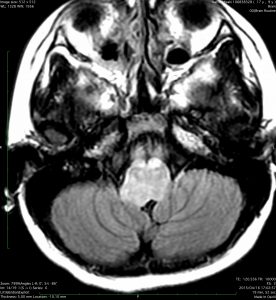
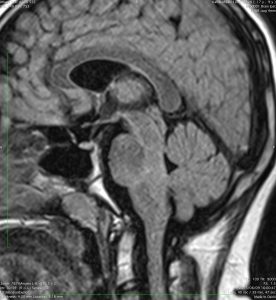
- MRIでは脳幹部(とくに橋)が腫れて大きくなります
- 多くの場合は左右対称ですが,非対称のものもめずらしくありません
- MRIのFLAIR(フレア)画像とかT2強調画像で,白くぼーっと滲んだように映ります
- 髄液にのって脊髄に転移する髄液播種が生じることがあります
- 脳幹部の橋というところを中心にして発生し,上方の中脳や下方の延髄に浸潤して伸びていきます
- この様な典型的なものでは手術をしなくてもMRIで確定診断がつくものですから,病理遺伝子診断のための定位的生検術 stereotactic biopsy や開頭手術は何の利益もありません
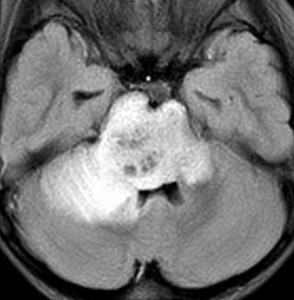
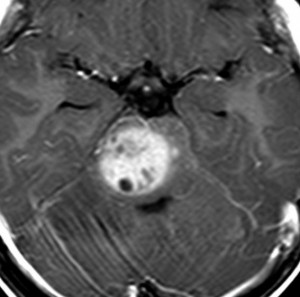
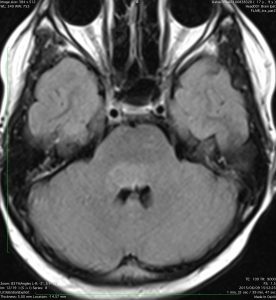
- ガドリニウムという造影剤を静脈注射してMRIをとると一部分で白く増強されることが多いです
- ガドリニウムでリング状に増強される腫瘍は生存期間が短いとされています
- 腫瘍は大きいのですが,水頭症にならないのが特徴です(水頭症は2割くらい)
- 上の写真の例では,症状は軽く,たいていの場合はこのくらいの大きさになってから発見されます
- 腫瘍の前方の中心に黒い点のようなものが見えますが,これは脳底動脈で,この脳底動脈の囲い込み engulfment は,DIPGに特徴的なものといえます
- 腫瘍の一部分だけが脳幹部から突出してキノコのように伸びる所見 exophytic grwoth は2割くらいにみられます
- 腫瘍内部に小さな腫瘍内出血が生じることもあります
- MRIでは,H3-K27M遺伝子変異があるかどうかは判別できません
治療:放射線治療です
- 摘出手術は脳幹部の重大な機能障害を生じるのでできません
- 手術しても何の意味もないことが多いです
- 開頭手術もしくは定位脳手術や内視鏡手術で,少し取って病理診断をする(生検術)と提案された時には,お子さんにとって何の利益になるのかはっきりした理由を聞いて下さい
- 手術で遺伝子を調べると言われても,H3 KM27遺伝子変異のあるなしがわかったところで治せる治療法は判明していません(2025年6月時点)
- 生検術してH3 K27変異がなくても,結局DIPGとして治療します
- 米国でも研究体制が整った限られた施設でしか生検術は許されていませんし,日本で行われる根拠はありません
- 誰がどんな手術をしても手術では治らない病気です
- 世界標準治療は放射線治療です
- 1回(1日)1.6から2.0グレイで,48グレイから54グレイの照射をします
- 多くの場合,放射線照射により一時的な腫瘍の縮小効果と症状の改善は得られます
- 70%くらいのお子さんで,症状がかなりはっきり改善します
- T2-FLAIR mismatch signのあるものには,放射線治療の有効性が高いとされます
- しかし,長期の治療効果はきわめて不良で再増大(再燃)します
- 一般的には48-54グレイという放射線量が用いられますが,ちょっと多いかも
- 放射線治療を細かく分けてたくさんの回数で行う多分割照射hyperfractionationという方法で大きな線量(70グレイくらい)をかけようという試みがなされましたが利点はありませんでした
- また1日線量を2グレイより多くする小分割照射 hypofracitonationも生存期間を短くします
治療:放射線以外のもの
- 脳幹部の腫れが強くなって症状が悪化してきたときにはステロイド(リンデロン、デカドロン)を使うと一時的に症状が改善します
- 化学療法は効かないと思った方がいいですし,強くお勧めできるものはありません
- 世界中で,ニドラン,インターフェロン,カルボプラチン,ビンクリスチン,エトポシドやシスプラチン,シクロフォスファミド,テモゾロマイド,アバスチン,ニモツズマブ,ゲフィニチブ,タルセバなどが試されましたが,全て無効でした
- テモゾロマイド(抗がん剤)は10年以上前から試されていますが,有効であったという研究結果はありません,無効であったという意見がほとんどです
- 逆にテモゾロマイドが放射線治療後の症状の悪化を早める可能性があります
- 遺伝子を調べて分子標的治療をする targeted therapyでの治療成功例はありません(2025年時点)
- K27M変異をターゲットにした経口低分子治療薬 ONC201 Akt/ERK inhibitorという低分子薬剤の治験もいまだ有効性は認められていません
- 2025年6月時点で,世界で有効とされた内科治療薬はありません(no medicinal products with regulatory approval.)
- 陽子線治療 proton therapyが従来の放射線治療より有効であるという報告はありません
- でも,これからも多くの新薬の治験が始まるでしょう
予後
- 橋グリオーマの子供たちが1年くらいのうちに死亡する確率は50%程度です
- 治療してもおよその生存期間中央値は,10ヶ月から1年くらいです
- 2025年時点で,2年生存割合は10%以下です
- でも,5年生存している子もいます,2%くらいです
- 2020年の段階では特別な治療法というのはありませんから,できる限り自宅に近いところで治療を受けましょう
- この病気の場合は遠方の経験数の多い施設へ移動するということはしない方がいいです
- びまん性橋グリオーマとは違って,脳幹部の毛様細胞性星細胞腫は化学療法で小さくなりますし放射線治療が有効なことも多いです
- 小児と異なり成人の脳幹部の星細胞腫では,長期生存例もあります,病理診断は同じでも生物学的には異なった特性を持つものです
- 神経線維腫症の1型(NF-1)の患児にできる脳幹部膠腫は大きくならないし,大きくなっても治療をしてはいけないので気をつけて下さい
- NF-1の患者さんは放射線治療を安易に受けてはいけません
- 毛様細胞性星細胞腫やNF-1に合併する脳幹部膠腫との鑑別診断は慎重にしていただきましょう
びまん性橋グリオーマ (DIPG) の多施設共同前方視的観察研究
https://jrct.niph.go.jp/latest-detail/jRCT1030240186
- 2024年に埼玉医大の鈴木智成先生が中心となって開始された日本での全国共同臨床研究です
- 目的は,DIPGに対する緩和ケア診療の実態を明らかにし、医療現場の指針となるガイドを作成することです
- 登録する施設ではきめ細かな診療が提供されますし,支持緩和にも注力しています
- 何かありましたら,鈴木先生まで (tmsuzuki@saitama-med.ac.jp) お問い合わせください
- 患者さんからのメールでもいいです

びまん性橋グリオーマではないかもしれない時というのは
- 何か典型的な橋グリオーマと違う時には,定位脳手術あるいは開頭手術による生検術での病理組織診断が必要なときもあるかもしれません(でも結局,放射線化学療法しかないので利益がないかも)
- 症状が出てから腫瘍が発見されるまで6ヶ月以上経過しているときは,何かがちがうかもしれません
- 思春期以降のものでは長期生存がありますから,年齢が高い場合は違った治療と予後があるかもしれません
- 逆に,3歳未満ではまれに長期生存例があります(しかし誤診,生検がなされないので病理組織が違うという意見もあります)
- 画像所見が典型的ではない時(でもこれは医師の画像診断能力よって大きく異なります)
- MRIで境界が極めて明瞭で,びまん性に見えない時で,T2/FLAIRで均一に高信号になる時
- 腫瘍全体(一部ではなく)がガドリニウムで均一に増強される時
- 腫瘍の主体が延髄か中脳にあるもの
- 腫瘍が橋内部から発生していても,ほとんど大部分(一部分ではない)が橋の外側に突出している時
- では何が考えられるかというと,毛様細胞性星細胞腫,神経節膠腫,乏突起膠腫グレード1か3,胎児性腫瘍,PNET,AT/RT,星細胞腫グレード1-4 などなどです
- これらの腫瘍では長期生存例があります
- でも,しかし,安易に生検術を受けてはいけません,画像で鑑別できることが多いからです
この脳幹部グリオーマは橋から小脳脚に浸潤したものです。びまん性橋膠腫の進行例にもみえますが,ガドリニウム増強のされ方が中心部で強すぎて非定型的です。これを生検術して病理確定診断をすれば,胎児性腫瘍やAP/RTという診断がつくのかもしれません。しかし,できることは局所放射線治療が主体の治療でなんらかの化学療法を組み合わせるくらいです。リスクの大きい病理診断で時を失うより早く治療を開始したほうがよいと思われる経過と画像でした。
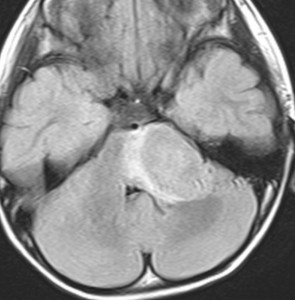
この脳幹部の橋グリオーマは小児に発生したものです。lateratityが強いと表現するのですが,左側に偏って存在しています。これは通常のびまん性橋膠腫では理解ができない画像ですから,生検術が必要かもしれません。でも病理確定診断がついたからといって,治療としてできることは50グレイくらいまでの局所放射線治療だけかもしれません。
小児びまん性橋グリオーマの病気の進行
- 放射線治療をすると大部分の患児で病気の進行がとまって症状が良くなります
- この症状の改善は30グレイくらいの放射線が入ったところくらいで生じます
- 放射線治療を終了してから,また病気が悪化(再燃)してしまうまでの期間 (PFS, TTP, EFS) は,5ヶ月から9ヶ月くらいが目安です
- 生命を失ってしまうまでの期間(OS)は,中央値で7ヶ月とも16ヶ月とも記載されています
- 放射線治療が終了してから数ヶ月の期間しかないのですが,この時間を大切にしようというのが大部分の医師の考え方です
- 入院機関が長い化学療法をするのは大切な時間を失うだけの結果となります
- 生存期間が比較的長いのは,3歳未満の小児,病気が発見されるまでの症状の継続期間が長かった例とされています
究極に難しい問題
とても難しいことなのですが,「びまん性橋膠腫」と「脳幹内部から発生した退形成性星細胞腫」は,病理組織診断は同じでも,治療方法と予後が違います,また画像所見がちょっと違います,これを小児科の先生が理解して下さることを望みます
小児脳幹部グリオーマの会という患者さんの集まりがあります
(ホームページはここをクリック)
生検術はしない:古いけれどとても大切な文献
Children’s Cancer Group Protocol CCG-9882の結果からAlbrightが次のように指摘しました
”橋グリオーマの生検術は脳外科の歴史の中に葬られるべきである”
Routine biospy should be relegated to neurosurgical history.
2018年時点でも,DIPGが疑われて生検術を受けてもいい場合というのは,新たな分子標的治療の治験にお子さんが登録して参加できる特殊な場合のみです。日本では行われていません。
大後頭孔減圧術・後頭下減圧術はしない
- 小脳と脳幹部の圧迫をとるために,後頭部の骨をはずす手術を勧められることがあります
- これは世界的に見ればかなり非常識な外科治療ですから,受けないほうがいいでしょう
短い予後に対して手術侵襲が大きく,期待される効果が少なすぎるので行われません
米国のトライアルの真似はできません
NIHの臨床研究の広報に,Molecularly Determined Treatment of Diffuse Intrinsic Pontine Gliomas (DIPG)というプロジェクトがありました。Dr. Kieranが提唱したもので,生検術で判明した遺伝子情報(MGMTとEGFRの変異)によって,アバスチン,タルセバ,テモダールを使い分けるという計画です。2011年9月に開始され,登録は締め切られましたが結果は公表されていません。しっかりした臨床試験の整っていない日本では,倫理的な観点から,このような実験的治療を日本でまねて行うことはできません。
ONC201(OP-10) 米国で臨床第3相試験が始まりました
2022年12月,ONC201を1週間ごとに1回経口摂取、1コースは3週間,8コース行うという試験が始まりました。この3週間を1コースとし、第8コース目(24週)まで実施されます。ONC201は,ドパミンD2 受容体dopamine receptor D2/3拮抗薬(低分子化合物)です。有害事象(副作用)は比較的少ない薬剤です。450例の無作為試験が予定されていて,この試験結果がでるのは2026年終了予定ですから,試験に成功しても発売されるのはさらに後になります。残念ながらDIPGは試験対象となりません。
ONC201は,ミトコンドリア内のL-2HGを増加して腫瘍細胞の増殖を抑制します。
国立がんセンターのONC201臨床試験
https://www.ncc.go.jp/jp/ncch/division/clinical_trial/patient/to_patients/03/T5272.html
- 2025年4月に日本でも開始されました
- 投与薬剤は,週1回あるいは2回のONC201です
- 対象は,H3K27M変異があると証明されたびまん性神経膠腫です
- DIPGは除外されていません
- 体重が10kg以上,放射線値長をすでに受けているというような条件があります
- この試験は,はっきりした結果を出すのにかなり多くの登録患者さんが必要です,おそらく十分な結果は出ないで終了するという,今までの日本の臨床試験と同じ轍を踏むのでしょう
- でも,ONC201が日本で使用できる唯一の窓口です
DIPG registry(新たな薬剤の臨床試験登録リスト)
びまん性橋膠腫への臨床試験はDIPG registryというページにあります。英語ですがさまざまな試験が書いてあります。多くは臨床第1相という実験的なレベルのものです。
治療してはいけない神経線維腫症1型のびまん性橋膠腫
 これは神経線維腫症1型 NF-1 の子どもにできたびまん性橋膠腫 (? です。何の治療もしなくても自然によくなる(自然退縮)ので治療の必要がありません。
これは神経線維腫症1型 NF-1 の子どもにできたびまん性橋膠腫 (? です。何の治療もしなくても自然によくなる(自然退縮)ので治療の必要がありません。
高線量放射線治療をするべきでなかったかもしれない脳幹部病変:DIPG ???
時として,DIPGの画像診断は難しいことがあります。
7歳女児です,発熱の後で右外転神経麻痺が生じました。その後,左外転神経不全麻痺。翌年に,軽度の嚥下障害,嗄声,軽度の四肢失調が出現しています。その翌年8歳時にMRIにて脳幹部病変を発見されています。両側瞳孔散大,右顔面神経麻痺,体感失調など加わり,DIPGの診断で54グレイ27分割の放射線治療を受けました。照射中2週間くらいで症状の進行が止まり,改善傾向となりました。照射終了時には脳幹病変は著しく縮小しました。
これはDIPGでしょうか? 中脳被蓋,橋被蓋,延髄が腫大しています。右下中脳脚の腫大と延髄の肥大が目立ちます。逆に脳橋腹側の腫大は軽度です。拡散強調は等信号でガドリニウム増強されません。壊死やのう胞形成は認められません。DIPGとしては,橋底部の異常信号が軽度なことが非典型的です。びまん性橋膠腫と呼ばれますが,橋の信号がびまん性ではありません,DIPGの特徴であるhomogenous high-signalがないのです。DIPGは延髄から中脳まで進展することは多いのですが,びまん性に連続性にmass effectを有して連続性腫瘍性病変となるものです。逆にまだらな高信号になっています。
治療後半年のMRIです。病変はほぼ完全に消失しています。右外転神経麻痺(後に矯正手術しました)のみを残し,マラソンもできるくらいに症状は回復し,発症後10年以上になりますが,普通に通学しています。この例では,感染による亜急性の脳幹脳炎 localized brain enchephalitisや感染後脳症 (ADEM)などが疑われるのかもしれません。もしかして,ステロイド治療をまず使用してみるべきだったのかもしれません。
ここから下は文献なので難しいです
ONC201は,再発したびまん性正中グリオーマにわずかながら効果が認められる
ONC201 (Dordaviprone) in Recurrent H3 K27M-Mutant Diffuse Midline Glioma. J Clin Oncol 2024
50例の再発患者さんでONC201の効果が試されました。成人が46名,18歳以下は4名です。放射線治療からは90日以上が経過しており,PSは60以上で,びまん性橋膠腫 DIPG は除外されています。ORR(全奏功割合 RANO-HGG)は20%でした。TTR中央値は8.3ヶ月,DOR(有効期間)中央値は11.2 ヶ月でした。PSの改善(症状の改善)は評価しうる34人の内6人に認められました。
H3K27変異のあるびまん性正中グリオーマに対する,ONC201とPaxalisibの併用
ONC201 in Combination with Paxalisib for the Treatment of H3K27-Altered Diffuse Midline Glioma. Cancer Res 2023
PIK3CA変異を有するDIPG(びまん性橋膠腫)はONC201に対する感受性が高いと仮定されます。PI3K/mTOR阻害薬であるPaxalisibをONC201と組み合わせた臨床第2相試験が行われているという報告です。
3歳以下のDIPGの生存期間は少し長い
Bartlett A: Characteristics of Children ≤36 Months of Age with Diffuse Intrinsic Pontine Glioma (DIPG): A Report from the International DIPG Registry. Neuro Oncol 2022
生存期間中央値は15ヶ月でした。放射線治療を受けなかった子の生存期間は2ヶ月で,受けた子は17ヶ月でした。5年以上生存した子が3例(7.5%) いました。
T2-FLAIRミスマッチがみられるDIPGは放射線治療によく反応する
Yamasaki F: T2-FLAIR Mismatch Sign and Response to Radiotherapy in Diffuse Intrinsic Pontine Glioma. Pediatr Neurosurg 2021
21例のDIPGを調べて,FLAIR画像で周囲が高信号に縁取りされ内部が低信号になるT2-FLAIR mismatch signが5例に認められました。DIPGの25%くらいです。この5例では放射線治療(54Gy/30fr)で明らかな腫瘍縮小が得られ,予後が比較的に良かったとされています。一方,ミスマッチがない例では放射線の奏功が認められたのは4人に一人くらいでした。
陽子線治療は従来の放射線治療と比較して生存期間を延長しない
Muroi A: Proton therapy for newly diagnosed pediatric diffuse intrinsic pontine glioma. Childs Nerv Syst. 2020
筑波大学からの報告です。12例のDIPGの子供に54Gy30分割の陽子線治療が行われました。結果,OS 生存期間の延長は得られませんでした。
放射線治療の分割回数は多すぎても少なすぎても生存期間が短くなる
Role of Radiation Therapy in the Management of Diffuse Intrinsic Pontine Glioma: A Systematic Review. Adv Radiat Oncol 2019
多くの文献データを集積した結果です。通常の放射線治療,分割回数を増やした放射線治療,治療期間を短くした放射線治療の成績が比較されました。通常の分割回数の放射線治療 (conventional RT, 1日線量1.8グレイなど)を受けた1,286人での生存期間中央値は12ヶ月,多数回に分けた照射 hyperfractionated RT (348人) では10.2ヶ月,1日線量を多くする照射 hypofractionated RT (92人) では7.9ヶ月でした。1日線量を多くして短期間で治療することも,一回線量を小さくして多数回照射することにも利点はありません。
OCN201のパイロット研究
Pediatric and adult H3 K27M-mutant diffuse midline glioma treated with the selective DRD2 antagonist ONC201. J Neurooncol 2019
放射線治療後あるいは再燃した18例のH3 K27M mutant gliomaに週一回のOCN201の投与がなされました。再燃した成人3例で1年近い無増悪生存が得られ,4例の小児DIPGに放射線治療すぐ後でOCN201を投与したところ,2例が53週と81週無増悪生存しているそうです。
DRD2/3拮抗剤 ONC210の新たな症例報告
Chi AS: Pediatric and adult H3 K27M-mutant diffuse midline glioma treated with the selective DRD2 antagonist ONC201. J Neurooncol. 2019
下の論文と同じ試験です。放射線治療後に再燃したびまん性正中グリオーマの患者さん18人が対象とされました。成人例7人中の3人で腫瘍再発が抑えられ,49週間(1年)以上にわたりなお薬剤投与が継続中です。4人の小児のうちDIPGの2人が53週と81週で増悪がない状態で維持できています。視床と橋のグリオーマ例で画像上での縮小がみられています。今後は臨床第2相試験が行われる予定です。
小児DIPG: DRD2/3拮抗剤 ONC210の初めての臨床使用例
Hall MD: First clinical experience with DRD2/3 antagonist ONC201 in H3 K27M-mutant pediatric diffuse intrinsic pontine glioma: a case report. J Neurosurg Pediatr. 2019
H3 K27M変異を有するグリオーマは,ドパミン受容体DRD2を過剰発現し,DRD5を抑制しています。ONC201はDRD2拮抗剤です。10歳の女の子が定位脳生検術でH3 K27M変異があるDIPGと診断されました。放射線治療の1ヶ月後に,ONC201の投与を受けました。腫瘍は徐々に縮小して症状は改善しました。ONC201治療1年後に照射野外に2つの病変が出現したので,ステロイド,ベバシズマブ,追加局所放射線治療の治療が加えられました。診断以来22ヶ月,症状は改善してその後の腫瘍増大はないそうです。
「解説」残念ながら経過観察が22ヶ月までしかなされていません。ONC201後に再燃して再照射が加えられていて,PFS 22ヶ月というのはDIPGではさほど珍しくないことです。結果についてはなんとも評価できません。
生検術の安全性は高い??
Prospective feasibility and safety assessment of surgical biopsy for patients with newly diagnosed diffuse intrinsic pontine glioma. Gupta N, Neuro Oncol. 2018
50人のDIPGの子供(中央値6歳)が生検術の後で,放射線治療とベバシズマブの治療を受けました。MGMTメチレーションとEGFRの発現によって,エロチニブかテモゾロマイドの投与の是非を判断して維持療法が行われました。一人の患児が手術によって回復しない左半身麻痺(手術合併症)を生じました。結論として,生検術は安全に行えるとしています。この論文の中で,治療成績は公表されていません。
この論文を詳しく読むと,50人の子供たちが生検術(neuronavigation biopsy) を受け,施術後14日以内に,無呼吸2人,意識障害3人,呼吸障害2人,血腫1人,水頭症3人,低血圧1人,頭蓋内出血2人,傾眠傾向1人,呼吸不全1人が生じたと書かれています。新規の治療を受けた患児は一人もいません。生存期間が延長された可能性はないようです。
頭がおかしい人でなければ,2018年時点で,生検術というおそろしい診断法を受けてもなんの利益も見返りもないということがわかります。少なくとも体制の整わない日本で行われるべきではありません。
髄液と血液で遺伝子診断する:liquid biopsy
Panditharatna E et al.: Invasive Tumor Surveillance of Pediatric Diffuse Midline Gliomas Using Patient-Derived Liquid Biopsy. Clin Cancer Res. (2018)
画像で腫瘍再燃かどうか迷った時に,血液と髄液でH3K27Mを調べることができるという論文です。circulating tumor DNA (ctDNA) を調べるので,liquid biopsyといわれます。患児から採取した髄液と血液をdroplet digital PCR調べたら,48人中,42人(88%)でH3K27M 変異が検出できたとのことです。
2年以上生の生存例の特徴
Hoffman LM, et al.: Clinical, Radiologic, Pathologic, and Molecular Characteristics of Long-Term Survivors of DiffuseIntrinsic Pontine Glioma (DIPG): A Collaborative Report From the International and European Society for Pediatric Oncology DIPG Registries. J Clin Oncol. 2018
1,008例のデータ分析です。101例(10%)が2年以上生存し,5年生存割合は2%です。2年以上の生存者は,3歳未満と11歳以上で発症した子供が多く,診断までの症状の継続期間が長かったそうです。生存期間が短い例での特徴は,リング状の増強所見,腫瘍壊死所見,脳槽内腫瘍発育,脳神経麻痺発症,HIST1H3B変異です。
生存期間は11ヶ月
Veldhuijzen van Zanten SE, et al.: Development of the SIOPE DIPG network, registry and imaging repository: a collaborative effort to optimize research into a rare and lethal disease. J Neurooncol. 2017
ヨーロッパの694例の統計値です。症状が悪化するまでの期間は6ヶ月,生存期間は11ヶ月,2年生存率は10%,5年生存率は2%と報告されました。
再燃した時の再照射
Janssens GO, et al.: Survival benefit for patients with diffuse intrinsic pontine glioma (DIPG) undergoing re-irradiation at first progression: A matched-cohort analysis on behalf of the SIOP-E-HGG/DIPG working group. Eur J Cancer, 2017
31人の子どもが再発(再燃症状悪化)した時に再照射 (dose 19.8-30.0 Gy)を受けました。77%でまた症状の改善が得られたとのことです。でも生存期間はわずかに伸びるのみです。また初回治療から再燃進行までの期間が長かった子に有効性が高かったと書かれています。実際は2度目の放射線治療ははあまり用いられません。でも初回放射線治療がかなり効いた子は寛解導入手段として一つの選択肢ではあります。
生検手術は必要なのか
MacDonald TJ: Diffuse intrinsic pontine glioma (DIPG): Time to biopsy again?
Dr. MacDoaldは強調します,手術のリスクは低くなったとはいえ歴然としてある。もし生検術が必要なら,小児脳腫瘍センターの正式な臨床研究のもとで熟練した脳外科医が行うべきである。The mere presence of an oncogenic mutation does not necessarily constitute a ‘‘therapeutic target,’’ and thus treatment-making decisions based on these data would be premature and should be avoided. 現在,生検術をしても治療方針が変わる訳ではないと結論しています。
解説:欧米でも積極的に生検術をする施設がありますが,それは将来の治療法の開発のために研究材料として腫瘍のサンプルを採取するのが主目的となります。米国においても橋グリオーマの生検術がむやみに許されているわけではありません。かなり厳しい臨床研究目的のレギュレーションの下に行ってもいいだけです。日本においては研究体制は整備されておらず,MRIで橋グリオーマと診断されるものを生検してはなりません。誤った考え方は,「悪性か良性かは採ってみなければ解らない」「病理所見が決定できないと治療方針が決まらない」といって意味のない手術をすることです。
ニモツズマブの効果
Bartels U, et al.: Phase 2 study of safety and efficacy of nimotuzumab in pediatric patients with progressive diffuse intrinsic pontine glioma. Neuro Oncol 16:1554-1559, 2014
再燃(再発)した44人のびまん性橋膠腫(年齢中央値6歳)にたいして,抗EGFR抗体であるNimotuzumab (150mg/m2)が使用されました。1週間に1回を7週間投与して,後は2週間に1回の投与です。8週間投与(2ヶ月)ができた19人の子どもで,PR 2例,SD 6例でした。5人で18週間の投与ができました。44人での生存期間中央値は,3.2ヶ月でした。2人の患児がニモツズマブ投与開始から,663日と481日生存しました。
解説:わずかながらの効果 (modest activity)があるようです。44人のうち8人 (18%) で,2ヶ月くらいは病勢の進行はとどめることができたということです。
分割回数を少なくして短期間の放射線治療に利点がある,でも要注意
Janssens GO, et al.: The role of hypofractionation radiotherapy for diffuse intrinsic brainstem glioma in children: a pilot study. Int J Radiat Oncol Biol Phys (Epub) 2008
Zaghloul MS, et al.: Hypofractionated conformal radiotherapy for pediatric diffuse intrinsic pontine glioma (DIPG): A randomized controlled trial. Radiother Oncol. 2014 Feb 20
2008年の論文では,3歳から13歳まで,びまん性脳幹部グリオーマの9人が治療されました。3グレイを13回あるいは5.5グレイを6回で3週間で放射線治療を済ませ ようとする試みです。全ての患児で2週間以内に症状の改善が見られました。腫瘍の再増悪 (progression) までの期間中央値は4.9ヶ月,全生存期間中央値(OS)は8.6ヶ月でした。2014年に書かれた論文では,79人のびまん性橋膠腫の患児が,3グレイを13回あるいは1.8グレイを30回の治療を受けました。両者に差はなかったので短期間で終えることができる13分割の方に利点があるとの結論でした。
解説:著者が結論で書いているように,治療期間が短いというのがこの治療法の利点です。生命予後が短くどうしても命を救えないからこそ,短期間で治療を終えて,症状の改善の早い放射線治療が良いとしています。注意しなければならないのが,一日線量3グレイで総線量が39グレイという,かなり大量の放射線をしようしていることです。特に幼児では早期の放射線壊死を生じる可能性がある強度の高い放射線治療といわざるを得ません。またもしこの治療に加えて,テモゾロマイドを併用した時のスードプログレッションが生ずれば,照射後早期に脳幹症状が急速に悪化する可能性があります。
一回線量を高くする放射線治療
Hypofractionation vs conventional radiation therapy for newly diagnosed diffuse intrinsic pontine glioma: a matched-cohort analysis. Int J Radiat Oncol Biol Phys 2013
1回3グレイもしくは2.8グレイという大きな線量で,39-44.8グレイの放射線治療をします。目的は放射線治療の期間を短くすることです。6,9,12ヶ月での全生存期間は74%, 44%, 22%でした。8割が1年以内に亡くなっています。著者は従来の成績と変わらないと主張しますが,明らかに生存期間を短くしています。おそらく早期の脳幹部の放射線壊死が生じているのでしょう。
3歳未満の脳幹部神経膠腫は予後が良いことがある,何か違う
Broniscer A, et al.: Young age may predict a better outcome for children with diffuse pontine glioma. Cancer 113: 566-572, 2008
3歳に満たない10人のこどもの橋グリオーマ (diffuse pontine glioma)を調べた報告です。4人のこどもが亡くなって,6人のこどもが生存していたとの事です。 3年の時点で腫瘍が進行しないで生存していた(無増悪生存率)のは45%,全生存率は69%だったそうです。治療は,放射線のみ2例,放射線化学療法6 例,化学療法のみ2例です。この生存率は,もう少し年齢が上の脳幹部神経膠腫より遥かにいいものです。書いた先生は,3歳未満の脳幹部神経膠腫は,通常の ものとは生物学的になにか異なった腫瘍ではないかと考えています。
解説:一つだけ注意しておくことがあります。3歳未満の子供たちは骨の増殖速度が速いです。ですから,腫瘍が顕著に増大しても後頭窩の骨の拡大も早くて脳幹部の圧迫症状である意識や呼吸障害が出るのが遅いという例もあります。
テモダールの効果がない
Broniscer A, et al: Role of temozolomide after radiotherapy for newly diagnosed diffuse brainstem glioma in children: results of a multiinstitutional study (SJHG-98). Cancer 103:133-139, 2005
初発例のびまん性脳幹部膠腫29例(年齢中央値6歳)に対し放射線治療後に同様なテモゾロマイドの投与(200mg/m2を5日間連続投与)を行った報告では,生存期間中央値12ヶ月で全例が死亡しびまん性脳幹部神経膠腫の予後を改善することはできないとされました。
Jalali R , et al.: Prospective evaluation of radiotherapy with concurrent and adjuvant temozolomide in children with newly diagnosed diffuse intrinsic pontine glioma. Int J Rad Oncol Biol Phys, 2009 (Epub)
すでに同様の結果の論文はあるのですが,同じことがまた確認されました。20人の子供が治療されたのですがテモゾロマイドの上乗せ効果はなく,放射線単独治療と比べて生命予後の改善はなかったとされました。でも詳しく読むと,1人の患者さんが病気の進行がなく4年以上生存しています。この患者さんが びまん性橋膠腫ではなくなにか他の腫瘍だったのかどうかは解りませんが,例外的に長期生存例があるのかもしれません。
Cohen KJ, et al.: Temozolomide in the treatment of children with newly diagnosed diffuse intrinsic pontine gliomas: a report from the Children’s Oncology Group. Neuro Oncol 13:410-416, 2011
COGからの報告です。62人の子どもが59.4Gyの放射線治療期間中にテモゾロマイド 90mg/m2を42日間投与されました。その後は4週にサイクルのテモゾロマイド維持療法です。1年無増悪生存割合 EFSは14%であり,テモゾロマイドを使用しなかった過去の成績の21.9%を下回りました。1年全生存割合は40%と32%でした。テモゾロマイドを使用したほうが再燃が早まるとも解釈されます。この大きな線量とテモゾロマイドではpseudoprogressionが生じているのかもしれません。
Rizzo D, et al.: Temozolomide in the treatment of newly diagnosed diffuse brainstem glioma in children: a broken promise? J Chemother 2014 Dec [Epub]
また繰り返しなのですが,15人のびまん性橋膠腫の子どもに放射線治療とテモゾロマイドの併用治療が行われました。テモゾロマイドの効果は無かったとのことです。
びまん性橋膠腫の子供たちの生存の予測
Jansen MH, et al.: Survival prediction model of children with diffuse intrinsic pontine glioma based on clinical and radiological criteria. Neuro Oncol 17:160-166, 2015
ヨーロッパで316人の患児を解析した報告で,生存期間中央値は10ヶ月でした。腫瘍が発見されるまでの症状の期間が長い,3歳以下,化学療法が使用されているという条件で生存期間が少し長いそうです。ガドリニウム増強剤でリング状に増強される腫瘍は予後が悪かったそうです。
「解説」 化学療法が使用できるということはある程度状態 (PS) が良かったことでもあり何とも言えません。2015年の大きな報告ですが,いままで言われて来たことと変わりはありませんでした。
ゲフィチニブと放射線治療
Pollack IF, et al.: A phase II study of gefitinib and irradiation in children with newly diagnosed brainstem gliomas: a report from the Pediatric Brain Tumor Consortium. Neuro Oncol 13:290-297, 2011
びまん性脳幹部グリオーマの43人の子どもに,放射線治療中に250 mg/m(2)/dayのゲフィチニブが経口投与され,病勢の進行がない限り13ヶ月継続されました。12ヶ月と24ヶ月の無増悪生存割合 PFSは,20.9%と9.3%でした。全生存割合 OSは,56.4%と19.6%です。3人の子どもが3年を越えて生存しました。この生存割合はとても良い成績です。しかし,対象となった腫瘍がdiffuse brainstem gliomaであったことに注意が必用です。diffuse pontine gliomaではないのです。3年以上長期生存した子どもも病理組織は退形成性星細胞腫で,橋と延髄の境界にできた比較的限局性の腫瘍でした。びまん性橋グリオーマの成績とびまん性脳幹部グリオーマの治療成績は異なるということに注意して論文を解釈しなければならないということです。
分子標的治療 nimotuzumab
この10年で,悪性神経膠腫(グリオーマ)が成長するために必用とする分子(サイトカインなどのタンパク質や受容体)がたくさん知られてきました。 今までは実験室の中でのお話でしたが,現在ではたくさんの薬(化学療法剤や抗体)が実際の患者さんに使用されてきています。臨床試験の段階から薬剤として 期待されてきているものもありますが,欧米でのお話であり,日本では治験も始まっていません。たとえば,EGFRという受容体 (ErbB1) の働きを抑えるニモツズマブ nimotuzumabという抗体が,欧州では小児悪性神経膠腫(脳幹部神経膠腫)に期待を持たれましたがあまり良い結果は出ませんでした。残念ながらいまのところ,国外から個人輸入してでも使って下さいと強くお勧めできる薬剤はありません。
ビンクリスチンとエトポシド化学療法
Korones DN, et al.: Treatment of children with diffuse intrinsic brainstem glioma with radiotherapy, vincristine and oral VP-16: a Children’s Oncology Group phase II study. Pediatr Blood Cancer, 20: 227-230, 2008
3歳から14歳まで,びまん性橋内部グリオーマの30人が治療されました。54グレイを上限とする放射線治療と同時に,ビンクリスチンを1日目,8 日目,15日目に静脈注射,エトポシドを1日目から21日目まで続けて服用する化学療法が2コース行なわれました。放射線治療が終わってからは10コース まで続けられました。7人の患児で奏効(PR)して,18人の患児では不変(SD)で,2人では進行(PD)しました。結果的に30人全員が命を失っ て,1年生存割合は27%,2年生存割合は3%でした。生存期間中央値は9ヶ月でした。結論として,この化学療法は生存期間を延長できないし,また血液毒 生や嘔気や感染などの有害事象(副作用)が生じたと書かれています。
解説:化学療法を放射線治療に加えても副作用がでるのみで何もならないと言うことがまた確認されたという印象です。
多剤併用化学療法を放射線治療の前にする
2005年の国際脳腫瘍学会で,シスプラチン,ロムスチン,メトトレキセート,ハイドロキシウレアの併用化学療法の結果が発表されました。化学療法 を先に行っておいて放射線治療は症状の悪化などの時に使われました。生存期間はわずかに延長するのですが,腫瘍が治る率は変わりませんでした。また化学療 法を行うために入院期間の延長があり,もともと非常に予後が短い患児が自宅に帰る期間が短くなります。
たぶん患者さんにとってはまだ役に立たない分子生物学の知見
H3F3A.3 K27M mutation in 71%
p53 mutation in 40-77%
PDGFR amp in 13-36%
EGFR amp in 28%
下の両論文は2014年に,Natureに発表されたものです。臨床的に役に立つレベルの知見ではありません。日本では,組織診断はできてもこのような研究はできませんので,欧米に期待です。基礎研究のレベルはこの段階であるということを理解するために読んで下さい。
Buczkowicz P, et al.: Genomic analysis of diffuse intrinsic pontine gliomas identifies three molecular subgroups and recurrent activating ACVR1 mutations. Nat Genet 46: 451-456, 2014
DIPGs comprise three molecularly distinct subgroups (H3-K27M, silent and MYCN) and uncovering a new recurrent activating mutation affecting the activin receptor gene ACVR1 in 20% of DIPGs. Mutations in ACVR1 were constitutively activating, leading to SMAD phosphorylation and increased expression of the downstream activin signaling targets ID1 and ID2.
Wu G, et al.: The genomic landscape of diffuse intrinsic pontine glioma and pediatric non-brainstem high-grade glioma. Nat Genet 46:444-450, 2014
We identified recurrent somatic mutations in ACVR1 exclusively in DIPGs (32%), in addition to previously reported frequent somatic mutations in histone H3 genes, TP53 and ATRX, in both DIPGs and NBS-HGGs. Structural variants generating fusion genes were found in 47% of DIPGs and NBS-HGGs, with recurrent fusions involving the neurotrophin receptor genes NTRK1, NTRK2 and NTRK3 in 40% of NBS-HGGs in infants. Mutations targeting receptor tyrosine kinase-RAS-PI3K signaling, histone modification or chromatin remodeling, and cell cycle regulation were found in 68%, 73% and 59% of pediatric HGGs, respectively, including in DIPGs and NBS-HGGs.
腫瘍関連遺伝子の研究
Grill J, et al.: Clitical oncogenic mutation in newlyu diagnosed pediatric diffuse intrinsic pontine glioma. Pediatr Blood Cancer 58: 487-488, 2012
TP53 (40%), PI3KCA (15%), and ATM/MPL (5%) に変異があったそうです。テント上の悪性神経膠腫とは異なった遺伝子変異で橋グリオーマが発生していることを強く示唆する結果です。つまり一般的な星細胞系腫瘍に有効な薬剤が効かない恐れがあるということも示しています。この研究のために20人の子供たちが定位生検術を受けて腫瘍組織を採取されました。でも,この子供たちにとっては何の利益もありませんでした。将来の研究のためにそんなことをしていいのかどうか > (;_;). <
モテキサフィン・ガドリニウムと放射線治療
Bradley KA, et al.: Motexafin gadlinium and involved field radiation therapy for intrinsic pontine glioma of childhood: a Children’s Oncology Group phase I study. Neuro Oncol 10: 752-758, 2008
44人の橋グリオーマの患児が,54グレイ/30分割の放射線治療とモタキサフィん・ガドリニウム (1.7-9.2mg/kg daily)で治療されました。副作用はグレード3から4の高血圧と肝障害でした。生存期間中央値は313日(10ヶ月)でした。
解説:この報告は臨床第1相試験といって新しい薬剤の有害事象(副作用)と使用量をみるためのものです。HIF1-alpha (hypoxia-inducible factor-1 alpha)という物質を抑制するMotexafinが放射線治療の効果を上げるかもしれないという考えからの試験です。でもあまり期待できないと思われ ます。
文献
- Aboian MS: Diffusion Characteristics of Pediatric Diffuse Midline Gliomas with Histone H3-K27M Mutation Using Apparent Diffusion Coefficient Histogram Analysis. AJNR Am J Neuroradiol. 2019
- Albright AL, Packer RJ, Zimmerman R, et al. Magnetic resonance scans should replace biopsies for the diagnosis of diffuse brain stem gliomas: A report from the Children’s Cancer Group. Neurosurgery 33: 1026–1029, 1993
- Broniscer A, et al: Role of temozolomide after radiotherapy for newly diagnosed diffuse brainstem glioma in children: results of a multiinstitutional study (SJHG-98). Cancer 103:133-139, 2005
- Broniscer A, et al.: Young age may predict a better outcome for children with diffuse pontine glioma. Cancer 113: 566-572, 2008
- Cohen KJ, et al.: Temozolomide in the treatment of children with newly diagnosed diffuse intrinsic pontine gliomas: a report from the Children’s Oncology Group. Neuro Oncol 13:410-416, 2011
- Grill J, et al.: Clitical oncogenic mutation in newlyu diagnosed pediatric diffuse intrinsic pontine glioma. Pediatr Blood Cancer 58: 487-488, 2012
- Hoffman LM, et al.: Clinical, Radiologic, Pathologic, and Molecular Characteristics of Long-Term Survivors of DiffuseIntrinsic Pontine Glioma (DIPG): A Collaborative Report From the International and European Society for Pediatric Oncology DIPG Registries. J Clin Oncol. 2018
- Jalali R , et al.: Prospective evaluation of radiotherapy with concurrent and adjuvant temozolomide in children with newly diagnosed diffuse intrinsic pontine glioma. Int J Rad Oncol Biol Phys, 2009
- Jackson S , et al. Clinico-radiologic characteristics of long-term survivors of diffuse intrinsic pontine glioma. J Neurooncol 114: 339–344. 2013
- Jansen MH, et al.: Survival prediction model of children with diffuse intrinsic pontine glioma based on clinical and radiological criteria. Neuro Oncol 17:160-166, 2015
- Janssens GO, et al.: The role of hypofractionation radiotherapy for diffuse intrinsic brainstem glioma in children: a pilot study. Int J Radiat Oncol Biol Phys (Epub) 2008
- Janssens GO, et al.: Survival benefit for patients with diffuse intrinsic pontine glioma (DIPG) undergoing re-irradiation at first progression: A matched-cohort analysis on behalf of the SIOP-E-HGG/DIPG working group. Eur J Cancer, 2017
- Kieran MW: Time to rethink the unthinkable: upfront biopsy of children with newly diagnosed diffuse intrinsic pontine glioma (DIPG). Pediatr Blood Cancer 62: 3-4, 2015
- Korones DN, et al.: Treatment of children with diffuse intrinsic brainstem glioma with radiotherapy, vincristine and oral VP-16: a Children’s Oncology Group phase II study. Pediatr Blood Cancer, 20: 227-230, 2008
- MacDonald TJ: Diffuse intrinsic pontine glioma (DIPG): Time to biopsy again?
- Warren KE: Diffuse intrinsic pontine glioma: poised for progress. Front Oncol 2: 205, 2012
- Pollack IF, et al.: A phase II study of gefitinib and irradiation in children with newly diagnosed brainstem gliomas: a report from the Pediatric Brain Tumor Consortium. Neuro Oncol 13:290-297, 2011
- Rizzo D, et al.: Temozolomide in the treatment of newly diagnosed diffuse brainstem glioma in children: a broken promise? J Chemother 2014
- Veldhuijzen van Zanten SE, et al.: Development of the SIOPE DIPG network, registry and imaging repository: a collaborative effort to optimize research into a rare and lethal disease. J Neurooncol. 2017
- Zaghloul MS, et al.: Hypofractionated conformal radiotherapy for pediatric diffuse intrinsic pontine glioma (DIPG): A randomized controlled trial. Radiother Oncol. 2014 Feb 20