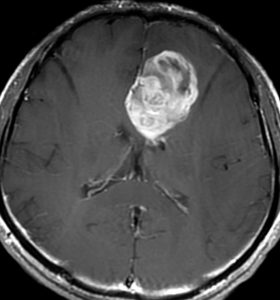
グリオーマ glioma 神経膠腫 (しんけいこうしゅ)
注意!
グリオーマ(神経膠腫 しんけいこうしゅ)は病名ではありません
- グリオーマは脳腫瘍の2割くらいを占める腫瘍です
- グリオーマといっても何十種類もあります
- グリオーマというのは治療を決める診断名ではないのです
- どの国でも,10万人に6人程度の発生率で,男性は女性の1.6倍です
- 悪性腫瘍が多いです
- 脳の神経細胞の働きを助ける役目の細胞(グリア)が腫瘍になってしまったものです
- ですから,脳の中にしみ込むように発育します
- ですから,手術では簡単にとれません
- グリオーマと言われたら命が危ないかもと考えてください
- 半年くらいで命を失うことも,30年経っても何でもないこともあります
最大の特徴は脳にしみ込むように広がることです
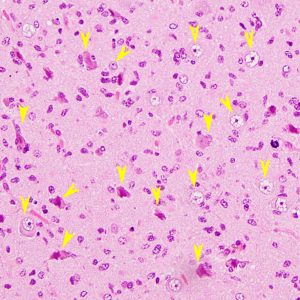
星細胞腫グレード2の組織像です。黄色い矢印は神経細胞で大型です。点のように見えるのがほとんどすべてグリオーマ細胞です。左の画像の被殻という神経細胞 (spindle / large round neuron) のあるところ,右画像の白質というところは,腫瘍に侵されていてもなお正常に機能している脳です。ここにある腫瘍細胞を手術で全部とろうとすれば,この働いている脳(神経細胞と神経線維)もいっしょに取ってしまうことになります。ですから,グリオーマは全部取れないのです。手術だけでは治らないかもしれないと考えて下さい。
- 脳神経外科医は日常会話で,”びまん性グリオーマ diffuse glioma” (びまん性神経膠腫) を『グリオーマ』といいますが誤りです
- グリオーマでは解決がつかないので,なんと言うグリオーマが予想されるか質問してください
- 毛様細胞性星細胞腫(生命を失うことはほとんどない)
- 星細胞腫 IDH変異型(1年から60年の生存期間)
- 乏突起膠腫(5年から60年の生存期間)
- 膠芽腫(3ヶ月から5年の生存期間)
- などなど,星細胞系腫瘍だけでもできる部位と遺伝子診断で予後の違いが大きいです
- 組織診断ではなくて遺伝子診断も必要になりました
- たとえば,第1染色体と第19染色体に欠失があるものだけを,乏突起膠腫として治療する
- IDH遺伝子に変異のあるグリオーマでは、放射線や化学療法に期待が持てるなどです
- でも,同じ分子診断でも,MRIによる腫瘍増大速度の把握 radiological growth rate の方が生存期間を正確に予想できますので,生存期間の予想には病理診断に画像変化を加えて説明をします
- 治療の最優先目的 high priority は,生活の質 QOL を保って生存することです
- 社会復帰を目指すのであって,グリオーマを根絶することではありません
- 2023年,いままで有効な治療薬がなかった星細胞腫に,ボラシデニブ vorasidenibという経口薬が登場しました ヾ(^▽^)ノ
- もちろん,グリオーマでも治ってしまう患者さんはたくさんいるので,診断と治療を慎重に選択しましょう
low-grade glioma 低悪性度グリオーマという用語は治療選択で使わない
文献を読むと LGG low-grade gliomaという言葉が山ほどでてきます。星細胞腫グレード2も乏突起膠腫グレード2もLGGです。初期画像診断時には用いても良いのですが,両者は予後と治療方法が全く異なるので,臨床医は治療選択時にはこの言葉に従った考えを捨てます。
夏目敦至先生が相談にのります(ここをクリック)
夏目 敦至(なつめ あつし)
河村病院 脳神経外科部長
グリオーマについてメールで相談できます。相談フォームをクリックして開いてください。
成人びまん性グリオーマ,びまん性神経膠腫,diffuse glioma
脳外科医が会話と説明で使うグリオーマ
- 脳神経外科医は日常会話で,”びまん性グリオーマ diffuse glioma” (びまん性神経膠腫) を『グリオーマ』といいます
- 慣習として次の,3つの腫瘍がふくまれます
- グレード2の星細胞腫と乏突起膠腫を,low-grade glioma LGG 低悪性度グリオーマということがありますが,正確な用語ではありませんので,なるべく使わない
- まだ細分類もありますのが,知りたい方はクリックして各項目を開いて読んでください
1. 星細胞腫 グレード 2, 3, 4
2. 乏突起膠腫 グレード 2, 3
3. 膠芽腫 グレード 4
びまん性グリオーマの1年生存割合(米国の8,651例の解析)
Ostrom QT: National-level overall survival patterns for molecularly-defined diffuse glioma types in the United States. Neuro Oncol 2023
- 98.0% : WHO grade 2 IDH-mutant 星細胞腫
- 92.4% : WHO grade 3 IDH-mutant 星細胞腫
- 76.3% : WHO grade 4 IDH-mutant 星細胞腫
- 97.9% : WHO grade 2 IDH-mutant 1p/19q-codeleted 乏突起膠腫
- 94.4% : WHO grade 3 IDH-mutant 1p/19q-codeleted 乏突起膠腫
- 55.9% : H3 K27M-mutant diffuse midline gliomas(これは主として小児腫瘍です)
- 53.7% : WHO grade 4 IDH-wildtype 膠芽腫
同じグレード4でも,膠芽腫より星細胞腫の生存割合は高いです
診断には画像診断と病理診断があります
- 画像診断で予想を深めれば,治療の方向性はだいたい予想できます
- 病理診断で確定すれば,治療の方向性が決まります
- 2021年のWHO分類では同じ診断名でも,組織学的な悪性度が異なると違った治療法になるのでとても注意が必要です! 星細胞腫はグレード2から4まであります。
- 医師からの,「手術して病理を見なければ良性か悪性かわからない」という説明は乱暴で,画像診断でもほとんどのことは分かるものです
画像診断
- MRIとCTを用います
- MRIでは特に, T2強調画像,FLAIR画像,T1強調と,ガドリニウム増強の軸面,冠状断,矢状断を撮影します golden standardとされます
- 生検術を行う時には,perfusion MRIやメチオニンペットがターゲットを絞るのに有効です
グリオーマ(神経膠腫)と言われてまず最初に聞かなければならないこと
- グリオーマ 神経膠腫というのは脳から発生する腫瘍の総称です
- ですから,グリオーマだからといっても何がなんだかわかりませんし,グリオーマだから手術するとか放射線治療が必要だとかいう説明は通じません
- MRI所見からどのようなグリオーマ(神経膠腫)ですかと質問します
- 予想される病理組織診断を教えてくださいと言います
- そこで答えられないなら,別な脳神経外科医を選びます
- そうしないと命が危ない病気です
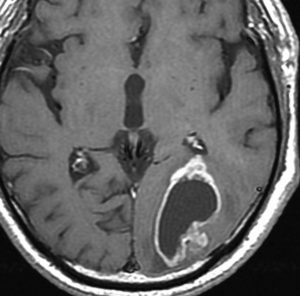
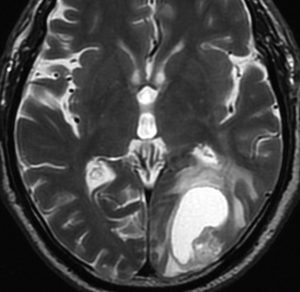
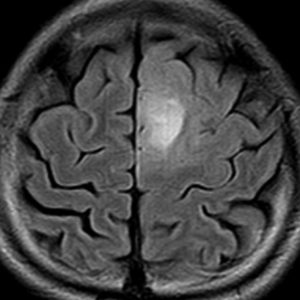
高齢者に発生したグリオーマです。左はガドリニウム増強MRIといいます。腫瘍の周囲が白く縁取られるように見えます。でも,右側のT2強調画像では,白く滲む部分が周囲に広がっています。
グレード3(かつての退形成性星細胞腫)かグレード4(膠芽腫),おそらく膠芽腫と「予想」できる画像です。確実ではないのですが,この予想は治療計画の上で重要なものです。
病理診断では,遺伝子診断をしなければならなくなったこと
まず病理組織像で診断名がつきます。それから,IDHという遺伝子と,1p/19qという染色体(FISHという検査)でみなければ,びまん性グリオーマの確定診断はつけられないことになりました。
成人びまん性グリオーマ 2021年の分類は3種類
星細胞腫 グレード2か3か4(治療方法がグレードで異なります)
Astrocytoma, IDH mutant, nuclear ATRX lost
乏突起膠腫 グレード2か3(治療方法がグレードで異なります)
Oligodendroglioma, IDH mutant, nuclear ATRX retained, 1p/19q codeleted
膠芽腫 グレード4
Glioblastoma, IDH wildtype, nuclear ATRX retained, typical histology or TERT, EGFR, +7/-10
小児タイプのびまん性低悪性度グリオーマ 2021年の分類は4種類
Pediatric-type diffuse low-grade gliomas
びまん性星細胞腫, MYBあるいはMYBL1 遺伝子異常 (グレード1)
Diffuse astrocytoma, MYB or MYBL1-altered
血管中心性膠腫 アンジオセントリック・グリオーマ (グレード1)
Angiocentric glioma
Polymorphous low-grade neuroepithelial tumor of the young (グレード1)
MAPK pathwayに異常があるびまん性低悪性度グリオーマ
Diffuse low-grade glioma, MAPK pathway-altered
小児タイプのびまん性高悪性度グリオーマ 2021年の分類は4種
Pediatric-type diffuse high-grade gliomas
びまん性正中グリオーマ H3 K27遺伝子異常 (グレード4)
Diffuse midline glioma, H3 K27-altered, IDH wildtype, nuclear ATRX retained
びまん性半球性グリオーマ H3.3 G34変異型 (グレード4)
Diffuse hemispheric glioma, H3.3 G34 mutant, IDH wildtype, nuclear ATRX lost, age<50
びまん性小児高悪性度グリオーマ (グレード4)
Diffuse pediatric-type high-grade glioma, H3-wildtype and IDH-wildtype
乳児半球性グリオーマ
Infant-type hemispheric glioma
境界明瞭な星細胞系グリオーマ(びまん性ではない)
毛様細胞性星細胞腫
Pilocytic astrocytoma (グレード1)
piloid-featuresを含む高悪性度星細胞腫 (グレード4)
High-grade astrocytoma with piloid features
多型黄色星細胞腫
Pleomorphic xanthoastrocytoma (グレード 2, 3)
上衣下巨細胞性星細胞腫 (グレード1)
Subependymal giant cell astrocytoma SEGA
脊索腫様膠腫 コルドイド・グリオーマ (グレード1)
Chordoid glioma
星芽腫, MN1-遺伝子異常
Astroblastoma, MN1-altered
悪性かどうかについてはここをクリック
それぞれの脳腫瘍が治りやすいか治りにくいかを示す指標です。グレード1,グレード2,グレード3,グレード4があります。患者さん側の観点からはグレード1だけが良性といえるでしょう。悪性度は従来どおりの病理組織診断にほぼ依存します。乏突起膠腫グレード2か3と診断されても,治療は従来の乏突起膠腫と退形成性乏突起膠腫に準ずることになります
他のグリオーマの WHO 2021年分類は ここをクリック
いろいろな珍しいグリオーマの病名と詳細な記述に入れます
手術治療
世界の常識 Most diffuse gliomas are not cured by surgery!
cureというのは日本語に訳すと「完治せしめる」と言う意味です
注意! 「ネットや雑誌の宣伝」に惑わされてはいけない
- ある程度,ある場合には,有効かもしれないけれど,科学的に生存期間の延長が証明されていないものが多いです
- 学会などで発表されて,最新あるいは必須の治療法,先進医療のように宣伝されますが,実際のところは長期生存割合には大きく影響しないものです
- 「しっかりした英語の論文でレベルの高い学術誌に掲載された信頼するに足る科学的な実績」はなくて,患者さんを引きつけるための宣伝が多いと考えた方がいいでしょう
- このような科学的根拠というものはエビデンスレベルというもので評価されますから,「日本語で自前の良い成績」が書かれていても何の証明にもなりません
- もちろん,病院のホームページに自書で載せてある成績は認められません
- 例えば,アミノレブンリン酸(ALA)を使うことで,悪性度の高いグリオーマの摘出率が向上するというのは証明されています,話が難しいのですが摘出率と生存期間というのは一致するものではありません
- 澤村はALAを使用して手術しています,でも患者さんには,それによって延命効果が得られるとは説明しません
- 覚醒下手術はかなり限られた条件でしか行うべきではありません,ほとんどの手術では無用なものです
- オプチューン NovoTTFは,膠芽腫患者さんの生存期間中央値を延長しますが,かなり限られた条件での使用となります
イメージ・ガイド手術:
術中MRI,ALA(アラベル)による可視化,ナビゲーションなどを,術中イメージ・テクノロジーといいます
覚醒下手術
免疫治療(自己樹状突起細胞,ワクチン治療,リンパ球活性化治療)
アミノレブリン酸(ALA)による可視化と光線力学治療(PDT)
重粒子療法,中性子補足療法
NovoTTF(オプチューン)
組織診断,形態的診断 histological phenotypic diagnosis
分子診断,遺伝子診断 molecular genetic diagnosis
2016年までは,グリオーマは病理診断医が,顕微鏡を覗いて診断していました。これを組織診断(形態学的診断)といいます。でもこれからは,分子解析による遺伝子診断になります。
WHO 2016年分類による大混乱
- 一番の理由は,この数十年間積み重なってきた世界の脳腫瘍の治療データが見えなくなってしまうことです
- 新しい分類は他のページに書いてあるので見てください(ここをクリック)
- これまでも多少の病理診断の定義の変化はあったのですが,今回はあまりに激変 drastic change でした
- たとえば,顕微鏡で覗いて「乏突起膠腫」と診断していたものが,遺伝子診断しなおすと「びまん性星細胞腫」に変わってしまうということです
- 免疫組織診断で「退形成性乏突起膠腫」であったものが, FISHで「膠芽腫」に変わってしまうということも頻度としては高いでしょう
- その逆もあります
- 文献で調べて,乏突起膠腫の臨床成績とされているものに,びまん性星細胞腫や膠芽腫が大量に混じっているということになります
- 新しい分類を採用すると,過去の文献のデータによる根拠に基づく医療 EBMができなくなってしまいます
- ではどこに,その腫瘍のことが書いてあるかといえば,英語で世界の文献情報を探っても何にも出てきません
- なぜなら,この分類による治療成績や患者さんの予後は,今後20年くらいかかって徐々に明らかになってくるからです
グリオーマの根拠なき治療 non-EBM が始まります
わかりにくいので例をあげましょう
退形成性乏突起膠腫 グレード3を遺伝子診断で見直してみたら
Dubbink HJ, et al.: Molecular classification of anaplastic oligodendroglioma using next-generation sequencing: a report of the prospective randomized EORTC Brain Tumor Group 26951 phase III trial. Neuro Oncol 18:388-400, 2015
ヨーロッパで行われた大きな臨床第3相試験(EORTC 26951)を,遺伝子診断で再分析したものです。グレード3オリゴ AO, AOAと診断されて臨床試験された126例を遺伝子解析で見直したら,20例が IDH mutation, “astrocytoma“,49例が1p/19q codeletion, “oligodendroglioma”,55例が7+/10q- or TERTmut and 1p/19q intact, “glioblastoma”だったというのです。
なんのこっちゃ!!
結論は同じで,PCV化学療法が有効か否かはやはりMGMTメチレーションで決まるそうです。
退形成性乏突起膠腫の病理組織診断の半数近くが,分子診断で膠芽腫に変わったということでしょうか。これからは病理組織診断なんて,全く不要?ということに結論されます。
じゃあ今までのは何だんったんだ(;_;)
英語の論文を読むのにさらに深い知識と注意力が必要となります
日本においての現実問題
- 遺伝子診断は日本でも可能です
- でも,普通の脳神経外科医は,どこでこんな診断をしているのかわかりません
- グリオーマの専門家というのは数少ないし,そこに患者さんが集まるわけでもありません
- 保険診療で認められていないので,患者さんに数万円以上の自費がかかります
- グリオーマで入院して手術して放射線化学療法しても,自己負担は普通の人で1ヶ月あたり9万円弱です
- そこに余分に数万円以上の医療費が重なります
なぜ勝手な治療,根拠なき治療が始まるのか
- どこにもデータがないので,基づく根拠なし
- これからスタートというわけです
- だから遺伝子診断(分子診断)に基づいて私の大学はこの方針で治療をしているという説明がなされます
- もうすでにかなり多くの日本の施設でこのような治療方針が始まっています
現状で遺伝診断をしても患者さんにメリットが少ないわけ
- 暗い話をするようで申し訳ありませんが,選択肢となる治療方法がないからです
- グリオーマに使用できる信頼できる治療法は,放射線治療とテモダール化学療法のみです
- 2014年にアバスチンは生存期間の延長さえできないとされてしまいました
- もちろん,とても細かい微調整はできます
- 遺伝子診断に基づく腫瘍の治りやすさに応じて,放射線の照射範囲と線量を増減したりする微調整です
- また腫瘍によってはアバスチンで腫瘍体積を大きく減らすことも可能です
グリオーマ治療の白紙委任状 carte blanche application
carte blancheはフランス語で,自由裁量とか白紙委任状とか訳されます。医師法の範疇では,グリオーマの治療は脳外科医に白紙委任されています。科学的に有効性が証明できていない外科治療も医師の自由裁量で行うことができます。
de Leeuw CN: Supratotal Resection in Glioma: A Systematic Review. Neuro Oncol. 2018
de Leeuwの批評的な論文があります。例えば,グリオーマは浸潤性なのでMRI画像でみえている腫瘍より広い範囲の脳まで切除してしまえば,再発する可能性は低いと予想されます。それを “supratotal resection” (周りの正常に見える脳も少し取る)といいます。この考えで手術をするのに,覚醒下手術,ALA,ナビゲーション,術中MRI などが応用されます。その結果,最新の脳外科技術を用いて腫瘍がたくさん取れると治る(PFS, OSの延長)との論文や学会発表があるのですが,それらは本当に正しいのかどうかは不明です。前方視的な臨床試験でなければ証明できないことです。
脳外科医も患者さんも,”supratotal resection” でグリオーマが治せると信じたい,という希望は理解できます。
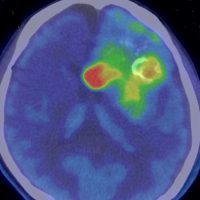
メチオニンペット Met-PET
11C-メチオニンという放射性物質を静脈から注射して,脳のPET(ポジトロン断層撮影)をします。メチオニンの取り込みが高いところが赤く描出されます。グリオーマと炎症性疾患や壊死などとの鑑別に迷った時に用いられることがあります。グリオーマでは,悪性度の高いもの,乏突起膠腫に取り込みが高く見られますが,病理診断を超える価値はありません。
これを見たからといってグリオーマの治療方法が変わるわけではありませんから,保険診療は認められていません。自己負担で6万円以上はかかるでしょう。
生検術(せいけんじゅつ)とは
- 生検術というのは腫瘍のほんの一部をちょびっと取って,病理診断することをいいます
- 定位生検術は,腫瘍に近いところの頭蓋骨に12mmくらいの穴を開けて,そこから太い針みたいなもの(鈍針)を脳の中にずーとゆっくり差し込んで,腫瘍のかけらを採ってくることです
- CTとかMRIの画像をもとにしてコンピューター・ガイドでするので場所は間違わないです(定位生検術といいます)
- 脳室内に突出する腫瘍では,神経内視鏡を使用する生検術 endoscopic biopsy もあります
- 簡単な全身麻酔併用の局所麻酔でもできますから,眠っているうちに短時間で終わります
- でもしかし,グリオーマは病理診断を間違いやすいので,ごく小さな腫瘍片だと誤診してしまうことがあります
- ですから逆に,小さな開頭手術で,多めの腫瘍組織を採取するという生検術の方が診断は正確です(開頭生検術といいます)
- 遺伝子診断が必要となり,深部のものを除けば,開頭生検術のほうが多く行われるようになっています
- 開頭生検術の欠点は,手術時間がかかることと,傷を大きくしてしまうと治るのに時間がかかって,放射線治療などの開始時期が遅れることがあることです
グリオーマ摘出手術の原則:2017年ヨーロッパのガイドライン
The goal of surgery is to remove as much of the tumour as safely possible to improve neurological function. The prevention of new, permanent neurological deficits is more important than extent of resection as gliomas are not cured by surgery, because tumour cells infiltrate far beyond the lesion and demonstrate network-like growth, both of which are hallmarks of diffuse gliomas. It remains uncertain whether extent of resection truly matters.
日本語訳:目的は脳神経機能を回復させるために,安全性を確保しながら,より多くの腫瘍を摘出することです。新たなあるいは回復しない神経脱落症状を出さないように手術することが,より多くの腫瘍を摘出するよりも重要なことです。なぜなら,多くのグリオーマは外科手術だけでは治らない病気だからです。腫瘍細胞はMRIでみえる領域を超えて浸潤していますし,網の目のように増殖しています。これがグリオーマというものです。手術摘出の程度が真に問題かどうかははっきりしていないかもしれません。
もちろんヨーロッパの先進国で,下に書いてあるような最新の外科技術を駆使した上で,さらに重要な原則として記述されています。
手術で用いられるもの
- 一般的に,グリオーマは手術で完全摘出すれば治るという原則があります
- でも完全摘出をできる例は多くはありません
- 少しでも多く摘出したほうが,元気に暮らせる期間が長くなる PFS,生存期間が長くなる OSという原則もあります
- でも手術だけで治らないものもたくさんあるので,障害を出してまで無理して摘出しないという方針が選択されることが多いでしょう
- 手術で用いられるもっと重要な手法として,ナビゲーション,術中 iMRI,MEPモニタリング,機能的MRI画像 (functional MRI)による運動野・言語野の同定,DTI-FTによる錐体路・視路の同定,MEGによる優位半球決定,SEPによる一次感覚野・中心溝同定,覚醒下手術などいろいろな技術があります
- でもこれらも常時ではなく,あくまでも時には有用というものです
- いずれも全く非侵襲的(行うことによって害がない)という訳ではありません
- それぞれに副作用(合併症)もあり,お金もかかり,術前検査と手術時間が長くなり,さまざまな問題があるものです
- 特に問題が多いのは覚醒下手術です,あまりにも根拠ない例で使用されています
- 左前頭葉の言語野など,覚醒下手術の利点がかなり期待できるグリオーマに限定的に用いられるべきです
- 覚醒下手術で,グリオーマの20%くらいを摘出されている術後の患者さんをみることがありますが,なんのために覚醒下手術をしたのかさっぱり理解ができません
- 小児のグリオーマに覚醒下手術を積極的に行うということには,倫理的な問題もあります
- てんかんの焦点を明らかにするという目的での,硬膜外電極の埋め込みのために開頭手術を勧められた時も拒否した方がいいです,グリオーマの治療とはなんの関わりもありません
- 執刀医の経験と技術に裏打ちされていて,使用しないで済むのであればその方がいいでしょう
- そもそも解剖生理学的に取れない位置にあるグリオーマは,覚醒下手術でも,術中MRIでもALAで可視化できても,生理学的なモニタリングをしても摘出できません
- ちなみに私は,ALAもナビゲーションも使用していますし,覚醒下手術も経験しています,MEPモニタリング,機能的MRI画像による運動野・言語野の同定,DTI-FTによる錐体路・視路の同定,MEGによる優位半球決定,SEPによる一次感覚野・中心溝同定,術中の表面深部脳波モニターも全部したことあります o(^o^)o
- 応用できて価値のある手段は利用しますが,これがあれば生存率が上がるという考え方はしません
手術後のMRI評価
- グリオーマの摘出を正確に把握するためには,手術後できたら24時間もしくは48時間以内にMRIをします
- 必要があればガドリニム増強MRIと拡散強調画像 DWIを撮影します
- 主たる理由は,残存腫瘍の大きさと,手術による摘出腔周囲の虚血病巣の広がりを把握しておくためです
- 手術が午後に終わる時が多いので,翌日の午後にMRIをするか,2日後にMRIをするということになります。
放射線治療(詳しい内容はここをクリック)
- 目的は,生活の質を保って生存期間を延長することです
- いつ行うか timing,どの程度の線量を使うか dosing,スケジュール schedulingを決めます
- 病理診断,予後推定,年齢,KPS(一般状態),外科摘出度が判断基準となります
- 手術後に行う場合は3−5週間以内に開始します
- 標準的には,局所照射で50-60グレイ,1日線量 1.8-2.0グレイです
- 予後の悪い患者さんや高齢者には,回数を少なくして線量をあげる低分割照射が用いられます,たとえば1日2.67グレイを15回に分けて治療するなどです
- グリオーマは浸潤性の腫瘍ですから,MRI T2/FLAIR でみえるグリオーマ病変から1cmあるいは2.5cmくらい離れたところまで放射線治療の範囲 CTV clinical target volume に含めます
- どのくらい離れたところまで照射領域に含めるかということはグリオーマの悪性度と病理診断を踏まえて決めます,膠芽腫であれば2.5cmは欲しい
- マージンを含めるというのですが,治療計画するとこれがかなり広い範囲になります
- 放射線治療計画はとても複雑で難しいので,グリオーマの治療に慣れた放射線治療医が行います
治療薬
- テモダール(テモゾロマイド),アバスチン(ベバシズマブ),ギリアデル(グリアデル)などの抗がん剤が使用されています(名前をクリックすると見れます)
- 最も有効性が高いのがテモゾロマイド(経口薬)です
- 2023年に,ボラシデニブ vorasidenib(経口薬)のIDH変異型グリオーマへの有効性が臨床第3相試験で証明されました
- CCNU(ロムスチン),ACNU(ニドラン,ニムスチン),BCNU(カルムスチン),FTM(フォテムスチン)などのニトロソウレア系薬剤はセカンドラインとして用いられます
- 日本ではニドランだけが保険診療で使えます
- ヨーロッパでは低悪性度グリオーマ全般にPCV化学療法が使用されますが,日本では使えません
- ロムスチンはグリオーマに有効ですがネット通販で買う必要があります,使用は混合診療となるので医師の協力が得られず,現実的には使えません
- オブジーボ(ニボルマブ)はグリオーマには効きません,しかも年間で2000万円くらいかかりますから使わない
- BRAF阻害剤のタフィンラー(ダブラフェニブ)とメキニスト(トラメチニブ)の併用投与が保険診療でできます
- BRAF v600遺伝子に変異のある例で従来の治療に抵抗性のものに,タフィンラーカプセル(ダブラフェニブ,BRAF阻害剤),メキニスト錠(トラメチニブ,MEK阻害剤)を経口投与するものです
グリオーマの悪性転化 malignant transformation
セカンダリー・グリオブラストーマ
- 低悪性度グリオーマが高悪性度グリオーマとして再燃(再発)することです
- 悪性転化といわれていますが,もともとグレード2でも悪性腫瘍なので,良性のものが悪性になったわけではありません
- 単に再燃時にグレードが上がると理解した方がいいでしょう
- 病理学的には,もともと高悪性度グリオーマが,初回診断で低悪性度グリオーマとして誤診されたのみで,特に遺伝子変異 transformation したわけではないと理解されることも多いです
- 放射線治療をすると腫瘍が悪性化するということがよく言われますが,そうではない場合がほとんどです
いくつかの代表的な再発パターンがあります
- グレード2のびまん性星細胞腫が,短期間の間にグレード4膠芽腫として再発する
- グレード3の退形成性星細胞腫が,何年か後にグレード4の膠芽腫として再発する
- グレード2の乏突起膠腫が,何年も後でグレード3の退形成性乏突起膠腫として再発する
もっとも気をつけなければならない分子診断
IDH wild-type 野生型のびまん性星細胞腫 グレード2と診断された場合です,このタイプは,早期に膠芽腫として再燃することが多いです
退形成性星細胞腫 グレード3の膠芽腫としての再発例
左上前頭回のびまん性グリオーマ diffuse glioma です。手術でほぼ全摘 gross total removalして54グレイの放射線治療とテモゾロマイド化学療法をしました。病理診断は,oilg 2陽性,1p/19q染色体の欠失はない退形成性乏突起星細胞腫 グレード3とされました。全体的にはグレード2であるとの病理医の意見もありましたし,当時は北大病院でもIDHの正確な分子病理診断は行われていませんでした。
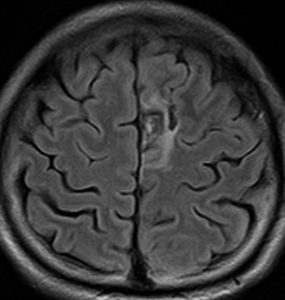
5年後です。上前頭回の病巣は落ち着いていましたが,初回にはなかったはずの場所,脳梁前方に急激な再発増大を生じました。また手術で全摘出 gross total removalして,かなり絞った領域に60グレイの放射線治療とテモゾロマイド,アバスチンの投与をしました。病理診断は,IDH wild-tpye, 1p/19q non-codel, MIB 40%, ATRX positive, MGMT negativeの膠芽腫でした。
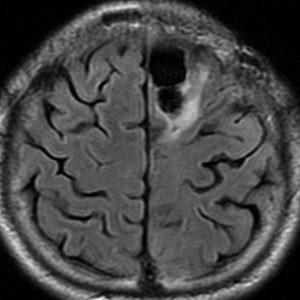
その後またしばらく寛解継続できました。
考えられることと不明なこと
- oligoとしての分化像を含むAA anaplastic astrocytomaが,再発時にGBMになったという事実があります
- これは最初から単なるGBMであったものではありません
- oligoの部分像をかなり含む,グレード3あるいは2の diffuse gliomaでしたが,1p/19qの欠失はありませんでした
- secondary GBMのように,治療反応性がよいものでしたが,再発時にはIDHはwild typeでした
- 再発は初発部位とはかなり離れた部位で,放射線線量がほとんど入っていない部位でした
- これを放射線誘発GBMとして捉えるのかどうか不明です
- 逆に,CTVはかなり広くとてあったので放射線の掛け損ないでの再発ではありません
- びまん性グリオーマが予想以上にかなり広く浸潤するということを示唆しています
ここから下は難しいです
臨床医のための分かりやすいグリオーマ遺伝子診断:ここをクリック
(2021年ヨーロッパの基準)
発生部位によって特徴付けられるグリオーマ
診断では,Low-grade gliomaという言葉はなるべく使わない
- 低悪性度グリオーマ low-grade gliomaという用語があります
- 毛様細胞性星細胞腫や星細胞腫や乏突起膠腫などのグレード1とグレード2のグリオーマを示しますが,これもグリオーマという用語と同じで意味をなしません
- 診断時にlow-grade gliomaを疑うというコメントは使用してよいでしょう,しかし,治療方針を決める時には使用してはなりません
- 何故なら、星細胞腫グレード2と毛様細胞性星細胞腫では治療方針が全く異なるからです
- これらを一緒くたにして,時にはびまん性橋膠腫も含めてlow-grade gliomaとして治療している小児科の先生がいますが,それは大きな誤りです
- 病理組織が分類されていないlow-grade gliomaの手術成績や放射線化学療法の論文報告も読まない方がよいでしょう
治療法の選択は生存期間だけではない
低悪性度グリオーマ治療の oncofunctional balance
- 低悪性度グリオーマでは,生存期間の優劣のみで治療方法を選択してはいけません
- 「命永らえること」と「治療後の生活の質 QOL」は同等に重要な判断材料です
- QOLは手足の麻痺などが重要視されてきましたが,グリオーマで特に重要なのは,認知機能(知能,人格など)を悪くしないことです
- 患者さんが治療後に,「社会復帰できる程度の治療侵襲」のみが受け入れられる選択肢となります
- 学校や職場に戻れないような,積極的な手術や強い放射線治療はしません
- 分子診断よりも,画像所見による腫瘍増大速度の把握 radiological growth rate の方が生存期間を正確に予想できるので,患者さんの生存期間の予想には画像変化を加えて説明をします
- その上で治療選択肢を提示します
- てんかん発作,認知機能,患者さんの希望,経済状態,家族構成などをよくよく考えて治療方針を決めます
分子診断での治療選択
- 星細胞系腫瘍と乏突起膠細胞系腫瘍では,旧来の組織診断が同じでもかなり違った予後になります
- 治るか治らないか,同じ診断名でばらつきが大きかったということです
- 最近は,遺伝子診断 molecular diagnosis がそれを補います
- 2021年時点で重要なものには次の3つの分子マーカーがあります
- もっとも重要なマーカーはIDHという遺伝子です
- これらが検出されると治療が効きやすく比較的に予後が良いとされています
- 例えば,乏突起膠腫(グレード3)で1p/19qの共欠失があり,MGMTのプロモーターメチレーションがあり,IDH1/2の遺伝子変異があれば,治る期待がもてます
- これらのマーカーを用いて治療方法を選択しようという意見は,2005年ころからあるのですが一般化しませんでした
- 検査が面倒でしばしば信頼性に欠けるということも原因です
- もう一つの大きな理由に,2022年時点でも有効性がある化学療法剤がテモゾロマイドしかないという事実があります
- MGMTメチレーションがないとテモゾロマイドの有効性は低いのですが,だからといって他に何か選択肢があるかというと,無いので,結果的に使用する制がん剤がテモゾロマイドなら,分子マーカーがなんであれ同じ治療選択となります
mutations of isocitrate dehydrogenase (IDH) 1 and 2
IDH1 codon 132, IDH2 codon 172 missense mutationをみます。方法として,IDH1 R132H 抗体による免疫染色かIDH1/2 mutation hotspot sequencingをします。IDH遺伝子変異があるグリオーマは組織型によらず予後が良い(治りやすい)ことが知られています。MRSという検査でこの変異の有無が予測できる可能性があります。IDH変異があるグリオーマでは手術で摘出できる確率が上がります。2023年6月に,変異型IDH阻害剤,ボラシデニブ vorasidenib(飲み薬)の臨床第3相試験の結果が発表され,グレード2びまん性グリオーマでの無増悪生存期間の延長が証明されました,もうすぐ日本でも使用できるようになるのでしょう
1p/19q chromosomal codeletion
乏突起膠細胞系腫瘍のマーカーです,第1染色体単腕と第19染色体長腕の共欠失があるものには化学療法と放射線治療が良く効きます。
O(6)-MGMT promoter methylation
MGMTメチレーションがあるとテモダールなどの化学療法剤が効くことが知られています。メチレーションがない例では逆に薬剤が効きません。メチレーションの有無の判定は難しく免疫組織染色での信頼性は低いですが,日本ではほとんど免疫組織染色に頼っています。IDH変異のあるグリオーマの80%くらいに,MGMTのメチレーションがあります。高齢者では特に重要な指標であり,テモゾロマイドを使用するかどうかの判断の基準とします。ただし2022年時点で,グレード2のびまん性グリオーマではMGMTメチレーションを検査する臨床的意義はないとされています。
loss of nuclear ATRX expression
免疫組織染色で判定できます。星細胞系腫瘍に特徴的ですから,IDH変異があってこの欠損が認められれば1p/19qの染色体検査をしなくても星細胞系腫瘍 astrocytic lineage tumor と判定できます。逆に,やや治りにくいグリオーマの指標とも言えます。
CDKN2A/CDKN2B homozygous deletion
特にグレード3のグリオーマ(退形成性星細胞腫と退形成性乏突起膠腫)の予後不良因子の一つとされました。2021年時点では,CDKN2A共欠失があるとIDH変異があっても予後不良でグレード4の星細胞系腫瘍とされます。
Histone K27M mutation
びまん性正中グリオーマの分子マーカーです。グレード4で予後不良です。
Histone H3.3 G34 mutation
大脳半球びまん性グリオーマで,WHO グレード4に相当します
EGFR amplification
膠芽腫の半数くらいで認められます
TERT promotor mutation
ほとんどの乏突起膠腫,7割くらいの膠芽腫で変異があります
BRAFV600E mutation
成人のグリオーマではまれで,小児のPXAやgangliogliomaなどで変異が認められます
患者さんの全身状態の指標 Performance Status (PS)
この指標値が高いと積極的な治療をしない,低ければ強い化学療法も行うという判断基準になります。PS 3以上では治療しないとか,KPS 70以上でこの治療を行うとか記述します。
脳腫瘍の領域では,ECOGというヨーロッパの指標がよく用いられます(原典はここをクリック)Zubrod scaleといいます。
0 問題なく社会活動できる。 発病前と同じ生活が制限なく行える。
1 軽度の症状があり,肉体的に激しい活動は制限されるが、歩行、軽作業,座っての作業は 行うことができる。例えば軽い家事、事務。
2 歩行ができ,自分の身の回りのことできるが,軽作業ができない。日中の50%以上は起床して過ごす。
3 自分の身の回りのある程度のことしかできず,しばしば介助が必要。日中の50%以上をベッドか椅子で過ごす。
4 ほどんど動くことができず, 自分の身の回りのことは全くできない。終日ベットか椅子で過ごす。
KPS (カルノフスキー・パーフォーマンス・ステイタス)
カルノフスキーの一般全身状態スコアとは,PSを10段階に分けるスケールです
100 正常
90 軽い臨床症状はあるが正常活動可能
80 かなり臨床症状があるが,努力して正常の活動可能
70 労働することはできない
60 自分に必要なことはできるが,ときどき介助が必要
50 病状を考慮した看護および定期的な医療行為が必要
40 動けなくて介護や医療が必要な状態
0 死亡
グリオーマ治療のエビデンスレベル
いろんな情報がどこまで信じられるかをレベルに表したものです。1〜4とか1〜6とかに分類されます。専門家個人の意見の意見ではなく,根拠に基づいた客観的な治療を選ぶための指針です。例えば,免疫治療,ウィルス治療,ワクチンで悪性脳腫瘍が治るというのは,レベル5で,最低ランクの情報なのです。
グリオーマの免疫治療(詳しくはここをクリック)
ここから下は専門家むけ
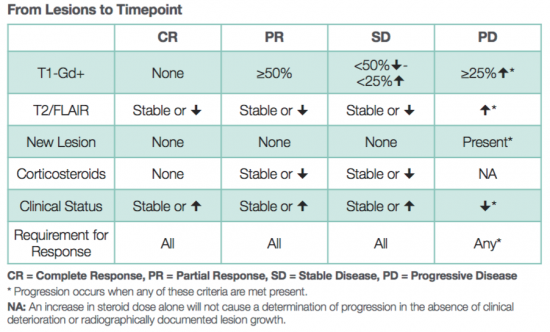
治療効果の判定をどうするか RANO criteria
MacDonald criteriaという判定法が使用されてきました。MRIで,ガドリニウム増強される部分の腫瘍を交差する2つの長径で測定する方法です。25%以上の増大で腫瘍進行 PDとします。それに臨床症状とステロイドの使用量を加味して評価します
しかし,この評価方法が通用しなくなってきました。理由は2つあります。第1に,テモゾロマイドと放射線治療を行なうと,3ヶ月以内くらいに一見腫瘍が大きくなったように見えるスードプログレッションという現象が2−3割で生じることで,ガドリニウム増強病変が拡大します。 しかし,この病変拡大は自然に改善します。第2に,アバスチン (antiangiogenetic agent) を使用すると,投与数日以内にガドリニウム増強病変が縮小して,一見治療がとても有効なようにみえることです。でも腫瘍が悪化していると,T2/FLAIRで高信号になる病変だけは拡大していきます。これは血液脳関門の透過性が下がってガドリニウムが腫瘍組織内に漏出できなくなるという現象をみているだけなのです。
MacDonard criteriaを改変したRANO (Response Assessment in Neuro-Oncology) criteriaが用いられます。治療終了12週間以内では,80% isodose lineを越えた新増強病変の出現か再手術によって病理診断されなければ腫瘍進行 PDとはいいません。その後には,25%以上のガドリニウム増強病変の増大,新病変の出現,臨床症状の明らかな悪化,antiangiogenic agentの使用にも関わらずT2/FLAIR病巣が拡大することなどです。
RANO criteria
patient-reported outcome (PRO)
最近の治療法を評価するための一つの大きな基準です。医師は5年生存率が改善すれば,その治療が良い治療だと言います。でも,患者さんは治療を受けることによって単に命が数ヶ月伸びて,生活がすごく苦しくなるということもあります。患者さん側からの評価 PROでその治療法が有益かどうかを判断するという基準です。
分子診断より画像診断の方が予後が良くわかる
Gozé, C, Blonski, M, Le Maistre, G et al. Imaging growth and isocitrate dehydrogenase 1 mutation are independent predictors for diffuse low-grade gliomas. Neuro Oncol 16, 2014
131人の組織学的低悪性度グリオーマの患者さんの予後解析です。107人にIDH1の変異がありました。画像診断では5.4mm/年の平均増大速度でした。無増悪生存期間 PFSは,
IDH1変異があると予後が良いことが知られています。全体で見ると,悪性進行のないPFSは画像上でゆっくりした増大速度を示したもので149ヶ月,IDH1変異のあったもので100ヶ月です。IDH1の変異の有無に関わらず,画像上で増大速度の遅い低悪性度グリオーマの予後は良いということです。
「解説」IDH1変異がないと膠芽腫の可能性があり,かなり積極的な治療を行うという風潮にあります。しかし,しばらく経過を見ていてMRIでかなりゆっくりしか増大しないものの予後は,分子診断で予想するよりもはるかに良いということです。
MRI画像診断で見える予後
Pallud, J, Blonski, M, Mandonnet, E et al. Velocity of tumor spontaneous expansion predicts long-term outcomes for diffuse low-grade gliomas. Neuro Oncol 15, 2013
407人の成人低悪性度グリオーマの患者さんの予後解析です。画像診断では5.8mm/年の平均増大速度でした。7年余りの追跡期間で209人に悪性転化 malignant transformationが生じました。治療前のMRI上での増大速度のゆっくりしたものは,生存期間が長いというはっきりした結果が出たそうです。分子診断だけではなく,治療前の腫瘍増大速度を見ることによって生存期間の予測ができることを再認識するべきでしょう。
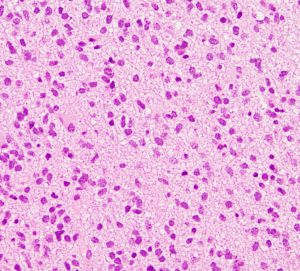
悪性度のもう一つの指標:ミブ MIB
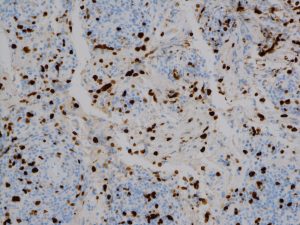
組織診断するとKi-67という抗体で「MIB-1免疫組織染色」ができます。そのMIB-1 (Ki-67) 染色率をlabling indexといいます。黒っぽく染まっているのが陽性細胞,薄い青が陰性細胞です。この例では20%くらいになります。
これはグレード診断,分子診断とともに,患者さんの予後を決める大きな因子です。腫瘍の増殖速度が遅いグレード1は1%,グレード2で2-5%くらいです。膠芽腫では20%を超える値にもなり,そのようなものでは1週間単位で腫瘍が大きくなります。
豆知識 グリア
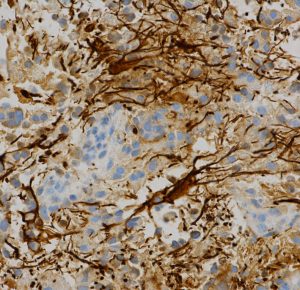
グリア glia, glialは,ギリシャ語の”glue”に由来します。粘っとしたものという意味です。英語の glue は糊(ノリ)です。実際に手術で摘出しようとするとちょっとねばっとしています。そのわずかな粘り,硬い粘液のような感触を手掛りに腫瘍摘出をします。日本語での膠細胞,膠腫の「膠 にかわ」という訳はあまりいただけません。膠ほどには粘性の強いものではありません。
左の写真は長い突起を四方に伸ばすアストログリアです。
豆知識 遺伝するグリオーマ
遺伝性に発生するグリオーマがあります。神経線維腫症1型 (NF-1),ターコット症候群 (Turcot syndrome),リ・フラウメリ症候群 (Li Fraumeni syndrome)です。
NF-1以外は極めて稀なものです。ですから,NF-1を持っている家系でなければグリオーマは遺伝しないと考えます。
文献情報
BRAF V600 mutationのある低悪性度グリオーマには,ダブラフェニブとトラメチニブとの併用が有効
Dabrafenib plus Trametinib in Pediatric Glioma with BRAF V600 Mutations. N Engl J Med 2023
下記の学会発表が論文となりました。ダブラフェニブは単独あるいはトラメチニブとの併用で,BRAF V600 mutationを有する低悪性度グリオーマに有効なことが知られています。ダブラフェニブ/トラメチニブとCBDCA/VCRの効果が比較されました。CBDCA/VCRは旧来小児のグリオーマに最も使用された併用化学療法です。ダブラフェニブ/トラメチニブで44%,CBDCA/VCRで11%の奏功率 (CR or PR)が得られました。臨床的な利点はそれぞれ86%と46%でした。PFS中央値は20ヶ月と7.4ヶ月でした。
「一言』PFSが20ヶ月ということは,2年を待たずに再燃するということです。
BRAF V600 mutationのある高悪性度グリオーマには,ダブラフェニブとトラメチニブとの併用がある程度有効
Phase II Trial of Dabrafenib Plus Trametinib in Relapsed/Refractory BRAF V600-Mutant Pediatric High-Grade Glioma. J Clin Oncol 2023
BRAF V600 mutationは小児悪性神経膠腫の8-10%に認められます。41例の再発あるいは治療抵抗性の悪性グリオーマが対象です。奏功割合は56%,反応期間中央値は22ヶ月でした。半分くらいの例で2年弱有効であるという結果です。
ボラシデニブ vorasidenibは,グレード2の星細胞腫と乏突起膠腫の無増悪生存期間を延長する:臨床第3相試験の結果
Mellinghoff IK: Vorasidenib in IDH1- or IDH2-mutant low-Grade glioma. New Engl J Med 2023
vorasidenibは、変異型IDH1/2酵素の作用を阻害する経口薬で、腫瘍の2-ヒドロキシグルタル酸(2-HG)を90%以上低下させます。経口薬ですが脳内移行がよい薬剤です。術後の残存腫瘍あるいは再燃 168例にvorasidenib (40 mg once daily) が投与されました。観察期間中央値14.2ヶ月の時点で,7割の患者さんがvorasidenibあるいはプラセボを継続服用していました。PFS中央値は,vorasidenibで27.7ヶ月,プラセボで11.1ヶ月でした。グレード3以上の有害事象は22.8%でみられ,ALTの上昇が目立ったそうです。有害事象による中止は3.6%でした。
BRAF v600変異のあるグリオーマとその比率
Andrews LJ: Prevalence of BRAFV600 in glioma and use of BRAF Inhibitors in patients with BRAFV600 mutation-positive glioma: systematic review. Neuro Oncol 2022
1. epithelioid glioblastoma (eGBM) : 69%
2. pleomorphic xanthoastrocytoma (PXA) : 56%
3. anaplastic pleomorphic xanthoastrocytoma (aPXA) : 38%
4. ganglioglioma (GG) : 40%
5. anaplastic ganglioglioma (aGG) : 46%
6. Prevalence in astroblastoma : 24%
7. desmoplastic infantile astrocytoma (DIA) : 16%
9. subependymal giant cell astrocytoma (SEGA) : 8%
10 dysembryoplastic neuroepithelial tumor (DNET): 3%
11 diffuse astrocytoma (DA) : 3%
12 pilocytic astrocytoma (PA) : 3%
circumscribed gliomas, glioneuronal and neuronal tumorsの治療指針
EANO – EURACAN – SNO Guidelines on circumscribed astrocytic gliomas, glioneuronal, and neuronal tumors. Neuro Oncol 2022
これらの腫瘍は小児から若年成人に発生します。これらの腫瘍では,肉眼的な全摘出ができれば,生存期間や症候性てんかんの長期予後がよいです。グレード3と全摘出できなかったグレード2には原体照射 conformal radiaiton therapyを加えます。再発に対しては,再手術と定位照射を用いた再照射を行います。BRAFとMEK阻害剤が毛様細胞性星細胞腫,多型黄色星細胞腫,神経節膠腫に用いられ,mTOR阻害剤エベロリムスは上衣下巨細胞性星細胞腫に有効なことがあります。
「解説」ガイドラインとは書いてありますが,あまりに多くの組織型を対象としているので,雑な論文になってしまっています。
広範囲摘出 supratotal resection は,IDH変異型グリオーマのFPSとOSをかなり延長する
Rossi M: Association of Supratotal Resection with Progression-Free Survival, Malignant Transformation, and Overall Survival in Lower-Grade Gliomas. Neuro Oncol 2020
319例のIDH変異型グリオーマ(星細胞腫も乏突起膠腫なども含む)に積極的な摘出術が試みられました。追跡期間中央値は6.8年で190例 (60%)でprogression 再燃が生じました。35%の患者さんでsupratotal resectionができprogressionは6例 (5.4%)でした。一方で,部分摘出や亜全摘出の患者さんでは82%にprogressionが生じました。supratotal resectionの患者さんでは92ヶ月の時点でPFS 94%でした。この結果はIDH以外の遺伝子異常や腫瘍グレードには優位な関連性はなかったとのことです。
術後評価のMRIは48時間以内にする
Bette S: Patterns and time dependence of unspecific enhancement in postoperative magnetic resonance imaging after glioblastoma resection. World Neurosurg. 2016.
手術後45時間以内では虚血あるいは手術反応性のガドリニウム増強所見は17.9%に認められ,45時間後だと34.1%に増えます。線状の増強像は手術反応性のものだとわかり残存腫瘍との区別が可能です。残存腫瘍の評価は手術後の早い時期にMRIを行った方が正確に判断できるという結論です。
文献
- Ellingson BM, et al. Consensus recommendations for a standardized brain tumor imaging protocol in clinical trials. Neuro Oncol 17: 1188–1198, 2015
- Gozé, C, Blonski, M, Le Maistre, G et al. Imaging growth and isocitrate dehydrogenase 1 mutation are independent predictors for diffuse low-grade gliomas. Neuro Oncol 16, 2014
- Mitchell DA, et al.: Tetanus toxoid and CCL3 improve dendritic cell vaccines in mice and glioblastoma patients. Nature 519: 366–369, 2015
- Mohammadi AM, et al.: Use of high-field intraoperative magnetic resonance imaging to enhance the extent of resection of enhancing and nonenhancing gliomas. Neurosurgery 74: 339-348, 2014
- Pallud, J, Blonski, M, Mandonnet, E et al. Velocity of tumor spontaneous expansion predicts long-term outcomes for diffuse low-grade gliomas. Neuro Oncol 15, 2013
- Pichlmeier U, et al. ALA Glioma Study Group: Resection and survival in glioblastoma multiforme: an RTOG recursive partitioning analysis of ALA study patients. Neuro Oncol. 10:1025-1034, 2008
- Wen PY, et al.: Updated response assessment criteria for high-grade gliomas: response assessment in neuro-oncology working group. J Clin Oncol 28: 1963–1972, 2010