抗腫瘍性天然物サフラマイシン群の化学
−酵素ハイブリッド迅速全合成
東京大学大学院理学系研究科化学専攻 谷藤涼、大栗博毅(被支援者)
Ryo Tanifuji, Kento Koketsu, Michiko Takakura, Ryutaro Asano, Atsushi Minami, Hideaki Oikawa,* Hiroki Oguri*
Chemo-enzymatic Total Syntheses of Jorunnamycin A, Saframycin A, and N-Fmoc Saframycin Y3
J. Am. Chem. Soc. 140:10705. DOI: 10.1021/jacs.8b07161 (2018)
https://pubs.acs.org/doi/abs/10.1021%2Fjacs.8b07161
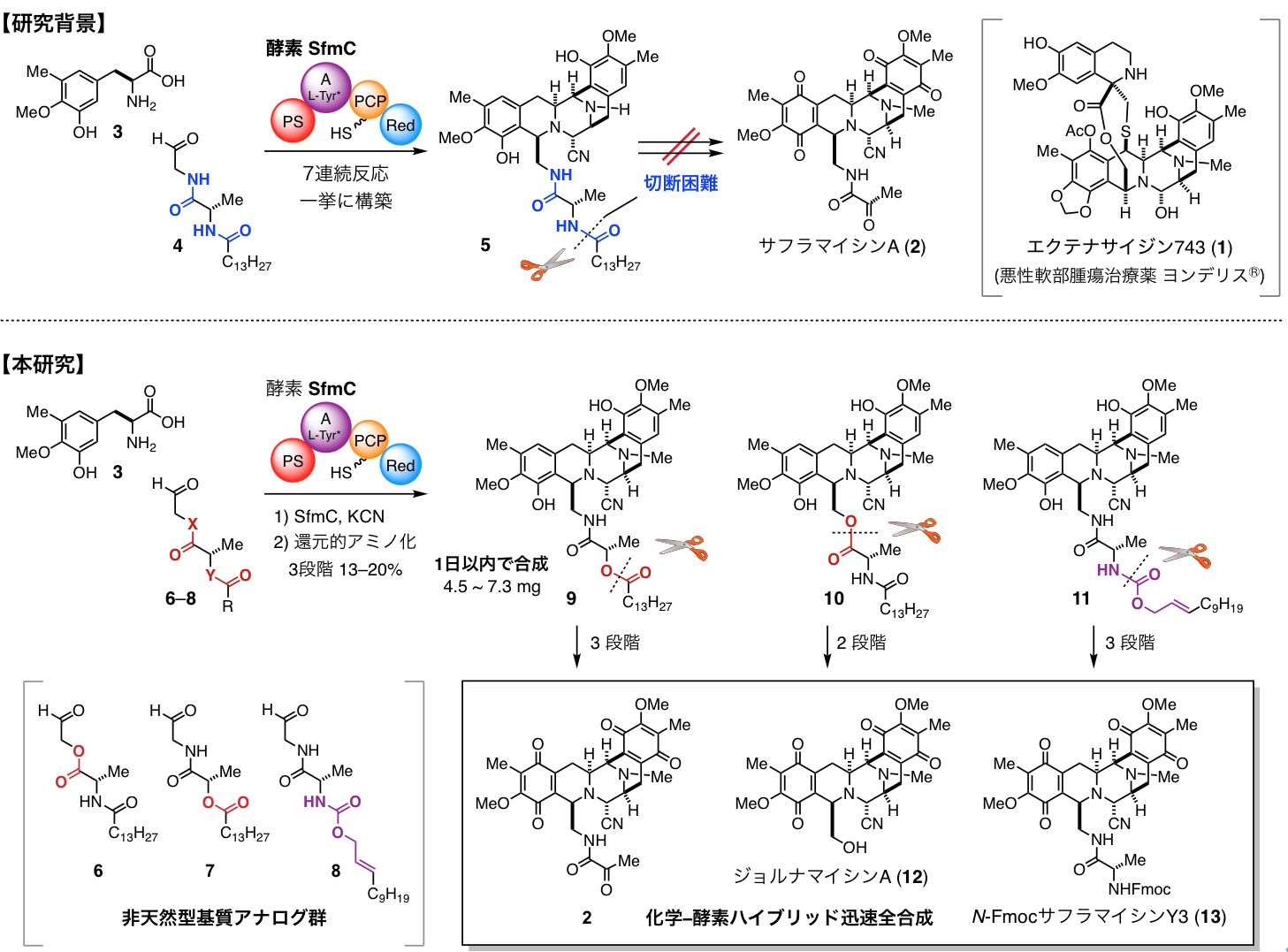
エクテナサイジン743 (1) は悪性軟部腫瘍治療薬 ヨンデリス®︎ として臨床応用されています。ほぼ同一の五環性母骨格を共有するサフラマイシン群 (2 等) も強力な抗腫瘍活性を発揮します。これらは革新的な中分子創薬候補群として注目されています。しかし、極めて複雑な構造の中分子医薬品の供給は困難であり、繊細な官能基が密集した五環性母骨格は10工程以上の多段階変換を経て化学合成する必要がありました。
一方微生物は、非リボソーム依存型ペプチド合成酵素 SfmC を用いて、単純な2つの基質 (3, 4) からこの五環性母骨格 (5) を一挙に生合成します。北海道大学の及川グループでは、この生合成プロセスに着目し、ユニークな7連続反応を経て五環性母骨格が形成される機構を明らかにしていました (Nat. Chem. Biol. 2010)。
本研究では、酵素 SfmC による多環性骨格構築と化学合成を融合し、サフラマイシン群の迅速合成プロセスを開発しました。生合成プロセスにおいては、鍵酵素 SfmCが、基質 4 の長鎖脂肪酸側鎖を認識し、五環性骨格を構築します。その後、膜結合性のペプチダーゼがアミド結合を位置選択的に切断して脂肪酸側鎖を除去し、強力な抗腫瘍活性を発現するサフラマイシン類を生合成します。一方、合成化学的なアプローチでは、位置選択的にアミド結合を切断することは極めて困難でした。
酵素による骨格形成後に、長鎖脂肪酸側鎖を確実に除去できるプロセスを開発するため、酵素に受容される非天然型基質群 (6–8) を設計し、化学合成しました。アミド結合の代わりにエステルやアリルカルバメートを介して長鎖脂肪酸側鎖を連結した基質群 (6–8) に酵素 SfmC を作用させ7連続反応を進行させた後、同じ反応容器内でシアノ化しました。更に、不安定な中間体を単離せずにそのままN-メチル化する手法を開発し、適切に官能化された五環性母骨格 (9–11) を僅か一日で再現性良く合成することに成功しました。エステルやアリルカルバメート部位での開裂反応により脂肪酸側鎖を除去した後、1〜2 段階の化学変換を施し、抗腫瘍性アルカロイド群[サフラマイシンA (2)、ジョルナマイシンA (12)、サフラマイシン Y3 の窒素保護体(13)]を系統的に迅速合成できることを実証しました。今回開発した化学–酵素ハイブリッドプロセスにより、シンプルな基質群 (3, 6–8) から僅か 4〜5 ポットの変換で、多数の官能基を持つ複雑な多環性中分子アルカロイド群を作り分けられるようになりました。
本手法は中間体を単離せずに、シンプルな基質群から複雑な縮環骨格を迅速合成 (< 1日) できます。in vitro酵素変換の長所と基質/中間体の構造・反応性を合理的に最適化できる有機合成化学の利点を相乗的に活かすことができるのが特徴です。本論文の成果を基盤として創製した天然物類似化合物群も強力な細胞増殖阻害活性を示すことが本支援活動より明らかになりました。複雑な生物活性中分子群を迅速に創出する環境調和型の次世代創薬基盤技術として、今後の発展が期待されます。
図1 抗腫瘍性天然物群の化学−酵素ハイブリッド迅速全合成
イメージ図