虚血性脳梗塞マウスにおける延髄網様体腹側核(MdV)と痙縮との関連
名古屋大学大学院医学系研究科総合保健学 予防・リハビリテーション科学
李 佐知子
Isumi S, Futamura D, Hanasaki T, Sako Y, Miyata S, Kan H, Suzuki Y, Hasegawa N, Mushiake H, Kametaka S, Uchiyama Y, Osanai M, Lee-Hotta S
Association of medullary reticular formation ventral part with spasticity in mice suffering from photothrombotic stroke.
NeuroImage, 298,2024,120791, DOI:10.1016/j.neuroimage.2024.120791
https://www.sciencedirect.com/science/article/pii/S105381192400288X?via%3Dihub
中枢神経が傷害されるとその傷害領域が担っていた機能は失われます。さらに運動機能においては運動麻痺が生じた骨格筋に意図しない骨格筋の収縮や反射の亢進を伴う痙縮という症状が出現し、関節が動かなくなる関節拘縮や骨格筋の疼痛を二次的に呈し、日常生活動作や生活の質が低下することが知られています。痙縮発症メカニズムについて、脊髄レベルにおける脊髄運動神経細胞の活動亢進や易興奮性、前および後シナプス抑制の機能不全などが関与することは知られていますが、脊髄より上位運動レベルにおける関与については、ほとんど明らかになっていません。また痙縮が出現する骨格筋は、上肢では屈曲筋に、下肢では伸展筋に出現する傾向が高いことから、機能局在を有する上位運動レベルにおける関与が考えられています。特にヒト脳卒中患者では手指屈曲筋に痙縮が強く出現し、重度の巧緻動作障害を呈します。近年、マウスを用いた研究で手指の巧緻動作に脳幹に存在する延髄網様体腹側核(medullary reticular formation ventral part, MdV)が強く関与することが報告されました。そこで、我々は脳梗塞後痙縮発症マウスにおける、痙縮発症後の経時的な脳幹MdVの細胞活動を定量的活動依存的マンガン造影MRI(qAIM-MRI)を用いて測定しました。さらにqAIM-MRIで検出した細胞活動の変化の要因について、組織学的解析により明らかにしました。
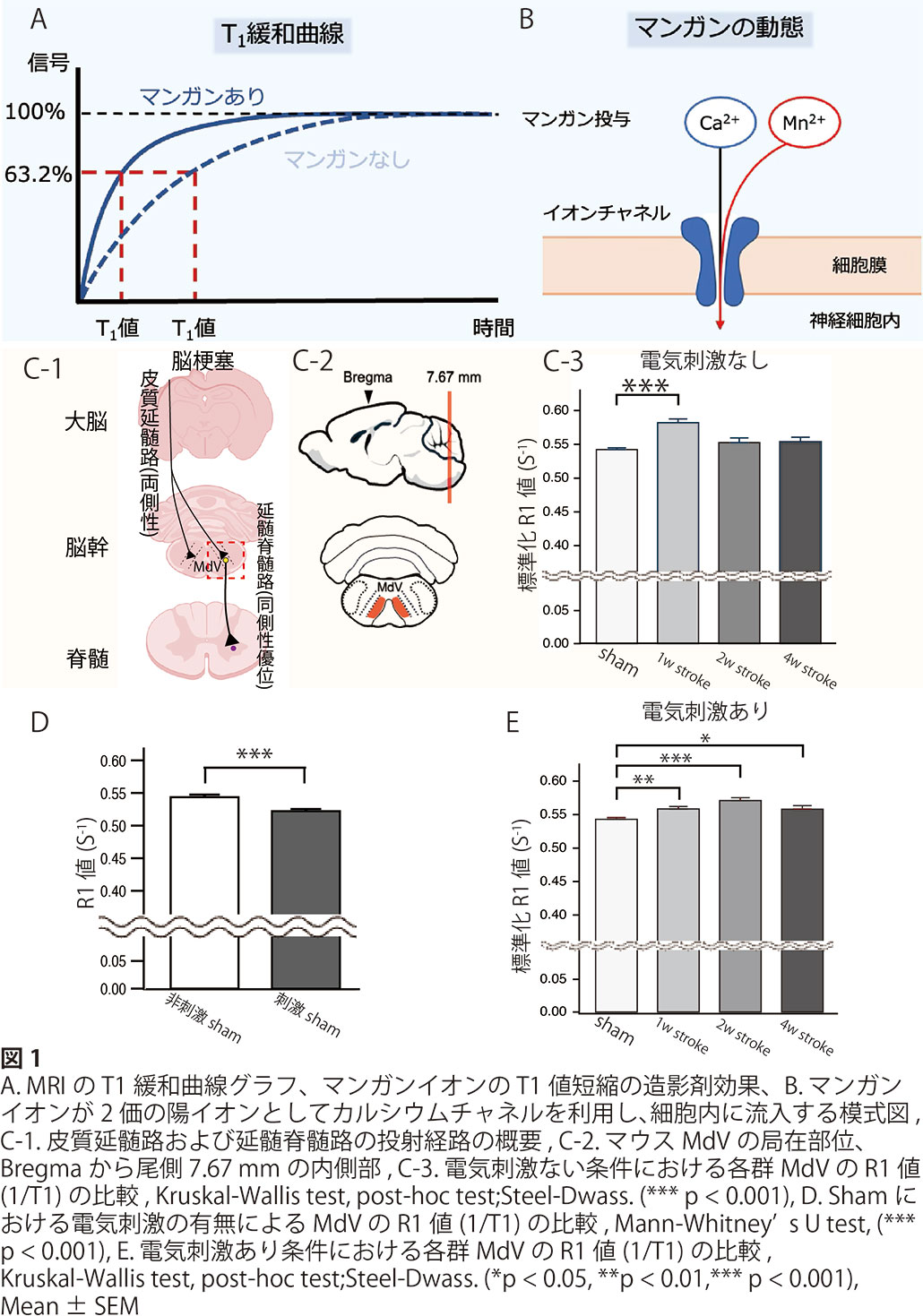
はじめに、マウスの吻側および尾側前肢運動野を光感受性色素rose bengalで血栓を誘発し、脳梗塞を作成し、Hoffman's反射の頻度依存的振幅の減弱(rate dependent depression, RDD)で痙縮を確認しました。脳梗塞後のマウスは、前肢の粗大運動および巧緻動作の機能低下が観察されました。続いて生体下における経時的な細胞活動の変化をqAIM-MRIを用いて測定しました。本測定は、【先端モデル動物支援プラットフォーム(AdAMS)】の支援を受けて実施しました。MRIは、静磁場下におかれ整列したプロトンが、電磁波を加えられることでその軸方向が変化させられ、元に戻る時の情報(核磁気共鳴)を得て画像化したものであり、qAIM-MRIではその縦緩和時間(図1A)を使用します。T1値は組織固有の値であり、プロトンが63.2%に戻るまでの時間を指します。またマンガンはT1強調画像の陽性造影剤としての特性を持ち、さらに2価の陽イオンとして、神経細胞にあるCaイオンチャネルから細胞活動依存的にCa2+が細胞内に取り込まれる際にMn2+も細胞内に取り込まれることから間接的にCa2+の動態、つまり細胞活動の累積量を観察することが可能となります(図1B)。本研究ではqAIM-MRI撮像を、脳梗塞群、sham群に加え、両群に電気刺激の有無を追加しました。痙縮は脊髄伸張反射亢進を呈することから電気刺激により脊髄伸張反射弓を賦活刺激することで、痙縮関連神経領域の活性化を図る目的です。この結果、脳梗塞後1週時点で非損傷側脳幹MdVの細胞は活動性が有意に亢進していることがわかりました(図1C1-3)。さらに、電気刺激で賦活すると、通常ではMdVにおける細胞の活動性は低下(図1D)するのに対し、脳梗塞後は細胞の活動性が脳梗塞後4週にかけて有意に高まることが明らかになりました(図1E)。これは、通常では見られない異常な細胞活動の応答が脳梗塞で生じること意味します。続いてqAIM-MRIで観察された細胞活動が神経細胞であることを確認するために組織学的に解析しました。成熟神経細胞のマーカーとして使用されるNeuNと、神経活動依存的に発現増加するc-Fosを用いて、脳梗塞後の脳幹MdV領域の免疫組織化学染色をおこなった結果、脳梗塞後1および2週で有意にc-Fos陽性神経細胞数が増加していることを確認しました。
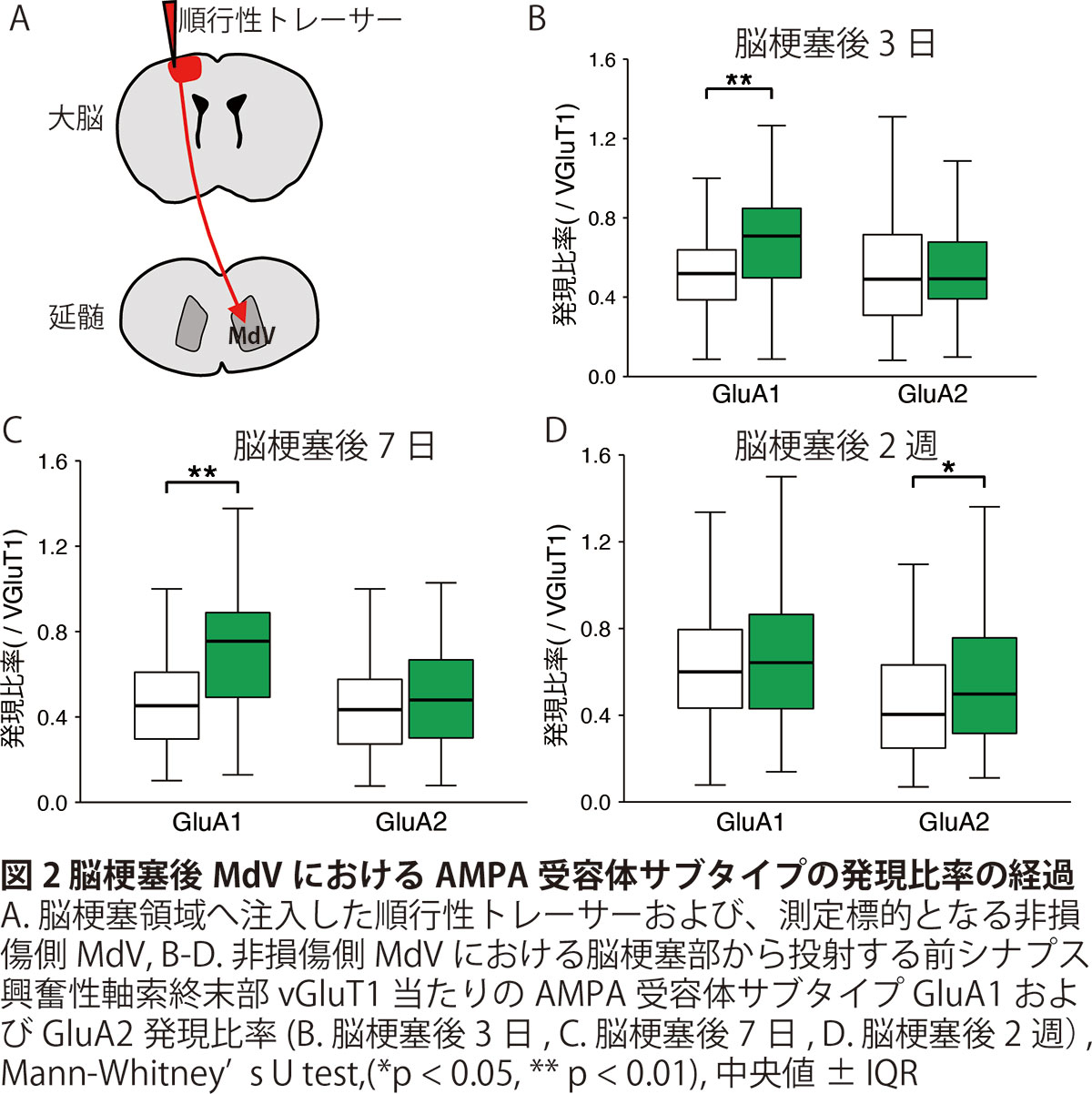
さらに、この神経細胞の活動亢進の要因について、恒常的可塑性(homeostatic plasticity)の関与を確認するために興奮性受容体であるα-amino-3 hydroxy 5 methyl− 4isoxazolepropionic acid (AMPA)受容体のサブタイプであるGluA1およびGluA2の発現変化を確認することとしました。すでに先行研究において、恒常的可塑性を起こした細胞ではGluA1からGluA2にサブユニット比が変化することが報告されております。脳梗塞を起こした大脳皮質5層錐体細胞から対側性に投射している軸索を順行性トレーサーを用いて可視化し(図2A)、非損傷側MdV神経細胞に接続する軸索終末部を小胞性グルタミントランスポーター(vGluT1)で確認し、共局在するGluA1およびGluA2の発現変化を免疫組織化学染色像で半定量的に解析しました。その結果、脳梗塞後3および7日ではAMPA受容体のGluA1サブタイプの発現比率はshamと比較し脳梗塞群で有意に高くなり、脳梗塞後2週時点ではGluA2の発現比率が高くなることがわかりました(図2B-D)。つまり、本現象の要因の一つとして恒常的可塑性が生じていることが示唆されました。
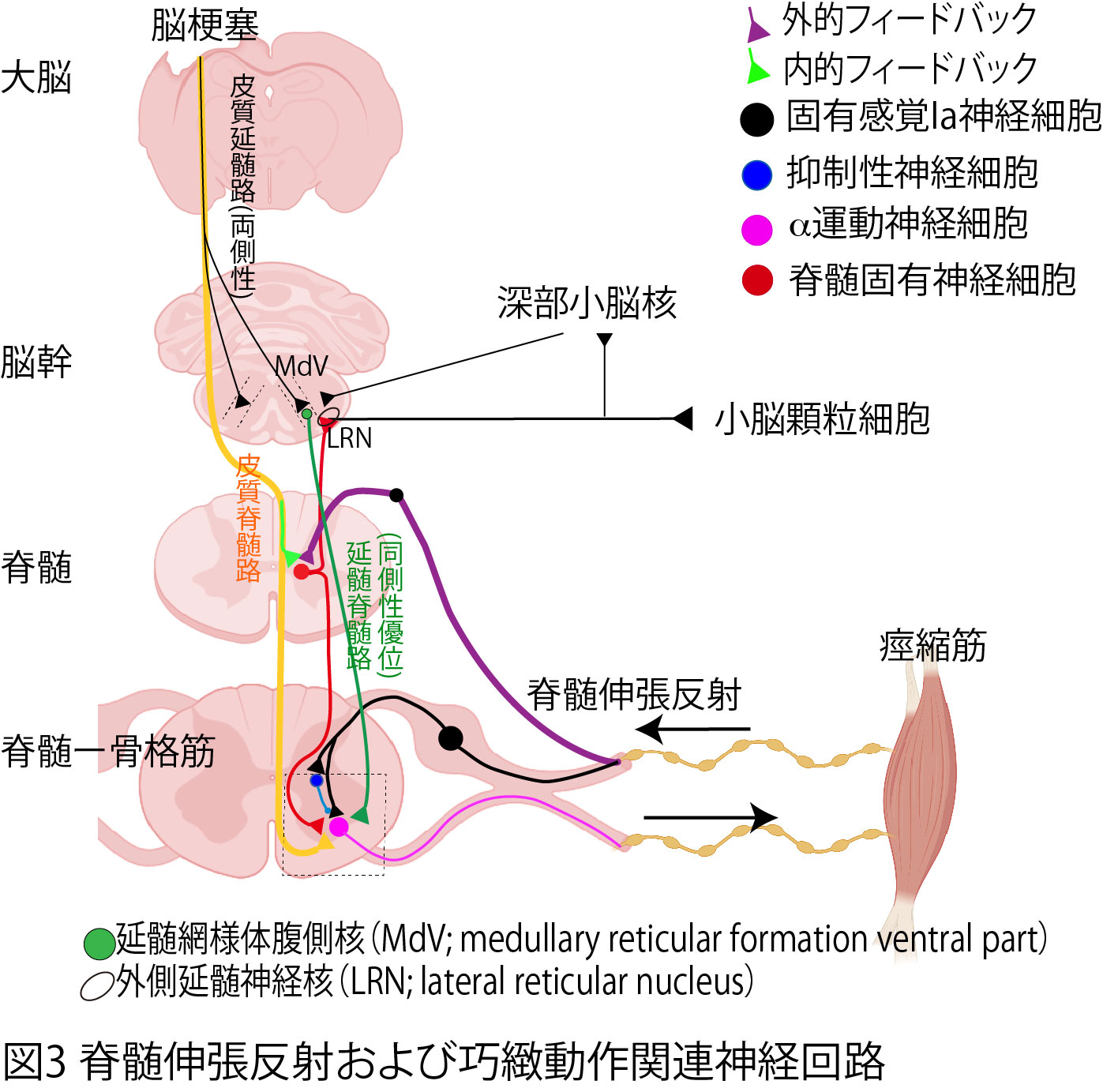
非損傷側MdV神経細胞の脊髄への投射は、同側性優位であり麻痺側に投射し、その8割が興奮性シグナルであることが先行研究より報告されています。今回の結果から、非損傷側MdV神経細胞の活動亢進は、その投射先である麻痺側脊髄運動神経細胞に過剰な興奮性シグナルを送っていると推測され、このことは痙縮病態である可能性が考えられます。またMdV神経細胞は双極性神経細胞である脊髄固有神経細胞を介し、外側延髄神経核(LRN)を経由し、小脳から感覚フィードバック情報を受けることも知られています(図3)。痙縮病態において、脊髄固有神経細胞の活動亢進についての報告があることから、LRNを介した小脳への感覚フィードバック情報も亢進している可能性が考えられます。このことが、本研究において脊髄伸張反射弓の賦活刺激した際のMdV細胞の異常な応答に関連している可能性が考えられます。今後痙縮病態におけるこれらの関与について、確認したいと思います。
最後に、脳卒中後の痙縮病態には上位運動ニューロンの関わりがあり、その一つとして脳幹MdV神経細胞の興奮性亢進が関連している可能性を本研究で初めて明らかになりました。