肺組織由来新規IL-33誘導因子の発見とそのメカニズムにおける解析
兵庫医科大学 安田 好文
Adachi, T., Yasuda, K., Muto, T., Serada, S., Yoshimoto, T., Ishii, KJ., Kuroda, E., Araki, K., Ohmuraya, M., Naka, T. and Nakanishi, K. Lung fibroblasts produce IL-33 in response to stimulation with retinoblastoma-binding protein 9 via production of prostaglandin E2. Int Immunol. 32:637-652 doi: 10.1093/intimm/dxaa031 (2020).
https://doi.org/10.1093/intimm/dxaa031
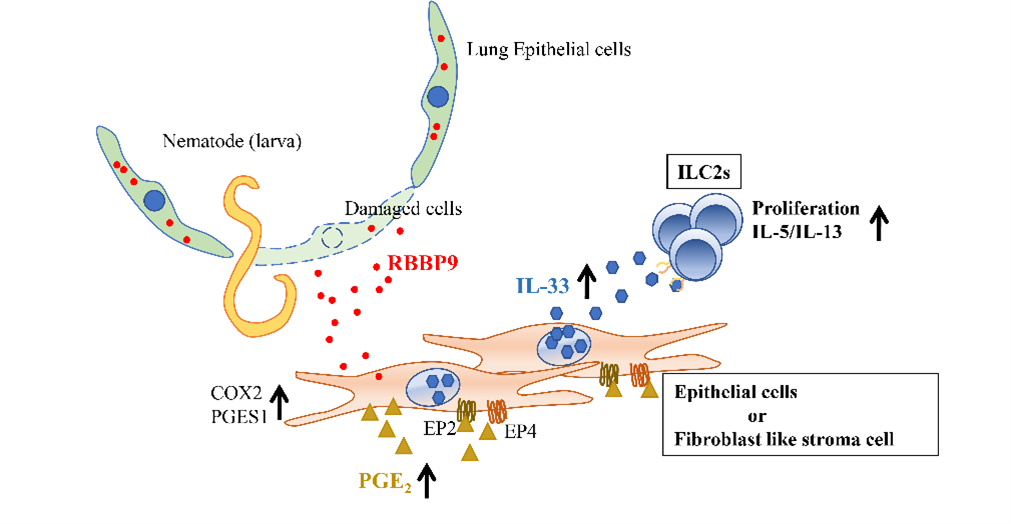
消化管寄生線虫であるStrongyloides venzuelensis(SV)は肺を通過する過程でInterleukin 33(IL-33)の放出を介して肺好酸球性肺炎を誘導しますが、その際の肺におけるIL-33発現誘導メカニズムは未だ明らかになっていません。SV線虫は肺を移動することで顕著な損傷を与えることから、我々は、肺由来のdamage-associated molecular patterns(DAMPs)がIL-33発現誘導活性(IL33ia)を持っていると推測しました。実際、肺抽出物を鼻腔内投与することで、肺におけるIL-33の発現が誘導されました。さらに、肺抽出物は、初代培養肺線維芽細胞におけるIL-33のmRNAの発現上昇を促しました。プロテオミクス分析により、Retinoblastoma-binding Protein 9(RBBP9)がIL33iaの主要なDAMPsの一つであることが確認されました。 RBBP9はもともと、トランスフォーミング成長因子(TGF)-β1の成長阻害効果に対する耐性を細胞に与えるタンパク質として発見されました。本研究で我々は、RBBP9の細胞外からの刺激が、初代培養線維芽細胞においてプロスタグランジンE2(PGE2)の産生を促し、その結果、同細胞に対してPGE2がオートクライン、もしくはパラクライン的に働くことでIL-33の発現が誘導されることを発見しました。 RBBP9で活性化された初代培養線維芽細胞は、アラキドン酸をPGE2に変換するシクロオキシゲナーゼ-2(COX-2)およびPGE2シンターゼ-1のmRNAを発現しました。さらに、同細胞はPGE2受容体E-プロスタノイド(EP)2およびEP4を発現しました。そこで、COX-2阻害剤またはEP2またはEP4受容体拮抗薬で同細胞を前処理すると、RBBP9によるIL-33発現誘導が顕著に抑制されました。SV線虫感染マウスモデルでは肺の組織において著しいIL-33のmRNA発現が誘導されますが、これはCOX-2阻害剤またはEP2およびEP4アンタゴニストによって阻害されるため、SV線虫感染がPGE2のシグナルを介して肺のIL-33のmRNAを誘導したことを示唆しています。 RBBP9は定常状態の肺で恒常的に発現し、SV線虫感染による組織傷害で放出され、周囲の細胞に作用すると考えられます。このたびAdAMS の⽀援(モデル動物作製⽀援)を受け、作製して頂いたRbbp9欠損マウスでは、野生型マウスと比べて線虫感染後の肺のIL-33のmRNA発現を上昇させる能力が低下していることがわかりました。本研究の結果から、SV線虫の感染に際し損傷した肺から放出されるRBBP9などのDAMPsによって活性化されるPGE2-EP2/EP4経路は、マウスの肺でのIL-33産生を誘導することで、SV線虫の排除に関わる2型自然リンパ球(ILC2)の活性化に伴ったIL-5、IL-13の産生を代表とする2型炎症応答の惹起において重要な役割を持つことが明らかになりました。