AYA世代の希少がん「間葉性軟骨肉腫」のモデル化に成功
~融合遺伝子HEY1-NCOA2による細胞分化と発がんの関係を解明し、治療に効果のある薬剤を発見~
公益財団法人がん研究会 がん研究所
田中 美和
Tanaka M, Homme M, Teramura Y, Kumegawa K, Yamazaki Y, Yamashita K, Osato M, Maruyama R, Nakamura T.
HEY1-NCOA2 expression modulates chondrogenic differentiation and induces mesenchymal chondrosarcoma in mice.
JCI Insight, 8(10): e160279 (2023). doi: 10.1172/jci.insight.160279
https://insight.jci.org/articles/view/160279
【研究の背景】
骨軟部肉腫はがん全体の1%程度を占める希少がんですが、さらに50以上の異なる性質の腫瘍に細分化されることから、個々の肉腫の診断や治療には高度の専門性と、それぞれの疾患特有の病態に対する正確な知識が要求されます。間葉性軟骨肉腫もその一つで、AYA世代に発生する悪性度の高い予後不良で有効な治療薬のない腫瘍として、疾患の正しい理解を通した治療法開発が待たれている疾患です。そのためには生体内で病態を正確に再現する動物モデルが不可欠です。しかしながら、本疾患では原因遺伝子を導入して腫瘍の発生機構を解き明かすモデル系がこれまで存在しなかったことから、HEY1-NCOA2の発現がどうして発生期の軟骨分化を模倣しながら悪性化を惹起させるのか、多くの不明点が存在していました。
【本研究で得られた結果】
今回研究チームは、世界で初めてとなるHEY1-NCOA2の遺伝子導入モデルを作製することに成功しました。間葉性軟骨肉腫の特徴とされる未分化間葉性細胞と硝子軟骨の二層性構造が正確に再現されるとともに、軟骨発生に特徴的な制御因子や構造蛋白、マーカー分子の発現も示されました。さらに腫瘍から単一細胞に分離してRNAシークエンシングを行うと、腫瘍の分化経路を辿ることが可能となり、それぞれのコンパートメントに対応する軟骨分化関連遺伝子との関係性が明らかになりました。
軟骨の分化は、SOX9やRUNXファミリー、HEY/HESファミリーといった転写因子による遺伝子の発現調節を介して制御されています。間葉性軟骨肉腫では、SOX9とRUNX2が腫瘍細胞全体に、HEY1が未分化細胞に強く発現され、HEY1-NCOA2と共存していることが分かりました。HEY1-NCOA2はエンハンサーにしばしば結合して内在性HEY1の発現をドライブするとともに、DNAへの結合に際してRUNX2と複合体を形成していることがわかり、新たな転写ネットワークの存在が示唆されました。間葉性軟骨肉腫でRUNX2をノックアウトすると、成熟軟骨成分が消失し悪性度が高くなることから、RUNX2とHEY1のバランスが本腫瘍の形態と悪性化に重要である可能性も考えられました(図)。
間葉性軟骨肉腫には現状では効果のある薬剤はあまり知られていません。今回「分子プロファイリング支援」の化合物ライブラリーを用いて、我々のモデルでスクリーニングを行った結果、ヒストン脱アセチル化酵素(HDAC)阻害薬の一つであるパノビノスタットが有効であることがわかりました。難治性である本疾患の治療に有用な情報を提供する成果と考えられます。
【今後の展望】
間葉性軟骨肉腫は、その希少性から外科的切除以外の治療法は確立していません。今回、新たなプレクリニカルモデルを創出したことは、既存治療薬の評価や創薬につながるものと期待されます。軟骨発生と分化における転写ネットワークの重要性は知られているところですが、原因融合遺伝子HEY1-NCOA2による干渉作用を明らかにしたことは、軟骨の再生や炎症・老化といった病態の解明にも資するものと考えられます。
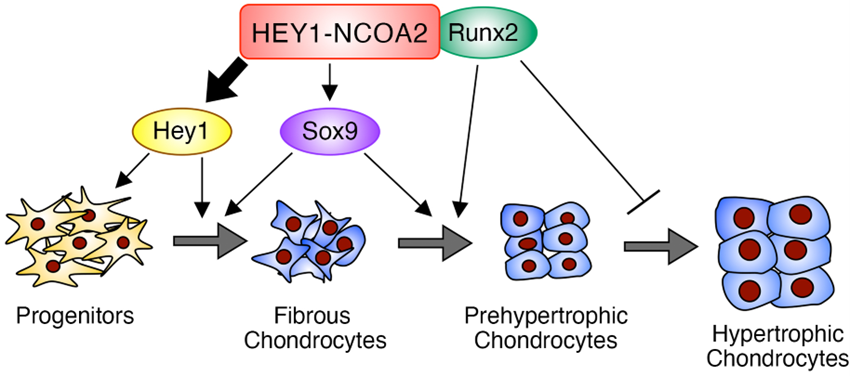
図:軟骨発生におけるHEY1-NCOA2の転写ネットワークへの干渉作用

