Protein Kinase C delta (PKCδ) ノックアウトマウスの解析
―PKCδの欠損はマウス胎児の発育を阻害し、成体PKC ノックアウトマウスの心臓弾性線維過形成および肺炎症に関連しているー
大東文化大学 新野由子
Yuko S. Niino, Ikuo Kawashima, Yoshinobu Iguchi, Hiroaki Kanda, Kiyoshi Ogura, Kaoru Mita-Yoshida, Tomio Ono, Maya Yamazaki, Kenji Sakimura, Satomi Yogosawa, Kiyotsugu Yoshida, Seiji Shioda, Takaya Gotoh
PKCδ deficiency inhibits fetal development and is associated with heart elastic fiber hyperplasia and lung inflammation in adult PKCδ knockout mice.
PLoS One. 2021 Jul 1;16(7):e0253912. doi: 10.1371/journal.pone.0253912.
PMID: 34197550; PMCID: PMC8248728.
https://doi.org/10.1371/journal.pone.0253912
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0253912
Protein kinaseC(PKC)は1977年に西塚らによって同定されたCaとリン脂質依存性のセリン/スレオニンキナーゼで、細胞内のシグナル情報伝達において様々な機能を持つ重要な分子であることが古くから知られている。PKCはその構造と活性化機構からconventional PKC (cPKC)、novel PKC (nPKC)、atypical PKC (aPKC)の3つのグループに分かれている。
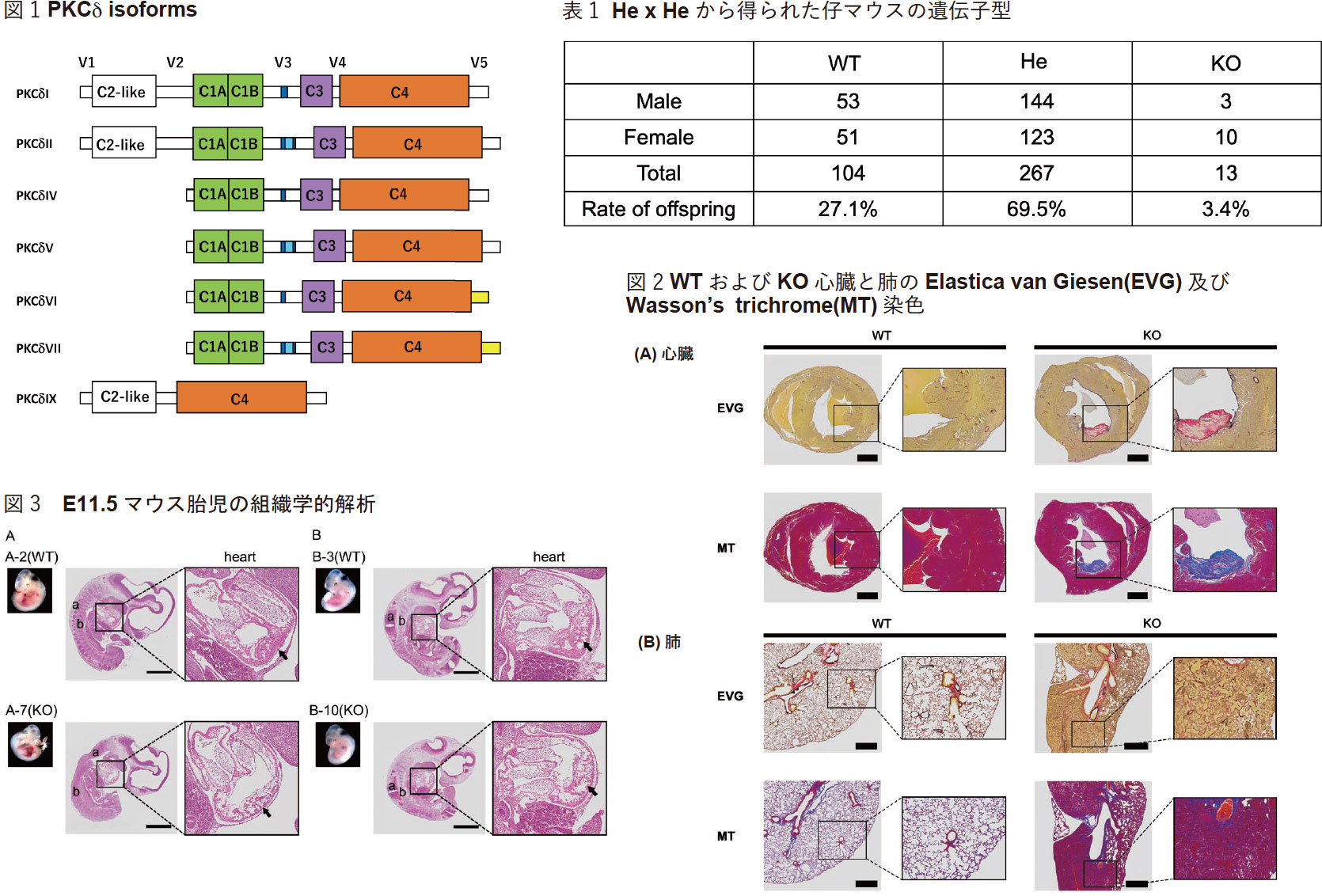
我々が研究しているPKCδはnPKC グループに属し、1つの遺伝子から複数のスプライシングバリアントが生成される(図1)。最初に報告されたPKC Iは、 様々な組織及び細胞に普遍的に存在しており、細胞増殖、Apoptosis、腫瘍抑制、cell migrationなど多くの現象に関わりを持つキナーゼとして知られて来た。マウスでは、PKCδI, IV, VIにCaspase-3認識配列が存在しており、PKCδII, V, VIIはそれぞれPKCδI, IV, VIのCaspase-3認識配列にフレームシフトを伴わない配列が挿入した構造になっている。
今回、PKCδの機能を網羅的に解析するために、すべての分子種(本研究開始時にはPKCδIXは報告されていなかった)に共通するエキソン(exon 7)を欠損するノックアウトマウスを作出した。PKCδ遺伝子exon7の上下流域にLoxPを配置し、C57BL/6N の ES cell lineであるRENKAを用い、PKCδI, II, IV, V, VI, VII分子種を欠損可能なコンディショナルノックアウトマウス(PKCδ flox mice)を作出した。全身でPKCδを欠損するマウス作出のため、このマウスから遺伝子型ヘテロマウス(He)を作出・維持した。Heマウスの交配で得られた384匹の仔マウスの離乳時の遺伝子型はメンデルの法則には従っておらず、本来なら25%を占めるはずのホモノックアウトマウス(KO)は、3.4%しかいなかった(表1)。KOマウス4匹を解剖したところ、脾臓はすべて野生型(WT)の物より肥大しており、心臓はPKCδ KOマウスの4例中3例が肥大しており、肺は4例中3例に硬化性の変形が観察された。これらの臓器の組織学的解析を行うと、KOマウス4例中2例の心臓に石灰化が見られ、4例中3例の肺に含気不良を示す炎症が観察された。心臓で石灰化が認められたマウス切片をElastica van Gieson stain (EVG)とMasson's Trichrome Stain (MT)を行ったところ、WTマウスの心臓に比べ、KOでは明らかな弾性繊維の増成が見られた(図2A)。ただし、この心臓内膜の弾性繊維の増成と石灰化はPKCδ KO マウス4匹中2匹の心臓において見られた所見であり、これが有意な変化であるかどうかは断定できない。肺については、KOはWTと比較して肺胞内に好酸性の浸出物とマクロファージが目立ち、また、円形細胞浸潤も強かった。マクロファージは気管支内にも見られた。肺には強いうっ血と炎症があったが、線維の増生は目立たず、肺のこの所見は心機能低下から起きた変化が疑われると思われた(図2B)。
PKCδ He mice同士の交配からPKCδ KO miceが約3.4%しか産まれない事実はなぜ起きたのかを検証するために、embryonic day11.5 (E11.5)の胎児を解析した。全胎児(104)の遺伝子型はWT:He:KO=22 (21.2%) : 58 (55.8%) : 24 (23.1%)であり、メンデルの法則に極めて近い値だったことから、受精、初期卵割、着床(胎盤確認済み)には問題のないことが示唆された。しかし、E11.5の段階で、すでに死亡していた胎児(吸収されている、吸収されている途中のもの、心拍のないもの)の割合は、着床数に対して、WT, 6/22=27.3%; He, 6/58=10.3%; KO, 17/24=70.8%であり、PKCδKOマウス胎児の死亡率は突出していた。PKCδKOマウスの胎児は、着床の割合は全体の23.1%あったものの、E11.5のときの生存率は9.3%となり、出生後4週令では3.4%にまで落ちた。E11.5で心拍がみとめられていたKO胎児を組織学的に観察すると、PKCδKOの胎児はWTに比べ全体的に少し小さく、発生学的には全体的に細胞増殖が悪い状態であり、特に硬節、脊髄、心室等の臓器が未熟だった。心室では構造がまだ単純で、硬節も構造が成熟していないものが認められた(図3)。E11.5のPKCδKOマウスは全体に発生状態が悪く、その死因は特定の臓器の異常に求めるよりは、全体の生育不良と考えるべきだと考えた。この結果はPKCδ分子を欠如することが胎児の発育に大きなダメージがあることを示している。
PKCδKOマウスの作出により、胎児の成長および生体におけるPKCδ分子の重要性が明らかになってきた。本研究を進めるに当たり、先端モデル動物支援プラットフォームの支援を受け、専門性の高い組織学的解析が可能になりました。心から感謝致します。
※なお本稿の図は、(公財)東京都医学総合研究所 基盤技術支援センター 研究技術開発室 中央映像室のご協力により作成しました。