星細胞腫グレード3(退形成性星細胞腫 anaplastic astrocytoma)
- 「たいけいせいせい せいさいぼうしゅ」と読みます
- WHO 2021年分類では「退形成性星細胞腫」の名前が廃されて,星細胞腫グレード3と呼ぶことになりました
- グレード3の悪性腫瘍です
- 星細胞系腫瘍の仲間です
- 業界用語で,anaplastic astrocytomaですからAA エイエイ といいます
- IDH変異があるものでの発症年齢中央値は36歳です
- 大脳に多いのですが,小脳に発生することもあります
- 世界的に確立された標準治療は,手術摘出の後で,局所放射線治療,テモダール化学療法です
- 「治る」という期待がもてるグリオーマです
- IDH変異をシークエンスでしっかり調べると,びまん性星細胞腫グレード2に近い性質の腫瘍と言えます
- 再発時には,組織像での悪性度が増して膠芽腫に変化することがあります,IDH変異が保たれていれば IDH-mutant astrocytoma WHO grade 4と呼びます
診断と治療の基本的な考え方は,星細胞系腫瘍のところにあります
(ここをクリック)
日本での治療方法は,ほとんど膠芽腫と同じですが,間違っているかもしれません(ここをクリック)
治療の前に,IDH遺伝子変異,IDH 1/2 mutationを必ず調べます
- IDH1/IDH2遺伝子の変異 mutation があります
- もしIDHが野生型 wild-typeであれば,臨床的には膠芽腫グレード4です
- 2021年時点では,野生型は,IDH wild-type astrocytoma WHO grade 4といい,退形成性星細胞腫から除外ます
MGMTのメチレーション
- 英語で,promoter methylation of the O6- methyguanine methyltransferase (MGMT) gene
- MGMT遺伝子のメチレーションがあることが証明できれば,テモダール化学療法や放射線治療がよく効くということを示します
- 長い生存期間が期待できます
- 退形成性星細胞腫では一番大切な病理所見ですが,だからといって治療方法が変わるわけでもないので,調べることが必須ではありません,調べなくてもよい
MRI画像でのびまん性星細胞腫との違い
- 浸潤能が高い傾向があります
- 白質に沿って近傍の脳により広く広がって行きます
- ガドリニウムで部分的に増強されることが多いです
diffuse, infiltrative びまん性のもの
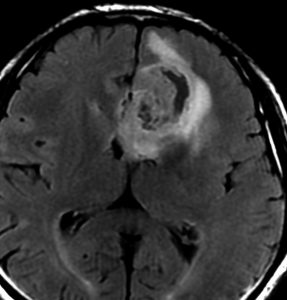
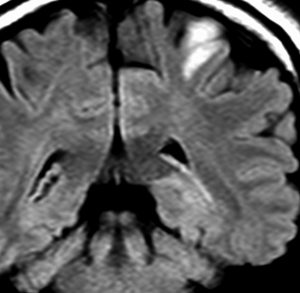
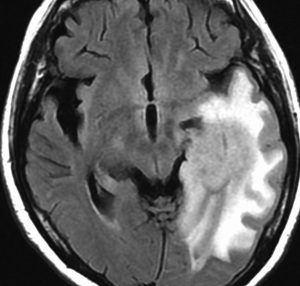
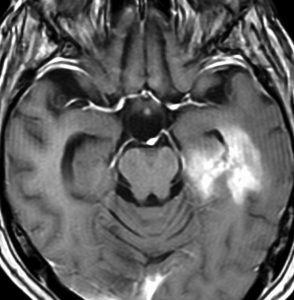
染み込むように左前頭側頭葉から島回に広がるAAです。T2/フレア像でにじむように広がり,ガドリニウム増強されません。グレード 2 (びまん性星細胞腫)と区別が難しいものです。
もちろん手術摘出できないもので,生検手術のみを行います。この大きさのものに60グレイの放射線治療をすれば高度の認知機能低下は避けられませんから,患者さんと照射線量をよくよく相談します。でもAAは放射線化学療法で長期生存が望めます。50-54グレイの線量が選択されます。
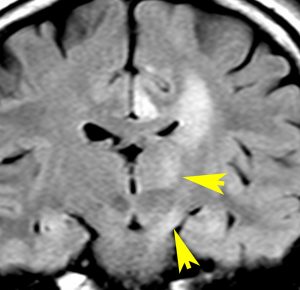
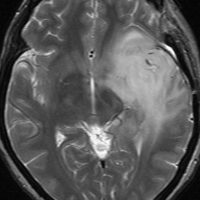
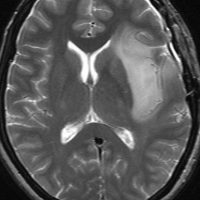
expanding, solid 固形腫瘍的なもの
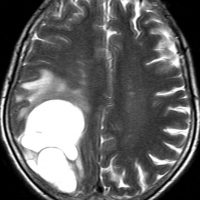
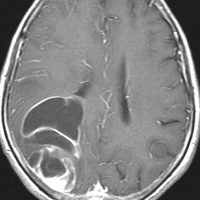
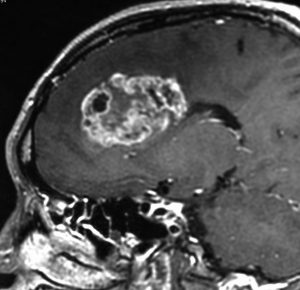
壊死ではない「のう胞」を伴い,ガドリニウムで強く増強されます。グレード 4 (膠芽腫)と間違えるようなものです。しかし,のう胞はありますが中心壊死がありません。
腫瘍を大部分摘出できるので,積極的な摘出術をして,手術後には放射線化学療法を加えます。この例では,手術後の放射線治療計画の領域が狭ければ,60グレイを使用できる部位です。
治療法の概略
- 可能な限り手術で摘出します(全部は絶対にとれません)maximal safe resection
- 手術後に病理診断が出たら,腫瘍の部分とその周辺2cmくらいの正常に見える脳の領域を含んで局所分割放射線治療をします
- これまでの放射線治療は60グレイ 30分割(1日2グレイ)でしたが,近年は少し減量されて59.4グレイ 33分割(1日1.8グレイ)です
- 1日線量1.8グレイの方が汎用される傾向にあります
- でも長期生存における認知機能を考慮すれば正直これはきつい!
- 1日2グレイだと27回,6週間,総線量54グレイくらいが適切でしょう
- 退形成性星細胞腫の患者さんは長期生存あるいは治癒する人がいます
- 広範囲の60グレイでは5年後くらいの認知機能/高次脳機能がかなり落ちます
- 腫瘍の発生した部位によっては,広範囲高線量照射で治った後で社会復帰をして,その後に会社を辞める,家庭生活を失うことになる患者さんがいます,長く患者さんをみていると哀しいこともあります
- 腫瘍のできた部位によっては放射線量を減らすことも必要です
- 放射線治療中に,テモゾロマイドという制癌剤を毎日 75mg/m2 飲みます
- 治療が終わってからも4週間に5日間だけテモゾロマイド 100mg-200mg/m2 を服用します
- これを24ヶ月くらい継続します
- 放射線治療中のテモゾロマイドが無益という大規模研究の中間結果もありますが,2021年,現時点では投与するという方向で良いでしょう
- 2021年CATNONは,24コースのテモゾロマイドが生存期間中央値を82.3ヶ月まで延長すると報告しました
- テモゾロマイド治療中でも,外来通院で服用しながら働くことができます
膠芽腫との違い
- 膠芽腫との違いで意識しなければならないのは,退形成性星細胞腫では長期生存例(10年を超えるあるいは治癒する)があることです
- ですから,社会復帰に希望をいだいて治療する場合には,放射線治療の強度をなるべく落とす必要があります
- 放射線治療の線量と照射範囲が広いと,認知機能(高次脳機能)の低下が何年もかかってゆっくり進行します
- 日本で多用されいている膠芽腫とおなじような60グレイを用いると,照射された部分の脳機能はかなり落ちますので,54グレイ以下に抑えることがポイントです
- 54グレイでも両側前頭葉や大脳半球の3分の2くらいに及ぶ照射野は避けて,腫瘍のコアだけにして周辺線量を50グレイ程度に落とすということもします
- 「60グレイ当てないと再発して助からないかもしれない」担当の先生には言われるかもしれません,それはそうなのですが—-
予後
- 生存期間中央値は6-7年です
- でも治ってしまって数十年という患者さんもいます,そこが膠芽腫との大きな違いです
- 再発した時には膠芽腫グレード4になっていることがありますが,でも退形成性星細胞腫グレード3のままであればまた再治療しても長期生存が期待できます
もし再発したら
- 世界標準といえる治療法はありませんから,個々の患者さんの治療歴と病態を考えて相談しながら行うことになります
- まず,手術摘出できるかどうか考えます
- 再手術してみると,IDH-mutant 退形成性星細胞腫のままで再治療がとても有効なこともあり,一方で膠芽腫グレード4に悪性化していて再治療が難しいこともあります
- 初回の放射線治療から12ヶ月以上経過していれば,再照射(追加照射)ができるか検討します
- MGMTメチレーションがある例では,テモゾロマイドの再投与が有効です
- 初回治療で化学療法が行われていない患者さんでは,テモゾロマイドあるいはニトロソウレア剤(日本ではニドラン)の投与を考慮します
- アバスチン投与で無増悪生存期間が数ヶ月伸びるという成績がありましたが,2018年には否定的な論文が出ました,ガドリニウム増強される腫瘍が増大している時や脳浮腫が強い時には使用します
焼尻島のサフォーク羊,とてもおいしい
ここから下は難しい
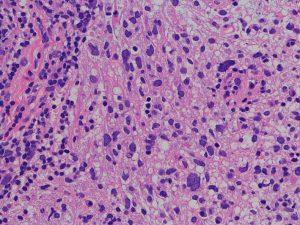
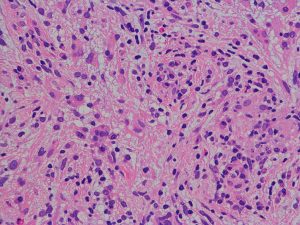
退形成性星細胞腫の病理組織
- びまん性星細胞腫と膠芽腫との中間の所見です
- 膠芽腫との違いは,腫瘍細胞が死んでいる部分(壊死 necrosis)がないことが最大の特長です
- びまん性星細胞腫との違いは,細胞核の異型性 anaplastyと分裂能の高さです,核の大きさが大小不同で歪んだ形をしています
- 画像で見えるよりかなり広範囲に広がっていて single cell infiltrationといいます
核の異型性,多核細胞が目立つ例です。グレード3の典型例です。
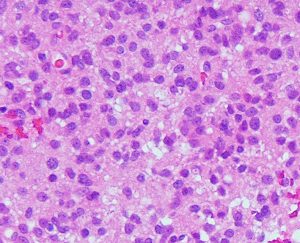
核異型性は乏しいのですが,細胞密度が高い例で,MIB-1染色率は12%です。グレード2と鑑別しづらいことがしばしばです。核分裂が散見されたりMIB-1染色率が高い場合はグレード3として治療をしたほうがいいでしょう。
悪性転化 malignant transformation,膠芽腫への進展 progression
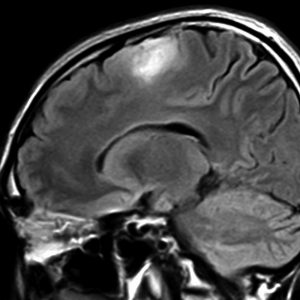
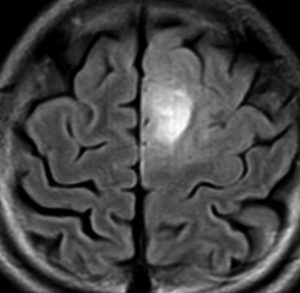
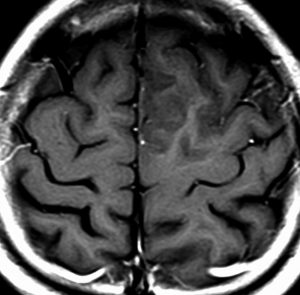
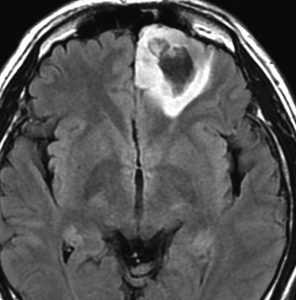
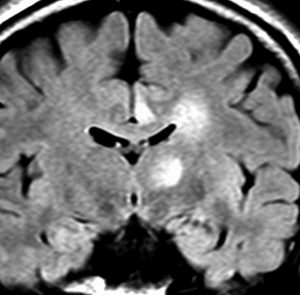
40代の患者さんです。夜間睡眠中の全般発作(症候性てんかん)で発症しました。フレア画像で左上前頭回に滲むような高信号領域(白い部分)がみられます。右側はガドリニウム増強MRIですが,全く増強されません。グレード2か3の星細胞腫あるいは乏突起膠腫を疑います。白く滲むような領域はよく見るとかなり広範囲に広がっています。
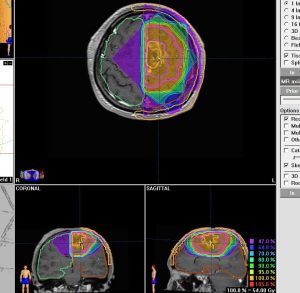
画像上では全摘出 gross total removalできて,病理診断は,退形成性乏突起星細胞腫 anaplastic oligoastrocytomaでした。IDH変異あり,1p/19q欠失なしです。現在の診断なら,退形成性星細胞腫 グレード3です。
手術後に54グレイの広範囲な局所放射線治療とテモゾロマイド化学療法を行いました。左の画像は放射線治療計画の時の線量分布図です。
5年後にいきなり激しい再発を生じました。再発部位は,放射線照射野外 out-of-fieldの前頭部帯状回でした。手術前に急速に増大して,画像所見も初回と全く違いました。摘出後の病理は,IDH1/2 wild type, 1p/19q intact, ATRX negative, MGMT met negative, MIB-1 40%という典型的な膠芽腫の所見でした。
この例とは異なって,退形成性星細胞腫の再発時には,IDH mutantのままの方が多いです。もしかすると先行した放射線誘発膠芽腫かもしれません。
anaplastic astrocytoma,IDH-wildtype IDH 野生型
- この分類は2021年になくなりました
- びまん性に広範浸潤する星細胞腫で,一部あるいは全体的に核の異型性と顕著な増殖活性を有する腫瘍です
- IDH変異型より高い年齢層に発生します
- 2020年までのWHO分類教書では,組織診断による退形成性星細胞腫の20%程度がIDH wild-typeと記載されていました
- 遺伝子解析では膠芽腫に近似したmolecular featuresを有します
- また,正中に位置するものでは,H3 K27M-mutant glioma (びまん性正中グリオーマ)に類似するとされます
- 臨床経過はグレード4ですが,組織像によるグレード分類は “3” です
- このタイプにはテモゾロマイドが有効ではないとされます
- ものすごく広い領域に広がっているものをグリオマトーシス gliomatosisといいます
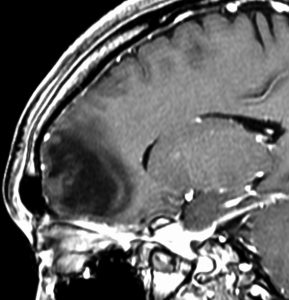
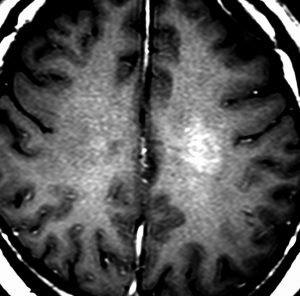
無症状で発見された若年成人の左前頭葉グリオーマです。ガドリニウム(右側)では全く増強されません。手術で全摘出しました。組織像は退形成性星細胞腫でした。壊死も血管内皮増生,多核巨細胞なし,核の腫大,形不整,多形成あり,免疫組織染色とシークエンスともにIDH野生型,1p/19q共欠失なし,MIB-1染色率 10%,nuclearATRX欠失。
この例を,グレード3とするかグレード4とするかの定義はありません。
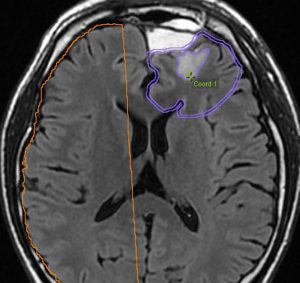
膠芽腫グレード4に準じた治療を行いました。拡大局所50Gy/25fr, 局所10Gy/5frとテモゾロマイド併用の初期治療とテモゾロマイド維持療法2年間でした。
7年後のMRIには再発はありませんでした。
振り返って見れば,この例はIDH野生型だけど,きっと星細胞腫グレード3だったんでしょう。
グリオマトーシス gliomatosisのような例
病理組織診断で退形成性星細胞腫 WHO grade IIIとされるものに,全く違った性質を示すグリオーマがあります。
ゆっくり進行する軽い右麻痺で発症した50歳くらいの患者さんです。脳梗塞や脱髄疾患を疑われていました。左頭頂部皮質下から脳梁,内包,中脳大脳脚まで非常に広範囲に浸潤しています。single cell infiltrationという浸潤形態を想像させます。右下はT!ガドリニウム造影で,この部分だけが増強所見があります。
おそらく今後は,diffuse hemispheric glioma WHO grade 4と診断されます。
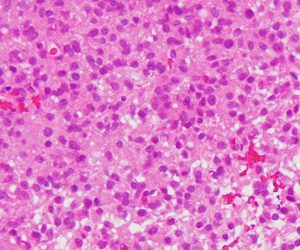
軽度の異型性を認め,細胞密度が高く核分裂が目立ち,Ki-67 (MIB)染色率は20%に達しました。1p/19q欠失はなくMGMTメチレーションもありませんでした。IDH変異は調べていない年代の例で不明です。病理組織診断でanaplastic astrocytomaとされました。治療は,全脳に近い照射野となるので50Gy/25分割が限界でした。TMZを併用しています。
照射後も症状は一度も改善することなく悪化して,数ヶ月後にはもともと腫瘍が見えなかった内側側頭葉に大きな腫瘍塊が発生増大しました。この例は退形成性星細胞腫と診断するしかなかったものですが,2020年時点でははっきり分類できない星細胞系腫瘍です。
wild-type AAやこのような例が分子診断で徐々に除かれていけば,退形成性星細胞腫 IDH mutantの予後はかなり良いものと理解されてくるのかもしれません。
文献情報
退形成性星細胞腫にはテモゾロマイドだけが有効
van den Bent MJ: Adjuvant and concurrent temozolomide for 1p/19q non-co-deleted anaplastic glioma (CATNON; EORTC study 26053-22054): second interim analysis of a randomised, open-label, phase 3 study. Lancet Oncol 2021
CATNONトライアルの中間報告で,正確にはIDH変異ありかつ1p/19q共欠失がないグレード3のグリオーマが対象です。放射線治療は3D-conformal RTかIMRT 59.4Gy/33frです。751例が登録され,追跡期間中央値56ヶ月です。放射線治療中にテモゾロマイドが投与されると全生存期間 OSは66.9ヶ月,投与なしで60.4ヶ月で有意差がなくて無益とのことです。一方で,放射線治療後の24コースのテモゾロマイド補助療法(維持化学療法)は有益であり,82.3ヶ月のOSが得られました。テモゾロマイドなしでは46.9ヶ月です。
IDH wild-type グレード3のグリオーマにはテモゾロマイドが有効ではない
van den Bent, M: ACTR-11. Second interim and 1st molecular analysis of the EORTC randomized phase III intergroup CATNON trial on concurrent and adjuvant temozolomide in anaplastic glioma without 1p/19q codeletion. Neuro Oncol 2019
751例の1p/19q欠失のないグレード3に対する試験です。59.4グレイの放射線治療にテモゾロマイドが加えられました。生存期間中央値は,IDH wild-typeでは19ヶ月,mutantでは116ヶ月でした。極端に言えば1年と10年の開きがありました。テモゾロマイド維持療法はwild typeには有効性がないと結論しています。
CDKN2A共欠失は高悪性度グリオーマのの予後不良因子
CDKN2A homozygous deletion is a strong adverse prognosis factor in diffuse malignant IDH-mutant gliomas. Neuro Oncol 2019
IDH変異があるグレード3か4の高悪性度グリオーマ911例でCDKN2A cyclin-dependent kinase inhibitor 2Aの欠失が調べられました。組織診断で言えば,膠芽腫IDHmutant 216例,退形成性星細胞腫 212例,退形成性乏突起膠腫 483例です。それぞれの組織型において,CDKN2Aがあると予後 PFS, OS が有意に悪いとの結論です。加えて病理所見で微小血管増殖像 microvascular proliferationがあると予後が悪いとしています。
膠芽腫はともかく,退形成性星細胞腫と退形成性乏突起膠腫には予後の大きく違う群がありました。その予後判別の目安となる遺伝子異常と捉えられます。
再発時にアバスチンを使用しても効果がない
van den Bent MJ, et al.: Bevacizumab and temozolomide in patients with first recurrence of WHO grade II and III glioma, without 1p/19q co-deletion (TAVAREC): a randomised controlled phase 2 EORTC trial. Lancet Oncol. 2018
grade 2か3で1p/19q欠失がない,びまん性星細胞腫か退形成性星細胞腫の再発です。登録条件としてガドリニウム増強初見を伴う再発と書かれているので,基本的にはアバスチンが聞きそうな例です。155人の患者さんが無作為第2相試験を受けました。2週に一度アバスチン10mg/kg1の投与です。再発治療開始後12ヶ月生存割合は,テモゾロマイド単独で61%,アバスチンを加えた群で55%でした。有害事象も多く,再発にはアバスチンを使用しないと結論されています。
放射線治療にテモゾロマイドを併用した方がいい
van den Bent M, et al .: Interim results from the CATNON trial (EORTC study 26053-22054) of treatment with concurrentand adjuvant temozolomide for 1p/19q non-co-deleted anaplastic glioma: a phase 3, randomised, open-label intergroup study. Lancet 2017
1p/19q non-co-deleted anaplastic glioma(ほとんど退形成性星細胞腫)745例の臨床試験の中間報告です。放射線治療にテモゾロマイドを併用した群で5年生存割合が56%,使用しないと44%という結果です。テモゾロマイドの維持療法は12コース行われています。
再発した退形成性星細胞腫に対する治験薬
2017年米国でエフロルニチンという薬剤の臨床第3相試験が行われています。ここで興味があるのはロムスチン CCNUがコントロールアームとして使用されていることです。ロムスチンは単独でも再発退形成性星細胞腫に多少の有効性があります。古い安価な飲み薬ですが日本では使用できません。
変異型IDH1選択的阻害剤(DS-1001)の臨床試験
2017年11月時点で,IDH mutationのある退形成性星細胞腫に対する治験が日本で行われています。変異型イソクエン酸脱水素酵素 mutant IDH1に対する選択的阻害剤(DS-1001)を用いるもので,臨床第1相試験です。主に薬剤毒性を調べる段階の治験であり,効果はまだまったく不明です。
生存割合
Smoll NR: Incidence and relative survival of anaplastic astrocytomas. Neuro Oncol. 2014
3,202例の統計で,退形成性星細胞腫の5年全生存割合は23.6%であったそうです。文献では30-40%とされているのですが,これは臨床試験などで治療が十分にできた群の治療成績であるといえます。
DIHが野生型ならアルキル化剤が有効かもしれない
Wick W, Meisner C, Hentschel B, et al. Prognostic or predictive value of MGMT promoter methylation in gliomas depends on IDH1 mutation. Neurology 2013
IDH-wild-type tumours and MGMT promoter methylationがある患者さんでアルキル化剤を用いる化学療法が有効かもしれないという報告です。
おまけ
延髄のもの:びまん性正中グリオーマと組織鑑別する必要があるか?
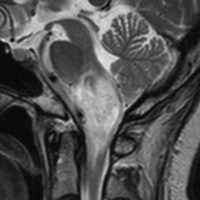
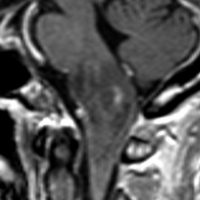
30代の患者さんです。起立性低血圧や呼吸苦,右片麻痺と多彩な脳神経症状で発症しました。
左はT2強調画像で,延髄を中心とするびまん性グリオーマの所見です。右はがドリニウム増強像で,一部が増強されて白く見えています。
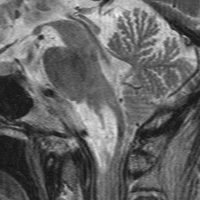
50.6Gy/28fr, TMZ 24コースの治療をした4年後のMRIです。腫瘍は縮小して固まったようにみえ,症状も落ち着いて自宅で暮らせてました。
しかしこの後に,激しい腫瘍再燃があり制御できませんでした。
脳幹部に発生するAAを,画像だけで「びまん性正中グリオーマ diffuse midline glioma」 と区別することは難しいです。だとすれば生検手術が必要か ? といえばそうとも言えません。どちらであっても治療方法は同じだからです。ただし,平均的な生命予後が退形成性星細胞腫の方が長く,治る患者さんもいます。