グリオーマ摘出の術中イメージ・テクノロジー
- グリオーマは脳の中に浸み込んでいていて取ることが難しい腫瘍です
- 外科医個人の経験値にもとづく技術がもっとも大切です
- それを補うために手術中に蛍光発色や画像イメージを利用するテクニックがあります
- 術中MRI,5-ALA (アラベル), ナビゲーションなどで,イメージガイド手術と呼ばれます
- 術中MRIは数少ない施設で利用が可能ですが,他のものはどこの病院でもできます
- これらを使用して,果たして患者さんの生存期間や生存の質がほんとうに改善されるのかどうかは,2023年時点では不明です
術中イメージの評価:いづれの方法もエビデンスレベルは低い
Jenkinson MD, et. al. Intraoperative imaging technology to maximize extent of resection for glioma. Cochrane Database of Systemic Reviews, 2018
イメージガイド手術を利用するとより多くのグリオーマ組織が摘出できるかもしれないという報告があります。著者は4つの無作為試験の結果を総括しました。これらの報告の中の摘出率 extent of resectionのエビデンスレベルは,低いあるいはかなり低いと評価されています。いずれのトライアルでも,全生存期間,病勢の進行までの期間,生存の質を評価しうるデータはないと結論しています。
手術で最大切除をめざす方法
手術中ナビゲーション
- カーナビと同じ原理です
- 手術中に腫瘍がどこにあって,脳のどの部位を操作していることがわかります
- 利点としては,開頭の位置を正確に把握して開頭範囲を必要最小限にできる
- 脳深部にあるグリオーマに対して最短のルート tragectoryで入るので脳損傷を最低限にできる
- 同時に深部白質の重要な神経路を選択的に避けることができることなどです
- 注意しなければならないのは,手術前の画像を用いるので腫瘍摘出に伴って形態が変わり位置がずれてくること
- 髄液排出などで脳全体の位置が動いて術前画像とのずれが生じるためにナビを信じすぎると誤った部位の脳を損傷することがあることです
- この欠点を補正するために,手術前MRIにたよるのではなく,手術中に手術室内でMRIを撮影しながら手術を進めていく方法が広がってきました
術中MRI intraoperative MRI
- 腫瘍が手術でとれているかどうか,手術中に確認します
- 全身麻酔で開頭手術している最中にMRIを撮影することです
- 手術室とMRI室が併設されている限られた施設しかできません
- とくに,脳と腫瘍との境界がわからない,グリオーマの手術で有効です
- 欠点は,MRIは超強力な磁石ですから,磁性体(鉄とか)の金属類が持ち込めないので,手術道具に制限がでたりします
- MRI装置の中に患者さんの頭部を入れるので,手術ベッドの移動とかとても面倒で,手術時間も長くなります
- 手術中に開頭したままの状態で患者さんをMRIに入れるという煩雑さと事故の可能性,医療費・経費・設備投資がかなり高額となります
- これらの欠点のため術中MRIの導入に関して否定的な意見も多いです
- また,2023年5-ALAとの比較試験が発表され,5-ALAに対する術中iMRIの優位性が否定されました
覚醒下手術と術中MRIで症状が出やすい領域のグリオーマを摘出する
Motomura K, et al.: Surgical benefits of combined awake craniotomy and intraoperative magnetic resonance imaging for gliomas associated with eloquent areas. J Neurosurg. 2017
名古屋大学からの報告です。”eloquent area ものを言う領域”(目立つ症状が出てしまう脳の部分)にできたグリオーマの患者さん25人を,覚醒下手術と術中MRIを応用して手術しました。9例でMRIの前に腫瘍が摘出できていて,16例ではMRIで残存腫瘍がみられたために追加切除がなされました。この16例中の7例では,EOR(切除割合)が15%増えました。術中MRIは,島葉グリオーマ insular gliomaで特に有用だったそうです。
術中MRIで摘出割合が上がる
Olubiyi OI, et al.: Intraoperative Magnetic Resonance Imaging in Intracranial Glioma Resection: A Single-Center, Retrospective Blinded Volumetric Study. World Neurosurg 2015
ハーバード大学の関連施設で2人の執刀医が164例のグリオーマの手術を行いました。グリオーマの摘出割合はMRIを用いると97%,用いないと90%でした。全摘割合は,それぞれ49%と21% でした。5年生存割合が改善したというのですが,いろいろな組織型の混じった後方視的解析ですから分析結果の統計解析はあてになりません。
手術中にMRIを使用すること
Mohammadi AM, et al.: Use of high-field intraoperative magnetic resonance imaging to enhance the extent of resection of enhancing and nonenhancing gliomas. Neurosurgery 74: 339-348, 2014
手術中に1.5テスラMRIを用いて102人のグリオーマ患者さんの手術が行われました。手術中のMRIの所見で約半数の患者さんで追加切除を行ったとあります。ガドリニウム増強されないT2強調画像でみえるグリオーマでMRIの使用によって切除率が上がったとの報告です。一般的に,低悪性度グリオーマ low-grade gliomaでの有用性が高いと言えます。しかし問題は,low-grade gliomaは機能を有している脳に浸潤するので,T2強調画像で見える腫瘍を摘出するということは脳の機能を損傷しながら手術を遂行するという大きな矛盾をはらむことです。術後の画像がきれいでも,患者さんの高次脳機能が温存できるかという二律背反が旧来からの命題として残ります。
もともと脳の解剖を熟知する経験ある脳神経外科医と,手術中MRIの,どちらが有用だという議論は,しなければならないような,してはいけないような (;¬_¬)
電気生理学的モニタリングと脳機能マッピング ISM
- ISM intraoperative stimulation mapping といいます
- 手術中に脳表面を刺激して一次運動野(手足の動きをMEPでみる)や感覚野(手足の感覚をSEPでみる)の位置を把握するという方法は広く応用されいています
- 深部の皮質脊髄路 corticospinal tract や脊髄視床路 spinothalamic tract の位置も捉えることができ,手術後の麻痺や感覚異常を避けることができます
- 覚醒下手術 awake surgery は,脳腫瘍学と認知機能神経科学 cognitive neuroscienceの融合で生まれた手術方法です
- 脳にはeloquent area (モノを言う領域,重い後遺症を出す領域)と呼ばれる部分があります,例えば一次運動野(手足を動かす)や言語野(言葉を話す脳領域)などです,その部分は個人個人で微妙に異なる位置にあるので,それを手術中に確認しながら脳を切除するという考えです
- 腫瘍摘出中に患者さんの意識を覚まして,意思疎通ができる状態で神経学的な検査をすることによって,運動錐体路,言語発語と理解力, 視覚機能,他の高次脳機能などをモニターしながら腫瘍摘出をして後遺症を避けます
- 目的は,生活の質 OoLを落とすような後遺症を出さないでグリオーマを脳と一緒に摘出することです
- この覚醒下手術には反論もあります,そこまでして,グリオーマの患者さんの生存期間が延びたというデータがないことです
- 例えば,乏突起膠腫で,旧来の方法で30%摘出しても,覚醒下手術で60%摘出しても生存期間は変わりません,倍の量取れているという手術結果が残るだけです
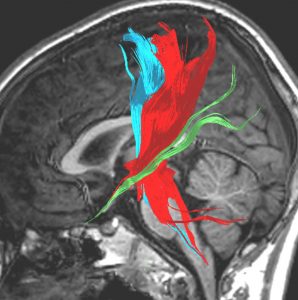
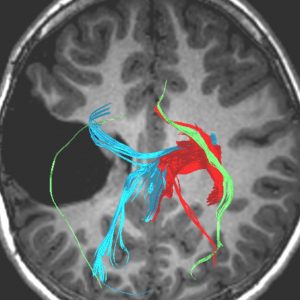
拡散テンソル画像 DTI tractography
神経路(白質路)をMRI画像に投射して可視化した画像です。緑は視路 optic tract (pathway) です。青や赤は皮質脊髄路 corticospinal tract です。脳のどの部分を切除するとどういう機能が失われてしまうのかがわかります。手術中のナビゲーションに応用することもあるのですが,開頭手術で参考にします。右の画像では錐体路ギリギリで腫瘍が切除されていることがわかります。もう少し踏み込むと完全な左片麻痺になる手術でした。
ISMを使用すると摘出割合が上がり,術後障害が少ない
De Witt Hamer: Impact of intraoperative stimulation brain mapping on glioma surgery outcome: a meta-analysis. J Clin Oncol, 2012
ISMには無作為試験ができないので,メタアナライシスで解析が行われました。2010年までに報告された8,000例ほどのグリオーマの手術が対象です。重い神経症状は,ISMを使用した群で 3.4%,使用しなかった群で 8.2%生じました。術後の画像で全摘出 gross totalできていた割合は,ISMで75%,使用しなかったら58% でした。覚醒下手術での言語と認知機能のモニターも有用であるとしています。
5-ALA 蛍光マーカーでの可視化
手術中に赤外線レザーを用いて行う治療補助手段です
光線力学的診断法 PDD photodynamic diagnosis
術中蛍光診断 (アミノレブリン酸 5-ALA による可視化)
- 40年くらい前から臨床応用がされていて新しいものではありません
- グリオーマをできるだけ多く摘出するために開発された方法です
- グリオーマを治す力はありません
- 手術の直前にアミノレブリン酸 5-ALAを飲みます
- 5-ALAは,グリオーマ腫瘍細胞に取り込まれて,正常の脳の細胞には取り込まれないという性質を利用します
- 5-ALAは体内でプロトポルフィリンIX (PPIX) に変化して,増殖の旺盛な腫瘍細胞に蓄積します
- PPIXのたまっている腫瘍細胞に,青色光線 400-410nm をあてると,腫瘍の部分だけが赤色蛍光を発します(見えにくい悪性腫瘍の可視化といいます)
- ですから,手術前に患者さんにアミノレブリン酸を投与して,手術中に赤く光っている部分(グリオーマ細胞)を摘出すれば腫瘍が確実にとれるというもくろみです
- 悪性度の高いものでは,燃えている木炭のように赤く蛍光発色します
- でも,そのような部分は手術顕微鏡で見ても明らかに悪性グリオーマと判別できます
- 実際は,淡く赤く光るだけで,正常組織との境界がはっきり見えるわけではありません
- また,もともとグリオーマ細胞は正常脳組織の中にしみ込む様に入り込むので,実際には赤く光っていたとしても,どこまで摘出してよいものか区別がつかないことが多いです
- 手術中に蛍光でぼんやり光るとことを摘出するかどうか迷います
- 結論的に,すごく役に立つとは言えませんが,澤村も実際には常に使用しています
- 経験の浅い術者ほどグリオーマの境界がわからないという不安もあり,赤く光ると腫瘍だけがはっきり見えるようで術者はなんとなく安心します,これが使用される最大の理由かも
- とても気を付けなければならい事は,赤く光っているから腫瘍が残っていると判断して,切除範囲を大きくしてしまう事です,正常脳を一緒に摘出することになり,術後に重い後遺症を出してしまうというリスクがあることです
- 赤く発光している,脳深部の白質を安易に摘出しない!!
- 5-ALAはを応用するにしても経験が必要です
- 慣れた術者という前提では,手術中MRIよりALAのほうが有用です
使いかた
- 日本でも保険診療で使用できます
- アラベルやアラグリオというお薬 (20mg/kg) を,摘出手術の2-4時間前に服用してから手術室に行きます
- 体重50kgの患者さんで1gです
- 光に対しての皮膚炎,日焼けが副作用ですから,患者さんのいる部屋の電気を消して暗くします
- 手術中に特殊な光を当てなければならないのですが,この装置を持っている脳外科病院は少ないです
- 手術後も患者さんの周囲を遮光します
- 他の副作用は悪寒,悪心,嘔吐,発熱,肝機能異常などですが,重篤なものはほとんどありません
膠芽腫の手術で,術中MRIより5-ALAのほうが有用である
Roder C: Intraoperative MRI-Guided Resection Is Not Superior to 5-Aminolevulinic Acid Guidance in Newly Diagnosed Glioblastoma: A Prospective Controlled Multicenter Clinical Trial. J Clin Oncol 2023
ドイツからの報告です。膠芽腫の手術においてガドリニウム増強される部分の全摘出にはどちらの手法が有用なのかが前向き試験されました。対象は5-ALA 127人のうち90人 (78%),iMRI 150人のうち115人 (81%)で全摘出 complete resection(増強部分の摘出)が可能でした。生存割合に差はありませんでした。大きな差は,incision-suture times 開閉等時間で,iMRI 316分とALA 215分でした。手がかかって面倒で経費もかかるのが手術中のMRIです。
高悪性度グリオーマで摘出率が上昇する
Intraoperative 5-ALA fluorescence-guided resection of high-grade glioma leads to greater extent of resection with better outcomes: a systematic review. J Nemuro Once 2022
後方視的な文献検索結果です。ALAは摘出率を上げて生存割合を上昇させるらしいとのことです。でも統計学的に優位な差はなにもありません。白色光線よりALA発光が,術後後遺症を勘案しても優位な予後改善となるかどうかはまだ不明です。
生検術でALAを応用する
Millesi M: Is intraoperative pathology needed if 5-aminolevulinic-acid-induced tissue fluorescence is found in stereotactic brain tumor biopsy? Neurosurgery 2020
定位脳手術で組織生検を行うとき,腫瘍部分を確実にとるために多くのサンプルを採取したり,手術中に病理組織を確認すると手術時間が長くなります。そこで,5-ALAを応用して腫瘍組織を確実に採取する方法が試されました。蛍光で赤く発色する組織が採取できたらそこで生検術を中止するということです。はっきり発色する組織がとれないときは,生検を継続してさらに何箇所からの組織採取を続けます。要は,5-ALAを利用することで80%くらいのケースで腫瘍組織が確実に採取できたということが手術中にわかるという意味です。
PDD グリオーマの可視化に関する大規模研究
2017年のFDAの公式ページに書かれています。手術前にグレード3あるいはグレード4のグリオーマと予測診断された,349人の患者さんが対象の無作為試験です。Percentage of patients who had “completeness” of resection was 64% in the ALA arm and 38% in the control arm, with the difference of 26% (95% CI: 16%, 36%).と記載されいてます。ALAを投与すれば64%の患者さんで十分な摘出ができるけれど,ALAを投与しない顕微鏡下手術では38%でした。
「解説」このcompletenessというのは耳慣れない用語です。使用した方がより多くの悪性グリオーマが摘出できるという結論なのですが,それが患者さん全体の生命予後の改善と機能予後の保持に有用なのかどうかはまた別問題です。グリオーマの手術にとても慣れている脳外科医が執刀すると,ALAを使用しても使用しなくてもあまり大きな差が出ないとも言えます。日本ではALAを使用していない施設のほうが多いのですが,慣れていない術者は使用した方がいいのでしょう。
ALAの臨床研究
Pichlmeier U, et al. ALA Glioma Study Group: Resection and survival in glioblastoma multiforme: an RTOG recursive partitioning analysis of ALA study patients. Neuro Oncol. 10:1025-1034, 2008
ヨーロッパで243人の膠芽腫の患者さんにこの治療方法が試されました。結果的に,アミノレブリン酸で可視化を行なって手術しても,そうしなくても生存割合に差はありませんでした。この研究の後で臨床応用は下火になりました。
大規模臨床研究 第3相試験
Stummer W, et al. Fluorescence-guided surgery with 5-aminolevulinic acid for re-section of malignant glioma: a randomized controlled multicentre phase III trial. Lancet Oncol. 2006
悪性神経膠腫の手術で,ALAを用いるとガドリニウム増強される腫瘍部分の完全摘出が65%で可能となり,使用しない36%より摘出割合が上がりました。しかし,患者さんの生存期間には変わりはありませんでした。

こんな風景のように光ります
光線力学療法によるグリオーマの治療 PDT photodynamic therapy
- 原理はALAによる可視化とおなじです
- 日本では,タラポルフィンナトリウム(レザフィリン)という薬剤が原発性悪性脳腫瘍の保険診療で使用できます
- 光感受性物質がグリオーマ細胞に取り込まれたところで,レーザ光を当てると腫瘍細胞が死滅するという原理を応用しています
- レザフィリンを22から26時間前に静脈内投与 (40mgm2) しておいて,手術中に腫瘍摘出をした部位にレーザ光 (波長664nm,照射パワー密度150mW/cm2,照射エネルギー密度27J/cm2) を当てます
- 限られた施設の少数例報告で有効とされるのみです,研究段階の治療法です
- これで延命効果(全生存期間の延長)が得られるという確実な証拠となる臨床研究(科学的根拠)はありません
- 理論上の有効性にとどまる治療法ですから,標準治療では用いません
- 最大の障害は,1980年代後半(25年くらい前)になされた研究にけりがついていないことです
- 「脳腫瘍の細胞だけに光感受性物質が治療に有効な十分量が取り込まれているか」ということで,これがそもそも解っていませんから,理論的根拠の根幹がないのです
- またグリオーマは脳の深い所に浸潤しますが,そこまでレーザがとどかないという致命的な欠点があります

文献
- Duffau H: Mapping the connectome in awake surgery for gliomas: an update. J Neurosurg Sci. 2017
- Engel AK: Invasive recordings from the human brain: clinical insights and beyond. Nat Rev Neurosci. 2005
- Ojemann G: Cortical language localization in left, dominant hemisphere. An electrical stimulation mapping investigation in 117 patients. 1989. J Neurosurg. 2008
- Sanai N: Functional outcome after language mapping for glioma resection. N Engl J Med. 2008
- Southwell DG: Language outcomes after resection of dominant inferior parietal lobule gliomas. J Neurosurg. 2017