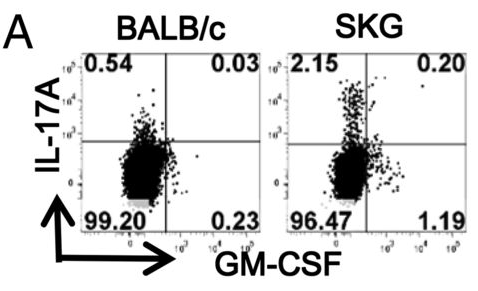
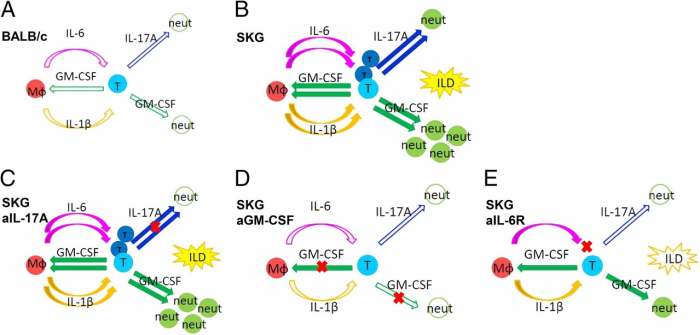
Diabetes mellitus as a long COVID-19 syndrome
最近の研究では、COVID-19と新たに発症する糖尿病との間に有意な関連があることが示唆されています。COVID-19後の糖尿病の発症率は1000人年あたり15.53であり、非COVID個体と比較して相対リスクが1.62倍高いことがわかりました(Zhang et al., 2022)。このリスクはすべての年齢層および性別で上昇しており、感染後最初の3ヶ月間でピークに達しました(Zhang et al., 2022)。糖尿病はまた、long COVID-19症候群を発症するリスク要因と考えられています(Kreutzenberg, 2023; Harding et al., 2022)。COVID-19と糖尿病の関係は双方向性であり、糖尿病患者はlong COVID-19を発症しやすいです(Kreutzenberg, 2023)。COVID後の糖尿病の病因は多因子性であり、膵臓のβ細胞への直接的なウイルス効果、自己免疫、および全身性炎症が関与している可能性があります(Kim et al., 2023)。新たな証拠に基づき、一部の研究者はCOVID-19後に発症する新たな糖尿病を独自のpost-COVID症候群として分類し、さらなる研究を提案しています(Kim et al., 2023)。
Recent studies suggest a significant link between COVID-19 and new-onset diabetes. The incidence of diabetes after COVID-19 was found to be 15.53 per 1000 person-years, with a 1.62 times higher relative risk compared to non-COVID individuals (Zhang et al., 2022). This risk was elevated across all age groups and genders, peaking within the first three months post-infection (Zhang et al., 2022). Diabetes is also considered a risk factor for developing long COVID-19 syndrome (Kreutzenberg, 2023; Harding et al., 2022). The relationship between COVID-19 and diabetes is bidirectional, with diabetic patients more likely to develop long COVID-19 (Kreutzenberg, 2023). The etiology of post-COVID diabetes is multifactorial, potentially involving direct viral effects on pancreatic β-cells, autoimmunity, and systemic inflammation (Kim et al., 2023). Given the emerging evidence, some researchers propose classifying new-onset diabetes after COVID-19 as a distinct post-COVID syndrome for further study (Kim et al., 2023).
References
HARDING, J. L., ALI, M. K., GANDER, J. C., & PATZER, R. E. (2022). 174-LB: Diabetes as a Risk Factor for Long-COVID-19—A Scoping Review. 71(Supplement_1), 174-LB. https://doi.org/10.2337/db22-174-LB
Kim, S. H., Arora, I., Hsia, D. S., Knowler, W. C., LeBlanc, E., Mylonakis, E., Pratley, R., & Pittas, A. G. (2023). New-Onset Diabetes After COVID-19. 108(11), e1164–e1174. https://doi.org/10.1210/clinem/dgad284
Kreutzenberg, S. V. de. (2023). Long COVID-19 and diabetes mellitus: a short review. 3(1), N/A-N/A. https://doi.org/10.20517/mtod.2022.30
Taylor, K., Eastwood, S., Walker, V., Cezard, G., Knight, R., Arab, M. A., Wei, Y., Horne, E. M. F., Teece, L., Forbes, H., Walker, A., Fisher, L., Massey, J., Hopcroft, L. E. M., Palmer, T., Coronado, J. C., Ip, S., Davy, S., Dillingham, I., … Zhu, J. (2024). Incidence of diabetes after SARS-CoV-2 infection in England and the implications of COVID-19 vaccination: a retrospective cohort study of 16 million people. 12(8), 558–568. https://doi.org/10.1016/S2213-8587(24)00159-1
Zhang, T., Mei, Q., Zhang, Z., Walline, J. H., Liu, Y., Zhu, H., & Zhang, S. (2022). Risk for newly diagnosed diabetes after COVID-19: a systematic review and meta-analysis. 20(1), 444. https://doi.org/10.1186/s12916-022-02656-y