中枢神経原発リンパ腫 PCNSL,その他のリンパ腫
PCNSL (primary central nervous system lymphoma)
大まかなこと
- 脳のどこにでもできる悪性腫瘍で,脳腫瘍の3%くらいです
- 60から80歳代の高齢者に多く発生します
- 発生率は増加の傾向にあります
- 悪性のBリンパ球が脳の中で勢いよく増えます
- 専門医はPCNSLと呼びます
- 欧米では免疫力が落ちた患者さん(エイズなど)での脳のリンパ腫の発生が多いのですが,日本ではとても稀です
- 症状は知能低下(認知症)や麻痺などが多いです
- 片方の目の視力が急に低下する眼内リンパ腫(ブドウ膜炎)は初発症状として多いものです,その後に脳に発生します
- 亜急性,つまり数日から何週間単位で進行するものが多いです
- 一度症状が出たら悪化するのは早いと考えなければなりません
- 治すためには1日も早く治療を開始することが大切です
- 治療の基本は化学療法(制ガン剤)です
世界標準の治療法は,生検術(病理診断),メソトレキセートを基材とした併用化学療法です
- その後に全脳照射を加えるか,さらに大量化学療法を行うかは意見が分かれます
- いずれの治療法を選択しても再発率や死亡率は高いものです
以下はPCNSLに関しての記述です
検査と診断は
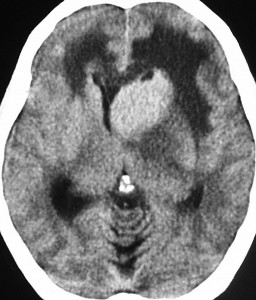
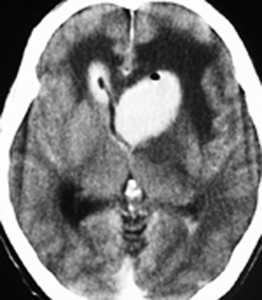
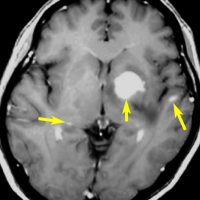
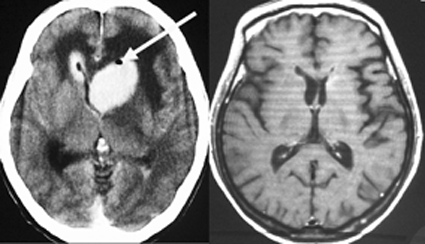
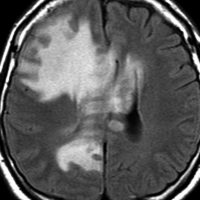
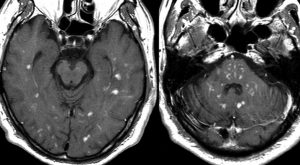
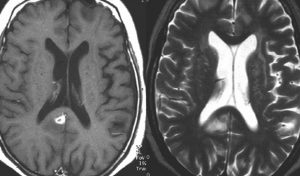
単純CT(左側の画像)で腫瘍の部分が少しだけ高吸収値域を示す(ちょっと白っぽくなる)のが大きな特徴で,この所見をもってグリオーマとの区別をします。周囲に黒っぽい部分がありますが,これは脳の腫れで脳浮腫と言います。右側のCTは造影剤を入れたものでよりはっきり写ります。
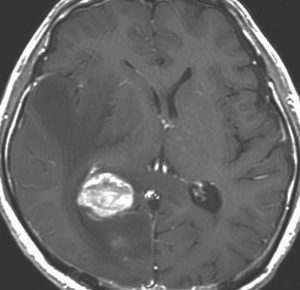
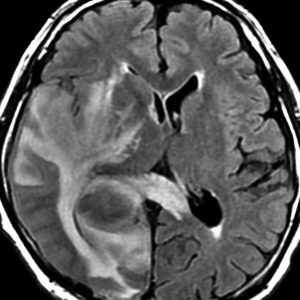
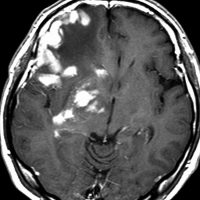
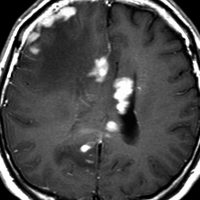
MRI検査で,はっきりわかります。MRI造影剤を入れると均一または斑らに増強(真っ白になる)されて(左側),周囲には脳の腫れ(脳浮腫)がみられます(右側)。できやすい場所は側脳室の周囲・大脳脳基底核・小脳・脳幹部など脳の深いところ(深部白質)です。脳の中に2個以上のリンパ腫が同時にできる多発例というのもしばしばあります
- 脳ではない体のどこかに発生したリンパ腫が脳に転移したものかもしれません
- 脳にだけできたのか,体のどこかに原発巣があるのかを区別するのはとても難しいです
- 全身を調べるのにはガリウムシンチという検査が用いられます
- ペット FDG-PETという検査もあります
- 膠芽腫や転移性脳腫瘍よりFDG-PETの取り込みが高いのですが,確定診断には至りませんし,この検査を予約していると治療開始までの時間がかかってしまうという欠点があります
- 骨を刺して検査する骨髄穿刺をして全身のリンパ球に異常がないか調べます
- 眼科で,目の中にも眼内リンパ腫がないかどうかを調べます
手術による病理診断
- CTとMRIが終わってリンパ腫が疑われたら,急いですぐに「定位脳手術」か「小さな開頭手術」でちょびっとだけ腫瘍をとります(生検術)
- 脳原発のものはほとんどがnon-Hodgkinリンパ腫 (NHL)で,びまん性大細胞型 B細胞リンパ腫が約80~90%を占めます
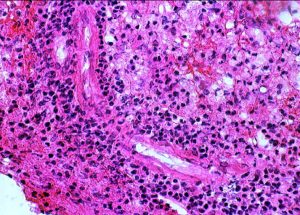
- 病理組織学的には,異型性の高いリンパ球の腫瘍細胞が,血管周囲に集まりさらに深く周囲の脳実質内に浸潤しています
- ですから,手術でとりきれることはありませんし,開頭手術だけでは再発します
- 脳ヘルニアを生じるような頭蓋内圧亢進があるときだけ減荷手術 debulking surgeryを考えます,その他の状況では開頭摘出術に利点はありません
- ステロイドという薬を使うと一時期に症状がよくなって,MRIをみると消えてしまうことがあります
- しかし,その場合も数週から数ヶ月後に再発します
- 病理組織を確認する手術の前にステロイドを使うと病気が判らなくなってしまうので,生検術の前にステロイドを使用してはいけません
- その他のいろいろなリンパ腫は後述しています,例えば硬膜(髄膜)から発生するモルト・リンパ腫は髄膜腫と間違えやすいです
治療
2023年時点の標準治療は,
MTX(メトトレキサート) を基材とした化学療法
全脳照射30グレイ/15分割を加えるかどうかは個別判断
- 進行が早いので治療はとても急がなければなりません
- 開頭手術でたくさん腫瘍組織をとるのは意味がありません,時間を失うのと,摘出してもまたすぐに大きくなってしまうからです
- そうしないと治らなかったり,治っても後遺症が大きくなります
- 導入化学療法から治療を開始します
- 全身状態と腎機能が良ければ高齢者にもMTX大量化学療法は使用されます
- 放射線療法(全脳照射)は有効で,照射だけで消失して治ることがあります
- 日本では1日線量2.0グレイですが,1.8グレイにした方がいいという意見も多いです
- しかし,高齢者の脳に広く放射線治療をすると脳の萎縮がきて何ヶ月か後には認知障害になることが多いです
- 全脳照射を加えるかどうかには議論があり,患者さんも迷います
- でも逆に,全脳照射しないで,この治療が良いという確かな選択肢もありません
- 薬物療法(化学療法,制がん剤)は有効なことが多いですが,20-30%くらいの高悪性度群のリンパ腫には効きません
- 他に臨床試験が進んでいるのは,リツキサンを併用する,全脳照射の線量を落とす,大量化学療法の方法を変える,維持化学療法をする,などの方向性があります
- 結論は出ていません
- 70歳以上の状態の悪い高齢者では,開頭手術をしない,化学療法をしない,局所放射線治療のみに止めるなど,体に負担の大きい無理な治療を選択しないこともあります
治療の順番(地固め療法までを行うことが多いです)
1 導入化学療法:どれか一つ
- MTX大量化学療法
(MTX at HD (≥3 g/m2, 2-3 h iv infusion, 4-6 injections, 2-3 weeks interval) - それにリツキサンを加える(2022年時点でコンセンサスはありません)
- さらにアルキル化剤 (procarbazine, carmustine, thiotepa) などを加える強化併用化学療法を行う,有効性は断定できませんが,奏功割合や無増悪生存期間 PFS が高いとされています,当然,有害事象はきつくなります
- cytarabine大量療法を加える化学療法は日本ではあまり使用されません
2-1 地固め療法:放射線治療か大量化学療法どれか一つ
- 30グレイ15分割の全脳照射 WBRT(治療後の認知機能の低下が問題)
- CR(化学療法で腫瘍消失)患者さんへの,全脳照射の減量 (23.4–30 Gy in 1.8–2.0 Gy fractions),臨床試験の結論は出ていません
- 残存腫瘍あるいは腫瘍床への局所放射線治療の追加 (boost)
- 逆に導入化学療法中に,進行あるいは明らかな残存腫瘍がある場合には,全脳照射の増量(36–40 Gy with a 1.8–2 Gy dose/fraction)
- 60歳以上の高齢者では,地固め療法に全脳照射を用いると認知機能障害のリスクが高いです
2-2 地固め療法:放射線治療か大量化学療法どれか一つ
- 自己幹細胞移植 ASCT を使う大量化学療法は,65-70歳くらいまでであれば有効性が認められます
- 全脳照射に匹敵する効果は期待できます
- thiotepaを基剤とした大量化学療法が用いられることが多いです
3 維持療法
- 経過観察のみで何もしないことが多いです
- アルキル化剤による長期外来化学療法
- テモゾロマイドは有効ではありませんから除外します
化学療法 (制がん剤治療)
- この20年くらいは,MTX (メトトレキサート) の大量化学療法が基本でした
- 併せて30グレイくらいの全脳照射が生存率においてはよい成績をあげてきました
- 生存期間中央値は3年以上になると報告されています
- 新しい治療の方向性は,化学療法を主体にして治すことです
- 全身のリンパ腫と同じ治療となり,強力な化学療法を使うので専門施設(がん化学療法の専門家がいるところ)でしか行なえません
- 脳のリンパ腫だと診断されたら血液腫瘍内科(白血病やリンパ腫を専門に治療する内科)に移していただきましょう
- 脳神経外科医が行う治療ではありません
- 特に,60歳以上には放射線治療による認知障害が強く出るので化学療法だけにする方向性です
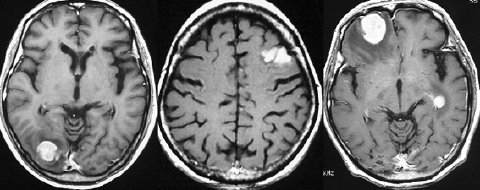
若い患者さんのリンパ腫です。左が診断時MRIで,黄色の矢印でみれる3ヶ所に同時にリンパ腫が発生しています。定位生検術後にすぐにMTX化学療法を3コースしたら,真ん中の画像になりました。ほとんど消失しているのですが,矢印の先にぼーっと少し残っているのでCR(消失)とはいいません。化学療法を終えた後に全脳照射30グレイをしたら右の画像になり治りました。これは順調な治療経過の例です。
- 2010年以降は,さまざまな併用化学療法が提案されていて,結論は出ていません
- CD20陽性のB細胞リンパ腫に対するリツキシマブ rituximab(商品名リツキサン)という抗体が化学療法と併用できるようになりました
- 欧米ではリツキシマブを使用する報告が多いです
- シクロフォスファミド,ドキソルビシン,ビンクリスチン,プレドニゾロンを使うCHOP療法などに併用されています(R-CHOP)
- 髄液内への抗がん剤の注入は一般的ではありません
- MTX大量化学療法の後で,血液幹細胞移植を用いた地固め化学療法や維持化学療法を行った方が再発率が低いとの報告が増えています
- この大量化学療法と幹細胞移植を用いてリンパ腫が消失した場合には,全脳照射を行わないという取り組みもありますが,放射線治療をしない治療が確立されているわけではありません
- 併用化学療法の最新のものに関しては,下の方の文献情報に書いています
予後
- 最初にできた場所とは違う脳の部分に再発することが多いです
- 再発率は高く,治療後にある程度の寛解期が得られるのは半数くらいの患者さんです
- 再治療はもちろん難しくなりますが,化学療法を行ったり局所照射を追加したりして抑えることも可能です
- 患者さんのPS 一般状態が悪くなった時には,緩和ケアを選択します
- 文献上では,臨床試験された患者さんの母集団によって生命予後が全く違ってきます
- きちんと治療を受けることができた患者さんで,5年生存割合は40%くらいと考えるのが妥当でしょう
- 過去の放射線治療だけを行なった場合で,生存期間は15か月前後でした
- 最近の化学療法を加えた治療法ではもっと伸びて生存期間中央値は40ヶ月以上になっています
- 明らかに生存率がよいのは50歳以下の若い患者さん,PS70%以上(自分のことはできる状態くらい)の患者さんです
- 70歳以上の高齢者では,全脳照射もつらく,大量化学療法も制限されるので5年生存割合は2割以下になります
- 70歳以上の高齢者の生存期間中央値は,1970年代で6ヶ月,2010年代で7ヶ月とも言われます
- リンパ腫は高齢者に増えているのですが,完全に治せる確率は低く,放射線治療でも化学療法でも無理な治療はしないほうがいいでしょう
再発時の治療
- 初回治療で大量化学療法を受けていない患者さんは,自己幹細胞移植 ASCT を使う大量化学療法が候補としてあがります
- 同様に,初回治療で全脳照射を受けていない患者さんは,導入化学療法と全脳照射を用いることができます
- 初回治療でMTXに良い反応を示した患者さんでは,もう一度,MTXを使用するという選択肢があります
- その他,様々な治験や治療法が血液内科の領域で試されています(脳外科医の考えることではないようです)
リンパ腫の特徴
腫瘍増大が早い
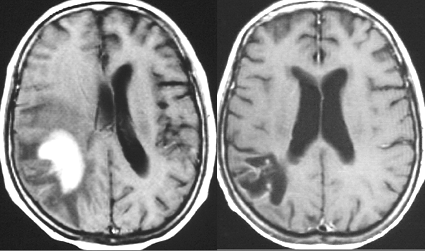
これは1990年代の古い例ですがリンパ腫の増大が早いことをお見せします。左側のはTHP-COPという化学療法をする前のものです。真ん中のは化学療法から4日目で,腫瘍は小さくなりました。でも,2コース目の化学療法の直前(4週間後)にもう一度MRIをしてみたらすごく大きくなっていました。この化学療法は効いているのだか効いていないのだか判らないことになります。化学療法を行なうならとても強い薬剤を使わなければなりませんし急がなければなりません。
違う部位に再発する
リンパ腫を疑ったら数日中には定位脳手術(ちょっとだけ腫瘍をつまんで病理検査をする)をします。そして病理で確認したらすぐに化学療法を開始します。患者さんが外来に初めて訪れてから,すぐに生検手術して,ステロイド治療あるいは化学療法開始までを手術後1週間くらいにした方がいいと考えています
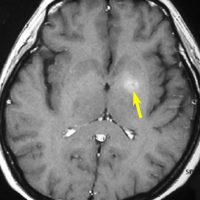
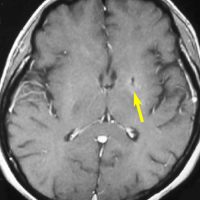
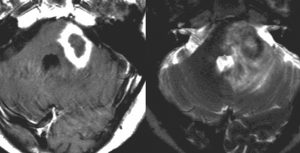
矢印の所を定位脳手術で取りました。病理の結果がリンパ腫と確定されましたから,MTX化学療法をしてから放射線をあてたら,右側のMRIのように腫瘍は消えました。患者さんの症状は良くなって退院したのですがーー。
左から,1回目の再発,2回目の再発,3回目の再発です。再発するたびになんとか治療はできるのですが,違った場所に再発してきてだんだん治療が効かなくなってくることが多いです。このような現象から,脳のリンパ腫は脳に発生するのではなくて,体のどこかに原発巣があるのではないかという考えもあります。もちろん、こんな再発をしないで治ってしまう患者さんも多いです。
40グレイの全脳照射だけだと脳萎縮と認知機能低下が生じる
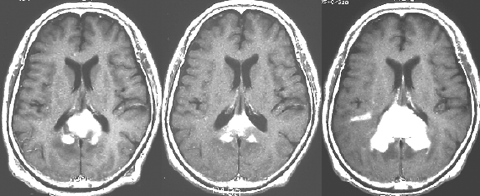
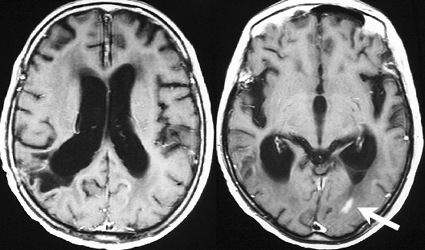
1990年代に放射線治療をした古い例です。定位生検術の後で全部の脳に40グレイという線量を照射しました。左から2番目の写真で腫瘍は消えています。でも,6ヶ月後の3番目の写真では脳がやせてきています(脳萎縮)。患者さんの精神機能は著しく低下しました(いわゆる認知障害)。4番目の写真は治療後8ヶ月目のものですが,すでに左側に小さな再発が見られます。全部の脳にあてる放射線の量はできる限り少ない方がいいのです。2017年時点では30グレイというのが標準的線量です。
開頭手術だけでは治らない
開頭手術で全部取ったといわれて紹介された例です。でも右側の写真ではほんの少し残っているようです。この後で化学療法と放射線治療をしました。
開頭腫瘍摘出術をすると化学療法の開始の時期が遅れますし,それを待っている間にも再発してしまうことがあります。また,手術でたくさんとっても治る確率が高くなる病気ではないので,利益はとても少ないと言えます。定位脳手術では取りそこなうことがあるから,小さな開頭手術をするにしても,生検術(ほんの少しだけ腫瘍をつまんで病理診断)するだけです。積極的な腫瘍摘出はしません。
かなり広がった例でも治療ができる
かなり広範囲に急速に広がった例です。脳の他の悪性腫瘍,例えば膠芽腫や転移性脳腫瘍ですとこれだけ広がれば治る見込みがありません。でもリンパ腫は化学療法と放射線治療で治る見込みがある治療をすることができます。諦めないで急いで治療を開始してください。
2021 WHO分類 lymphomas
CNS lymphomas
Primary diffuse large B-cell lymphoma of the CNS: PCNSL 中枢神経原発びまん性大細胞型B細胞リンパ腫
Immunodefficiency-associated CNS lymphoma
lymphomatoid granulomatosis (LYG)
Intravasclar large B-cell lymphoma (IVL)
Micellaneous rare lymphomas in the CNS
MALT lymphoma of the dura 硬膜モルトリンパ腫
Other low-grade B-cell lymphoma of the CNS
Anaplastic large cell lymphoma (ALK+/ALK-)
T-cell and NK/T-cell lymphomas
PCNSLを除けばそれぞれ臨床的な特徴もあります。例えば,血管内大細胞型B細胞性リンパ腫 IVL は脳梗塞のような症状で発症します。LYGは硬い肉芽種や脳腫瘍のような塊を形成します。また一方で,硬膜モルトリンパ腫はMRI診断では髄膜腫と間違えられるものです。原発性眼内リンパ腫 PIOL primary intraocular lymphoma はPCNSLの一部分症として認知されているので,全身のリンパ腫とはせずPCNSLと診断します。
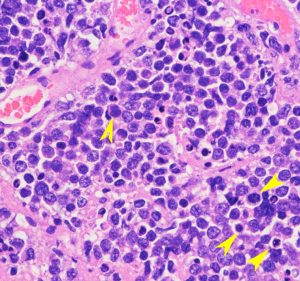
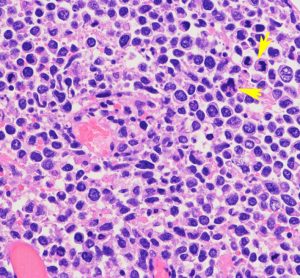
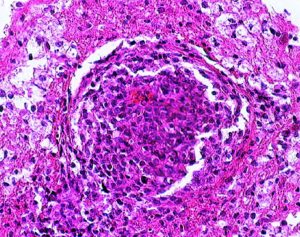
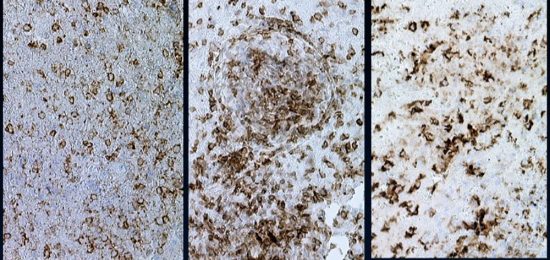
円形から楕円形の核腫大を伴う異型細胞がびまん性に増殖しています。核は水泡状のものが目立ちます。黄色の矢印は核分裂像を示します。大細胞性リンパ腫 large B cell lymphoma の特徴的なHE染色像です。
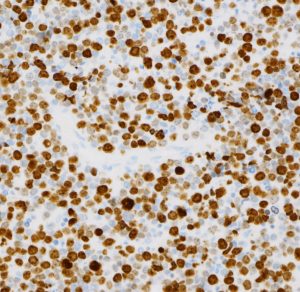
Ki-67染色によるMIB-1染色率は80%を超え,細胞の分裂増殖が激しいことを示します。リンパ腫増殖はとても早く,1週間単位でMRI上の腫瘍増大が認められます。
CD20陽性のB細胞リンパ腫でした。
中枢神経の特殊なリンパ腫
miscellaneous rare lymphomas of the CNS
- 眼内リンパ腫の合併 : IOL intraocular lymphoma
- 硬膜のリンパ腫:MALT lymphoma of the dura モルト・リンパ腫
- 血管内リンパ腫 : IVL intravasclar large B-cell lymphoma
- リンパ腫様肉芽腫症 : LYG lymphomatoid granulomatosis
脳神経にできるリンパ腫ですが,通常のPCNSLとはMRI画像も異なり,治療法も異なるものです
眼内リンパ腫(intraocular lymphoma, IOL)
- これは通常のlarge B-cell lymphomaです
- 片眼の比較的に急速な視力低下で発症し,ぶどう膜炎 uveitisと類似した症状であるので,ぶどう膜炎と診断されることが多いです
- 原発性眼内リンパ腫 PIOL primary intraocular lymphoma はPCNSLの一部分症として認知されているので,眼内リンパ腫があっても全身のリンパ腫とはせず,PCNSLと診断します
- ステロイド治療で寛解が得られることがあり,眼内生検手術をされていない場合には確定診断がつかないまま,ぶどう膜炎の既往として残るのみであるので,PCNSLの患者さんの病歴をとっていると,ぶどう膜炎と言われたというような訴えを聞くこともあります
- また脳病変と同時に進行することも多いし,合併頻度が高いのでPCNSLを疑う場合には眼科での検査も必要です
- 孤発性のPIOLならば眼内局所療法(制がん剤注入 intravitreal methotrexate,局所放射線治療 ocular radiotherapy)など特有の治療法があります
- 脳病変と合併する場合にはまずはPCNSLに準じた治療法をします
- Grimmらの眼内病変を合併した221例のPCNSLの報告では,眼内単独で再発が生じる場合は20%で,眼内病変への局所治療を加えた場合に局所制御率はよいが,全生存割合 OS は局所治療を加えない群との差がないとされています
硬膜のリンパ腫:MALT lymphoma of the dura モルト・リンパ腫
- 硬膜から発生するリンパ腫が知られています
- 成人女性に多い傾向があります,男性の5倍
- 浸潤性の髄膜腫やガンの硬膜転移と誤診されるような画像所見です
- 硬膜の肥厚 plaque のみが初見のこともあります
- 主として硬膜下に腫瘤形成します
- 周辺脳組織に浸潤して,脳浮腫所見を伴います
- MALTリンパ腫 (marginal zone lymphoma) がほとんどで,B細胞リンパ腫はまれです
- 脳のPCNSLよりは,比較的にゆっくり大きくなるリンパ腫です
- MIB-1 indexは5%以下が多いです,非定型髄膜腫 grade II より低いくらいです
- 腫瘍部分摘出/生検術と局所放射線治療だけで,5年無増悪生存割合が80%以上となる予後の良いリンパ腫です
- 放射線治療も低線量で治癒が期待できるという報告もあります
- 他の臓器での再発例はありますが,硬膜リンパ腫には無理な化学療法や全脳照射はしません
血管内リンパ腫 : IVL intravasclar large B-cell lymphoma
- リンパ腫細胞が血管の内部で増える血液腫瘍です
- IVLの患者さんの8割くらいに脳病変が生じます
- そのため,脳血管閉塞が生じて,脳梗塞で発症します
- 拡散強調画像 DWIで高信号となります
- 初発では脳梗塞と誤診されることがほとんどです
- もしくは浮腫性変化が強いもので,亜急性脳炎 subacute encephalopathyに類似します
- 一度収縮して治っても,また違った部位に再燃します
- 脳梗塞で入院して,また脳梗塞が再発したという経過をたどる患者さんが多いです
- 病理診断は,リンパ腫のいる血管を採取しないと確定に至りません
- ですから,生検術で証明できないことがあります
- 血管内に,large atypical B-cellsが増殖します
- 治療はPCNSLに準じるものです
- R-CHOP とMTX, cytarabine, prednisoloneの髄注,血管内ヘパリン投与の併用(血管閉塞予防)などの報告があります
皮膚病変で診断されていた患者さんの同時多発性脳病変
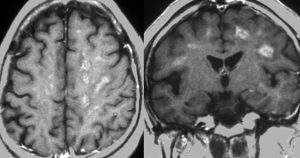
60代女性で,皮膚結節がB cell lymphoma (neoplastic angioendotheliosis)がありました。1年後に急性の認知機能障害と歩行障害がありMRIで発見されたものです。SPECT, PET検査では多発性虚血性病変です。生検手術でIVLの診断が得られました。
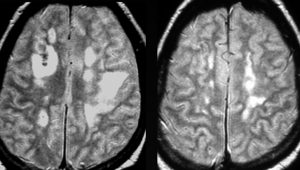
左は発症時,右はCHOP化学療法1コース後のT2強調画像です。化学療法で寛解しました。
リンパ腫様肉芽腫症 : LYG lymphomatoid granulomatosis
ALPD angiocentric lymphoproliferative disorder
- 滲む様にガドリニウム増強される病変です
- 周囲に脳浮腫を伴い,髄膜浸潤がみられ,mass effectを有する様な病変では内部に壊死像を伴います
- 単発のことが多いのですが,多発性脳病変となることもあります
- diffuse large B-cell lymphomaとされています
- 肺に最も多くて,次いで中枢神経,腎臓,皮膚,肝臓などに多発します
- 両側の肺に結節と浸潤像が見られます
- 血管中心性 angiocentric,血管破壊性 angiodestructive に異型細胞が浸潤します
- 免疫不全の患者さんに多いです
- 原因として,Epstein Bar virus感染が疑われています
- 予後が良いものと不良なものがあります
- 単発性のものでは自然寛解するものもあります
多発散在性病変例
50代男性,痙性四肢麻痺による歩行障害で発症しました。多数の散財性病変を呈するタイプです。
単発・再発例
既往に両肺野,皮膚病変があった50代女性が,右片麻痺と小脳失調で発症しました。確定診断のために生検手術をしました。
血管壁を破壊し,脳実質内に浸潤像が見られます。
左から順に,L26, UCHL-1, CD69-KP-1染色です。
脳幹部病変は局所照射で消失しましたが,2年後に右頭頂部に再発しました。
文献
- de la Fuente MI: Marginal zone dural lymphoma: the Memorial Sloan Kettering Cancer Center and University of Miami experiences. Leuk Lymphoma. 2017
- Grimm SA, et al.: Prmary CNS lymphoma with intraocular ivolvement: International PCNSL Collaborative Group Report. Neurology 71, 2008
- Katzenstein AL, et al: Lymphomatoid granulomatosis: insights gained over 4 decades. Am J Surg Pathol. 2010
- Nizamutdinov D, et al.: Intravascular Lymphoma in the CNS: Options for Treatment. Curr Treat Options Neurol. 2017
- Puri DR: Low-dose and limited-volume radiotherapy alone for primary dural marginal zone lymphoma: treatment approach and review of published data. Int J Radiat Oncol Biol Phys. 2008
文献情報
ものすごくたくさんの文献があるのですが,2017年までに無作為試験というのは3つしかなくて,臨床第3相試験の結果というのは1つしかありませんので惑わされないでください
テモゾロマイドの効果はない
Mishima K: Randomized phase III study of high-dose methotrexate and whole-brain radiotherapy with/without temozolomide for newly diagnosed primary CNS lymphoma: JCOG1114C. Neuro Oncol 2023
日本で行われた第3相試験です。大量MTX化学療法と全脳30Gyとboostの標準治療に加えて,維持療法として,テモゾロマイドを2年間投与の有無の効果が試験されました。対象は122人です。中間解析で,テモゾロマイドを加えない群の全生存割合OSは86.8%,加えると71.4%でした。治験は中断されました。
2022年ヨーロッパのガイドライン
Hoang-Xuan K: European Association of Neuro-Oncology (EANO) guidelines for treatment of primary central nervous system lymphoma (PCNSL) Neuro Oncol 2023
前回のガイドラインとの主たる変更は,初期治療においてのASCT 幹細胞移植による consolidationが確認されたこと,若年者と高齢者では化学療法を使い分けること,リツキシマブの有用性がはっきりして来たことです。
2021年の総論
Primary Central Nervous System Lymphoma, Blood 2021
5年生存割合は,この時点でも30-40%としています。新たな治療薬候補として,イブルチニブ ibrutinib (the Bruton Tyrosine Kinase (BTK) inhibitor) やレナリドミドlenalidomideとポマリドマイド pomalidomide (immunomodulatory drugs (IMiDs) を挙げています。これらの薬剤は,再発したPCNSLに対しての報告はありますが,いまだ無作為第3相試験の結果はありません。
中枢神経へ転移した secondary CNS lymphomaの治療
Ferreri AJM: MATRix–RICE therapy and autologous haematopoietic stem-cell transplantation in diffuse large B-cell lymphoma with secondary CNS involvement (MARIETTA): an international, single-arm, phase 2 trial. Lancet Haematol 2021
化学免疫療法に自家造血幹細胞移植を加えた治療が試みられました。中枢神経に転移した大細胞B細胞リンパ腫が対象です。3コースのrituximab, methotrexate, cytarabine, thiotepa化学療法,次いで3コースのrituximab, etoposide, ifosfamide, carboplatinが投与され,地固め療法として carmustine-thiotepaとautologous HSCTが加えられました。75人の患者さんが評価され,1年無増悪生存割合は58%(42名)でした。転移性の中枢神経系リンパ腫の予後は極めて不良なので,治療成績としてはかなり良い成績であると評価されます。しかし,骨髄抑制などの有害事象がかなりきついので,4人が治療関連感染症で亡くなっています。
チラブルチニブ Tirabrutinibの第1−2相試験の結果
Narita Y: Phase 1/2 Study of Tirabrutinib, a Second-Generation Bruton’s Tyrosine Kinase Inhibitor, in Relapsed/Refractory Primary Central Nervous System Lymphoma. Neuro Oncol 2020
44人の再発または難治性PCNSLに対する試験の結果です。第2相としてはチラブルチニブ 480mgが連日経口投与されました。奏功割合64%,無増悪生存期間中央値は2.9月でした。
チオテパ thiotepa が悪性リンパ腫の治療に使用できるようになりました
2020年3月,「リサイオ®点滴静注液100mg」(チオテパ)が「悪性リンパ腫における自家造血幹細胞移植の前治療」に使用できるようになりました。ブスルファンとの併用において認められます。
60歳以下の患者さんでは,全脳照射を避けてASCTで治療できる
Houillier C: Radiotherapy or Autologous Stem-Cell Transplantation for Primary CNS Lymphoma in Patients 60 Years of Age and Younger: Results of the Intergroup ANOCEF-GOELAMS Randomized Phase II PRECIS Study. J Clin Oncol 2019
60歳以下の患者さんで導入化学療法,R-MBVP (rituximab, methotrexate 3 g/m2, VP16, BCNU, prednisone)とR-AraC (rituximab, cytarabine)が用いられ,その後のASCTによる大量化学療法 (thiotepa, busulfan, cyclophosphamide)と全脳照射40Gyの効果が比較されました。2年PFSは,全脳照射で63%,ASCTの地固め療法で87%でした。両アーム共にものすごく治療侵襲の高い治療法が比較検討されています。日本では難しいでしょう。
日本からの大量化学療法と幹細胞移植の報告
Kondo E: High-Dose Chemotherapy with Autologous Stem Cell Transplantation in Primary Central Nervous System Lymphoma: Data From the Japan Society for Hematopoietic Cell Transplantation Registry. Biol Blood Marrow Transplant. 2019
102例のPCNSLの患者さんが治療され,upfrontとsalvageで大量化学療法が用いられたのですが,OS, PFSに差はなかったとのことです。全体では5年全生存割合55%,無増悪生存38%でした。Thiotepaを含むレジメンの方が有用性が高いと強調されています。
CAR-Tが再発PCNSLに有効だった
Anti-CD19 CAR T Cells in CNS Diffuse Large-B-Cell Lymphoma. N Engl J Med 2017
CD19 and CD70 Dual-Target Chimeric Antigen Receptor T-Cell Therapy for the Treatment of Relapsed and Refractory Primary Central Nervous System Diffuse Large B-Cell Lymphoma. Front Oncol. 2019
症例報告です。高額医療で話題となったキメラ抗原受容体を利用する CAR-Tという治療法です。再発しCD-19を発現しているPCNSLに対してCAR-T治療がなされ,寛解が得られたとの2つの報告です。CAR-Tは,有害事象としてcytokine release syndrome (CRS) や CART-related encephalopathy syndrome (CRES)が生じることがあり脳のリンパ腫治療には適さないとされて来ました。この治療が有効かどうかはまだ不明です。
70歳以上の高齢者の生存期間はこの40年間で改善されていない
Mendez JS: The elderly left behind – changes in survival trends of primary central nervous system lymphoma over the past four decades. Neuro Oncol. 2017
70歳以上の高齢者の生存期間中央値は,1970年代で6ヶ月,2010年代で7ヶ月だそうです
地固め療法としての全脳照射と幹細胞移植
Ferreri AJM, et al.: Whole-brain radiotherapy or autologous stem-cell transplantation as consolidation strategies after high-dose methotrexate-based chemoimmunotherapy in patients with primary CNS lymphoma: results of the second randomisation of the International Extranodal Lymphoma Study Group-32 phase 2 trial. Lancet Haematol. 2017
4コースのメソトレキセート (3·5 g/m2 on day 1)を基盤とし,group A: cytarabine 2 g/m2 twice daily on days 2 and 3, group B: the same combination plus two doses of rituximab 375 mg/m2 on days -5, group C: the same methotrexate-cytarabine-rituximab combination plus thiotepa 30 mg/m2 on day 4の3群で,219人の患者さんに導入治療がなされました。幹細胞が採取できたの患者さん118人のみが,無作為に全脳照射 group D もしくはカルムスチン/チオテパ化学療法 group E の2次治療(地固め療法)を受けました。2年無増悪生存割合は,全脳照射で80%,幹細胞移植で69%であり有意な差がありませんでした。幹細胞移植で2例の化学療法死がありました。この効果はほぼ同等であり,全脳照射による認知機能低下を考えて治療法を選択するべきだと結論しています。
血液幹細胞移植を用いる大量化学療法
Illerhaus G, et al.: High-dose chemotherapy with autologous haemopoietic stem cell transplantation for newly diagnosed primary CNS lymphoma: a prospective, single-arm, phase 2 trial. Lancet Haematol, 2016
ドイツで行われた多施設共同研究です。導入として,5コースのリツキシマブと4コースの大量メソトレキセート 8000 mg/m2を投与します。それから,リツキシマブ,シタラビン,チオテパを2コース投与します。3週間後に,自己血幹細胞移植を用いてリスキシマブ,カルムスチン BCNU 400 mg/m2,チオテーパ 2x5mg/kg の大量化学療法 HCT-ASCT を行います。腫瘍が消失しなかった患者さん non-CR のみに放射線治療が加えられました。79人の患者さんのうち,73人でHCT-ASCTが行われ,61人(77%)でCRが得られました。4人 (5%) で治療関連死が生じました。チオテーパとBCNUの大量化学療法は若い患者さんには有効な選択肢であると結論しています。
やはり治療関連死が数%でる治療法ですから日本で行うことは難しいかもしれません。またCR完全寛解導入が77%でできているのですが,5年無増悪生存割合がまだわかっていません。再発率が予想より高いという結果が出るのかもしれないです。
MATRixレジメン:シタラビン,チオテパ,リツキシマブを加える
Ferreri AJ: Chemoimmunotherapy with methotrexate, cytarabine, thiotepa, and rituximab (MATRix regimen) in patients with primary CNS lymphoma: results of the first randomisation of the International Extranodal Lymphoma Study Group-32 (IELSG32) phase 2 trial. Lancet Haematol. 2016
MTXにシタラビンを加える,さらにリツキシマブを加える,そしてさらにチオテパを加える3群が試されました。その後に放射線治療あるいは自己幹細胞移植が加えられています。219例の患者さんが登録されCR割合がprimary endopointでした。70歳までの患者さんではMATRixは有望性のある治療法だと結論しています。化学療法死が数%ありきついものです。
テモゾロマイドを維持療法として使う
Glass J: Phase I and II Study of Induction Chemotherapy With Methotrexate, Rituximab, and Temozolomide, Followed By Whole-Brain Radiotherapy and Postirradiation Temozolomide for Primary CNS Lymphoma: NRG Oncology RTOG 0227. J Clin Oncol. 2016
MTXとリツキシマブにテモゾロマイドを加えた導入化学療法,全脳照射による地固め,その後に1年までくらいテモゾロマイド維持化学療法が行われました。2年生存割合は81%に達したとのことです。53例の第2相試験であり信頼性は高くはありません。
血液幹細胞移植を用いる大量化学療法
Omuro A, et al.: R-MPV followed by high-dose chemotherapy with TBC and autologous stem-cell transplant for newly diagnosed primary CNS lymphoma. Blood 125: 1403-1410, 2015
Sloan-Ketteringからの報告です。リツキシマブ,メトトレキサート MTX (3.5g/m2),プロカルバジン,ビンクリスチンを用いるR-MPV併用化学療法が有効であった32人の患者さんが,地固め大量化学療法(チオテパ,シクロフォスファミド,ブスルファン)と自己血液幹細胞移植を受けました(HDC-ASCT.)。年齢中央値57歳と若く,KPSは80と良好な母集団です。R-MPVの奏功割合は97%であり,26 (81%) 人の患者さんが HDC-ASCTを受けることができました。無増悪生存期間中央値 PFS と全生存期間中央値 OS は45ヶ月を越えました。2年PFSは79%,2年OSは81%でした。移植ができた患者さんではPSもOSも81%です。治療関連死は3例 (9%) でした。認知機能が保たれ神経毒性のない治療であると結論されています。米国では可能でも,日本においては治療関連死3例 9%は厳しい化学療法だと言えます。
テモゾロマイドの効果:60歳以上の患者さんでの試験
Omuro A: Methotrexate and temozolomide versus methotrexate, procarbazine, vincristine, and cytarabine for primary CNS lymphoma in an elderly population: an intergroup ANOCEF-GOELAMS randomised phase 2 trial. Lancet Haematol. 2015
MTXにプロカルバジン,ビンクリスチン,シタラビンを加えるか,テモゾロマイドを加えるかが,60歳以上の98例の患者さんで試されました。放射線治療は行われていません。1年PFSは両者ともに36%でした。FPS中央値は3剤を加えると9.5ヶ月,テモゾロマイドでは6.1ヶ月でした。多剤併用化学療法をテモゾロマイド単独に置き換えることはできず,おそらく,いずれも再発(再燃)まで数ヶ月しかないということです。
メソトレキセート大量化学療法にリツキサンを加えた方が良い
Gregory G, et al.: Rituximab is associated with improved survival for aggressive B cell CNS lymphoma. Neuro Oncol 15: 1068-1073, 2013
オーストラリアの4つの大きな施設からの報告です。120例のB細胞脳リンパ腫の治療を分析すると,メソトレキセート大量化学療法にリツキサン rituximabを加えた例で生存期間が長かったとのことです。
全脳照射の線量を23.4 Gyに落とす
Morris PG, et al: Rituximab, methotrexate, procarbazine, and vincristine followed by consolidation reduced-dose whole-brain radiotherapy and cytarabine in newly diagnosed primary CNS lymphoma: final results and long-term outcome. J Clin Oncol 31:3971-3979, 2013
MTX,リツキサン,プロカルバジン,ビンクリスチンの化学療法後に,腫瘍が消失した例 CRでは,地固めとして23.4グレイの全脳照射と更にシタラビンが使用されました。腫瘍が消失しない場合には,標準的な45グレイ?が提案されました。中央年齢60歳,52人の患者さんで,31人(60%)がCRになりました。この群での2年無増悪生存割合は77%,無増悪生存期間中央値は7.7年です。全体52人での生存期間中央値は6.6年でした。
「解説』45グレイってどこの標準なんでしょうね。はっきり言えることは,導入化学療法で腫瘍が消失する例では,全脳照射の線量を落とせる可能性があるということです。でもやはり化学療法では40%ほどが完全寛解(腫瘍消失)に至りません。
全脳照射を行わないで大量化学療法をする
Rubenstein JL, et al.: Intensive chemotherapy and immunotherapy in patients with newly diagnosed primary CNS lymphoma: CALGB 50202 (Alliance 50202). J Clin Oncol 3:3061-3068, 2013
導入化学療法はMTX, テモゾロマイド,リツキサンです。その後に,地固め大量化学療法として,エトポシドとシタラビンが使用されました。全脳照射はしません。初期治療後のCR割合は66%で,2年無増悪生存割合は0.57でした。
「解説」控えめに見るのが当然ですから,半数くらいが2年以内に再発すると考えたほうがいいでしょう。
脳リンパ腫の手術
外科手術の役割は確実な病理診断を得るために組織をとるということであり,定位脳手術で生検をするべき。開頭手術で腫瘍をたくさん取る (debulking) という手術のメリットは証明されていない。内照射という脳の内部から放射線をあてるような特殊な状況下では生検術以外の手術もあるかもしれない。
Liu B-L, et al. Limited role of surgery in the management of primary central nervous system lymphoma (Review), Oncol Rep 22: 439-449, 2009
解説:脳外科の先生は大きな腫瘍を見つけると開頭手術を勧めがちです。理由は,腫瘍を取ってみないと診断がつかないから治療方針が立たない。生検術だと病理診断を間違うことがあるからたくさん取るために開頭する。腫瘍が大きいから脳の腫れと圧迫をとるために緊急の開頭手術をしなければならない。これらの理由は多くの場合,本当ではありませんので安易に開頭手術を受けてはいけません。
MTXとリツキサンを使った化学療法
Shah GD, et al. Combined immunochemotherapy with reduced whole-brain radiotherapy for newly diagnosed primary CNS lymphoma. J Clin Oncol 25: 4730-4735, 2007
30人(年令中央値57歳)のリンパ腫の患者さんに,5コースから7コースのR-MPV (リツキシマブ,メトトレキサート,プロカルバジン,ビンクリスチン)化学療法が投与されました。7コースの化学療法の後では78%の患者さんで腫瘍が消えました。腫瘍の完全に消えた(CR)患者さんは23.4グレイの全脳照射を受けて,腫瘍が完全に消えなかった患者さんは45グレイの全脳照射を受けました。放射線治療のあとでさらに2コースの大量のシタラビンが投与されています。2年の全生存割合は67%で,無増悪生存割合は57%でした。MPV化学療法にリツキシマブを加えると,好中球減少が顕著になるとのことです。この23.4グレイの全脳照射は認知機能を落とさなかったそうです。
約6割の患者さんで治療後に再発などなくて2年が経過するという良好な結果です。MTXを基剤とした併用化学療法にリツキサンを加えると腫瘍が消失する割合(奏功率)が明らかに上がるようです。全部の脳にあてる放射線治療の量が後遺症としての認知障害(痴呆)を決めますから,この化学療法を使えば放射線の量を減らすことができるであろうと推定されています。日本では一般的にMTX大量化学療法の後は,30グレイの全脳照射ですからそれよりも少ないです。
MTXが効かない時,血液幹細胞救援を用いた化学療法
Soussain C, et al.: Intensive chemotherapy followed by hematopoietic stem-cell rescue for refractory and recurrent primary CNS lymphoma: Societe Francaise de Greffe de Moelle Osseuse-Therapie Cellulaire. J Clin Oncol 26: 2512-2518, 2008
MTX大量化学療法に抵抗性のリンパ腫患者さん43人(年令23-65歳)になされた治療です。まず,チオテーパとシタラビンを2コースの化学療法がされます。治療関連死が3人でした。20人(47%)の患者さんで治療効果がみられました。さらに27人の患者さんでは,チオテパ,ブスルファン,シクロフォスファミドを使う大量化学療法と血液幹細胞救援が追加されました。この27人の患者さんの内の26人で腫瘍がいったんは消えました (complete remission)。 生存期間中央値は大量化学療法を受けれた患者さんで58.6ヶ月にもなり,2年生存率は69%です。
この結果は,血液幹細胞救援と大量化学療法が脳のリンパ腫にかなり有効であることを示してます。しかし,対象となった患者さんの年令の中央値が52歳であって,かなり若い患者さんでの成功例が多いと理解しなければなりません。脳のリンパ腫の発生年令はもっと高い所に平均値があります。MTX化学療法が効かない患者さんには用いる価値のある,けれどもきつい化学療法です。
大阪大学 平賀先生の有名な論文
Hiraga S, Arita N, Ohnishi T, et al.: Rapid infusion of high-dose methotrexate resulting in enhanced penetration into cerebrospinal fluid and intensified tumor response in primary central nervous system lymphomas. J Neurosurg 91: 221-230, 1999
古い文献です。メトトレキサート(MTX)という薬剤の大量療法とその後で30Gyの全脳照射をする治療法が書かれています。この論文の治療成績を確認するために,兵庫医大の有田憲生先生が全国共同研究をしました。
メトトレキサート(メソトレキセート)だけで認知機能障害は生じるか
Fliessbach K, et al. Neuropsychological outcome after chemotherapy for primary CNS lymphoma: a prospective study. Neurology 64: 1184-1188, 2005
MTXメトトレキサートを基剤とした化学療法だけで,放射線治療なしで治療を受けて,生存した23人の患者さんの認知機能(知能)と生存の質(QOL)を調査した研究です。前向き研究prospective studyです。治療後に22人の患者さんでは,認知機能は同じか治療前より改善していたとのことです。11人(43%)で軽度の認知機能障害があったのですが,これは治療の副作用というよりも腫瘍(リンパ腫)によって脳の機能が落ちていたためでした。19人(83%)が良い状態で生活していました(good QOL)。8人で脳の白質に異常がみられたのですが,これは認知機能の低下との関連はありませんでした。 MTXを基剤とした多剤併用化学療法のみで治療された場合には,顕著な認知機能障害は起こらないと結論されています。
確かに成人ではMTXの大量化学療法のみでは認知機能は落ちないのかもしれません。問題は,放射線治療とMTXの併用がなされた時ですが,この時は認知機能は落ちます。脳のリンパ腫を化学療法単独で治すことは難しいので,結局のところ放射線治療との併用がされることが多いのです。放射線治療を先にして,後でMTXを使うと白質脳症がより高度になります。
中枢神経原発リンパ腫 PCNSLの定義
初発時に中枢神経系外(眼窩内を除く)にはリンパ腫病巣を認めない、かつ他臓器リンパ腫由来の転移性中枢神経リンパ腫は含まないとされるので,リンパ腫の既往歴がないこと,さらに全身検索を一応しないと診断はできない。60歳以上の高齢者が3分の2を占め,欧米とは異なり日本ではエイズに合併する例は稀である。ほとんどの例 (>95%) が非ホジキンリンパ腫 (non-Hodgkin lymphoma, NHL)でB細胞由来のびまん性大型B細胞リンパ腫 (diffuse large B-cell lymphoma)である。なぜPCNSLが中枢神経から外に転移することが稀なのかの理由は不明。
PCNSLの髄液内播種(髄膜播種,meningeal dissemination, CSF seeding)
PCNSLの髄膜播種 meningeal disseminationは,10%とも40%ともいわれる。PCNSLが再発しやすいのは髄液中にリンパ腫細が胞存在し,抗がん剤の静脈投与や全脳照射では髄液中に浮遊する腫瘍細胞を根絶できないためとする意見もある。しかし実際に,MRIで脊髄表面あるいは大脳脳溝に播種をみることは稀であり, その意味においては頻度はとても低いと言える。
髄液細胞診 CSF cytomorphologyでの偽陽性や偽陰性は多く,確実な診断は必ずしも容易ではない。偽陽性になる場合には,髄液中に反応性に出たリンパ球を悪性リンパ腫細胞と誤認することである。一方,偽陰性となる場合には,採取した髄液量が少なくて陽性にならないこと,細胞診の前にステロイドを使用してしまった場合(一時的にも腫瘍細胞が消失する)である。髄液から十分な細胞数が採取できて,多量のリンパ腫細胞が確認できた場合と,免疫組織染色やCDR3 PCRが可能であれば確診ができる。
診断の不確実性からしても,髄液播種が予後因子となるか否かに関しては議論がある。しかし,少なくとも治療開始前に,髄液細胞診と脊髄のMRIを行なう努力はすべきである。予防的に髄液内へMTXの注入をする治療プロトコールもあるが一般的ではない。脳室内にチューブ・リザーパーを留置するか腰椎穿刺を繰り返し行なわなければならいこと,髄膜炎併発の危険性,放射線治療と併用すれば白質脳症のリスクが高まるためである。
十分な診断と治療開始時期の遅れの間のジレンマ
診断価値の高い単純CTに始まり,MRI,増強MRI,脊髄MRI,定位生検術(凍結標本HE,免疫組織染色による確定診断),眼科診断,血液検査(LDH, IL2-R),,胸腹部増強CT,ガリウムシンチ,髄液細胞診, FDG-PET,血液内科での骨髄穿刺など必要な治療前検査をあげればきりがないのかもしれない。さらに加えて,生命予後が不良な悪性疾患であり,治療侵襲が高い化学療法を行なうので,患者さんと家族への病態説明と治療法選択のインフォームドコンセントには予想以上に時間をとられる。
しかし,PCNSLの病勢の悪化は時として極めて早いので,十分な検査を行うことと,患者さんの機能予後を守るということは,しばしば背反する。PCNSLを疑った場合に最も大切なことは,画像上で類似する膠芽腫や転移性脳腫瘍よりも,PCNSLの増大速度が速いことを念頭におくことである。膠芽腫と同様なタイムテーブルで検査と治療計画をしてはならない。
特に,脳幹部,視床,大脳基底核,脳梁,海馬などを侵すリンパ腫が,急速に症状を悪化させる場合には,それらの部位に不可逆的な脳組織破壊をもたらしていると想像した方がよいし,また事実,化学療法が奏効しても高次脳機能障害をはじめとする神経脱落症状を残すことが多い。
開頭腫瘍摘出術 (radical removal) もこの意味においては術後補助療法の開始を遅らせる要因となり,腫瘍摘出割合と予後が関連しないことを考えても,患者さんには何の利益ももたらさない有害な手段といえるかもしれない。PCNSLを疑った場合には,できれば即刻,CT or MRI guideの定位生検術をするべきであろうし,開頭としても低侵襲な小開頭によるopen biopsyがよい。
ステロイドはリンパ腫細胞に対してcytocidal effectが強い。病勢の進行が早いので症状悪化を食い止めようと,ステロイドを投与して時間稼ぎをしようとすれば,一時的にではあるが病巣の壊死を招き,生検術をしても確定病理診断できないという結果にもなる。
あえてあげれば,病理診断のための生検術(臨時あるいは緊急手術)をできる限り早い日程で決定すること,それと同時にPCNSLの仮定診断のもとに患者さん側への説明と化学療法の開始を準備しながら,必須の諸検査を間に立てていくことであろう。症状の増悪が早ければ生検術の直後からのステロイドの投与開始はやむを得ない。