タイトルと同名の文献の一部を紹介1。この論文は、顆粒球マクロファージ コロニー刺激因子 (GM-CSF) は、もともと骨髄前駆細胞の顆粒球とマクロファージへの分化を誘導する刺激物として同定された造血増殖因子です。 GM-CSF は現在、多起源の多面発現性サイトカインであると考えられています。 GM-CSF 受容体シグナルは JAK2 を活性化し、JAK-STAT、MAPK、PI3K、およびその他の経路を通じて核シグナルを誘導します。肺サーファクタントの代謝と肺胞マクロファージの成熟と分化を促進することに加えて、GM-CSF は間質性肺疾患、アレルギー性肺疾患、アルコール性肺疾患、肺の細菌、真菌、ウイルス感染症において重要な役割を果たします。
サーファクタントとGM-CSFによる界面活性の恒常性
肺サーファクタントは、約 90% の脂質と 10% のタンパク質で構成されています。脂質の約 80 ~ 90% はリン脂質で、界面活性剤関連タンパク質には SP-A、SP-B、SP-C、および SP-D が含まれます。これらのタンパク質はリン脂質成分の細胞内輸送に関与し、肺胞における界面活性剤特性の維持に寄与します 2,3。界面活性剤のリン脂質とタンパク質はⅡ型肺胞上皮細胞(AT2)によって合成され、分泌されます4,5 。界面活性剤は気液界面で単層および多層を形成して表面張力を低下させ、肺胞の崩壊を防ぎます。界面活性剤は、機械的または生物学的作用によって不活性な小さな凝集粒子となり、AT2および 肺胞マクロファージ(AM) によって吸収、再利用、または分解されます6 。
GM-CSF欠損マウスにおける代謝研究では、GM-CSF欠損マウスの肺胞における界面活性剤の蓄積は、GM-CSFシグナル伝達の欠如が界面活性剤の異化作用を損なう一方、界面活性剤の異化作用が損なわれないことが原因であることが示されている。そのリン脂質およびタンパク質の合成または分泌を直接変更します7 。 GM-CSF欠損マウスから単離されたAMのin vitro研究では、SP-Aおよび界面活性剤リン脂質の異化における重大な欠陥、ならびにAMによるSP-AおよびDPPCの分解の顕著な減少が確認された8。さらに、肺における GM-CSF 発現が増加したマウスは、AM におけるサーファクタント異化速度の増加を示しますが、GM-CSF 欠損マウス AM によるサーファクタント成分の取り込みは妨げられません7 。これらの結果は、GM-CSFシグナル伝達が存在しない場合、界面活性剤のホメオスタシスにおける主な欠陥は、AMによる界面活性剤タンパク質および脂質の異化作用が不十分であることによって引き起こされることを示唆しており7、これは、細胞の増殖のためにAT2からのGM-CSFシグナル伝達が必要であることと関連している可能性がある。 AM の開発と分化。これは、AT2 と AM の間に相互に有益な共生関係があることも示しています。 AT2 由来 GM-CSF は、PU.1 および PPAR-γ の発現を促進することで AM の発生を誘導します。次に、成熟した AM は、AT2 によって生成される界面活性剤を分解し、肺胞環境のバランスを維持するために不可欠です (図2)。
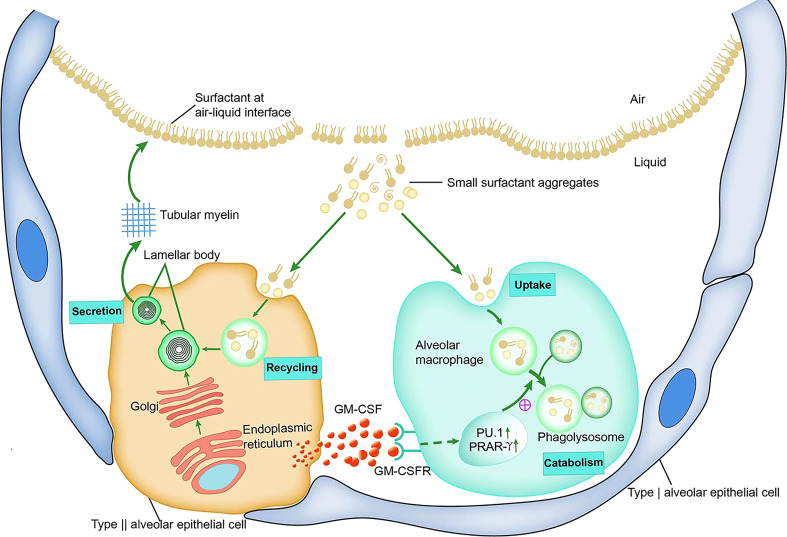
CCBY Chen, Li, Hua, Liang, Song1
GM-CSFと間質性肺疾患
間質性肺疾患 (ILD) には、肺実質の炎症と線維症を特徴とする一群の不均一性肺疾患が含まれます。 GM-CSF は肺線維症の進行に関与しています。気管支肺胞洗浄液中の GM-CSF 産生は、肺線維症患者で増加します 9。 GM-CSFはマクロファージを刺激して線維化促進性サイトカインを産生させ、気道平滑筋細胞の線維化を直接誘導することができます10,11 。自己免疫または炎症機構は、ILD に関連する結合組織病 ( CTD – ILD) の病因において重要な中心的役割を果たしています12,13 。
自己免疫性関節炎のモデルである SKG マウスを酵母多糖類で治療すると、慢性進行性 ILD が発症します。これらのマウスは、肺線維症を伴う、Th17 細胞、GM-CSF 産生 CD4+ T 細胞、CD11b+Gr1+ 好中球の大量の肺浸潤を示します。ナイーブ SKG マウス T 細胞は GM-CSF 産生細胞に分化します。これらはマクロファージによるIL-6およびIL-1βの産生を増強し、それによってIL-17Aおよび/またはGM-CSF産生T細胞の分化と肺への好中球の浸潤を促進します。 GM-CSFの中和はILDの発症を阻止するが、IL-17Aの中和は阻止しないことから、SKGマウスにおけるILDの発症にはIL-17AではなくGM-CSFが重要であることが示唆される14。また、GM-CSFがILD発症において重要な役割を果たすことも示したが、これらの著者らは、IL-17A+GM-CSF+好中球がカードラン処理SKGマウスの肺に浸潤した主な炎症細胞であると信じていた15。
SKGマウスにおける重度の間質性肺疾患の発症には、IL-17ではなくGM-CSFが重要である14
ザイモサンで治療した SKG マウスにおける ILD の病理学的および臨床的特徴は、ヒトの重度 CTD-ILD の特徴と類似していました。このマウスの ILD は、Th17 細胞、GM-CSF 産生 CD4 + T 細胞、および線維化を伴う CD11b + Gr1 +好中球の大量浸潤を特徴としていました。ナイーブ T 細胞は GM-CSF 産生細胞に分化するように偏っており、T 細胞によって分泌される GM-CSF はマクロファージによる IL-6 および IL-1β の産生を増強し、その結果、IL-17A および/または GM の分化が増強されました。
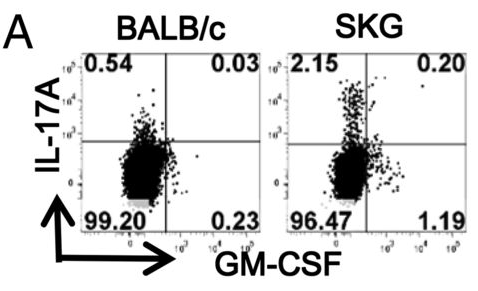
Fig4 A SKG T 細胞は、IL-17A 産生細胞と GM-CSF 産生細胞に分化するように偏っていました。14
GM-CSF の中和により、浸潤した総 CD4 + T 細胞(特に IL-17A、GM-CSF、および IL-6 産生 CD4 + T 細胞)、CD11b + Gr1 +好中球、および IL- 6 – CD11b + Gr1 −マクロファージ/単球を生成します。対照的に、IL-6 シグナルの遮断により減少したのはCD11b + Gr1 +好中球の細胞集団のみであり、IL-17A 中和ではいずれも減少しませんでした。注目すべきことに、主要なGM-CSF産生細胞であるGM-CSF + IL-17A – CD4 +細胞の数は、GM-CSFの中和および部分的にIL-6シグナルの遮断によって減少した。+ IL-17A +細胞は GM-CSF 中和によってのみ減少しました。これらの結果は、このマウスの ILD を治療する最も強力な分子標的は GM-CSF であり、IL-17A、GM-CSF 産生 CD4 + T 細胞、IL-6 産生 CD11b + Gr1 –マクロファージの浸潤であることを実証しました。 単球、およびCD11b + Gr1 +好中球は、ザイモサン処理SKGマウスにおけるILDの発症においてGM-CSFアップレギュレーションに続いて進行し、GM-CSFの中和によって阻害することができた。
GM-CSFの中和は、ILDの発症後であってもザイモサン処置SKGマウスにおけるILDの進行を阻害した。これらの結果は、GM-CSFの中和がヒトの重度CTD-ILDの治療戦略として高い可能性を示唆する。
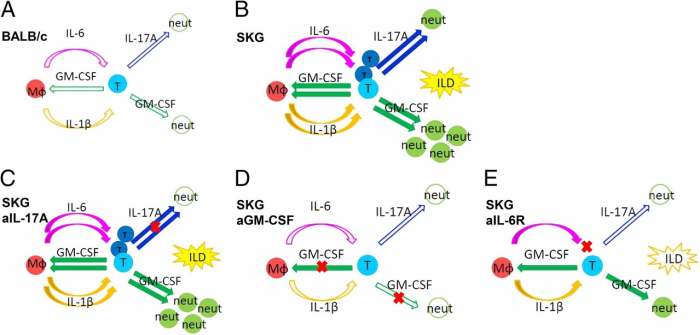
Fig 8 SKGマウスにおけるILDの発症におけるGM-CSFの役割のモデル。 ( A ) ザイモサン処理した BALB/c マウスの T 細胞は、マクロファージ刺激に応答して産生する GM-CSF または IL-17A の量が減少し、IL-17A および GM-CSF 産生 T 細胞の増殖の悪循環は生じません。悪化した。 ( B ) ザイモサン処理した SKG マウスの T 細胞は、マクロファージのサイトカイン産生を刺激する GM-CSF を優先的に産生し、その結果、IL-17A および GM-CSF 産生 T 細胞増殖の悪循環が悪化しました。 ( C – E ) ザイモサン処理 SKG マウスにおける IL-17A 中和 (C)、GM-CSF 中和 (D)、および抗 IL-6R Ab (E) 処理のモデル。14
References
- 1.Chen Y, Li F, Hua M, Liang M, Song C. Role of GM-CSF in lung balance and disease. Front Immunol. 2023;14:1158859. doi:10.3389/fimmu.2023.1158859
- 2.Tlatelpa-Romero B, Cázares-Ordoñez V, Oyarzábal LF, Vázquez-de-Lara LG. The Role of Pulmonary Surfactant Phospholipids in Fibrotic Lung Diseases. IJMS. Published online December 25, 2022:326. doi:10.3390/ijms24010326
- 3.Krygier A, Szmajda-Krygier D, Świechowski R, et al. Molecular Pathogenesis of Fibrosis, Thrombosis and Surfactant Dysfunction in the Lungs of Severe COVID-19 Patients. Biomolecules. Published online December 10, 2022:1845. doi:10.3390/biom12121845
- 4.CALKOVSKA A, KOLOMAZNIK M, CALKOVSKY V. Alveolar Type II Cells and Pulmonary Surfactant in COVID-19 Era. Physiol Res. Published online December 14, 2021:S195-S208. doi:10.33549/physiolres.934763
- 5.Andreeva AV, Kutuzov MA, Voyno-Yasenetskaya TA. Regulation of surfactant secretion in alveolar type II cells. American Journal of Physiology-Lung Cellular and Molecular Physiology. Published online August 2007:L259-L271. doi:10.1152/ajplung.00112.2007
- 6.IKEGAMI M. Surfactant catabolism. Respirology. Published online January 2006. doi:10.1111/j.1440-1843.2006.00803.x
- 7.Trapnell BC, Whitsett JA. GM-CSF Regulates Pulmonary Surfactant Homeostasis and Alveolar Macrophage-Mediated Innate Host Defense. Annu Rev Physiol. Published online March 2002:775-802. doi:10.1146/annurev.physiol.64.090601.113847
- 8.Yoshida M, Ikegami M, Reed JA, Chroneos ZC, Whitsett JA. GM-CSF regulates protein and lipid catabolism by alveolar macrophages. American Journal of Physiology-Lung Cellular and Molecular Physiology. Published online March 1, 2001:L379-L386. doi:10.1152/ajplung.2001.280.3.l379
- 9.Taniguchi H, Katoh S, Kadota J, et al. Interleukin 5 and granulocyte-macrophage colony-stimulating factor levels in bronchoalveolar lavage fluid in interstitial lung disease. European Respiratory Journal. Published online November 1, 2000:959-964. doi:10.1183/09031936.00.16595900
- 10.Xing Z, Braciak T, Ohkawar Y, et al. Gene transfer for cytokine functional studies in the lung: the multifunctional role of GM-CSF in pulmonary inflammation. Journal of Leukocyte Biology. Published online April 1, 1996:481-488. doi:10.1002/jlb.59.4.481
- 11.Shiomi A, Usui T. Pivotal Roles of GM-CSF in Autoimmunity and Inflammation. Mediators of Inflammation. Published online 2015:1-13. doi:10.1155/2015/568543
- 12.Vij R, Strek ME. Diagnosis and Treatment of Connective Tissue Disease-Associated Interstitial Lung Disease. Chest. Published online March 2013:814-824. doi:10.1378/chest.12-0741
- 13.de Lauretis A, Veeraraghavan S, Renzoni E. Review Series: Aspects of Interstitial lung disease: Connective tissue disease-associated interstitial lung disease: How does it differ from IPF? How should the clinical approach differ? Chron Respir Dis. Published online January 23, 2011:53-82. doi:10.1177/1479972310393758
- 14.Shiomi A, Usui T, Ishikawa Y, Shimizu M, Murakami K, Mimori T. GM-CSF but Not IL-17 Is Critical for the Development of Severe Interstitial Lung Disease in SKG Mice. The Journal of Immunology. Published online July 15, 2014:849-859. doi:10.4049/jimmunol.1303255
- 15.Kwon OC, Lee EJ, Chang EJ, et al. IL-17A+GM-CSF+ Neutrophils Are the Major Infiltrating Cells in Interstitial Lung Disease in an Autoimmune Arthritis Model. Front Immunol. Published online July 2, 2018. doi:10.3389/fimmu.2018.01544

