遺伝子治療
AAVベクターによる遺伝子治療
AAV(アデノ随伴ウイルス)は自然界に存在するありふれたウイルスのひとつで、多くの人が気づかぬうちに感染していますが、それ自身では増えることはできず、病気を引き起こすことはありません。これまでの研究により、AAVをもとに人工的に作られたAAVベクター(運び屋)は、体内に効率よく目的の遺伝子を導入することで、長期にわたって目的の蛋白質を合成することができるということがわかっています。AAVベクターは、神経細胞に多く発現する、受容体を介して、細胞内に取り込まれます。そのために神経疾患の治療に適しています。ベクターは、不要なウイルス自体の遺伝子を取り出し、その代わりに疾患の治療のための遺伝子を内包しています。ベクターを投与すると、エンドサイトーシスという、細胞に備わる機構で細胞内に取り込まれ、染色体(私たちの遺伝子の集合体)が格納されている核内に到達します。治療用の遺伝子はこの染色体に取り込まれずに安定して存在します。細胞に元々ある蛋白質合成装置を利用して、治療用の蛋白質を合成することが可能です。ベクターにより神経細胞に導入された治療用の遺伝子は10年以上、安定して働きます。
GLUT1欠損症の遺伝子治療開発
AAVベクターは、ウイルス由来の蛋白質の遺伝子を取り外して空いた部分に治療用遺伝子を載せることで、治療用ベクターとして治療に使用することができます。治験責任医師および共同研究を行っている製薬企業は、GLUT1欠損症の原因遺伝子のSLC2A1遺伝子を組み込んだAAVベクター、GT0006Xを開発しています。このGT0006Xを、GLUT1欠損症のモデルマウスに投与したところ、GLUT1欠損症の症状の1つである運動機能の向上に成功しました。また、このGT0006X投与マウスではSLC2A1遺伝子の活性が長期に渡り持続し、副作用も特に認められませんでした。このことから、GT0006XはGLUT1欠損症の患者さんに対しても同様に効果を発揮することが期待されます。
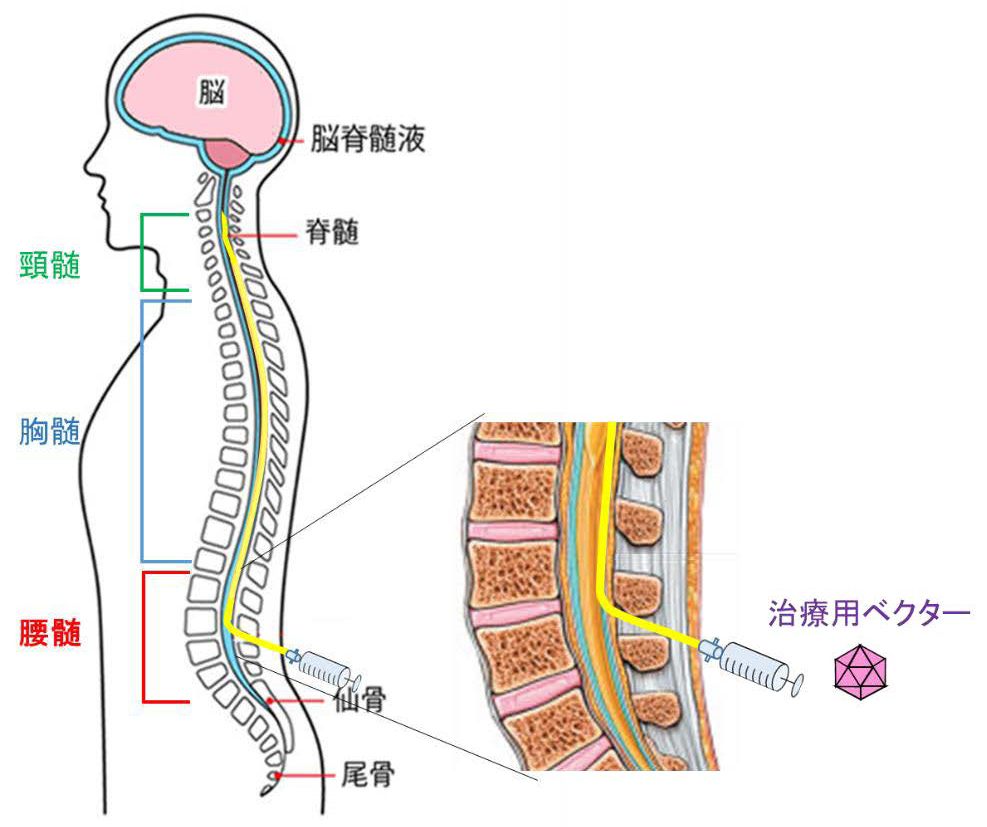
今回の治験では、GT0006Xを治験製品として、あなたの髄腔内に投与します。
なお、今回使用するGT0006Xは、人に対して初めて使用することになる治験製品です。AAVベクターを利用した他の遺伝子治療用製品としては、オナセムノゲン アベパルボベクという再生医療等製品があり、脊髄性筋萎縮症という病気に対して既に承認されています。今回使用するGT0006Xは、オナセムノゲン アベパルボベクで使用されているAAVベクターと同じ種類のAAVベクターを使用していますが、ベクターの外側のアミノ酸を一部改良しており、その点が少し異なります。
GT0006Xの投与は、背中から腰椎の間に注射用の針(髄注針)を穿刺してくも膜下腔(脊髄腔)まで挿入します。続いて、針の中に通したカテーテルを胸椎上部から頸椎のあたりの高さ(大槽)まで挿入して行います。投与後は、カテーテルを抜きます(図2)。
手術及び投与は手術室で行います。投与の際は局所麻酔をかけて行います。投与までの流れは、その時の状況に応じて多少変更する場合があります。
手術及び投与にかかる時間の目安は、麻酔を含めて1~2時間ほどです。また、GT0006Xの投与を行うのは治験期間を通して1回だけです。
なお、今回治験で使用するカテーテルは国に承認されている医療器具ではなく、このGT0006Xや類似の治療用ベクターを投与するために開発された器具です。現在、筋萎縮性側索硬化症に対する遺伝子治療の治験で使用されています。このカテーテルときわめて似ている別の医療器具(他のお薬を腰椎から刺して脊髄に投与するためのカテーテル)があり既に国から承認されていますが、その医療器具は体内に留置(埋め込み)をして脊髄に継続的にお薬を投与することを前提に設計されているという違いがあります。今回使用するカテーテルは、GT0006Xのような治療用ベクターを投与する目的で開発されました。GT0006Xの投与量は、どれくらいの量を投与すると安全で効果があるのかを調べる目的で、2段階に設定されています。まず、この治験に参加いただいた最初の3名の患者さんでは、第1段階として少ない量(2 × 1012 vg/kg)を投与します。そして、その後に治験に参加いただいた別の3名の患者さんでは、第2段階として多い量(6 × 1012 vg/kg)を投与します。
投与にあたっては安全を期して、GT0006Xを投与してから少なくともおおよそ1ヵ月が経過するまでは、次の患者さんへGT0006Xを投与することはありません。投与後1ヵ月間の安全性を治験担当医師が検討し、問題が無いと判断された場合にのみ、以降の患者さんへの投与を行います。
また、この治験が第2段階の多い投与量に進む前には、第1段階の少ない量を投与した3名の患者さんのデータを独立安全性評価委員会と呼ばれる第三者委員会が総合的に検討し、第2段階の投与量を投与しても問題が無いと判断された場合にのみ、第2段階の投与量に進むことができます。
この独立安全性評価委員会は、この治験とは関わりのない専門家や医師で構成されているので、公正な立場で審査を行います。


