細胞分裂終了時における染色体パッセンジャー複合体の不活化に対するAPC/CCdh1ユビキチンリガーゼ複合体の役割
徳島大学大学院医歯薬学研究部 口腔生命科学分野 工藤保誠
Tsunematsu T, Arakaki
R, Kawai H, Ruppert J, Tsuneyama K, Ishimaru N, Earnshaw WC, Pagano M, Kudo Y. APC/CCdh1 is required for the termination of chromosomal passenger complex activity upon
mitotic exit. Journal of Cell Science, 133(18):jcs251314 (2020).
doi: 10.1242/jcs.251314
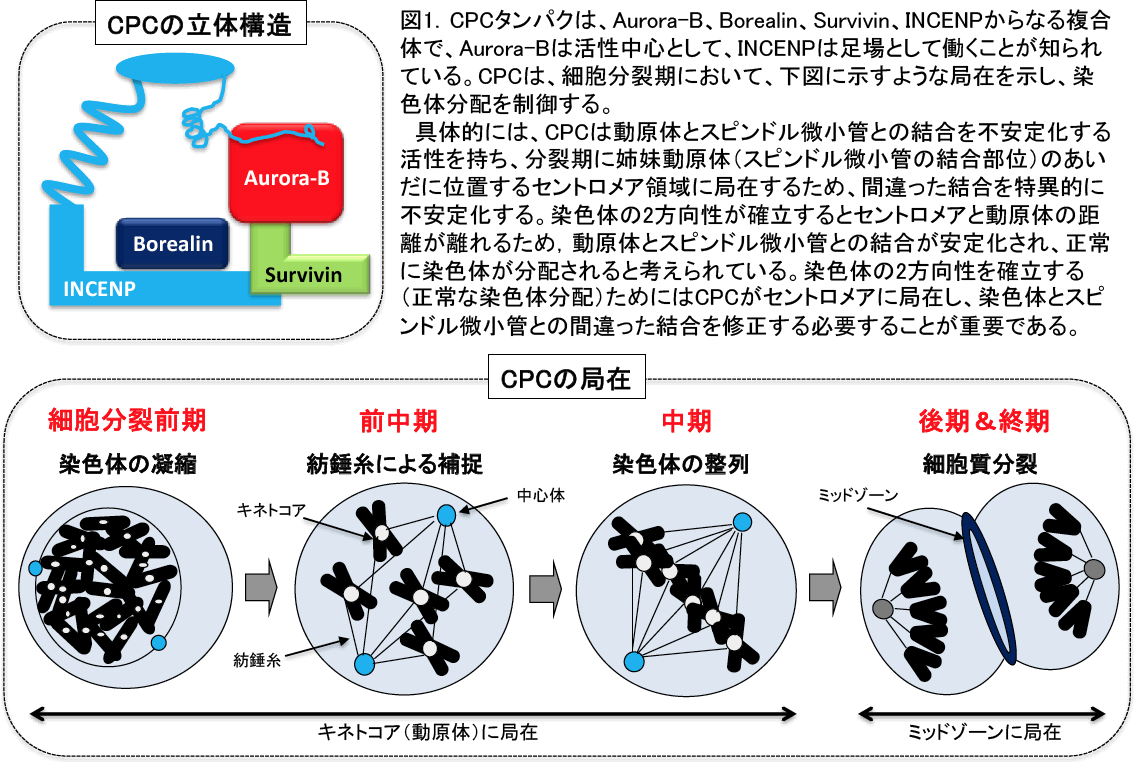
細胞分裂において複製した染色体を正確に分配することは、個体の発生や生命の次代への継承にとって必須である。染色体分配制御に必要不可欠な役割を果たすものとして染色体パッセンジャー複合体(Chromosome Passenger Complex: CPC)が知られており、酵母からヒトまで高度に保存されている。CPCは、その活性の中心となるAurora-Bキナーゼ、その活性を制御するSurvivinやBorealin、複合体の足場として働くINCENPの4つのタンパク質より構成されている(Ruchaud et al., Nat Rev Mol Cell Biol 8, 798-812, 2007)(図1参照)。CPCは、細胞分裂期からG1期に移行するとその機能を終えると考えられているが、未だその機構の詳細は明らかにされていない。今回、我々は細胞分裂後に、CPCタンパク質であるBorealinおよびAurora-BがAPC/CCdh1(Anaphase Promoting Complex/Cyclosome)ユビキチンリガーゼ複合体によりユビキチン分解され、CPCの機能を終えることを明らかにした。
ユビキチンープロテアソーム経路によるタンパク分解は、生命活動の場で広範な役割を担っており、その制御異常は、癌、神経変性疾患などの様々な疾病に関与することが明らかにされつつある。APC/Cユビキチンリガーゼ複合体は、数十個のサブユニットからなる大きな複合体で、時期特異的なユビキチン化に関わるアダプター因子であるCdc20やCdh1の可逆的な結合や構成サブユニットのリン酸化によってその活性が調節されている。Cdc20やCdh1は、C-boxやIR-tailと呼ばれる領域を介してAPC/C複合体に結合し、C末端にあるWD40ドメインを介して基質タンパクに存在するD-box (RxxL) あるいはKEN-box (KEN) と呼ばれる配列を認識して結合する。さらに、Cdc20やCdh1 は、D-boxやKEN-box以外にA-box (RxLxPSN)、CRY-box (CRYxPS)、GxEN-box (GxEN)、Spo13 D-box (LxExxN)、O-box (unknown sequence)といった配列も認識することが報告されている。本研究で着目したAPC/CCdh1複合体は、M期後期からG1期にかけて活性を示し、G1期においてCDK活性を低い状態に保つのに重要な役割を果たしている。過去に、Aurora-Bが分裂期後期〜G1期にAPC/CCdh1によりユビキチン分解されることが報告されている(Nguyen et al., FASEB J 23, 2741-2748, 2005; Stewart and Fang, Cancer Res 65, 8730-8735, 2005; Floyd et al., J Cell Sci 126, 2845-2856, 2013)。我々は、Borealinタンパク質の細胞周期における発現挙動がAurora-Bタンパク質に類似しており、APC/CCdh1の活性に相反することから、Borealinタンパク質もAPC/CCdh1によりユビキチン分解されるのではないかと考えた。我々の仮説のとおり、Borealinタンパク質はCdh1と結合し、Cdh1のノックダウンによりG1期でのユビキチン分解が抑制され、基質タンパク質であることが判明した。Aurora-Bは、C末端にあるD-box配列(RLPL)を認識してユビキチン化されることが知られている。しかし、Borealinは3つのD-box配列を有していたが、いずれもユビキチン化には必要ではなかった。欠失変異体や種で保存されたアミノ酸の変異体を用いた解析により、N末端に7つの疎水性アミノ酸(L21/F24/L25/F28/V32/W70/F74)がユビキチン化に必須であることを明らかにした。L21/F24/L25/F28/V32を含む20-KLASFLKDFDRV-32は、他の基質タンパク質との類似性を示すアミノ酸配列で、とくにL25のロイシン残基は多くの基質タンパク質で共通している。また、W70およびF74は、CPC複合体においてSurvivinとの結合に必須の部位であった。Survivinの過剰発現は、Borealinのユビキチン化を阻害し、Borealinと結合できない変異体(Survivin ΔEx 3)はBorealinのユビキチン化を阻害しないことから、SurvivinがCdh1とBorealinとの結合を競合するのではないかと考えた。実際に、これら7つのアミノ酸残基の変異体は、ユビキチン分解を受けない。
さらに、我々はAPC/CCdh1によるBorealinやAurora-Bの分解が阻害された際の恒常的なCPC活性の影響を調べるために、Cdh1ノックアウトマウスから採取された胎児線維芽細胞(MEF)を用いた。Cdh1-/-MEFでは、BorealinやAurora-Bタンパク質が細胞周期を通じて安定化し、Aurora-Bのキナーゼ活性も恒常的に活性化していることを見出した。これは、Cdh1-/-MEF では細胞分裂時のみではなく、恒常的にCPCが活性化していることを示している。Cdh1-/-MEFは、DNA複製の効率低下や早期の複製開始を示すことが知られているため(García-Higuera et al., Nat Cell Biol 10, 802-811, 2008)、M期開始時にAurora-B特異的キナーゼ阻害剤であるBarasertibを投与し、分裂後の間期でのAurora-B活性を阻害した。すると、Barasertib 投与によりDNA複製の効率低下や早期の複製開始が改善された。これは、恒常的なCPC活性が複製の効率低下や早期の複製開始に関わることを示唆している。
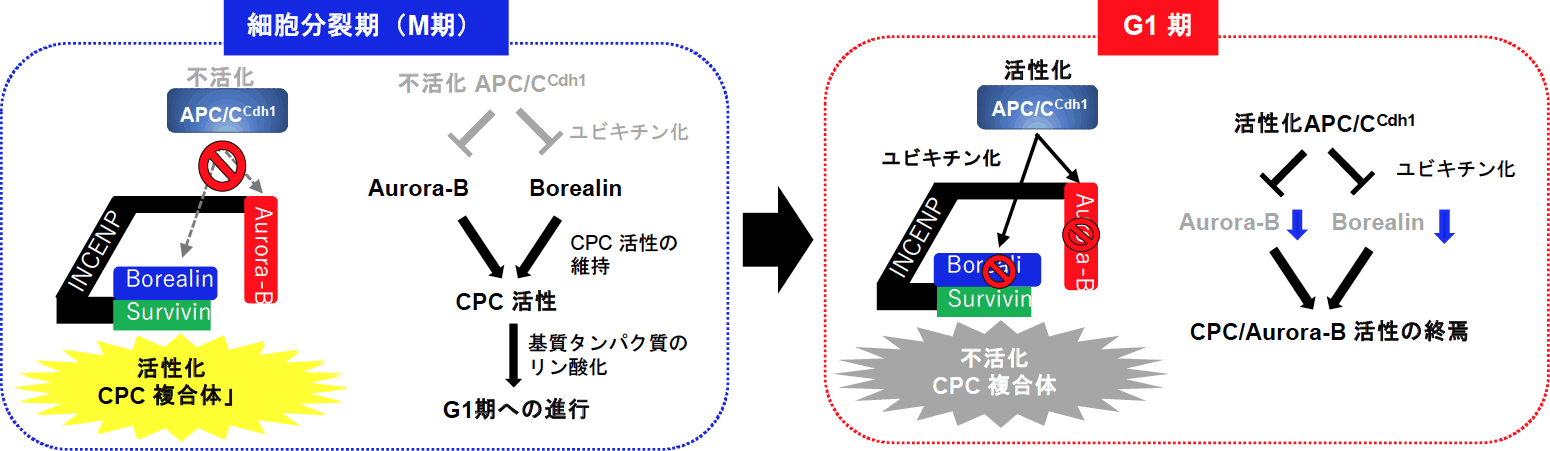
以上のように、細胞分裂後にAPC/CCdh1によるBorealinおよびAurora-Bタンパク質のユビキチン分解がCPC複合体の活性を消失させることを明らかにした(図2参照)。興味深いことに、CPCタンパク質は、種々の癌組織で高発現が報告されており、癌化への関与や治療の標的分子として近年注目されている。我々もAurora-BやSurvivinが口腔癌において高発現し、癌の悪性度とよく相関することを報告している(Qi et al., Virchows Arch 450, 297-302, 2007; Qi et al., Oral Oncol 46, 263-270, 2010)。CPCタンパク質の過剰発現は、染色体分配異常を引き起こし、染色体不安定性を介して癌化に関与すると考えられるが、これらタンパク質の過剰発現が起こる機序やそれによる癌化機構は未だ明らかにされていない。これら異常にAPC/CCdh1によるBorealinおよびAurora-Bタンパク質のユビキチン分解異常が関与しているかは未だ明らかにされていないが、今後の新たな研究課題である。