miR-142 が司る新たな好中球遊走制御機構の解明
miR-142はsmall GTPase を介した好中球細胞骨格制御による黄色ブドウ球菌感染創の改善に必須である
長崎大学大学院医歯薬学総合研究科(医学系)病理学
森亮一
Tanaka, K., Kim, S.E., Yano, H., Matsumoto, G., Ohuchida, R., Ishikura, Y., Araki, M., Araki, K., Park, S., Komatsu, T., Hayashi, H., Ikematsu, K., Tanaka, K., Hirano, A., Martin, P., Shimokawa, I., Mori, R.
MiR-142 is required for Staphylococcus aureus clearance at skin wound sites via small GTPase-mediated regulation of the neutrophil actin cytoskeleton.
J. Invest. Dermatol. 137:93 DOI: 10.1016/j.jid.2016.11.018 (2017)
https://www.sciencedirect.com/science/article/pii/S0022202X16326641?via%3Dihub
皮膚創傷治癒過程は、炎症期、増殖期、成熟期で構成される生体防御反応です。炎症期では、好中球が速やかに動員され、病原体感染防御に働きます。増殖期では、マクロファージが集まり、生理活性物質(サイトカイン、ケモカイン、増殖因子)の分泌および壊死組織片を貪食します。分泌された生理活性物質は、線維芽細胞や血管内皮細胞に作用して、肉芽組織形成に関与します。また、表皮細胞による再上皮化が行われて傷口が塞がれます。成熟期では、過剰に生産された細胞外基質が分解され、最終的に瘢痕(傷跡)が残ります。
糖尿病、肥満、免疫異常の患者さんは、治癒困難な難治性皮膚潰瘍を発症します。難治性皮膚潰瘍は、創部が長期にわたり露出状態となっているため、皮膚常在菌として知られている黄色ブドウ球菌(Staphylococcus aureus)などが創部で異常増殖します。そして感染が遷延すると、メチシリン耐性 S. aureus(MRSA)などの多剤耐性菌出現の原因となるため,院内感染を防ぐ観点からも,適切な治療が重要です。
microRNA(miRNA)は、標的 mRNA に結合し翻訳を抑制する非コード RNA です。私達は、炎症関連 miRNA として miR-142 ファミリー(miR-142-3p、miR-142-5p)を同定しました。miR-142 は,肥満細胞、樹状細胞機能、巨核球形成、リンパ球新生に関与しています。しかし、皮膚創傷治癒過程における miR-142 機能は、解明されていませんでした。そこで私達は、遺伝子改変マウス作製支援班の協力のもと(荒木正健、荒木喜美:熊本大学 生命資源研究・支援センター)、miR-142 KO マウスを作製し、S. aureus 感染皮膚創傷モデルを確立し、研究を行いました。
その結果 miR-142 KO マウスは、S. aureus 易感染と相まって、皮膚創傷治癒及び膿瘍形成の遅延が認められました。好中球は、膿瘍形成を通じて感染防御に働く重要な炎症細胞です。そこで私達は、miR-142 KO マウスのS. aureus 易感染の原因は、好中球の機能変化が要因であると推測し、さらに解析を進めました。膿瘍部位に集積している好中球を解析したところ、miR-142 KO 好中球は細長い形態を示し、S. aureus の認識機能並びに貪食能が低下していることがわかりました。
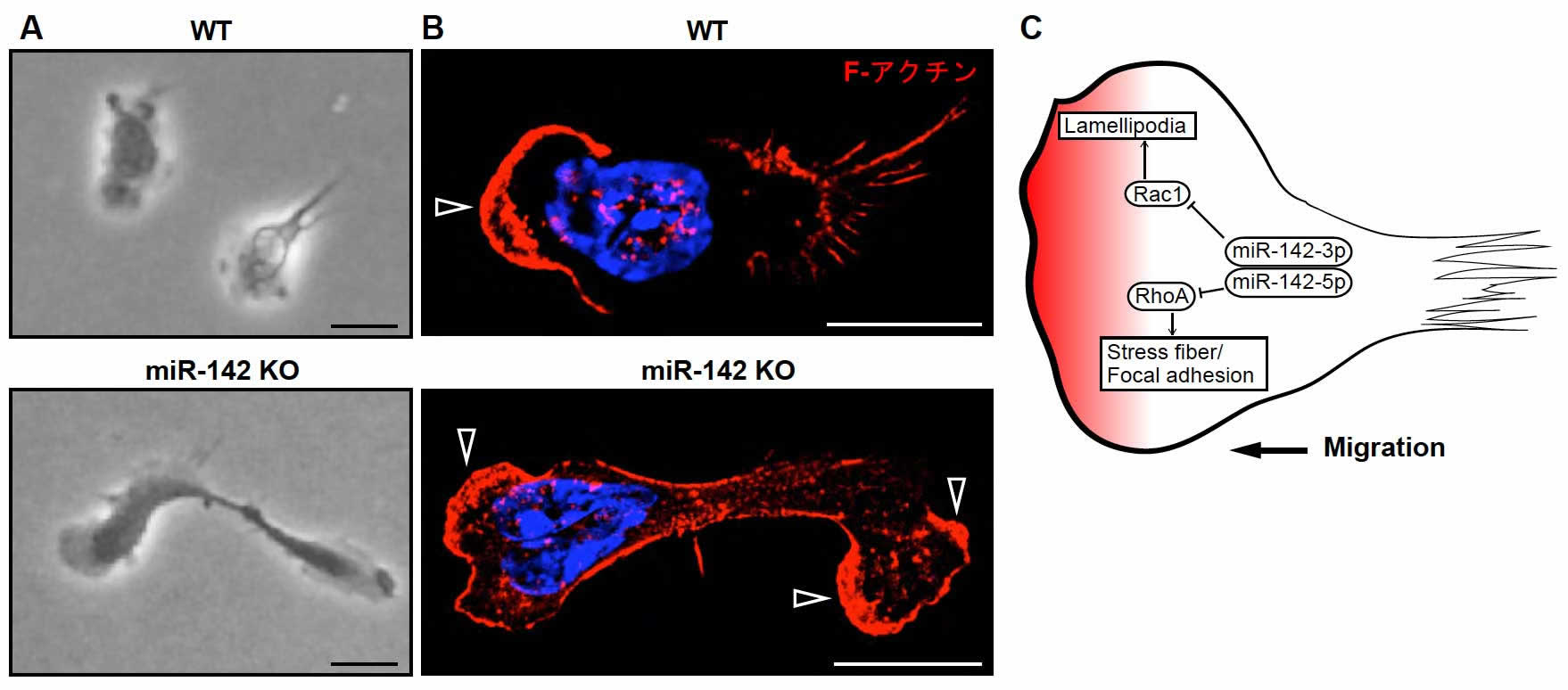
アクチンは、細胞運動や細胞形態に重要な細胞骨格形成に関わる蛋白質です。また miR-142 はバイオインフォマティクスにより、細胞運動に関与する低分子量 GTP 結合蛋白質ファミリー(RhoA、Rac1、Cdc42)の mRNA に結合することが示されています。私達は、細胞内の微細構造を高分解能で観察できる超解像顕微鏡を用いて、アクチンの構造解析を行いました。正常な好中球は、進行方向に高密度にアクチンに富む最先端(leading edge)を認めますが、miR-142 KO 好中球は、複数の leading edge 形成や後方退縮(uropod)の消失が観察されました。さらに、低分子量 GTP 結合蛋白質ファミリーの蛋白質発現量を調べた結果、miR-142 KO 好中球は、Rac1 及び RhoA 蛋白質量の上昇が認められました。さらに分子間相互作用を解析したところ、miR-142-3p はRac1 に、miR-142-5p は RhoA の mRNA 非翻訳領域に結合し,翻訳を抑制していることがわかりました。これら一連の解析より miR-142 は、好中球遊走における細胞極性制御に必須であることが明らかとなりました。今のところ、ヒトにおいて miR-142 遺伝子変異を示す患者さんは認められていません。私達の知見は、miR-142が未だ原因不明の好中球機能異常や免疫異常に関わる責任遺伝子として、新たに関連性を示すのではないかと推測しています。
図 好中球遊走における miR-142 の機能
(A)好中球遊走の様子。スケールバー:10 µm。
(B)超解像顕微鏡イメージング。△:leading edge。スケールバー:10 µm。
(C)好中球遊走における miR-142 ファミリーとRac1、RhoA 蛋白質翻訳抑制機構の模式図。
(関連論文より転載)