肺がんや悪性胸膜中皮腫といった胸部悪性腫瘍は予後不良の疾患で、本邦において肺癌は男性の死亡率第1位となっています。これまでに本疾患に対する治療法の開発が盛んに行われ、従来の化学療法に加えて、分子標的治療薬、血管新生阻害薬、免疫チェックポイント阻害薬、およびそれらを組み合わせた併用療法などが臨床応用されています。このように胸部悪性腫瘍に対する薬物療法は近年急速に進捗を示してはいるものの、依然として多くの課題が残されています。私たちの研究グループではこれらの課題の解決を目指し、以下に示す複数の研究テーマをもとに精力的に基礎および臨床研究を進めています。
1. 胸部悪性腫瘍に対する新規血管新生阻害療法の開発および耐性獲得機構の解明
血管内皮細胞成長因子(vascular endothelial growth factor; VEGF)は強力に血管新生を促進させることで各種悪性腫瘍の悪性化に寄与することが示されたことから、これまでに血管新生阻害薬の開発が精力的に進められ、現在抗VEGF抗体であるbevacizumabやVEGF受容体阻害薬が広く臨床で使用されています。一方で、これらの血管新生阻害薬に対する耐性機序の存在が示唆されていますが、その検討は十分ではなく、耐性克服が大きな課題となっています。
私たちは、担癌マウスを抗VEGF抗体で長期間治療を継続すると、一旦は治療に反応した腫瘍が耐性を獲得し再増大してくる現象をとらえました。この現象を詳細に解析することで、抗VEGF抗体投与に伴い骨髄由来線維細胞(bone-marrow derived fibrocytes)が腫瘍局所に集積し、それらが他の血管新生促進因子である線維芽細胞成長因子2(FGF2)を発現することで腫瘍血管を再動員し、抗VEGF抗体に対する薬剤耐性につながることを示しました(
Mitsuhashi A et al. Nat Commun. 2015、 Goto H et al. Int J Mol Sci. 2017)(図1)。本研究は血管新生阻害薬に対する耐性獲得機序を示した、また腫瘍進展における線維細胞の機能を示した初めての報告で、意義のあるものと言えます。
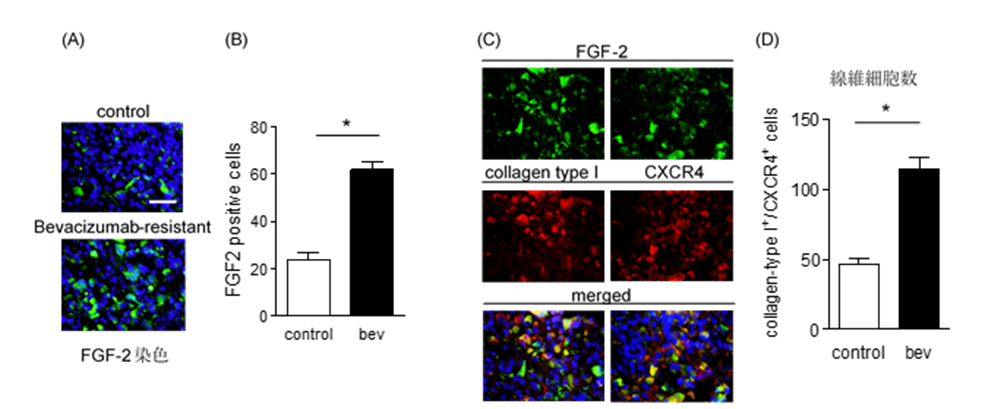 図1 Bevacizumab耐性組織内におけるFGF2発現亢進(A,B)、およびFGF2陽性線維細胞数の増加(C,D)
図1 Bevacizumab耐性組織内におけるFGF2発現亢進(A,B)、およびFGF2陽性線維細胞数の増加(C,D)
2. 骨髄由来線維細胞の腫瘍進展における役割の解明、および腫瘍内間質細胞の免疫チェックポイント阻害薬投与時における機能解析
骨髄由来線維細胞は末梢血単核球由来のコラーゲン産生能を有する細胞で、白血球分画中に占める割合は僅か0.1-0.5%程度ですが、骨髄系の表面マーカーと線維芽細胞類似の細胞外基質産生能を持つユニークな細胞です。末梢血中から主にCXCL12-CXCR4経路を介し線維化組織へ遊走し、組織修復や、肺線維症・気管支喘息など組織の線維化に重要な役割を果たすと考えられてきました。それに加えて1.で示した通り、本細胞が腫瘍進展においても種々の機能を有する可能性が示唆されたことから、さらなる詳細な機能解析を進めました。肺がん切除検体を用いた解析から、腫瘍内に線維細胞の多い患者は予後不良であることが明らかとなり、その腫瘍進展機序として線維細胞がosteopontinなどの液性因子を介して肺癌細胞の幹細胞化を誘導することでその悪性化に寄与していることを報告しました(
Saijo A et al. Cancer Lett. 2018)(図2)。
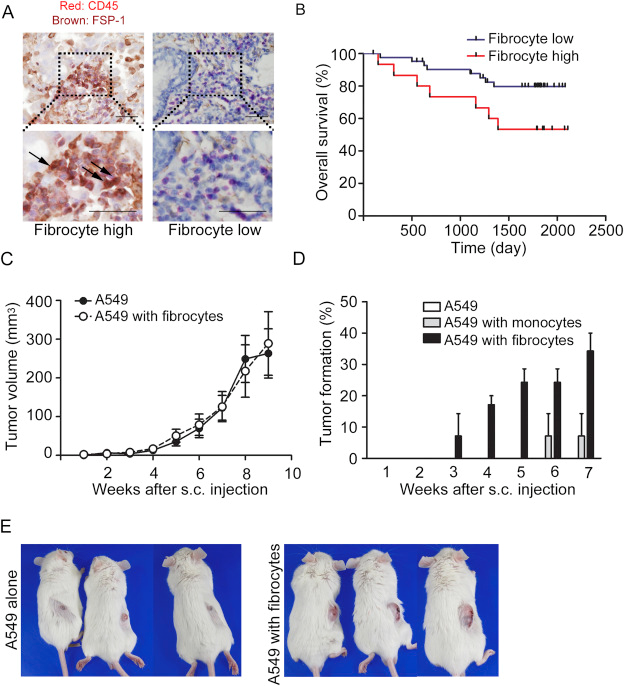
図2 肺腺がん組織内の線維細胞の予後因子としての役割とSCIDマウスモデルにおける線維細胞の肺がんに対する造腫瘍性促進効果(A:肺腺がん組織内の線維細胞(CD45+FSP-1+)、B:腫瘍内に線維細胞数の多い肺がん患者は予後不良である、C, D, E:線維細胞の投与はSCIDマウス皮下移植肺腺がん細胞株A542の増殖は刺激しないが造腫瘍性を亢進する)
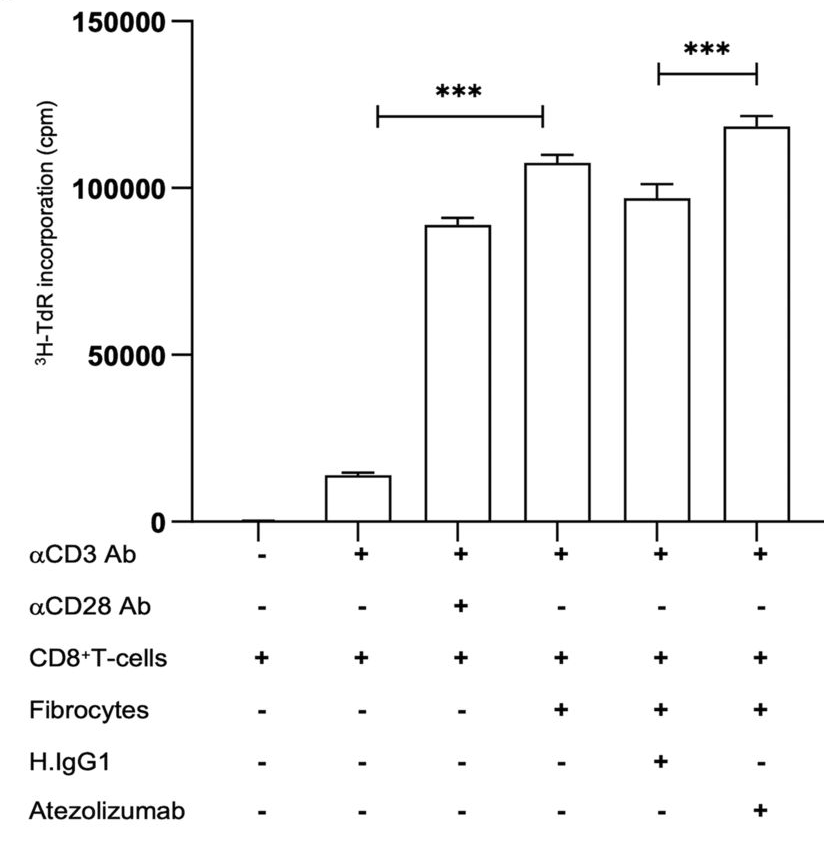
また線維細胞は抗原提示細胞としての機能を有し、共刺激分子であるCD86を高発現し、それを介してCD8 T細胞を活性化させる作用があること、さらに共抑制分子であるPD-L1を高発現しており、抗PD-1/PD-L1抗体存在下ではそのCD8 T細胞活性化作用がさらに増強することを明らかにしました(
Afroj T et al. J Immunol. 2021)(図3)。
図3(右図)ヒト末梢血由来線維細胞のCD8陽性T細胞刺激作用(ヒト末梢血より分離したCD8陽性T細胞を抗CD3抗体で刺激し、線維細胞との共培養後、3H-チミジン取り込み試験を用いてCD8陽性T細胞刺激活性を測定した。線維細胞はCD8陽性T細胞刺激活性を示すとともに、抗ヒトPD-L1抗体アテゾリズマブはその活性を増強した)
血管新生阻害薬と免疫チェックポイント阻害薬を併用することの有用性が示され、すでに臨床応用されていますが、私たちの研究成果はこの臨床効果のメカニズムの一部を科学的に証明するものであり意義があるものと考えています。
3. 悪性胸膜中皮腫に対する新規治療法の開発
我々は悪性胸膜中皮腫に高発現するポドプラニン分子に注目し、東北大学の加藤幸成博士との共同研究でその特異抗体を用いた免疫療法の開発研究を進めてきました。2006年に加藤博士が作成した抗ヒトポドプラニン抗体(クローンNZ-1)(
Kato Y et al. BBRC. 2006)は、悪性胸膜中皮腫に対して高い抗体依存性細胞傷害活性(ADCC)を示し、そのヒトキメラ抗体であるNZ-12は更に高い抗腫瘍効果を示したことから、悪性胸膜中皮腫治療薬としての開発が期待されています(
Abe S et al. J Immunol. 2013、 Abe S et al. Cancer Sci. 2016)(図4)。
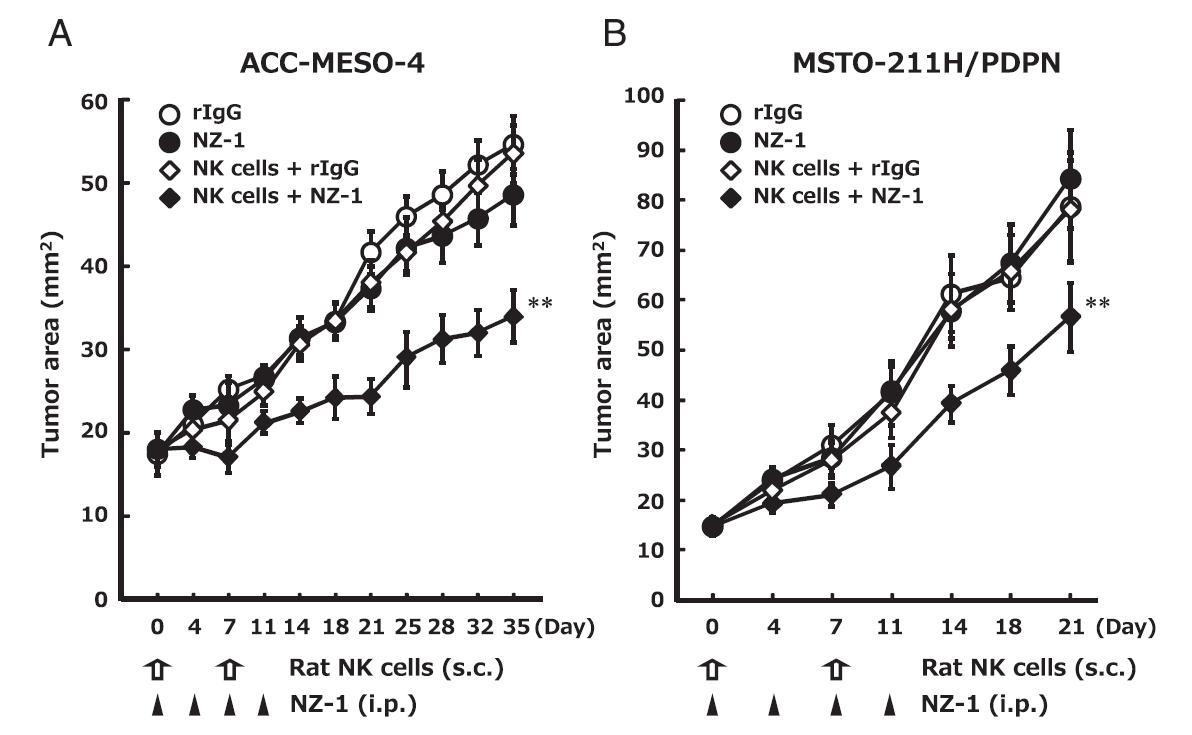
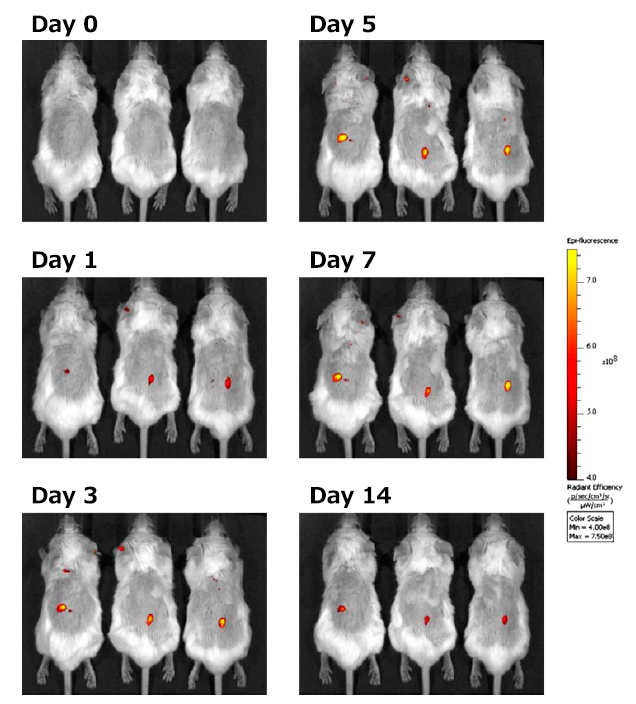 図4 SCIDマウスモデルによる抗ヒトポドプラニン抗体NZ-1の抗腫瘍効果と腫瘍集積 (A,B: SCIDマウス皮下にヒト悪性胸膜中皮腫株ACC-MESO-4およびMSTO-211H/PDPNを移植し、NZ-1の腹腔内投与およびラットNK細胞の腫瘍周囲への投与により抗腫瘍効果を検討した。NZ-1とNK細胞投与による腫瘍増殖抑制効果が確認された、C: ACC-MESO-4担癌マウスに蛍光ラベルしたNZ-1を腹腔内投与し、腫瘍集積をIVISシステムにて計測した。長期間の高い腫瘍集積が観察された)
図4 SCIDマウスモデルによる抗ヒトポドプラニン抗体NZ-1の抗腫瘍効果と腫瘍集積 (A,B: SCIDマウス皮下にヒト悪性胸膜中皮腫株ACC-MESO-4およびMSTO-211H/PDPNを移植し、NZ-1の腹腔内投与およびラットNK細胞の腫瘍周囲への投与により抗腫瘍効果を検討した。NZ-1とNK細胞投与による腫瘍増殖抑制効果が確認された、C: ACC-MESO-4担癌マウスに蛍光ラベルしたNZ-1を腹腔内投与し、腫瘍集積をIVISシステムにて計測した。長期間の高い腫瘍集積が観察された)
一方、悪性胸膜中皮腫に対しても抗PD-1抗体が承認され、日常臨床で使用されるとともに複合がん免疫療法の検討が進められています。私たちは、マウス悪性胸膜中皮腫株AB1-HAを用いたモデルを作成し抗PD-1抗体と化学療法による複合がん免疫療法の可能性を検討しました。その結果、抗PD-1抗体と化学療法の併用療法は腫瘍微小環境中に存在する骨髄由来免疫抑制細胞(myeloid-derived suppressor cells; MDSC)を減少させることで併用効果を示すことを報告しました(
Otsuka K et al. Lung Cancer. 2020)(図5)。
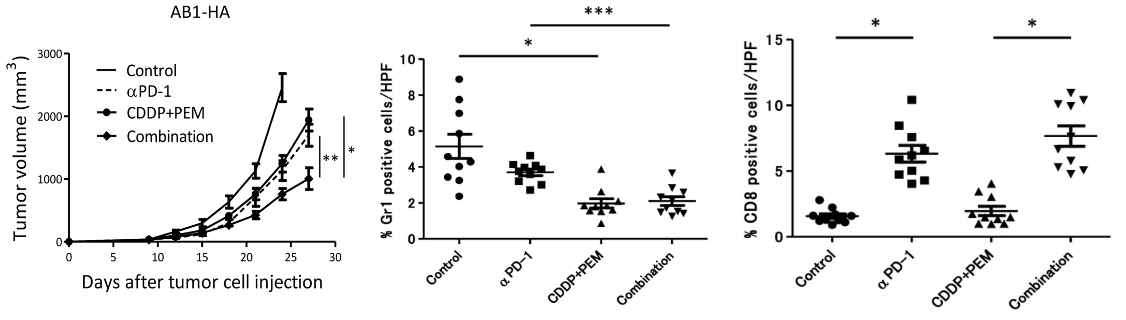
図5 BALB/cマウスにマウス悪性中皮腫細胞株AB1-HAを皮下移植し、抗PD-1抗体、化学療法(シスプラチン+ペメトレキセド)、およびその併用療法にて治療した。これらの治療による皮下腫瘍増殖抑制効果を検討したところ、併用治療において最も強い抗腫瘍効果が認められた(左図)。この際得られた腫瘍組織を用い、腫瘍局所における各種免疫関連細胞の数を計測したところ、併用治療において骨髄由来免疫抑制細胞(MDSC)数の低下が観察され(中央図)、またCD8陽性T細胞は増加していることが分かった(右図)。
現在もこれまでに得られた知見をもとに、線維細胞の更なる機能解析や、より良い複合がん免疫療法の開発を目指した研究を行っています。
4. 肺がんに対する臨床研究
(1)新規治療法開発に向けた前向き臨床研究
肺がんに対する新たな治療法開発に向けて、国際共同治験や多施設臨床試験グループ(日本臨床腫瘍研究グループ;JCOGなど)に参画するとともに、高齢者肺がんや間質性肺炎合併肺がんを中心に自主臨床試験にも取り組んでいます。2021年6月時点では3件の企業治験、14件の臨床研究が進行中です。
当教室が中心となって行った主な自主臨床試験には以下のようなものがあります。
<高齢者肺がんを対象とした前向き臨床試験>
日本のがん死亡の第一位は肺がんですが、特に肺がん死亡における75歳以上の高齢者が占める割合が年々上昇しています。高齢者は若年者と比較して合併症を有する割合が高く、特に高齢肺がん患者のquality of life (QOL)は他のがん種と比べ低いという報告もあります。このように高齢肺がん患者を対象とした治療戦略を確立することは重要で、その際はQOLを十分に考慮する必要があります。このような背景から私たちは関連医療機関と共同で、75歳以上の高齢者非小細胞肺がんを対象にTS-1単剤一次治療の有用性と安全性についてQOL評価を含め検討しました。その結果、TS-1単剤治療の有用性としては、病勢コントロール率(DCR)は89.5%、無増悪生存期間(PFS)の中央値が4.4ヶ月、全生存期間(OS)中央値が17.0ヶ月と、既報の高齢者進行非小細胞肺がんの治療成績と遜色ない成績でした。また患者報告アウトカム(PRO)を用いたQOL調査においては、全体として治療経過中のQOLは保たれており、一部の項目(EmotionalおよびSocial functioning)においては治療による改善が認められるなど、TS-1単剤治療は高齢者肺がんにおいて認容性があり、QOLを保持しつつ良好な病勢制御率が認められ、初期治療として有望であると考えられました(
Goto H et al. Respir Investig, 2018)(図6)。
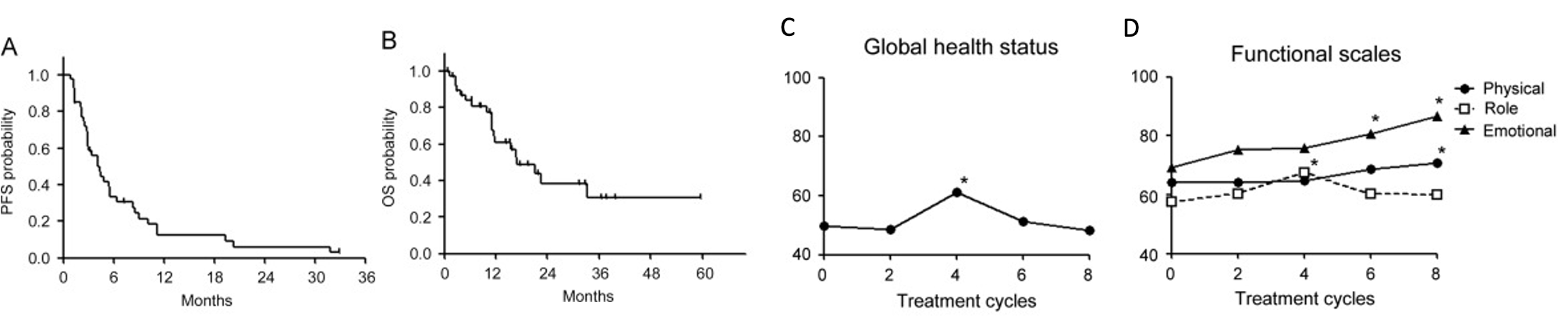
図6 高齢者進行非小細胞肺がんに対してTS-1単剤治療は無増悪生存期間(PFS)の中央値が4.4ヶ月(A)、全生存期間(OS)中央値が17.0ヶ月(B)であった。またQOL調査において全体として治療中のQOLは保たれており(C)、特にemotionalの要素においては改善が認められた(D)。
本試験以外にも当教室では同じく関連医療機関と連携し、高齢者進行非扁平非小細胞肺がんを対象にペメトレキセドおよび血管新生阻害薬であるベバシズマブの併用療法の有用性と安全性を検証する目的での前向き臨床試験を行い、現在データを解析しています。
<間質性肺炎合併肺がんを対象とした前向き臨床試験>
上間質性肺炎は本邦における肺がん症例においてしばしば合併が認められます。しかし間質性肺炎合併肺がんは治療選択肢が限られ、かつ治療中にしばしば間質性肺炎の急性増悪を引き起こすことが問題となっています。また間質性肺炎合併肺がんは一般的な大規模臨床試験からは除外されることが多く、標準治療が確立されていないのが現状です。この様な背景から間質性肺炎合併肺がんに対して比較的安全性が保たれかつ有用な治療効果が期待できる治療法の確立が急がれます。そこで私たちは以前に当施設において化学療法を行った肺がん症例を対象とし、後ろ向きに間質性肺炎急性増悪を発症する頻度について解析した結果、TS-1を含むレジメンを用いて治療された症例においてその頻度が比較的少ない傾向を明らかにしました(
Kakiuchi S et al. Respir Investig, 2017)。
この結果に基づき、関連医療機関と共同で、未治療進行期間質性肺炎合併非小細胞肺がんを対象にカルボプラチンとTS-1の併用療法の安全性と有効性を検証する前向き臨床試験を行いました。その結果、本レジメンの奏功率(ORR)は33.3%、病勢コントロール率(DCR)は78.8%と良好な成績が得られ、主要評価項目であるORRにおいて統計学的に有意な治療効果を示しました。安全性に関して、間質性肺炎急性増悪は全体の6.1%で認められ、過去の報告と比較し遜色ないデータであり、本レジメンは間質性肺炎合併非小細胞肺癌において認容性がありかつ有用な治療法であると考えられました(
Hanibuchi M et al. Lung Cancer, 2018)(図7)。
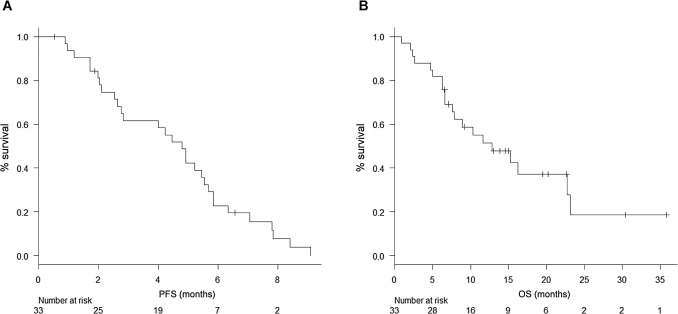
図7 間質性合併進行非小細胞肺がんに対してカルボプラチン+TS-1併用療法は無増悪生存期間(PFS)の中央値が4.8ヶ月(A)、全生存期間(OS)中央値が12.8ヶ月(B)であった。
(2)臨床検体を用いた研究 / 臨床情報を用いた後ろ向き研究
臨床検体を用いた研究としては、血漿中に存在するcirtulating free DNA (cfDNA)を高感度に検出する方法を開発し、EGFR活性型遺伝子変異を有する患者45例の血漿を同検査法で評価したところ、従来の生検組織を用いた検査法と同等の有用性があることを報告しました(Hanibuchi M et al. Oncotarget. 2019)。また後ろ向き研究としては、当院における進展型小細胞肺癌症例のデータを解析しその予後を探索した研究(Ogino H et al. J Med Invest. 2016)、また間質性肺炎合併小細胞肺癌症例に対するpaclitaxelの治療効果について検討した研究(Saijo A et al. Mol Clin Oncol. 2019)、膠原病合併肺癌の臨床的特徴を検討した研究(Saijo A et al. Respir Investig. 2019)、また高齢者肺癌における治療成績を検討した研究(Ogino H et al. Respir Investig. 2019)などを行ってきました。
現在も日常診療を通じて抱く様々な疑問点を解決することを目的とした複数の臨床研究に取り組んでいます。







