Williams症候群(ウィリアムズ症候群)
(Williams Syndrome)
[Synonyms:Williams-BeurenSyndrome]
Gene Reviews著者: BColleenAMorris,MD,FACMG,FAAP
日本語訳者:佐藤康守(たい矯正歯科)、櫻井晃洋(札幌医科大学医学部遺伝医学)
GeneReviews最終更新日: 2023.4.13. 日本語訳最終更新日::2023.8.4.
要約
疾患の特徴
Williams症候群(WS)は、発達遅滞、知的障害(通常は軽度)、特徴的な認知プロフィール、独特の人格特性、心血管疾患(大動脈弁上狭窄,末梢肺動脈狭窄,高血圧)、結合組織異常、発育障害、内分泌異常(思春期早発症,高カルシウム血症,高カルシウム尿症,甲状腺機能低下)、特徴的顔貌などを呈する疾患である。筋緊張低下や関節可動性亢進のため、運動発達指標の達成は遅延することが多い。また、摂食障害のため、乳児期にはしばしば体重増加不良に陥る。
診断・検査
WSの診断は、7q11.23にあるWilliams-Beuren症候群クリティカル領域(WBSCR)の1.5-1.8Mbのヘテロ接合性欠失が同定されることをもって確定する。
臨床的マネジメント
症状に対する治療:
摂食に問題がある乳児に対しては、摂食治療が有益な場合がある。発達障害に対しては、早期介入プログラム、特別支援教育プログラム、職業訓練で対応が行われる。具体的には、言語治療、理学療法、作業療法、摂食治療、感覚統合療法、乗馬療法などのプログラムがある。本読み教育にはフォニックス法が推奨される。心理学的、精神医学的評価・治療を行うことで、特に注意欠如/多動性障害と不安症に対する行動カウンセリングや投薬を、個人個人に合った形で提供することが可能となる。大動脈弁上狭窄、肺動脈狭窄、僧帽弁閉鎖不全、腎動脈狭窄に対しては、手術が必要になる場合がある。鎮静や外科的処置に先立って、麻酔科への相談と心電図検査を行うことが推奨される。咬合異常に対しては、矯正歯科への紹介を検討する必要がある。便秘については、年齢を問わず、常に積極的対応が必要である。有熱性尿路感染症を有する例については、下部尿路の評価を行う必要があり、腎石灰化症、持続性の高カルシウム血症、高カルシウム尿症の管理については、腎臓専門医への紹介を行う。
また、関節拘縮の予防や改善に向けて、可動域改善のための運動が推奨される。高カルシウム血症に対する治療としては、食餌の変更、副腎皮質ホルモンの経口投与、パミドロネートの静脈内投与などが考えられる。思春期早発症に対しては、ゴナドトロピン放出ホルモンアゴニストでの治療が考えられる。高血圧、睡眠障害、眼症候、反復性中耳炎、難聴、歯科的問題、甲状腺機能低下、インスリン抵抗性に対する治療は、一般集団の場合と変わるところがない。
定期的追跡評価 :
2歳未満の子どもに対しては、4-6ヵ月に1度の割合で血清カルシウムの検査を行う。
甲状腺機能のチェックは、3歳までは年に1度、その後は2年に1度行う。医学的評価、視覚のスクリーニング、聴覚評価、両腕での血圧測定、随時尿のカルシウム/クレアチニン比、尿検査は、年に1度行う必要がある。その他、全例に対して定期的に行う評価は以下の通り。
- 血清カルシウム値の測定を2年に1度
- エラスチン動脈症に関する心評価を5歳までは少なくとも年に1度、その後は2-3年に1度
- 腎と膀胱の超音波検査を10年に1度
成人に対する経口ブドウ糖負荷試験は20歳で開始するようにする。
避けるべき薬剤/環境:
小児用マルチビタミン剤は、すべてビタミンDを含むものとなっているため、服用を避ける。
遺伝カウンセリング
WSは常染色体顕性遺伝疾患である。WSと診断された罹患者の大半は、7q11.23に生じた1.5-1.8Mbのdenovoの欠失に起因する例であるが、稀には片親からの継承例もみられる。WS発端者の両親に対する推奨事項としては、WSの徴候や症候の有無を調べるための病歴調査がある。両親ともWSの臨床所見を有しない場合、発端者で同定された7q11.23の検査を両親に対して行うことまでは検討しなくてよい。WS罹患者の子が7q11.23の欠失を継承する可能性は50%である。WSの原因となった家系内に存在する7q11.23の1.5-1.8Mbの欠失が同定されている場合は、出生前検査や着床前遺伝学的検査が可能である。
診断
本疾患を示唆する所見
以下のような所見を示す例については、Williams症候群(WS)を疑う必要がある。
- 知的障害
これは大多数の罹患者にみられるがふつうは軽度である。
- 特異的認知プロフィール
言語性短期記憶と言語に強みがあり、視空間認知に極度の弱みをもつ。
- 独特の人格特性
他者に対する過度の無警戒な親しみ、感情移入、全般不安症、特定の恐怖症、注意欠如/多動性障害などがみられる。
- 心血管疾患(エラスチン動脈症)
最も多くみられるのは大動脈弁上狭窄である。
乳児期には末梢肺動脈狭窄が多くみられる。
狭窄は、どの動脈でも生じる可能性がある。
- 特徴的顔貌
横幅の広い額、両側側頭間距離の狭小化、眼の周囲の厚ぼったさ、星状/レース状の虹彩パターン(図1参照)、斜視、短い鼻、広い鼻尖、頰部の平坦化、長い人中、厚い上下の赤唇、広い口、咬合異常、小さな顎、大きな耳垂といったものは、すべての年齢層でみられる(図2参照)。
幼い子どもでは、内眼角贅皮、膨らんだ頰、空隙歯列を伴う小さな歯がみられる(図3参照)。
成人では、長い顔と頸、なで肩がみられる(図4参照)。
- 結合組織の異常
嗄声、鼠径/臍ヘルニア、腸/膀胱憩室、直腸脱、関節の可動域制限あるいは弛緩、柔らかく弛んだ皮膚などがある。
- 発育異常
出生前の発育不全、出生後の体重増加不良、線的成長の低下などがある。
- 内分泌異常
思春期早発症、高カルシウム血症、高カルシウム尿症、甲状腺機能低下、糖尿病などがある。
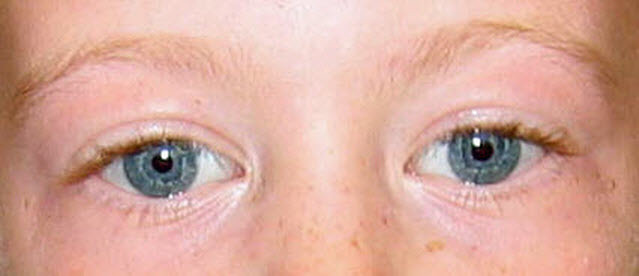
図1:Williams症候群罹患者にみられる星状虹彩パターン

図2:
横幅の広い額、両側側頭間距離の狭小化、眼の周囲の厚ぼったさ、斜視、短い鼻、広い鼻尖、頰部の平坦化、長い人中、厚い上下の赤唇、広い口、咬合異常、小さな顎、大きな耳垂といったものは、すべての年齢層、すべての民族でみられる。
ここに載せた子供たちの年齢は以下の通り。
A,B.3歳
C.4歳
D.7歳
E.8歳
F,G,H.12歳
I,J.16歳
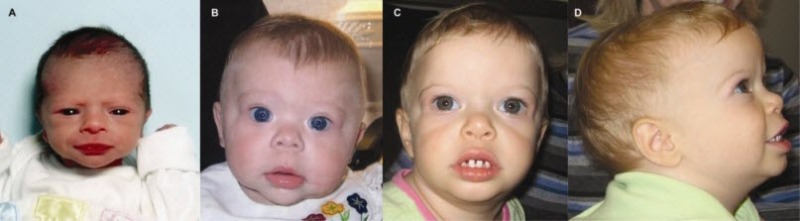
図3:
Williams症候群の幼い子どもでは、通常、ここに示した子どもたち(年齢は以下の通り)にみられるような内眼角贅皮、膨らんだ頰、空隙歯列を伴う小さな歯を有する。
A.新生児期
B.10ヵ月
C,D.21ヵ月
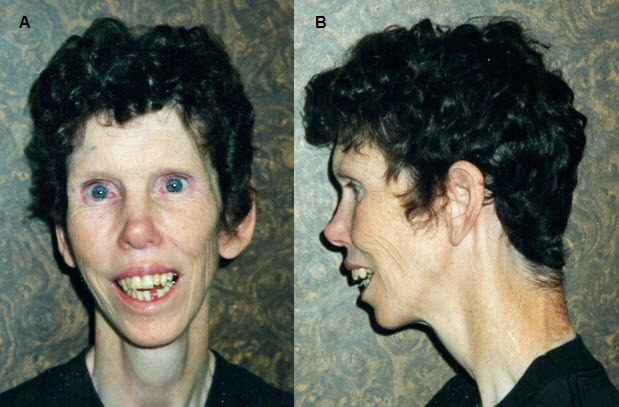
図4:
成人は、通常、ここに示した例(43歳)のように、顔や頸が長く、それがなで肩で強調されるため、非常に痩せた印象になる
注:さまざまな民族的背景をもったWS罹患者の写真については、アメリカ国立ヒトゲノム研究所(NationalHumanGenomeResearchInstitute;NHGRI)ヒト奇形症候群アトラス(AtlasofHumanMalformationSyndromes)を参照されたい(スクロールして「ATLASIMAGES」へ)。
診断の確定
WSの診断は、7q11.23に1.5-1.8Mbのヘテロ接合性欠失が同定されることをもって確定する。本GeneReviewでは、参照ゲノム(NCBIBuild38)のおおむねchr7:73,330,452-74,728,172の位置の1.5-1.8Mbの反復性欠失がみられることをもってWSの定義とする。
注:この領域のこれより大きい欠失やこれより小さい欠失で現れる表現型は、臨床的にWSとは明確に異なるものとなる可能性がある(「遺伝学的に関連のある疾患」の項を参照)。
1.5-1.8Mbの反復性欠失内にはいくつか注目すべき遺伝子(例えば、ELN)が存在するものの、病的バリアントが生じることでWSが生じる特定の1遺伝子の存在は同定されていない(この欠失領域内にある注目遺伝子については、「分子遺伝学」の項を参照)。
ゲノム配列のコピー数変化を検出するゲノム検査法としては、染色体マイクロアレイ(CMA)や蛍光insituハイブリダイゼーション(FISH)法を用いた標的型欠失解析がある。
注:7q11.23の反復性欠失は、通常のG分染法をはじめとする従来型の細胞遺伝学的分染法では検出することができない。
- 染色体マイクロアレイ(CMA)
オリゴヌクレオチドアレイあるいはSNPジェノタイピングアレイを用いたCMAにより、発端者のもつ反復性欠失を検出することが可能である。
欠失のサイズを同定する能力は、用いるマイクロアレイの種類、ならびに7q11.23領域のプローブの密度によって変わってくる。
注:(1)発達遅滞、知的障害、自閉症スペクトラム障害といったものに関連して行われたCMAでWSが判明した罹患者が大多数を占める。
(2)この反復性の欠失は、かつては初期のアレイ(例えば、BACアレイ)で検出が行われていた。
- 標的型欠失解析
CMAが利用できない場合は、7q11.23領域を標的としたFISHプローブで確実に診断を行うことが可能である。FISH解析は、WSであることが判明した発端者の、リスクを有する血族に対する検査としても用いられることがある。
注:(1)WSが疑われていたものの、7q11.23領域を標的として設計されたFISHやCMAで欠失が検出できなかった例について、FISHによる標的型欠失検査をその血族に対して適用することは適切ではない。
(2)FISHを用いて定常的に欠失のサイズを確認するということはできない。
表1:Williams症候群で用いられるゲノム検査
| 欠失1 | 方法 | 感度 | |
|---|---|---|---|
| 発端者 | リスクを有する血族 | ||
| 7q11.23の1.5-1.8Mbのヘテロ接合性欠失 ISCN:seq[GRCh38]del(7)(q11.23) Chr7;73,330,452-74,728,1722 ISCA-37392 |
CMA3 | 100% | 100% |
| FISH | 100% | 100%4 | |
- 欠失や注目すべき遺伝子の詳細に関しては、表A「分子遺伝学」の項を参照されたい。
- ClinicalGenomeResource(ClinGen)プロジェクト(旧InternationalStandardsforCytogenomicArrays[ISCA]コンソーシアム)によるゲノムバリアントのISCN標準的アノテーションと解釈。ゲノム座標は、ClinGenの示した7q11.23の反復性欠失の最小サイズを表している。欠失の座標は、検査機関の使用するアレイデザインにより、若干の違いが生じる可能性がある。 注:切断点近傍に存在する分節重複のため、このゲノム位置をもとに算出した欠失のサイズが、予測される欠失サイズと異なる場合がありうる。この領域に生じるこれよりも明確に大きな欠失、あるいは小さな欠失は、7q11.23の反復性欠失とは臨床的にはっきり異なる表現型を呈する場合がある(「遺伝学的に関連のある疾患」の項を参照)。
- オリゴヌクレオチドアレイあるいはSNPアレイを用いた染色体マイクロアレイ(CMA) 現在、臨床の場で用いられているCMAは、7q11.23領域を標的としたデザインとなっている。
- この領域を標的としたFISHあるいはCMAで異常が検出されなかったWilliams症候群罹患者の血族に対して、診断を目的としてFISHを行うことは適切ではない。
臨床的特徴
臨床像
Williams症候群(WS)は、心血管疾患(エラスチン動脈症;最も多いのは大動脈弁上狭窄の形での出現)、発達遅滞、通常は軽度の知的障害、特異的認知プロフィール、独特の人格特性、結合組織の異常、発育異常、その他の内分泌症候、特徴的顔貌等を特徴とする多系統疾患である。その他の症候としては、睡眠の問題、眼の問題、難聴、歯の問題、消化器疾患、尿路の異常筋骨格の問題などが生じることがある。
表2:Williams症候群:代表的症候の出現頻度
| 系 | 症候 | その症候を有する例の割合 | コメント |
|---|---|---|---|
| 神経発達 | 発達遅滞 | 100% | 歩行開始と発話は平均21ヵ月。 |
| 筋緊張低下 | 80% | ||
| 知的障害 | 75% | 通常は軽度。 | |
| 特徴的認知プロフィール | 95% | 視空間認知に重度の障害があり、言語に相対的強みあり。 | |
| 神経行動 | 特徴的人格特性 | 95% | 他者に対する過度の無警戒な親しみ,情動制御困難 |
| 不安症 | 80% | 特定の恐怖症が最も多くみられる。 | |
| 注意欠如/多動性障害 | 65% | ||
| 睡眠障害 | 65% | ||
| 自閉症スペクトラム障害 | 10%-20% | ||
| 心血管 | 何らかの動脈狭窄 | 80% | エラスチン動脈症 |
| 大動脈弁上狭窄 | 75% | ||
| 末梢肺動脈狭窄 | 40%-60% | 通常は経時的に改善。 | |
| 高血圧 | 50% | 腎動脈狭窄が関与している可能性。 | |
| 僧帽弁逸脱 | 15% | ||
| QTc間隔延長 | 13% | ||
| 眼/視覚 | 内斜視 | 50% | |
| 遠視 | 60% | ||
| 聴覚 | 反復性中耳炎 | 50% | |
| 音に対する過敏 | 90% | ||
| 感音性難聴 | 60%超 | 成人の90%超にみられる。 | |
| 歯 | 小歯症 | 95% | |
| 咬合異常 | 85% | ||
| 消化器 | 摂食困難 | 70% | |
| 便秘 | 50% | ||
| 臍ヘルニア | 50% | ||
| 鼠径ヘルニア | 40% | ||
| 大腸憩室 | 30% | ||
| 直腸脱 | 15% | ||
| 尿路 | 頻尿 | 70% | |
| 夜尿症 | 50% | ||
| 膀胱憩室 | 50% | ||
| 筋骨格 | 関節可動性亢進 | 90% | 幼い子どもで最も多くみられる。 |
| 関節拘縮 | 50% | ||
| 脊柱側彎 | 20%-35% | ||
| 皮膚/結合組織 | 嗄声 | 90% | |
| 柔らかく弛んだ皮膚 | 90% | ||
| 内分泌 | 低身長 | 50% | 成人の平均身長は3パーセンタイル未満。 |
| 思春期早発症 | 50% | ||
| 高カルシウム血症 | 20%-40% | 臨床的に明らかな高カルシウム血症は、通常、2歳未満で生じる。 | |
| 高カルシウム尿症 | 30% | 腎石灰化症が5%にみられる。 | |
| 甲状腺機能低下 | 10% | 30%は無症状。 | |
| 糖尿病 | 20% | 成人でより多くみられる。 | |
| 頭蓋顔面 | 特徴的顔面症候 | 100% | 図1,2,3,4参照。 |
| 小頭症 | 30% |
乳児期
WS罹患児は、過期産であることが多く、50%は在胎不当過小児である[Liら2022]。胃食道逆流症、吸啜嚥下障害、食感嫌悪、嘔吐をはじめとする、体重増加不良につながるような摂食困難が多くみられる。長期にわたって疝痛(4ヵ月を超えて続くもの)がみられる場合は、その背景に、胃食道逆流症、慢性便秘、特発性高カルシウム血症といったものが関与していることがある。
発達遅滞
WS乳児は、筋緊張低下を有し、かつ関節過伸展が存在することが多いため、運動発達指標の達成は遅延する[Morris&Mervis2021]。歩行は、通常、生後24ヵ月までに達成される。スピーチの獲得も遅延するものの、後にはこれが相対的に強みをもつ分野になる[Kozelら2021]。微細運動機能の問題は、全年齢を通じてみられる。
認知機能
知的障害は、通常は軽度ながら、WS罹患者の75%にみられる。認知プロフィールは独特で、言語性短期記憶と言語に強みをもつ一方、視空間認知に極度の弱みを有する。その結果、WS児は通常、視空間認知機能を測定する検査よりも言語に関する下位検査で高得点を獲得する[Mervis&GreinerdeMagalhães2022]。男女間でのIQの違いは報告されておらず、IQの値は小児期を通じて変わらない[Mervisら2012]。
学業面について言うと、WS罹患者は読字力が比較的良好で、成人になるとハイスクールレベルの読字が可能な場合があるものの、その達成度には大きなばらつきの幅がみられる。
読字力のレベルは、IQよりも読字教育の方法のほうと相関があり、体系的フォニックス学習を行った例で最も高い読字能力が得られていた[Mervis&GreinerdeMagalhães2022]。
書字、描画、計算には大きな問題を抱えるものの、多くの成人は、単純な足し算を行う能力は有している。
独特の人格/行動
WSには、他者に対する過度の無警戒な親しみ、社会的脱抑制、過度の感情移入、注意欠如の問題、非社交性不安などの独特の人格特性がみられる。多くみられるその他の行動上の問題としては、感覚調整/感覚処理の障害、情動制御の障害、忍耐力の障害などがある。WS罹患者の中には、興味関心の狭さや反復行動など、自閉症スペクトラム障害と重なる症候を有する例もみられる。自閉症スペクトラム障害(ASD)の診断基準を満たすWS児(10%-20%)は、孤立型(aloofsubtype)ではなく、積極奇異型(active-but-oddsubtype)によく合致する[Klein-Tasmanら2018]。子どもについては、注意欠如/多動性障害が罹患者の65%、不安障害が罹患者の57%でみられる(通常は特定の恐怖症)[Leyferら2006]。
不安は、生涯を通じて多くみられ、不安症の縦断研究によると有病率は80%とされている[Woodruff-Bordenら2010]。WSでみられる精神疾患に対し薬物治療を行う場合は、WS関連の併存疾患を十分頭に入れて行う必要がある[Thomら2021]。例えばADHDの治療を目的として刺激薬(これにより血圧や心拍数が上昇することがある)を用いるようなときは、その罹患者を担当している心臓病専門医とよく話をしておく必要がある。アトモキセチンは、代替薬となりうる非刺激薬である[Thomら2021]。
適応行動技能は、小児、成人とも、IQから予測されるレベルを下回り[Howlin&Udwin2006,Mervis&Pitts2015]、WS罹患成人が自立生活を送る上での障害となっている(自立生活を送ることができるのは10%未満)。通常、社交性やコミュニケーション技能に相対的強みがある一方で、運動能力と日常生活技能に大きな弱みがある。また、実行機能障害が、子どもならびに思春期のWS罹患者の70%にみられる。行動の問題や適応行動障害に関連して行動や情動の制御困難が、注意力の問題に関連して抑止困難が、そして、不安に関連して思考の焦点を柔軟に移し替えることができない障害が生じる[GreinerdeMagalhãesら2022]。
睡眠障害
睡眠障害、具体的には、睡眠潜時の上昇と睡眠効率の低下などが罹患者の65%に生じる[Goldmanら2009,Masonら2011]。夜間のメラトニンピークの異常あるいは消失が報告されている[Sniecinska-Cooperら2015,Santoroら2016]ことから、メラトニン治療が有用である可能性がある[Martensら2017,Morris&Mervis2021]。2歳のWS幼児について調べた研究で、睡眠関連の呼吸障害(15%で報告されている)や日中の過度の眠気(30%で報告されている)と外在化型問題行動と間に関連性がみられたという[GreinerdeMagalhãesら2020]。
心血管疾患
WS罹患者の80%に心血管疾患がみられる[Collins2018,Honjoら2022]。エラスチン動脈症が罹病や死亡の大きな原因になっている。動脈の狭窄はどの動脈にも生じうるが、中でも大動脈弁上狭窄(SVAS)は最も多くみられ、特に5歳までの間はこれが経時的に悪化していくことがある[Collinsら2010b]。SVASは、限局性の砂時計型狭窄を示すこともあれば、瀰漫性の大動脈弁狭窄である場合もある。治療を行わなかった場合、動脈抵抗の上昇により左心圧の増大、心肥大、心不全に至る。進行が最も生じやすいのは、狭窄の程度が中等度もしくは重度で、かつ乳児期あるいは幼児期に狭窄がみられる場合である。軽度のSVASについては、進行はあまりみられない。SVASを有する子どもの約3分の1については、外科的修正が必要となる。
乳児期には末梢肺動脈狭窄(PPS)が多くみられるものの、特別な介入を行わなくても通常は経時的に改善していく。ただ、SVASとPPSの両方を組み合わさった形(両室流出路閉塞)で有する例については、両室の肥大・高血圧が生じることがあり、これにより心筋虚血、不整脈、突然死のリスクが高まることになる[Phamら2009]。閉塞性病変の治療を受けた子どもの北米における30年生存率は90%である[Zinyanduら2023]。左心単独あるいは右心単独の閉塞性病変を有する例は、両方が組み合わさった例よりも生存率が高かった(96%対83%)という。院内死亡者の割合は2.5%、再手術(そのほとんどは再発性のSVASによるもの)を要した例の割合は9%であったという[Zinyanduら2023]。
WS罹患者の突然死の原因として、冠動脈狭窄の関与が指摘されている[Birdら1996]。
WS罹患者の10%-30%で冠動脈の狭窄あるいは拡張がみられ、バルサルバ洞-上行大動脈接合部で狭窄が生じている場合は、バルサルバ洞の位置で冠血流が制限される可能性がある[Brownら2018]。WS罹患者293人から成る1コホートでの突然死の発生率は、1,000患者-年あたり1件であったが、これは、年齢をマッチングさせた集団の25倍から100倍高い値である[Wesselら2004]。
WS罹患者における高血圧の有病率は40%-50%である。高血圧はどの年齢でもみられ[Bouchirebら2010]、一部には、腎動脈狭窄に伴う続発性のものと思われる例もみられる[Honjoら2022]。WS罹患者では血管硬度の上昇も報告されているが、これについては降圧薬が奏功する[Kozelら2014]。成人例で、僧帽弁逸脱や大動脈弁閉鎖不全の報告もみられる[Morrisら1990,Collinsら2010a]。
WS罹患者の13.6%でQTc間隔の延長がみられることから、再分極異常に関するスクリーニングが推奨されている[Collinsら2010a,Brinkら2022]。
WS罹患者については、麻酔や鎮静に伴うものとして、心停止も含めた有害事象のリスク上昇との関連が指摘されている[Olsenら2014]。鎮静と麻酔のリスク評価と管理のガイドラインが公表されており[Schmidtら2021,Staudt&Eagle2021]、血管内容積の維持、ならびに冠動脈還流を適正に保つことのできる安定した血圧の維持[Schmidtら2021]を目標とする内容になっている。WS罹患者に特化したこうした戦略を採用している医療機関においては、罹病や死亡が減少している。Brownら[2018]は、何らの有害事象も生じなかったのは、心臓の治療を受けている例の90%、心臓以外の治療を受けている例の95%であったと報告している。Schmidtら[2021]は、WSの新しい麻酔ガイドラインが採用された後の治療介入群と、それ以前の群とを比較し、心臓の有害事象の発生率が、後者では6%であったのに対し、前者では2%であったとしている。
これ以外の動脈の狭窄についてもいくつか報告がみられる。脳血管の異常の報告は稀ではあるが、これにより卒中が生じる場合がある[Cherniskeら2004]。また、腸間膜動脈の狭窄により、腹痛が生じる場合がある。
眼科的症候
WS罹患者では、鼻涙管閉塞、遠視(67%)、内斜視(50%)が多くみられる[Weberら2014]。成人では白内障も報告されている[Cherniskeら2004]。
耳と聴力
罹患者の50%に慢性中耳炎がみられる。また、音に対する感受性亢進が多くみられ(90%)、WS罹患者が不快を訴え始める音量は、対照群と比べ20dB小さかったという[Gothelfら2006]。罹患者の多くは、ある種の音に対し特定の恐怖を訴える[Levitinら2005]。聴覚過敏が35%にみられ、これは対側の音響反射の欠如に起因して生じている[Silvaら2021]。
進行性の感音性難聴が報告されており、小児の63%、成人の92%で軽度から中等度の難聴が確認されている[Gothelfら2006,Marlerら2010]。成人罹患者では、高周波帯域の軽度から中等度の感音性難聴、ならびに過剰な耳垢形成が多くみられる[Cherniskeら2004]。
歯の所見
歯の所見としては、空隙歯列弓(70%)、無歯症(50%)、小歯症、エナメル質形成不全、咬合異常(AngleⅡ級ならびにⅢ級)などがある[Castroら2019]。
消化器症候
WS罹患者には感覚防御反応がみられ、食感に関する問題により、母乳や調合乳から固形食への移行に問題が生じることになる。
WSの子どもや成人には、慢性腹痛が多くみられる。その原因として考えられることとしては、胃食道逆流症、裂孔ヘルニア、消化性潰瘍、胆石症、憩室炎、虚血性腸疾患、慢性便秘、不安の身体化などがある。憩室炎の有病率は、思春期[Stagiら2010]ならびに成人期[Partschら2005]で上昇するという。便秘に伴う合併症として、直腸脱、痔核、腸穿孔などが生じることがある。
高カルシウム血症は、いらいら、嘔吐、便秘、筋痙攣の原因となることがある。高カルシウム血症は乳児期に多くみられるが、成人期に至って再発するような例もみられる[Morrisら1990,Poberら1993]。
尿路の異常
WSの子どもでは、頻尿と遺尿が多くみられる。WS罹患者の50%に腎動脈狭窄、10%に尿路の構造異常、50%に膀胱憩室、そして5%未満に腎石灰化症がみられる[Poberら1993,Pankauら1996,Sforziniら2002,Sammourら2014]。罹患者の60%に膀胱容量の減少と排尿筋の過活動がみられる[Sammourら2006]。昼間の排尿調節ができるようになる平均年齢は4歳で、夜間の排尿調節は10歳までに50%が可能となる。夜尿が成人の3%にみられると推定されている[vonGontardら2016]。
筋骨格,ならびにその他の神経学的症候
筋緊張低下と関節弛緩のため、幼い子どもでは、姿勢の安定を得るため代償性の異常姿勢をとるようになる。一方、WSの年長の子どもや成人では、通常、筋緊張亢進と深部腱反射の亢進がみられる。アキレス腱やハムストリングが徐々に緊張していくことで、思春期には硬くぎこちない歩行、脊柱後彎・前彎に至る[Morrisら1988,Kaplanら1989,Copesら2016]。脊柱側彎も多くみられる[Damascenoら2014]。WS罹患者の10%に橈尺骨癒合症がみられる[Morris&Carey1990]。微細運動技能の障害のため、どの年齢においても、道具の使用や筆記はうまくできない。成人にみられる小脳症状としては、運動失調、測定異常、振戦などがある[Pober&Morris2007]。
神経画像
脳のMRIでは、脳容積の減少、灰白質の体積減少(特に頭頂部や後頭部)、脳回の複雑化が確認される[Jackowskiら2009,Eisenbergら2010]。罹患者の一部にはChiariⅠ型奇形がみられるが、これには小脳の大きさがふつうである一方、後頭窩のサイズが小さくなっていることが関係している可能性がある[Pober&Filiano1995,Mercuriら1997]。
皮膚,ならびにその他の結合組織症候
低調の嗄声が大多数の罹患者でみられるが、その背景にはエラスチン欠損に伴う続発性の声帯異常が原因として関与しているものと思われる[Vauxら2003]。皮膚は柔らかく、弛緩していることが多い。また、早発性の白髪がみられる[Morrisら1988]。
発育障害
体重増加不良が罹患乳児の70%にみられる。成長パターンの特徴としては、出生前の発育不全、体重増加不良、4歳までの線的成長不良、正常小児の75%程度にとどまる線的成長、思春期成長スパートの期間の短縮などがある。WS罹患者の身長は、両親の身長から予測される値より低い[Levy-Shragaら2018]。成人期の平均身長は3パーセンタイルを下回る。WSの成長曲線がすでに公表されている[Saulら1988,Martinら2007,Morrisら2020]。WSのコホートで行われた成長の研究に関するシステマティックレビューについては、deSausaLimaStrafacciら[2020]を参照されたい。肥満あるいは体重過多が、年長の小児と成人の50%にみられる[Cherniskeら2004,Stanleyら2021]。下肢の脂肪性浮腫が成人の25%にみられる[Shaikhら2018]。
思春期の出現は早いことがあり、中枢性思春期早発症がWS罹患者の18%にみられる[Partschら2002,Kimら2016]。思春期早発症の女児に対するゴナドトロピン放出ホルモンアゴニストを用いたホルモン抑制が有効で、この治療を受けた女児はWSの対照群に比べ高身長となる[Spielmannら2015]。
高カルシウム血症
高カルシウム血症は、2歳未満の段階で症状(いらいら、嘔吐、便秘)を伴って現れることがほとんどである[Martinら1984,Morrisら1988,Kimら2016]。高カルシウム血症は、脱水、高カルシウム尿症、腎石灰化症の原因となる。対照群との比較では、全年齢層で血清カルシウム値の中央値が高値を示す[Sindharら2016]。WSにおける高カルシウム血症の病因は不明である[Stagiら2016]。
その他の内分泌の問題
内分泌の異常としては、サブクリニカルな甲状腺機能低下(T3/T4値が正常で甲状腺刺激ホルモン値が上昇)を含めた甲状腺機能低下がある[Palacios-Verdúら2015]。耐糖能に問題がある例が42%に及び、思春期や成人のWS罹患者の糖尿病の発生頻度の高まりがみられる[Stanleyら2021]。WS成人の50%に骨密度の低下がみられると報告されており[Cherniskeら2004]、その背景には血清リン値の低下が関係している[Palmieriら2019]。
特徴的顔面症候
顔面症候の特徴として、横幅の広い額、両側側頭間距離の狭小化、眼の周囲の厚ぼったさ、星状/レース状の虹彩パターン(図1参照)、斜視、短い鼻、広い鼻尖、頰部の平坦化、長い人中、厚い上下の赤唇、広い口、咬合異常、小さな顎、大きな耳垂といったものが、すべての年齢層でみられる(図2参照)。幼い子どもでは、内眼角贅皮、膨らんだ頰、空隙歯列を伴う小さな歯がみられる(図3参照)。成人では、長い顔と頸がみられ、これがなで肩でさらに強調される(図4参照)。
遺伝型-表現型相関
7q11.23にあるWilliams-Beuren症候群クリティカル領域(WBSCR)の反復性欠失には、1.55Mb(WS罹患者の90%-95%)のものと1.84Mb(WS罹患者の5%-10%)のものがある[Palacios-Verdúら2015]。
- ELNの欠失によりエラスチン動脈症が生じる。
- WBSCRに隣接する低コピー反復配列ブロックの1つにあるNCF1を含む欠失を有するWS罹患者については、高血圧の有病率が低い[DelCampoら2006]。
- WBSCRを含む非常に大きな欠失(2-4Mb超)を有する罹患者については、通常の1.5-1.8MbのWBSCRの欠失を有する例より、認知機能の低い、より重症型の表現型を示す[Stockら2003,Marshallら2008,Ramockiら2010,Lugoら2020]。
WS関連の反復性欠失よりも小さいWBSCR内の欠失は稀で、その表現型は多様である。ELN以外の遺伝子に関しては、遺伝型-表現型相関は限定的である[Kozelら2021,Serrano-Juárezら2022]。
- WBSCRの部分欠失で、テロメア側の切断点が通常の欠失と同じもの(GTF2Iを含む欠失)は、知的障害をはじめとするWSの古典的症候を示す[Bottaら1999,Hellerら2003]。この領域内の遠位側の遺伝子(特にGTF2IRD1とGTF2I)を含むWBSCRの欠失を有する例は、知的障害と、WSに特徴的な顔面症候を有することが多い[Alesiら2021]。
GTF2Iを含むWBSCRの部分欠失を有していた1例は、境界域の適応機能と言語発達を有していた[Zhouら2022]。
- ELNを含む部分欠失の例は、SVASを有する。
- ELNは含むもののGTF2Iは含まない欠失を有する例は、知的障害は有しないものの、WSの認知プロフィールを示すことが多い[Morrisら2003]。
ELNとLIMK1の欠失を有していた2家系は、WSの認知プロフィールを示したものの、知的障害をはじめとするその他のWSの特徴は示さなかったという[Frangiskakisら1996]。
これと同様の欠失を示した別の1家系で、WSの認知プロフィールがみられなかったとする報告もみられる[Tassabehjiら2005]。
WBSCR内の欠失は母親起源であることもあれば、父親起源であることもある[Ewartら1993,Urbánら1996]。
親の起源の違いによる表現型の違いはみられなかったとする報告が存在する[Wuら1998]一方で、母親起源のWBSCRの欠失で小頭症が生じていたとする報告もみられる[DelCampoら2006]。
浸透率
浸透率は100%である。
疾患名
WSの初期の報告はいずれも、罹患者の主訴を反映したものであったという意味で、あるいは、報告者の医学的専門分野に偏ったものであったという意味で、不完全なものであった。
腎臓専門医や内分泌医は「特発性乳児高カルシウム血症」とし、心臓病専門医は「大動脈弁上狭窄症候群」として報告していた。
また、初期の報告では、伝説上の妖精に似た異常顔貌という点に注目し、一時期、「Williams妖精顔貌症候群」という病名が用いられたこともある。
Williamsら[1961]とBeurenら[1962]の報告以降、本疾患は、アメリカではWilliams症候群、ヨーロッパではWilliams-Beuren症候群と呼ばれている。
発生頻度
WSに関するノルウェーの1研究で、WSの発生頻度は7,500人に1人と報告されている[Strømmeら2002]。
遺伝学的に関連のある疾患(同一アレル疾患)
WBSCRを含む非定型的欠失
- 通常より大きな欠失
WBSCRを含む通常より大きな欠失は、より重症の表現型となって現れることが多い。
AUTS2を含む形の欠失を有する例は、小頭症を呈することが多い[Lugoら2020]。
YWHAGないしMAGを含む通常より大きな欠失を有する例は、発作性障害を有する可能性がある[Marshallら2008,Ramockiら2010]。
HIP1を含む欠失を有する例について、重度の知的障害と自閉症を認めたとの報告がみられる[Stockら2003,Serrano-Juárezら2022]。
- 通常より小さな欠失
ELNを含む通常より小さな欠失を有する例では、エラスチン動脈症が認められる。
LIMK1の欠失は、WSでみられる認知プロフィールの一部分である視空間構築障害に関係している[Morrisら2003]。
GTF2IとGTF2IRD1を含む欠失は、WSの表現型の中の認知・行動関連の症候と関連している。
GTF2Iの欠失は知的障害に、GTF2IRD1の欠失は行動の表現型に関連する。
7q11.23重複症候群
7q11.23重複症候群は、WBSCRの1.5-1.8Mbの反復性のヘテロ接合性重複に起因して生じる。
その最も顕著な臨床所見は、音韻障害をはじめとする表出言語の重度の障害で、Williams症候群罹患者が言語面に相対的強みをもつのとは対照的である。
その他の特徴的症候には次のようなものがある。
- 幼児期における運動能力と社会技能の遅延
- 神経学的異常
- 不安障害(特に社会的不安障害[社交恐怖症])、場面緘黙症、注意欠如/多動性障害、反抗挑発症、物理的攻撃性、自閉症スペクトラム障害などの行動の問題
- 知的障害(一部の罹患者)
特徴的顔面症候も多くみられる。
心血管疾患としては、上行大動脈拡張などがある。
ELN、GTF2IRD1、NCF1の生殖細胞系列の遺伝子内病的バリアントに関連して生じる疾患群を表3にまとめて示した。
表3:ELN、GTF2IRD1、NCF1の生殖細胞系列の遺伝子内病的バリアントに関連して生じる各種疾患
| 遺伝子 | 疾患名 | コメント |
|---|---|---|
| ELN | 常染色体顕性皮膚弛緩症1型(ADCL1)(OMIM123700) | さまざまな重症度の全身性皮膚弛緩。 大動脈基部拡張や気腫が生じる場合がある(「LTBP4関連皮膚弛緩症」のGeneReviewを参照)。 |
| 常染色体顕性大動脈弁上狭窄症(SVAS)(OMIM185500) | SVASを有する例については、WSと常染色体顕性SVASのどちらが正しい診断なのかを見極めるための評価を行う必要がある。 常染色体顕性SVAS罹患者にみられるのは、通常、結合組織の異常のみで、その点でWSと異なる。 |
|
| GTF2IRD1 | GTF2IRD1関連神経発達障害 | 今のところ報告は1家系のみで、自閉症、重度の神経発達遅滞(発作を含む)、顔面の形態異常(WSでみられるものとは異なる)を呈する2男性同胞例のGTF2IRD1にみられた両アレル性バリアントが報告されている。 本疾患は常染色体潜性遺伝の症候群と目され、ヘテロ接合体である両親や同胞に、徴候や症候は一切みられなかった[Cummings&Starr2023]。 |
| NCF1 | 慢性肉芽腫症(CGD) | 両アレル性の病的バリアントにより、常染色体潜性CGDが生じる。 この疾患は、細菌や真菌を死滅させる食細胞の機能障害に起因して生じる原発性免疫不全疾患である。 |
鑑別診断
Williams症候群(WS)については、発達遅滞、注意欠如/多動性障害、低身長、特徴的顔貌、先天性心疾患といったものを呈するその他の染色体異常(表4a参照)や単一遺伝子疾患(表4b参照)との鑑別が必要となる。
表4a:Williams症候群との鑑別を要する代表的染色体異常
| 遺伝学的メカニズム | 疾患名 | 臨床的特徴 | コメント |
|---|---|---|---|
| 22q11.2の2.54MBのヘテロ接合性欠失 | 22q11.2欠失症候群 | 非常に大きな幅をもったさまざまな症候が現れる。 主要な臨床症候としては、先天性心疾患(特に円錐動脈管奇形)、口蓋の異常、免疫不全、特徴的顔貌(例えば、フード状眼瞼,耳の奇形,突出した鼻梁,球状の鼻,啼泣時の顔の非対称)、学習障害、難聴などがある。 |
WSでみられる先天性心疾患は、通常、SVAS。 |
| 17p11.2の欠失もしくはRAI1の遺伝子内病的バリアント | Smith-Magenis症候群(SMS) | 特徴的身体症候、発達遅滞、知的障害、行動異常、睡眠障害、小児期に発症する腹部肥満がある。 顕著な睡眠障害、常同行動、不適応・自傷行動をはじめとする行動上の表現型は、通常、18ヵ月以降に初めて明らかになり、成人期まで変化し続ける。 顕著な不安症、ならびに実行機能の問題が多くみられる。 |
SMSとWSとで表現型の重なるものとしては、低身長、嗄声、先天性心疾患がある。 SVASは、WSでは一般的であるが、SMSでは稀である。 顔貌の特徴は両者で大きく異なる。 |
表4b:低身長と先天性心疾患を有し、Williams症候群との鑑別を要する代表的単一遺伝子疾患
| 遺伝子 | 疾患名 | 遺伝形式 | 臨床的特徴 | コメント |
|---|---|---|---|---|
| BRAF KRAS LZTR1 MAP2K1 MRAS NRAS PTPN11 RAF1 RASA2 RIT1 RRAS SOS1 SOS2 |
Noonan症候群(NS) | AD AR1 |
特徴的顔貌,低身長,さまざまな程度の発達遅滞,先天性心疾患(最も多いのは肺動脈弁狭窄で、しばしば異形成を伴う) 肥大型心筋症は出生段階で認められることもあれば、乳児期や小児期に発症することもある。 |
NSの顔面症候とWSの顔面症候は、乳児期には類似するものの、年長の子どもや成人では容易に見分けが可能である。 WSの先天性心疾患は、通常、SVASか末梢肺動脈狭窄であり、NSの場合は肺動脈弁狭窄が多い。 |
| KDM6A KMT2D |
カブキ症候群(KS) | AD XL2 |
特徴的顔貌,骨格の小奇形,胎児性指腹隆起の遺残,軽度から中等度の知的障害,出生後の発育不全。 罹患者の70%近くに先天性心疾患(最も多いのは左心閉塞性病変、特に大動脈縮窄)がみられる。 |
KSでは、下眼瞼の外反を伴う長い眼瞼裂がみられ、WSとは顔面の特徴が異なる。 KSでみられる左心病変は、通常、大動脈縮窄であるが、WSで最も多くみられる先天性心疾患はSVASである。 |
AD=常染色体顕性;AR=常染色体潜性;XL=X連鎖性
- Noonan症候群は、その大部分が常染色体顕性遺伝であるが、LZTR1の病的バリアントに起因するNSは常染色体顕性あるいは常染色体潜性の形での継承を示す。
- KMT2D関連カブキ症候群は、常染色体顕性の継承を示し、KDM6A関連カブキ症候群は、X連鎖性の継承を示す。
胎児性アルコールスペクトラム障害
特徴的顔貌(短い眼瞼裂、平坦な人中、薄い上赤唇)、発育不全、高次脳機能障害、脱抑制行動といった特徴を有する胎児性アルコールスペクトラム障害も、WSとの鑑別対象となりうる疾患である。胎児性アルコールスペクトラム障害では、中隔欠損が最も多くみられる先天性心疾患であるが、WSで最も多いのは大動脈弁上狭窄である。
臨床的マネジメント
すでにWilliams症候群(WS)の臨床的管理のガイドラインが公表されている[Morrisら2020]。
最初の診断に続いて行う評価
WSと診断された罹患者については、疾患の範囲やニーズを把握するため、診断に至る過程ですでに実施済ということでなければ、表5にまとめたような評価を行うことが推奨される[Morrisら2020]。
表5:Williams症候群罹患者の最初の診断後に行うことが推奨される評価
| 系/懸念事項 | 評価 | コメント |
|---|---|---|
| 全身 |
|
WS用成長曲線が公表されている1。 |
| 発達 | 発達評価 |
|
| 精神/行動 | 精神神経医学的評価 | 12ヵ月超の罹患者について行う:注意力,不安,適応技能,睡眠障害等の行動上の懸念に関するスクリーニング |
| 心血管 |
|
脈拍数の低下、血管雑音、瀰漫性胸部大動脈狭窄といったものがみられる例については、追加の心血管画像診断(CT,MRA,心カテーテル検査)が必要になる場合あり。 |
| 眼 | 眼科的評価 | 視力低下,眼球運動,最良矯正視力,屈折異常,斜視,鼻涙管狭窄に関する評価 |
| 聴覚 | 聴覚評価 | 難聴に関する評価 |
| 歯 | 歯科的評価 | 小歯症,咬合異常,無歯症に関する評価 |
| 消化器/摂食 | 消化器/栄養/摂食チームによる評価 | 栄養状態、胃食道逆流症、便秘、ヘルニア、直腸脱に関する評価を含むものとする。 |
| 腎尿路生殖器 |
|
|
| 筋骨格 | 整形外科/物理療法・リハビリテーション/理学療法・作業療法的評価 | 以下の評価を含むものとする。
|
| 高カルシウム血症 |
|
正常値については、Sargentら[1993]を参照されたい。 |
| 内分泌 | 甲状腺機能検査 | |
| 遺伝カウンセリング | 遺伝の専門医療職2の手で行う。 | 医学的、個人的な意思決定の用に資するべく、本人や家族に対し、WSの本質、遺伝形式、そのもつ意味についての情報提供を行う。 |
| 家族への支援/情報資源 | 以下に関する必要性の評価
|
- Martinら[2007],Morrisら[2020]
- 臨床遺伝医、認定遺伝カウンセラー、認定上級遺伝看護師をいう。
症候に対する治療
表6:Williams症候群罹患者の症候に対する治療
| 症候/懸念事項 | 治療 | 考慮事項/その他 |
|---|---|---|
| 体重増加不良 | 摂食治療 | 乳幼児期と小児期における摂食の問題に対する治療は、その原因(例えば、吸啜嚥下障害,食感嫌悪,胃食道逆流症,高カルシウム血症)によって変わってくる。 |
| 発達遅滞/知的障害 |
|
「発達遅滞/知的障害の管理に関する事項」の項を併せて参照。 |
| 行動ならびに精神医学的症候 |
|
「発達遅滞/知的障害の管理に関する事項」の項を併せて参照。 |
| 睡眠障害 | 睡眠医学の専門医による管理 | メラトニン治療を検討する4。 |
| 心血管 | 心臓病専門医によるSVASその他の心血管疾患の管理 |
|
| 高血圧の治療は、通常、内科的方法で行われる5。 | ||
| 鎮静や麻酔に伴う有害事象のリスク |
|
|
| 眼 |
|
|
| 聴覚 |
|
早期介入プログラム、あるいは公立学区を通じて行う地域の聴覚サービス |
| 歯科的問題 |
|
|
| 消化器症候 | 便秘の治療は、通常、まず水分や繊維の多い食餌、次いで浸透圧性下剤による治療を行う。 | 便秘は、憩室症/憩室炎の早期発症リスクがあるため、年齢を問わず積極的に対応する。 |
| 小児、成人の腹痛の治療は、その原因(例えば、胃食道逆流症,高カルシウム血症,裂孔ヘルニア,憩室炎)によって変わってくる。 | 重度の腹痛は、憩室炎や腸穿孔が原因である可能性あり。 WSでは、若年者にこれが生じる可能性あり。 |
|
| 尿路の異常 |
|
|
| 筋骨格症候 |
|
|
| 高カルシウム血症 |
その場合でも、血清カルシウムのモニタリングは必要である。
|
|
| 思春期早発症 | ゴナドトロピン放出ホルモンアゴニストを用いた治療8 | |
| 甲状腺機能低下症 | 経口サイロキシン治療 | 無症状の甲状腺機能低下は、通常、モニタリングのみで治療を要しない。 |
| インスリン抵抗性/糖尿病 |
|
|
| 家族/地域社会 |
|
|
- Mervis&GreinerdeMagalhães[2022]
- Cherniskeら[2004]
- WSの精神薬理学的側面についてはThomら[2021]を参照されたい。
- Morris&Mervis[2021]
- 抗高血圧治療については、Collinsら[2018]、Kozelら[2021]を参照のこと。
- Schmidtら[2021],Staudt&Eagle[2021]
- Rossら[2011]
- Stanleyら[2021]
発達遅滞/知的障害の管理に関する事項
以下に述べる内容は、アメリカにおける発達遅滞者、知的障害者の管理に関する一般的推奨事項を挙げたものである。ただ、そうした標準的推奨事項は、国ごとに異なったものになることもあろう。
0-3歳
作業療法、理学療法、言語治療、摂食治療、乳児のメンタルヘルスサービス、特別支援教育といったものが受けられるよう、早期介入プログラムへの紹介が推奨される。これは、アメリカでは連邦政府が費用を負担して、罹患者個人の治療上のニーズに対する在宅サービスが受けられる制度で、すべての州で利用可能である。
3-5歳
アメリカでは、地域の公立学区(訳注:ここで言う「学区」というのは、地理的な範囲を指す言葉ではなく、教育行政単位を指す言葉である)を通じて発達保育園に入ることが推奨される。
入園前には、必要なサービスや治療の内容を決定するために必要な評価が行われ、その上で、運動、言語、社会性、認知等の機能の遅れをもとに認定された子どもに対し、個別教育計画(IEP)が策定される。通常は、早期介入プログラムがこうした移行を支援することになる。発達保育園は通園が基本であるが、医学的に不安定で通園ができない子どもに対しては、在宅サービスの提供が行われる。
全年齢
各地域、州、(アメリカの)教育関係部局が適切な形で関与できるよう、そして、良好な生活の質を最大限確保する支援を親に対してできるよう、発達小児科医とよく話をすることが推奨される。押さえておくべき事項がいくつかある。
- IEPのサービス
- IEPは、認定を受けた子どもに対して、特別に構成された指導と、それに関連するサービスを提供する。
- IEPのサービスは、必要な変更点を決定するため、毎年見直しが行われる。
- 特別支援教育に関する法律は、IEPの対象となっている子どもについて、いつ、いかなる場にあっても、学校という場で実現可能な範囲で最も制約の少ない環境に置かれるべきであり、適切と判断された範囲内で、可能な限り多くの一般教育が受けられる環境が与えられるべきであると規定している。
- 当該児のIEPチームには、子どもが教材に接するための支援を行う目的で、視覚ならびに聴覚に関する相談員が配置される必要がある。
- IEPにおいては、子どもが教材に接するために必要と思われる範囲内で、理学療法、作業療法、言語治療の提供が行われる。
それを超える部分については、罹患児のニーズに基づいて、自費での支援治療が検討されるようなこともある。
行う治療の種類については、発達小児科医が個別に推奨を行う。
◦子どもがティーン世代になった時点で、移行計画についての話し合いが行われ、IEPの中にそれが組み込まれる。
IEPサービスを受ける人たちのため、公立学区はその人が21歳になるまでサービスを提供しなければならないことになっている。
- 504プラン(第504項:障害に基づく差別を禁じたアメリカの連邦法)に基づいて、教室内で前のほうへの着席、補助機器の使用、代書者の起用、業間の休み時間の延長、宿題の変更、大きな活字の教科書の使用といった配慮や変更が必要な人に対しては、対応の検討が行われる。
- 発達障害者福祉局(DDA)への登録が推奨される。DDAは、アメリカの公的機関で、認定を受けた人に対してサービスや支援を提供している。認定基準は州によって異なるものの、ふつうは、診断名やそれに伴う認知/適応障害の度合に従って決定がなされる。
- 収入が少なく、情報資源も不足している家族については、障害児のための補足的所得補償制度(SSI)の認定を受ける道がある。
運動機能障害
粗大運動機能障害
- 可動性を最大限確保し、遅発性の整形外科的合併症(例えば、拘縮や脊柱側彎)のリスクを減少させることを目的として、理学療法が推奨される。
- 乗馬療法(言語治療、理学療法、作業療法と同時並行での乗馬運動の利用)を検討する。
微細運動機能障害
摂食、身だしなみ、着替え、筆記などの適応機能に問題が生じる微細運動技能の障害に関しては、作業療法が推奨される。
口腔運動機能障害
口腔運動機能については、来院ごとに評価を行うようにする。そして、摂食時の窒息/嘔吐、体重増加不良、度重なる呼吸器疾患への罹患、特別な理由の見当たらない摂食拒否といった状況がみられる場合は、臨床的摂食評価やX線嚥下検査を行うようにする。罹患児が、口からの摂食を安全に行える状況にあるということが前提ではあるが、協調運動の改善、あるいは、感覚の関係した摂食の問題の改善を支援する手段として、摂食治療(ふつう、作業療法士あるいは言語治療士がこれを担当する)が推奨される。安全性を確保するため、食餌にとろみをつけたり、冷やしたりといったことが行われることがある。重度の摂食障害がみられる場合は、経鼻胃管あるいは胃瘻チューブが必要になることがある。
社会/行動上の懸念事項
小児に対しては、応用行動分析(ABA)をはじめとする自閉症スペクトラム障害の治療で用いられる治療的介入の導入に向けた評価を行うとともに、実際にそれを施行することがある。ABA療法は、個々の子どもの行動上の強みと弱み、社会性に関する強みと弱み、適応性に関する強みと弱みに焦点を当てたもので、ふつう、行動分析に関する学会認定士との1対1の場で行われる。
発達小児科医を受診することで、両親に対し、適切な行動管理の指針を指導したり、注意欠如/多動性障害や不安症の治療用の薬を処方したりといったことも可能になる。
定期的追跡評価
表7:Williams症候群罹患者で推奨される定期的追跡評価
| 間隔/年齢 | 検査/測定 |
|---|---|
| 乳幼児 |
|
| 全年齢を通じ年に1度1 |
|
| 全年齢を通じ2年に1度 |
|
| 全年齢を通じ10年に1度 |
|
| 成人 |
|
- 別に特記したものを除く。
- 異常なしの場合、その後は5年ごとに経口ブドウ糖負荷試験を反復する。
避けるべき薬剤/環境
小児用マルチビタミン剤は、すべてビタミンDを含むものとなっているため、WS罹患児にこれを与えてはならない。
リスクを有する血縁者の評価
リスクを有する血族に対して行う遺伝カウンセリングを目的とした検査関連の事項については、「遺伝カウンセリング」の項を参照されたい。
妊娠管理
WS女性の妊娠は高リスクである。WS妊婦については、妊娠誘発高血圧、不整脈、心不全の発生に備えたモニタリングを行う必要がある。妊娠後期には尿路感染症のリスクが高まることから、定期的に尿検査を行う必要がある。胎児に対する超音波でのモニタリングが推奨される[Linら2008]。
研究段階の治療
さまざまな疾患・状況に対して進行中の臨床試験に関する情報については、アメリカの「ClinicalTrials.gov」、ならびにヨーロッパの「EUClinicalTrialsRegister」を参照されたい。
注:現時点で本疾患に関する臨床試験が行われているとは限らない。
遺伝カウンセリング
「遺伝カウンセリングは個人や家族に対して遺伝性疾患の本質,遺伝,健康上の影響などの情報を提供し,彼らが医療上あるいは個人的な決断を下すのを援助するプロセスである.以下の項目では遺伝的なリスク評価や家族の遺伝学的状況を明らかにするための家族歴の評価,遺伝学的検査について論じる.この項は個々の当事者が直面しうる個人的あるいは文化的、倫理的な問題に言及しようと意図するものではないし,遺伝専門家へのコンサルトの代用となるものでもない.」
遺伝形式
Williams症候群(WS)は、denovoの遺伝学的変化によって引き起こされることの多い常染色体顕性遺伝疾患である。
家族構成員のリスク
発端者の両親
- Sと診断された罹患者の大半は、7q11.23に生じたdenovoの1.5-1.8Mbの欠失に起因して本疾患に至ったものである。・稀ながら、罹患者である親からの継承例がみられる[Morrisら1993,Sadlerら1993,Mulikら2004]。
- 欠失のきっかけとなった非罹患者である片親が7q11.23を含む7番染色体の逆位を有している家系が約25%存在することが研究により明らかになっている[Osborneら2001,Bayésら2003,Hobartら2010]。
逆位を有する人の子は、1,750人に1人の割合でWS罹患者となる[Hobartら2010]。
(注:一般集団の約6%が多型としてのこの逆位を有している[Hobartら2010]が、逆位そのものは臨床症候を引き起こす原因とはならない[Tamら2008]上に、逆位があった場合でも罹患者や家族に対して行う臨床的管理の内容は変わらないため、逆位の検査は推奨されない。)
- WS発端者の両親に対しては、WSの徴候や症候の有無を調べる病歴聴取が推奨される。
両親にWSの臨床所見がみられない場合、発端者で同定された7q11.23の欠失に関する検査を両親に対して行う必要はない。
発端者の同胞
-
発端者の同胞の有するリスクは、発端者の両親の遺伝学的状態によって変わってくる。
- 発端者で同定された7q11.23の欠失を片親が有していた場合、同胞がその欠失を継承して罹患者となるリスクは50%である。WSで現れる症候は、家族のメンバー間でばらつきがあるため、7q11.23の欠失を継承することになった同胞に現れる表現型を信頼性をもって予測することはできない。
- これまでに、同胞への再発がみられたとする報告が2例存在する。
一方の家系は、父親のほうに7q11.23を含む逆位がみられ、父親由来の染色体に欠失が生じたものであった。他方の家系では7q11.23の関係する逆位は認めなかったことから、母親が生殖細胞系列モザイクを有していたことが欠失の原因である可能性が高いものと思われた[Schererら2005]。
- これまで家族性の例がほとんど報告されていないことから、両親とも臨床的に非罹患者と目される場合、発端者の同胞の有するリスクは低い(1%未満)ものと思われる。
それでも、同胞の有するリスクは、一般集団よりは高くなる。
それは、片親が生殖細胞系列モザイクを有している可能性、ならびに、片親が逆位の多型を有している可能性が考えられるからである。
発端者の子
Williams症候群罹患者の子はそれぞれ、50%の確率で7q11.23の欠失を継承して罹患者となる。
他の家族構成員
他の血族の有するリスクは、発端者の両親の状態によって変わってくる。仮に、片親が罹患者であったということになれば、その片親の血族にあたる人はすべてリスクを有することになる。
関連する遺伝カウンセリング上の諸事項
家族計画
- 遺伝学的リスクの確定、出生前/着床前遺伝学的検査を受けるかどうかの話し合いに最も適しているのは、妊娠前の時期である。
- WSの子をもつことに関しリスクを有する若い成人に対しては、遺伝カウンセリング(子に生じる可能性のあるリスクや、子を儲ける上での選択肢についての説明を含む)を提供することが望ましい。
出生前検査ならびに着床前遺伝学的検査
家系内に存在するWSを引き起こす7q11.23の1.5-1.8Mbの欠失が同定されている場合は、出生前検査や着床前遺伝学的検査を行うことが可能である。
注:出生前検査の結果をもとに、出生後の表現型を信頼性をもって予測することはできない。
出生前検査の利用に関しては、医療者間でも、また家族内でも、さまざまな見方がある。現在、多くの医療機関では、出生前検査を個人の決断に委ねられるべきものと考えているようであるが、こうした問題に関しては、もう少し議論を深める必要があろう。
関連情報
GeneReviewsスタッフは、この疾患を持つ患者および家族に役立つ以下の疾患特異的な支援団体/上部支援団体/登録を選択した。GeneReviewsは、他の組織によって提供される情報には責任をもたない。選択基準における情報については、ここをクリック。
- CanadianAssociationforWilliamsSyndrome
- MedlinePlus
- NCBIGenesandDisease
- WilliamsSyndromeAssociation
- WilliamsSyndromeFoundation
- WilliamsSyndromeRegistry
Canada
Phone:204-256-6594
Email:contact@williamssyndrome.ca
www.williamssyndrome.ca
Phone:800-806-1871;248-244-2229
Fax:248-244-2230
Email:info@williams-syndrome.org
www.williams-syndrome.org
UnitedKingdom
Phone:02085671374
Email:enquiries@williams-syndrome.org.uk
www.williams-syndrome.org.uk
分子遺伝学
分子遺伝学とOMIMの表の情報はGeneReviewsの他の場所の情報とは異なるかもしれない。表は、より最新の情報を含むことがある。
表A:Williams症候群:遺伝子とデータベース
| クリティカル領域 | 遺伝子 | 染色体上の座位 | タンパク質 | Locus-Specificデータベース | HGMD | ClinVar |
|---|---|---|---|---|---|---|
| WBSCR | 対象外 | 7q11.23 | 対象外 | |||
| ELN | エラスチン | ELNdatabase | ELN | ELN | ||
| GTF2I | 基本転写因子Ⅱ-I | GTF2I | ||||
| GTF2IRD1 | 基本転写因子Ⅱ-Iリピートドメイン含有タンパク質1 | GTF2IRD1 | ||||
| LIMK1 | LIMドメインキナーゼ1 | LIMK1 | ||||
| NCF1 | 好中球細胞質基質因子1 | NCF1 database NCF1base: Mutation registry for autosomal recessive chronic granulomatous disease (CGD), deficiency of p47phox |
NCF1 | NCF1 |
遺伝子についてはHGNCから、染色体上の座位についてはOMIMから、タンパク質についてはUniProtから。 リンクが張られているデータベース(Locus-Specific,HGMD,ClinVar)の説明についてはこちらをクリック。
表B:Williams症候群関連のOMIMエントリー(内容の閲覧はOMIMへ)
| 130160 | ELASTIN; ELN |
| 194050 | WILLIAMS-BEUREN SYNDROME; WBS |
| 601329 | LIM DOMAIN KINASE 1; LIMK1 |
| 601679 | GENERAL TRANSCRIPTION FACTOR II-I; GTF2I |
| 604318 | GTF2I REPEAT DOMAIN-CONTAINING PROTEIN 1; GTF2IRD1 |
| 608512 | NEUTROPHIL CYTOSOLIC FACTOR 1; NCF1 |
分子レベルの病原
Williams症候群(WS)を引き起こす7q11.23の欠失と7q11.23の相互重複は、どちらもこの領域のゲノム構造によって引き起こされる。7q11.23領域には、これに隣接する形で低コピー反復配列があり、これが非同一アレル間相同組換えを起こす素因になっている。WS罹患者の95%は1.55Mbの欠失で、ここには25の遺伝子がある。そして、5%は1.84Mbの欠失で、ここには27の遺伝子がある[Bayésら2003]。欠失は、低コピー反復配列(LCR)ブロック間の非同一アレル間相同組換えによって生じ、欠失のサイズは、どのブロックがこれに関与するかによって決まる。
7q11.23のテロメア端でLCRに隣接する領域には、GTF2I、GTF2IRD1、GTF2IRD2という、転写因子をコードする3つの遺伝子が同定されている。これらのTFⅡ-I遺伝子ファミリーのメンバーは、さまざまなプロモーターにおいて基部・上流部両方の調節部位と結合する能力を有することから、WSの表現型を形作る上で重要な役割を果たしている可能性が高い。これらの転写因子は、複雑なタンパク質相互作用に関与して、シグナル伝達に一定の役割を果たしている。このファミリーに属する各タンパク質は複数のアイソフォームをもっており、それぞれ別々の組織で別々の発現パターンを示す。そしてこのことが、これらの遺伝子のヘテロ接合性欠失がWSの表現型形成に係わる数多くの異なる場面で関与している可能性の基となっている[Kozelら2021]。
この領域における注目すべき遺伝子
- ELN
ELNは、構造タンパク質であるエラスチンをコードしている。
エラスチンは、多くの組織中にある弾性線維の1つの主要な構成要素になっている。
ELNの欠失により、WSでみられる心血管疾患をはじめとする結合組織の異常が生じる[Ewartら1993]。
ELNの病的バリアントは、通常、常染色体顕性SVASとなって現れる[Liら1997]。
ELNの病的バリアントは、先天性皮膚弛緩症においても報告されている[Tassabehjiら1998,Zhangら1999]。
- LIMK1
LIMK1は、脳で発現し、神経細胞の移動を調節するタンパク質であるLIMドメインキナーゼ1をコードしている。
LIMK1の欠失は、WS罹患者でみられる視空間構築に関係する認知の異常に関与しているとされる[Frangiskakisら1996,Morrisら2003,Hoogenraadら2004]。
一般集団でみられるLIMK1のバリエーションは、頭頂間溝を通る背側視覚経路に影響を及ぼすことになるが、WSではこれが構造的、機能的に変化してしまっている[Gregoryら2019]。
Limドメインキナーゼ1は2つのLIMモチーフと1つのタンパク質キナーゼドメインをもち、細胞内シグナル伝達に関与していると考えられている。
- GTF2I
GTF2Iは、基本転写因子Ⅱ-I(GTFⅡ-I)をコードしている。
GTFⅡ-Iは、核内では誘導性多機能転写因子として[Roy2012]、細胞質内ではアゴニスト誘導性カルシウム流入調節因子として[Caraveoら2006]作用している。
GTFⅡ-Iは、胚発生、アクチン細胞骨格、軸索伸長、エピジェネティックな調節といったことに関与している[Kozelら2021]。WBSCRに非定型的小欠失を有する家系の欠失マッピング研究により、この遺伝子の欠失がIQに負の影響を及ぼしていることが示唆されている[Morrisら2003]。GTF2Iの多型は、自閉症スペクトラム障害の重症度[Malenfantら2012]、社会的不安のレベル、一般集団内での社会的コミュニケーション能力といったものと関係している[Crespi&Hurd2014]と同時に、特性不安と嫌悪的な社会的合図(socialcue)に対する脳の反応との間の関係にも影響を及ぼしているとされている[Jabbiら2015]。
- GTF2IRD1
GTF2IRD1は、基本転写因子Ⅱ-Iリピートドメイン含有タンパク質1(GTF2IRD1)をコードしている。WBSCRの定型的小欠失を有する例の研究から、GTF2IRD1は、頭蓋顔面症候[Tassabehjiら2005]、ならびに社会的コミュニケーション障害[Kozelら2021]に関与しているとされている。
- NCF1
NCF1は、NADPHオキシダーゼ系の1構成要素である好中球細胞質基質因子1(neutrophilcytosolfactor1)をコードしている。NCF1を含む形でのWBSCRの欠失を有する例は、高血圧に関して低リスクである。NCF1はWBSCR内でテロメア側に位置しており、この遺伝子の欠失を示すWS罹患者の割合は約40%である[DelCampoら2006,Kozelら2014]。
WSの表現型には以下の各遺伝子も関与している可能性があるものの、現時点では、これらの遺伝子の関与が確認されるところにまでは至っていない。
- STAX1A
STAX1Aは、神経伝達物質の放出とインスリン分泌に関与するシンタキシン1Aをコードしている。STAX1Aは、WSにおける糖尿病の発生に一定の役割を果たしている可能性がある[Kozelら2014]。シンタキシン1Aは、タンパク質-タンパク質相互作用を通じて神経伝達物質の放出を仲介していることから、WSにおける精神疾患の発生に一定の役割を果たしている可能性がある[Kozelら2021]。
- MLXIPL
MLXIPLは、グルコースと脂質の代謝を制御するChREBP転写因子である炭水化物応答配列結合タンパク質をコードしている。この遺伝子の欠失は、糖尿病、肥満、脂肪性浮腫といったWS罹患者で多くみられる代謝異常に関与している可能性がある[Kozelら2021]。
- BAZ1B
BAZ1Bは、タンパク質チロシンキナーゼBAZ1Bをコードしている。BAZ1Bはクロマチン再構成複合体の一部分である。ビタミンD受容体と結合することから、理論上、WSでみられる高カルシウム血症に一定の役割を果たしている可能性があるとされている[Mengら1998]。また、この遺伝子は神経堤細胞の遊走に関与していることから、WSでみられる頭蓋顔面の特徴と消化器症候にも関係しているのではないかとみられている[Kozelら2021]。
- CLIP2
CLIP2は、CAP-Glyドメイン含有リンカータンパク質2(CLIP2)をコードしている。CLIP2は脳内で強い発現を示し、膜微小管と相互作用することから、WSでみられる小脳異常に関与しているのではないかとの見方がなされている[Hoogenraadら2004]。
7q11.23の欠失に関連するその他の遺伝子については、WSの表現型との関連はわかっていない。
更新履歴:
- Gene Reviews著者: Colleen A Morris, MD, FACMG, FAAP
日本語訳者: 荒川航太、髙野亨子 (信州大学医学部遺伝医学・予防医学)
Gene Reviews 最終更新日: 2017.3.23 日本語訳最終更新日: 2017.12.29 - Gene Reviews著者: BColleenAMorris,MD,FACMG,FAAP
日本語訳者:佐藤康守(たい矯正歯科)、櫻井晃洋(札幌医科大学医学部遺伝医学)
GeneReviews最終更新日: 2023.4.13. 日本語訳最終更新日::2023.8.4.[in present]