インスリン受容体関連重症インスリン抵抗性症候群
(INSR-RelatedSevere Insulin Resistance Syndrome)
Gene Reviews著者: Aviv Mesika, Aharon Klar, MD, and Tzipora C Falik Zaccai, MD
日本語訳者:佐藤康守(たい矯正歯科)、櫻井晃洋(札幌医科大学医学部遺伝医学)
GeneReviews最終更新日: 2024.4.25. 日本語訳最終更新日: 2024.12.2.
原文: INSR-RelatedSevere Insulin Resistance Syndrome
要約
疾患の特徴
インスリン受容体(INSR)関連重症インスリン抵抗性症候群(INSR-SIRS)は、Donohue症候群という重症の表現型から、Rabson-Mendenhall症候群(RMS)という比較的軽症の表現型まで、一連の連続体としての表現型のスペクトラムを構成する疾患である。
Donohue症候群は、重症インスリン抵抗性(空腹時低血糖と食後高血糖を伴う高インスリン血症)、重度の出生前発育不全、出生後の成長障害、筋緊張低下、発達遅滞、特徴的顔貌(眼球突出,眼窩下部の皺,後方に傾いた低位の大きな耳,鮮紅色の肥厚した上下口唇,歯肉肥大)、心・腎・肝・脾・卵巣などの臓器腫大を特徴とする疾患である。多くは、満1歳に達する前に死亡する。
一方、RMSのほうはスペクトラムの軽症端にあるもので、Donohue症候群ほどではないものの、血糖値の変動、糖尿病性ケトアシドーシス、10歳代でみられる微小血管合併症などを伴う重症インスリン抵抗性が特徴である。所見的には、重度の発育遅延と知的障害を示すものから、正常な成長・発達を示すものまで幅がみられる。顔貌所見はDonohue症候群でみられるものよりは軽度なことがある。死亡原因として最も一般的なのは、長期の高血糖(long-standing hyperglycemia)に伴う合併症である。死亡時年齢は、多くの場合、10歳代であるが、もっと長く生きる罹患者も存在する。
診断・検査
発端者におけるINSR-SIRSの診断は、特徴的な臨床所見、臨床検査所見、X線写真所見、出生前超音波所見に加え、分子遺伝学的検査にてINSRの両アレル性病的バリアントが同定されることをもって確定する。
臨床的マネジメント
症候に対する治療
Donohue症候群:
現在のところ、インスリン抵抗性をはじめとするDonohue症候群の諸症候に対する効果的な治療法は存在しない。頻回の摂食、夕食をタンパク質含有量の多いものにすることなどが、空腹時低血糖の予防に役立つ。
RMS:
最初に、血糖値とグリコシル化ヘモグロビン(HbA1c)値の低減を目的としたインスリン感受性促進薬が用いられるものの、その効果は、経時的に減弱し、多くの場合、用量の見直しや多剤併用療法への移行が必要となる。高血糖が持続する場合は、糖尿病性ケトアシドーシスの治療に合わせて、通常は高用量でインスリンの投与を開始する。甲状腺機能低下症に対しては、標準治療を行う。アンドロゲン過剰症の治療としては、経口避妊薬、抗アンドロゲン療法、ゴナドトロピン放出ホルモン作動薬などが考えられる。卵巣肥大がある例では、卵巣摘出術が必要になる場合がある。栄養指導、発達支援、教育支援を行う。併発感染症に対しては、精密検査を行って治療を進める。心筋症に対しては、β遮断薬を用いる。腎石灰化症については、腎臓内科医による治療を行う。胆汁うっ滞については、消化器内科医による治療を行う。直腸脱については、外科医による治療を行う。悪性腫瘍については、標準治療を行う。患者や家族に対し、ソーシャルワーカーによる支援を提供する。
定期的追跡評価:
臨床的に適応と考えられる場合には、空腹時と食後の血糖値測定、あるいは継続的モニタリング。HbA1c、インスリン、C-ペプチドの測定を3ヵ月ごと。甲状腺機能とアンドロゲン過剰症の臨床評価を6ヵ月ごと、あるいは臨床的必要性に応じて。卵巣超音波検査を2歳までは3ヵ月ごと、その後は6ヵ月に1度あるいは必要に応じて。栄養と成長の評価を来院ごと。精神運動発達の評価を3ヵ月ごと。反復性感染症の評価を来院ごと。心エコーと心臓MRIを2歳まで6ヵ月ごと(それぞれを交互に3ヵ月ごと)、その後は1年ごと(それぞれを交互に6ヵ月ごと)あるいは必要に応じて。尿中カルシウムと腎超音波検査を6ヵ月ごと。膣からの異常出血がみられる例については、子宮内膜がんに関する婦人科的評価。
避けるべき薬剤/環境:
Donohue症候群については、低血糖を引き起こす薬剤、長時間の絶食、感染症患者との接触を避ける。RMSでは、高血糖を引き起こす薬剤、高炭水化物の食餌、感染症患者との接触を避ける。
遺伝カウンセリング
INSR-SIRSは、常染色体潜性の遺伝形式をとる。両親ともにINSRの病的バリアントのヘテロ接合体であることが判明している場合、罹患者の同胞は、受胎の段階で、両アレル性に病的バリアントを継承して同じく罹患者となる確率が25%、病的バリアントを1つだけ継承してヘテロ接合体となる確率が50%、その家系に存在するINSRをどちらも継承しない確率が25%である。ヘテロ接合体は、通常無症状であるが、同一座位アレル疾患であるA型インスリン抵抗性の症候を示すことがある。家系内に存在するINSRの複数の病的バリアントが同定されている場合は、有リスクの血族に対するヘテロ接合体検査、ならびに出生前検査や着床前遺伝学的検査が可能である。(INSRの病的バリアントのヘテロ接合体は、妊娠糖尿病に関し高リスクであり、妊娠前、妊娠中に耐糖能異常のモニタリングが必要になることを記憶に留められたい。)
GeneReviewの視点
| INSR関連重症インスリン抵抗性症候群:ここに含まれる表現型 |
|---|
|
- 別名については「疾患名について」を参照。
診断
次のようなDonohue症候群あるいはRabson-Mendenhall症候群(RMS)の臨床所見、臨床検査所見、画像所見を有する例については、INSR関連インスリン抵抗性症候群(INSR-SIRS)を疑う必要がある。
本疾患を示唆する所見
次のようなDonohue症候群あるいはRabson-Mendenhall症候群(RMS)の臨床所見、臨床検査所見、画像所見を有する例については、INSR関連インスリン抵抗性症候群(INSR-SIRS)を疑う必要がある。
臨床症候
Donohue症候群
- 第3三半期初期に始まる進行性の子宮内発育不全(intrauterine growth restriction;IUGR)、ならびに出生後の体重増加不良、成長障害、皮下脂肪の減少
- 眼球突出、眼窩下部の皺、後方に傾いた低位の大きな耳、肥厚した上下口唇、歯肉肥大などの顔面の形態異常(図1)[Grassoら2013]
- 筋緊張低下
- 発達遅滞
- 乾燥肌、多毛症(図2)、黒色表皮腫などの皮膚症候
- 目立つ乳頭(図3)
- 腹部膨満(図4)ならびに臓器腫大
- 大性器症(男女とも)(図4B)
- 直腸肥大と直腸脱(図5)
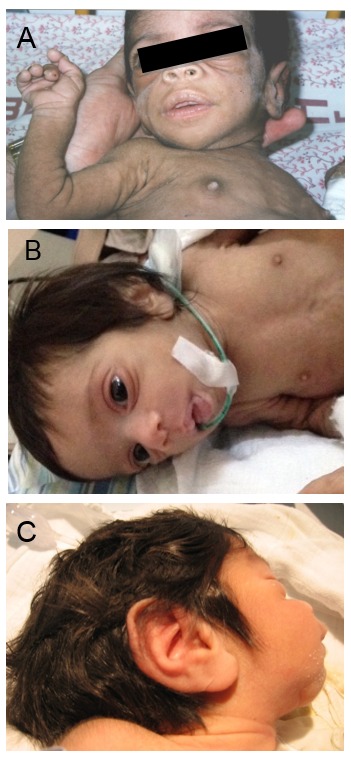
図1:Donohue症候群新生児にみられた特徴的形態異常
歯肉過成長,後方に傾いた低位の大きな耳,眼窩下部の皺,眼球突出,鮮紅色の肥厚した上下口唇。
図1Aと1CはFalik Zaccaiら[2014]より転載。
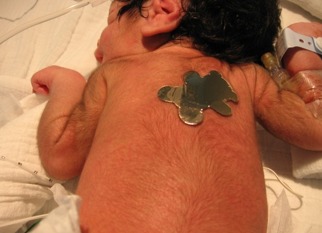
図2:
多毛症は、すべてのDonohue症候群罹患者にみられる症候である。
Falik Zaccaiら[2014]より転載。
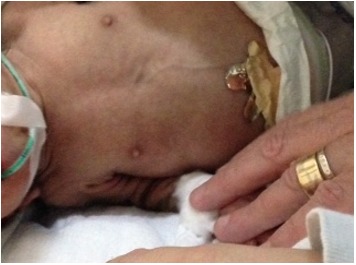
図3:
目立つ乳頭は、Donohue症候群新生児の大多数でみられる所見である。
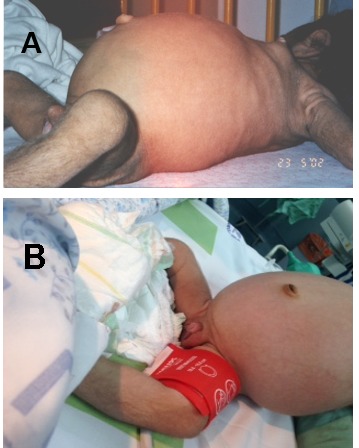
図4:
AならびにB.腹部膨満
B.Donohue症候群の4ヵ月女児にみられた陰唇肥大と陰核肥大
図4Aは、Falik Zaccaiら[2014]より転載。
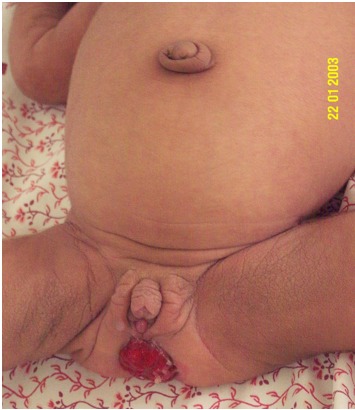
図5:
Donohue症候群乳児でみられた直腸肥大と直腸脱。
RMS
- Donohue症候群に類似していたり[Ben Abdelazizら2016]、それより軽度であったり[Mussoら2004]する顔面の形態異常
- 多毛症や黒色表皮腫などの皮膚症候
- 目立つ乳頭
- 大性器症(男女とも)
- 歯の早期萌出と叢生[Bathiら2010]
- 成長障害(Donohue症候群に比べ軽度)[Tuthillら2007]
- 発達遅滞(一部の例)[Ben Abdelazizら2016,Sinnarajahら2016]
臨床検査所見
Donohue症候群
- 重症の高インスリン血症。血漿インスリン値とC-ペプチド値が極端に高く、血糖値は変動(概して空腹時は低血糖、食後は高血糖)。
- ケトアシドーシスの報告はない。
RMS
- 出生から満1歳に達するまで
重症の高インスリン血症で、血漿インスリン値とC-ペプチド値が極端に高く、血糖値は変動(概して空腹時は低血糖、食後は高血糖)。
- 満1歳以降
インスリン値は着実に低下していき、当初は血糖値が上昇して低血糖イベントは減るが、その後、ケトアシドーシスに関し高リスクとなる。
- 中性脂肪の低値と、高密度リポタンパク質(HDL)の高値[Sempleら2009]
- アディポネクチン値の上昇[Sempleら2008]
画像所見
Donohue症候群,RMSとも
- 肥大型心筋症
- 腎・肝・脾の腫大
- 腎石灰症
- 腫大した多嚢胞性卵巣
診断の確定
発端者におけるINSR-SIRSの診断は、これを示唆する所見がみられることに加え、分子遺伝学的検査にてINSRの両アレル性病的バリアント(pathogenicとlikely pathogenicの両方を含む)が同定されることをもって確定する(表1参照)。
注:(1)アメリカ臨床遺伝ゲノム学会(ACMG)/分子病理学会(AMP)のバリアントの解釈に関するガイドラインによると、「pathogenic」のバリアントと「likely pathogenic」のバリアントとは臨床の場では同義であり、ともに診断に供しうるものであると同時に、臨床的な意思決定に使用しうるものとされている[Richardsら2015]。本GeneReviewで「病的バリアント」と言うとき、それは、あらゆるlikely pathogenicのバリアントまでを包含するものと理解されたい。
(2)INSRに両アレル性の意義不明バリアントが同定された場合(あるいは、既知の病的バリアント1つと意義不明のバリアント1つが同定された場合)、それは、本疾患の診断を確定するものでも否定するものでもない。
分子遺伝学的検査のアプローチとしては、遺伝子標的型検査(単一遺伝子検査、マルチ遺伝子パネル)と網羅的ゲノム検査(エクソームシーケンシング,ゲノムシーケンシング)を組み合わせるやり方が考えられる。遺伝子標的型検査の場合は、臨床医の側で関与が疑われる遺伝子の目星をつけておく必要がある(「方法1」参照)が、ゲノム検査の場合、その必要はない(「方法2」参照)。
方法1
- 単一遺伝子検査
INSRに生じたミスセンス・ナンセンス・スプライス部位バリアントや、遺伝子内の小欠失/挿入の検出を目的として、最初にINSRの配列解析を行う。
注:使用するシーケンシングの手法によっては、単一エクソン、複数エクソン、遺伝子全体といったサイズの欠失/重複が検出されないことがある。用いたシーケンシングの手法でバリアントが1つしか、あるいは1つも検出されないといった場合、次のステップとして行うべきは、エクソン単位や遺伝子全体の欠失や重複を検出することを目的とした遺伝子標的型欠失/重複解析である。
- マルチ遺伝子パネル
現況の表現型と直接関係のない遺伝子の意義不明バリアントや病的バリアントの検出を抑えつつ、疾患の遺伝学的原因の特定に最もつながりやすいのは、INSRその他の関連遺伝子(「鑑別診断」の節を参照)を含むマルチ遺伝子パネルであるように思われる。
注:(1)パネルに含められる遺伝子の内容、ならびに個々の遺伝子について行う検査の診断上の感度については、検査機関によってばらつきがみられ、また、経時的に変更されていく可能性がある。
(2)マルチ遺伝子パネルによっては、今このGeneReviewで取り上げている状況と無関係な遺伝子が含まれることがある。INSR-SIRSが稀な疾患であるため、糖尿病用パネルの中には、本遺伝子を含まないものがある点に注意を要する。
(3)検査機関によっては、パネルの内容が、その機関の定めた定型のパネルであったり、表現型ごとに定めたものの中で臨床医の指定した遺伝子を含む定型のエクソーム解析であったりすることがある。
(4)ある1つのパネルに対して適用される手法には、配列解析、欠失/重複解析、ないしその他の非配列ベースの検査などがある。
マルチ遺伝子パネル検査の基礎的情報についてはここをクリック。
遺伝学的検査をオーダーする臨床医に対する、より詳細な情報についてはここをクリック。
方法2
網羅的ゲノム検査の場合、臨床医の側で疑わしい遺伝子の目星をつけておく必要はない。エクソームシーケンシングが最も広く用いられているが、ゲノムシーケンシングを使用することも可能である。
網羅的ゲノム検査の基礎的情報についてはここをクリック。
ゲノム検査をオーダーする臨床医に対する、より詳細な情報についてはここをクリック。
表1:INSR関連重症インスリン抵抗性症候群で用いられる分子遺伝学的検査
| 遺伝子1 | 方法 | その手法で病的バリアント2が検出される割合 |
|---|---|---|
| INSR | 配列解析3 | 90%超4 |
| 遺伝子標的型欠失/重複解析5 | 10%未満4 |
- 染色体上の座位ならびにタンパク質に関しては、表A「遺伝子とデータベース」を参照。
- この遺伝子で検出されているバリアントの情報については、「分子遺伝学」の節を参照のこと。
- 配列解析を行うことで、benign、likely benign、意義不明、likely pathogenic、pathogenicといったバリアントが検出される。バリアントの種類としては、ミスセンス・ナンセンス・スプライス部位バリアントや遺伝子内の小欠失/挿入などがあるが、通常、エクソン単位あるいは遺伝子全体の欠失/重複については検出されない。 配列解析の結果の解釈に際して留意すべき事項についてはこちらをクリック。
- ヒト遺伝子変異データベース(HGMD)[Stensonら2020]の購読ベースの専門家向けビューのデータより。
- 遺伝子標的型欠失/重複解析では、遺伝子内の欠失や重複が検出される。具体的手法としては、定量的PCR、ロングレンジPCR、MLPA法、あるいは単一エクソンの欠失/重複の検出を目的に設計された遺伝子標的型マイクロアレイなど、さまざまなものがある。
臨床的特徴
臨床像
INSR関連重症インスリン抵抗性症候群(INSR-SIRS)は、Donohue症候群という重症の表現型から、Rabson-Mendenhall症候群(RMS)という比較的軽症の表現型まで、表現型の上で1つの連続体から成る疾患である。現在までにINSR-SIRSと同定された罹患者の数は100人に満たない[Termoteら2016]。以下に述べる本疾患の表現型上の特徴は、そうした報告を基にしたものである。表2:INSR関連重症インスリン抵抗性症候群:代表的症候ごとにみた表現型の比較
| 症候 | Donohue症候群 | Rabson-Mendenhall症候群 | |
|---|---|---|---|
| 内分泌 | 高インスリン血症 | 100% | 100% |
| 糖尿病性ケトアシドーシス | + | 100% | |
| 大性器症 | + | 100% | |
| 甲状腺機能低下症 | + | 50%超 | |
| 成長 | 子宮内発育不全 | 100% | + |
| 出生後の成長障害 | 100% | 60%-80% | |
| 神経 | 筋緊張低下 | 100% | + |
| 発達遅滞 | 100% | 100% | |
| 知的障害 | 100% | 50%超 | |
| 顔面形態異常 | 100% | 100% | |
| 皮膚異常 | 100% | 100% | |
| 臓器腫大 | 100% | 60%-80% | |
| 直腸肥大/直腸脱 | 100% | + | |
Kushchayevaら[2019],Bamborschkeら[2021],Angelidiら[2021],Gosaviら[2021],Iqbalら[2022],Metwalleyら[2022],Nicilescuら[2023],Vakili & Rezaei[2023]の報告に基づく。
+=報告あり(頻度は不明)
Donohue症候群
Donohue症候群は、重症のインスリン抵抗性、成長障害、筋緊張低下、発達遅滞、特徴的顔貌、臓器腫大を特徴とする。
内分泌症候
高インスリン血症を伴うインスリン抵抗性(空腹時低血糖と食後高血糖)が出生時からみられる。このインスリン抵抗性に対しては、現在のところ、効果的な治療法は存在しない。食後高血糖は、インスリン治療[Sempleら2010]やメトホルミンに代表されるグルコース低下療法[Mussoら2004]に応答しない。
外性器の肥大は、男性(陰茎の肥大)にも女性(陰唇と陰核の肥大)にも生じる。特徴的な卵巣腫大がみられ、卵巣の超音波検査では、通常、特発性多嚢胞性卵巣症候群でみられるような、周辺部の複数の嚢胞を認める。嚢胞は非常に大きくなることがあり、出血や捻転をきたしやすくなることから、外科的摘出が必要になるようなこともある[Sempleら2011]。目立つ乳頭は、全例で認められる。
中枢性甲状腺機能低下症の報告がみられる[Baqirら2012,Falik Zaccaiら2014]。
発育不全
出生時の体重・身長・頭囲は、すべて3パーセンタイル未満であるが、より強い影響を受けるのは、頭囲よりも身長や体重のほうである[Dagdeviren Cakirら2020]。新生児期以降も体重増加不良と重度の成長障害が続き、1歳時点での平均体重は4-5kgである[Longoら2002]。皮下脂肪の減少が全例でみられる。
発達遅滞/知的障害
大多数の乳児は、言語・運動・認知の障害を含めた重度の全般的発達遅滞を有する[Falik Zaccaiら2014]。大多数の例は早期に死亡するが、それまでの間に重要な発達指標を達成するには至らない[Falik Zaccaiら2014,Joshiら2021]。体軸筋の緊張低下と筋萎縮も認められる[Baqirら2012]。知的障害の原因は、反復性で重度の低血糖発作にあると考えられている[Ben Abdelazizら2016]。
特徴的顔貌
特徴的顔貌としては、眼球突出、眼窩下部の皺、後方に傾いた低位の大きな耳、肥厚した上下口唇、歯肉肥大などがある[Grassoら2013](図1を参照)。巨舌の報告がみられるものの、これについては、インスリン様成長因子1(IGF-1)の長期投与に伴う続発性のものである可能性もある[Joshiら2021]。
反復性感染症
肺炎や尿路感染症をはじめとする反復性細菌感染症が死亡の大きな原因になっている。反復性感染症には、医療関連感染も関わっている可能性がある[Rojekら2023]。
皮膚
出生段階で、多毛症と過角化症がすべての罹患児に認められる。出生時や乳児期初期に、黒色表皮腫が顕在化することもある[Mussoら2004]。
心症候
肥大型心筋症が罹患乳児の30%にみられ、これが死亡の主要原因になっている[Geffnerら1987,Hovnikら2013,Falik Zaccaiら2014]。
腎症候
腎腫大が多くみられる。レニン-アルドステロン系の異常の報告があり、低カリウム血症、高アルドステロン血症、高レニン血症に至ったという[Grassoら2013]。生後1ヵ月未満の時期に、高カルシウム尿症と腎石灰化症がしばしばみられ、中に、出生前にこれが検出された例も存在する[Simpkinら2014]。糸球体濾過量と血漿クレアチニン濃度でみたときの腎機能は正常である[Grassoら2013,Simpkinら2014]。
肝/消化器症候
新生児期には、胆汁鬱滞が多くみられる[Hovnikら2013,Kawashimaら2013]。肝機能障害を伴わない肝腫大が生じる。直腸脱や直腸肥大がみられることがあり、時に結腸人工肛門造設術が必要となる[Weberら2014]。
歯の所見
歯の所見としては、巨大歯症や歯の叢生などがある。
予後
通常、1歳未満の段階で死亡する。主要な死亡原因は、低血糖の合併症、反復性細菌感染症[Eldersら1982,de Bockら2012]、心筋症[Grassoら2013]である。
Rabson-Mendenhall症候群(RMS)
RMSは、一連のスペクトラムの軽症端にあるもので、血糖値の変動、糖尿病性ケトアシドーシス、微小血管合併症を伴う重症のインスリン抵抗性を特徴とする。重度の成長障害と知的障害をもつ例から、成長・発達の正常なものまで、大きなばらつきの幅がみられる。顔面症候は、Donohue症候群より軽度に留まることもある。
内分泌症候
高インスリン血症を伴うインスリン抵抗性は、Donohue症候群ほど重度ではない。血糖値の変動は、出生時から、空腹時低血糖、食後高血糖の形で生じる。満1歳を過ぎると、インスリン値は着実に低下し、当初は血糖値が上昇し、低血糖イベントも少なくなるが、その後、ケトアシドーシスのリスクが上昇していくことになる。比較的年長のRMS罹患者に生じる罹病は、長期にわたる高血糖と高インスリン血症に伴う微小血管合併症(例えば、増殖網膜症,末梢神経障害,腎血管合併症)が原因となって生じている[Mussoら2004,Carrasco de la Fuenteら2010,Jiangら2011]。
男女ともにみられる外性器の肥大は、RMSの場合、Donohue症候群より遅れて、小児期に現れるのがふつうである。卵巣腫大が一部の患者で報告されており、これに多発性嚢胞と腫瘍発生が合併する場合がある[Parker & Semple 2013]。目立つ乳頭が同じくみられる。
RMSで報告されている甲状腺異常として、甲状腺結節と甲状腺肥大がある[Kushchayevaら2019]。
成長
RMS罹患者の成長様相は、体重・身長・頭囲の減少を伴う重度の成長障害[Dagdeviren Cakirら2020]から、正常な成長を示すもの[Mussoら2004]まで、さまざまである。成長障害を示す例では、患児の成長ホルモンが低値の場合でも、ヒト成長ホルモン治療による線的成長の改善は得られない[Mussoら2004,Kimら2012,Brownら2013]。
発達遅滞/知的障害
発達遅滞は、重度のものから正常まで幅がみられる[de Kerdanetら2015,Ben Abdelazizら2016]。RMS罹患者の50%超に軽度の知的障害がみられるとの報告がある[Ben Abdelazizら2016,Angelidiら2021]。
顔面の形態異常
RMS罹患者でみられる顔面の形態異常は、Donohue症候群でみられるもの(例えば、眼球突出,眼窩下部の皺,後方に傾いた低位の大きな耳,肥厚した上下口唇,歯肉肥大)より軽微なものに留まることがある。顔では、顔面高径の拡大、下顎角の開大、巨舌、巨大歯症、歯の叢生、早期生歯、歯の形成異常などがみられることがある[Joshiら2021]。顔の症候は、歯の早期萌出、叢生、低い前頭部毛髪線のみであったとする報告もみられる[Jiangら2011]。
反復性感染症
RMS罹患者については、反復性の細菌性肺感染症が最も一般的である[Iqbalら2022]。
皮膚
RMS罹患者における皮膚の変化(多毛症と黒色表皮腫)は、ふつう、小児期後期に現れる。
心症候
肥大型心筋症が多くみられ、10歳未満でみられるようになるのがふつうである。一部の罹患者で、新生児肥大型心筋症の報告もみられる[Aftabら2022]。
腎症候
腎肥大が多くみられる。RMSの症候として、高カルシウム血症、腎石灰化症、髄質海綿腎の報告もみられる[Chrzanowskaら2023]。腎石灰化症が大多数の例で報告されている[Simpkinら2014]。
肝/消化器症候
肝機能障害や脾機能障害を伴わない肝脾腫が生じる。罹患者の一部で直腸脱が報告されている[Joshiら2021]。
悪性腫瘍
稀な悪性腫瘍の報告がみられる。重症インスリン抵抗性に対し、組換え体ヒトIGF-1(rhIGF-1)で治療を行った24歳の女性で、子宮内膜がんが報告されている[Joら2013]。また、卵巣顆粒膜細胞腫が、rhIGF-1で16ヵ月間治療を受けた重症インスリン抵抗性の35ヵ月女児[Weberら2014]と、この治療の行われていない幼い女児[Brisigottiら1993]で報告されている。上記のうちの2人は、rhIGF-1による治療を受けていることから、この治療の有害作用としてこうした腫瘍が生じた可能性が考えられる。
予後
RMS罹患者については、遷延する高血糖と高インスリン血症に伴う合併症が、主要な死亡原因となっており、多くの場合、10歳代で死亡する[Sempleら2010]。ただ、20歳代以降まで生存する例もみられる[Longoら2002,Mussoら2004]。
遺伝型-表現型相関
INSR-SIRSについて、遺伝型-表現型相関として知られているものはない。
疾患名について
妖精症(leprechaunism)は、Donohue症候群と同義である。
発生頻度
Donohue症候群はきわめて稀な疾患で、100万人に1人と推定されている[Desbois-Mouthonら1997]。
分子診断のなされたDonohue症候群とRMSが、現在までに96例報告されている[Ardonら2014,Ben Abdelazizら2016,Termoteら2016,Mooreら2017,Chenら2018,Dagdeviren Cakirら2020,Al-Kandariら2021,Dos Santosら2021,Joshiら2021,Laiら2021,Zhouら2021,Novoaら2022,Chrzanowskaら2023,Rojas Velazquezら2024]。
これら以外に、臨床診断でDonohue症候群やRMSとされたものが約10例存在する。
遺伝学的に関連のある疾患(同一アレル疾患)
A型インスリン抵抗症(OMIM 610549)
INSRの病的バリアントのヘテロ接合体(少ないながら、両アレル性のものもある)で、A型インスリン抵抗症が生じることがわかっている[Takahashiら1997,Longoら2002,Jiangら2011,Zhouら2021]。これが生じるのは、特に、病的バリアントが細胞内ドメインに存在する場合である。A型インスリン抵抗症は、アンドロゲン過剰症(多毛症,面皰,無月経の形で現れる)、肥満を伴わないインスリン抵抗性の徴候(例えば、黒色表皮腫や糖尿病)を特徴とする疾患で、多くの場合、思春期に、多嚢胞性卵巣症候群に似た所見が現れることで表面化する。注目すべきこととして、男性にも罹患の可能性があることが挙げられる。この疾患で現れるインスリン抵抗性は、INSR関連重症インスリン抵抗性症候群の場合より軽症で、治療可能である。成長や認知機能は正常である[Mussoら2004,Sempleら2010]。
鑑別診断
INSR関連重症インスリン抵抗性症候群(INSR-SIRS)との鑑別を要する疾患には、多毛症・重度の成長障害・発達遅滞をはじめとする症候群性の諸症候をもつ数多くの稀少疾患が該当する。そのうちのいくつかについて、その概要を表3に示した。
表3:INSR関連重症インスリン抵抗性症候群(INSR-SIRS)との鑑別を検討すべき代表的疾患
| 遺伝子/遺伝学的メカニズム | 疾患名 | 遺伝形式 | その疾患の臨床症候 | |
|---|---|---|---|---|
| INSR-SIRSと重なる症候 | INSR-SIRSと異なる症候 | |||
| 11p15.5の低メチル化,母性UPD7,その他 | Silver-Russell症候群(SRS) | 脚注1参照 |
|
|
| ABCC8 CACNA1D GCK GLUD1 HADH HK1 HNF1A KCNJ11 PMM2 SLC16A1 UCP2 |
家族性高インスリン血症(FHI) | AD AR |
|
|
| AGPAT2 BSCL2 CAV1 CAVN1(PTRF) |
Berardinelli-Seip先天性脂肪異栄養症(BSCL)(OMIM PS608594) | AR |
|
|
| IGF1R | インスリン様成長因子1抵抗性(OMIM 270450) | AR AD |
|
|
AD=常染色体顕性;AR=常染色体潜性;DS=Donohue症候群;INSR-SIRS=INSR関連重症インスリン抵抗性症候群;RMS=Rabson-Mendenhall症候群;UPD=片親性ダイソミー
- Silver-Russell症候群は、遺伝学的異質性をもった疾患である。臨床診断を受けた例で、遺伝学的検査でその診断が裏づけられる例の割合は、約60%である。SRSの再発リスクを正確に把握するためには、原因となった遺伝学的メカニズムを発端者で特定しておくことが必要である。
- SRS児の出生時体重は、通常、-2SD以下で、身長でみたときの出生後の成長も-2SD以下である。
- 家族性高インスリン血症(FHI)は、対応困難なほど重症の低血糖を示す新生児期発症疾患から、低血糖が軽度で診断の難しい小児期発症疾患まで、幅がみられることが特徴である。新生児期発症疾患は、生後数時間から2日以内に症候が現れる。新生児期については、現れる症候(痙攣・筋緊張低下・摂食不良・無呼吸など)はおおむね非特異的なものである。重症のFHIでは、血清グルコース濃度が、通常、きわめて低いため、容易にそれと気づく。小児期発症疾患のほうは、生後数ヵ月から数年のうちに症候が現れるが、より軽症のFHIについては、血糖値が変動したり異常の程度が軽かったりといった理由で、診断の難しい場合がある。
- 罹患者のおおむね25%-35%が15歳から20歳の間に糖尿病を発症する。
- 肥大型心筋症が罹患者の20%-25%にみられると報告されている。
- Klammtら[2011]
臨床的マネジメント
最初の診断に続いて行う評価
INSR関連重症インスリン抵抗性症候群(INSR-SIRS)と診断された罹患者については、疾患の範囲やニーズを把握するため、診断に至る過程ですでに実施済でなければ、表4にまとめた評価を行うことが推奨される。
表4:INSR関連重症インスリン抵抗性症候群罹患者の最初の診断後に行うことが推奨される評価
| 系/懸念事項 | 評価 | コメント |
|---|---|---|
| 内分泌 |
|
|
| 栄養/摂食 | 栄養士による評価 | 正常な血糖値を達成し、理想的な成長を誘導できる摂食と食餌の評価が目的 |
| 発達 | 発達評価 | |
| 心臓 |
|
|
| 腎臓 |
|
レニン-アルドステロン系の異常の評価と、腎石灰化症の評価が目的 |
| 肝機能/消化器機能 |
|
胆汁鬱滞性肝疾患の評価が目的 |
| 直腸脱の評価 | ||
| 歯 | 歯の叢生がみられる例については、口腔顎顔面の専門家による評価を検討 | |
| 遺伝カウンセリング | 遺伝の専門医療職1が行う。 | 医学的、個人的な意思決定の用に資するべく、本人や家族に対し、INSR-SIRSの本質、遺伝形式、そのもつ意味についての情報提供を行う。 |
| 家族への支援/情報資源 | 臨床医,広い範囲のケアチーム,家族支援組織 | 以下の必要性把握を目的とした家族構造,社会構造の評価
|
BNP=脳性ナトリウム利尿ペプチド;hs-CRP=高感度C反応性タンパク;hs-cTnT=高感度心筋トロポニンT;INSR-SIRS=INSR関連重症インスリン抵抗性症候群;NT-proBNP=N末端プロ脳性ナトリウム利尿ペプチド
- (訳注:わが国では)臨床遺伝専門医、認定遺伝カウンセラー、遺伝看護専門看護師など。
症候に対する治療
INSR-SIRSの根本的治癒を図る治療法は存在しない。
生活の質の向上、機能の最大活用、合併症の軽減を目的とした支持療法が推奨される。関連諸分野の専門家が集まった多職種連携によるケアが望ましい(表5参照)。
表5:INSR関連重症インスリン抵抗性症候群罹患者の症候に対する治療
| 症候/懸念事項 | 治療 | 考慮事項/その他 |
|---|---|---|
インスリン抵抗性と高血糖 |
Donohue症候群: 低血糖予防のため、食餌(母乳・胃瘻・グルコース静注等)摂取を頻回にし、夜の食餌をタンパク質含有量の多いものにする。 |
インスリン抵抗性をはじめとするDonohue症候群の諸症候に対する有効な治療はない。 投薬(インスリン・メトホルミン等)は無効。 |
RMS:
|
|
|
糖尿病性ケトアシドーシス(DKA) |
きわめて高用量のインスリン(500U/hr)使用例あり5。 | DKAは、RMSの主要な罹病・死亡原因となっているが、DKAに使用した治療法の報告は数例に過ぎない。 |
| 甲状腺機能低下症 | 内分泌内科医による標準治療 | |
| アンドロゲン過剰症 |
|
アンドロゲン過剰症のコントロールのため、一部の女性では、卵巣摘出術が必要8。 |
卵巣腫大 |
卵巣腫大により呼吸窮迫や発達阻害が生じたり、画像診断で顆粒膜細胞腫が疑われたりといった場合は、性腺摘出術も検討対象になる。 | |
栄養/摂食/成長 |
栄養支援 | 低身長の治療法はわかっていない。 |
| 発達遅滞/知的障害 | 必要に応じ、発達支援と教育支援 | |
| 反復性感染症 | 反復性感染症に対する精査と治療 | |
| 心筋症 | 心臓病専門医によるβ遮断薬 | |
| 腎石灰化症 | 腎臓専門医による治療 | |
| 胆汁鬱滞 | 消化器内科医による治療 | |
| 直腸脱 | 消化器内科医・外科医による治療 | |
| 悪性腫瘍 | 腫瘍専門医による標準治療 | |
| 家族/地域社会 |
|
緩和ケアや在宅看護の必要性に関する継続的評価 |
HbA1c=グリコシル化ヘモグロビン;RMS=Rabson-Mendenhall症候群
- Mussoら[2004],Moreiraら[2010]
- Chongら[2013]
- Carrasco de la Fuenteら[2010]
- Sempleら[2010]
- Chongら[2013],Mooreら[2017]
- Bathiら[2010],Wei & Burren [2017]
- Brownら[2017]
- Mussoら[2004]
定期的追跡評価
現段階でみられる症候の様相、支持療法に対する反応様相、新たな症候の出現様相のモニタリングを目的として、表6に示した評価が推奨される[Kushchayevaら2019,Pergeら2020,Huang-Doranら2021,Jansenら2022]。
表6:INSR関連重症インスリン抵抗性症候群罹患者で推奨される定期的追跡評価
| 系/懸念事項 | 評価 | 実施頻度 |
|---|---|---|
| 内分泌 | 血糖値 | 空腹時と食後、もしくは臨床的に適応と考えられた時;あるいは持続血糖モニター |
|
3ヵ月ごと | |
|
6ヵ月ごと、または臨床的に適応と考えられた時 | |
| 卵巣腫大の評価を目的とした卵巣超音波検査 | 2歳までは3ヵ月ごと、その後は6ヵ月ごと、または臨床的に適応と考えられた時 | |
| 栄養/摂食/成長 | 栄養評価と成長評価 | 来院ごと |
| 発達 | 精神運動発達評価 | 3ヵ月ごと |
| 免疫機能 | 反復性感染症の評価 | 来院ごと |
| 心臓 |
|
2歳までは6ヵ月ごと(両者を3ヵ月ごと交互に)、2歳以降は1年ごと(両者を6ヵ月ごと交互に)、または臨床的適応に応じ |
| 腎臓 |
|
6ヵ月ごと |
| 悪性腫瘍 | 子宮内膜がんの評価を目的とした婦人科的評価 | 膣からの異常出血がみられる例 |
HbA1c=グリコシル化ヘモグロビン
避けるべき薬剤/環境
Donohue症候群罹患者については、以下を避ける。
- 低血糖を引き起こす薬剤
- 長時間の絶食
- 感染症をもつ人との接触
RMS罹患者については、以下を避ける。
- 高血糖を引き起こす薬剤
- 高炭水化物の食餌
- 感染症をもつ人との接触
リスクを有する血縁者の評価
リスクを有する血族に対して行う遺伝カウンセリングを目的とした検査関連の事項については、「遺伝カウンセリング」の節を参照されたい。
研究段階の治療
INSR-SIRSの対照試験は行われていない。そのため、以下の節で述べる2つの治療法は、あくまで、INSRに病的バリアントを有する例に向けて、臨床経験・症例研究・専門家の意見に基づいて行われているものである。
組換え体ヒトインスリン様成長因子1(rhIGF-1)
重症インスリン抵抗性症候群の治療にrhIGF-1を用いようという考え方は、これが炭水化物代謝にもたらす直接的効果の観察結果に基づくものである。ヒトでは、rhIGF-1の投与により肝でのグルコース産生が抑制されるとともに、筋では末梢のグルコース取り込みが刺激され、これにより、循環血中のインスリン値が大きく低下している状況でも低血糖が引き起こされる。インスリン様成長因子1受容体(IGF1R)とインスリン受容体(INSR)は、互いに60%の相同性をもち、きわめてよく似た細胞内活性を有している[Weberら2014]。
治療レジメン
重症インスリン抵抗性症候群にrhIGF-1を用いたとする報告は数多く存在するものの、この治療に関する標準的プロトコルは存在しない。実際、報告されている治療レジメンは、それぞれ異なっている[McDonaldら2007,de Kerdanetら2015]か、記載されていないかのどちらかである。
重症インスリン抵抗性の子どものrhIGF-1療法の治療レジメンとしては、1日2回から4回の皮下注射、インスリンポンプを用いた持続皮下注入、静脈内注入の3つが報告されている[Backeljauwら1994]。確たるデータに基づくわけではないものの、経験上はrhIGF-1の持続注入を用いたほうが分割投与より有益のようである。投与量は、1日80μg/kg から1,120μg/kgまで幅がみられる[McDonaldら2007]。
治療の転帰
大多数の子どもについては、以下のような転帰であった。
- 代謝の状態が改善し、血糖・インスリン・グリコシル化ヘモグロビンの値が低下した。
- 成長パラメーターに改善がみられた[Nakaeら1998]。
- 腎尿細管機能不全が改善した[Hovnikら2013]。
心筋症については、rhIGF-1で治療を行った子どもの一部に心筋症の改善がみられ、生存期間が延びたとするものがある[McDonaldら2007,de Kerdanetら2015,Carmodyら2016]一方で、改善はみられなかったとするものもみられる[Mussoら2004,Grassoら2013]。
生じうる副作用
副作用としては、重度の低血糖と軟部組織の過成長が考えられる。
以下に2つの例を示すが、これらが治療の副作用であるのか、それとも高インスリン血症そのものであるのかについては、エビデンスが不足していて判然としない。
- 重症インスリン抵抗性(この報告の著者らはDonohue症候群としているが、臨床的にはRMSである可能性が高い)に対してrhIGF-1で治療を行った24歳の女性に生じた子宮内膜がん[Joら2013]
- 重症インスリン抵抗性に対して16ヵ月間 rhIGF-1で治療を行った35ヵ月女児に生じた卵巣の顆粒膜細胞腫[Weberら2014]
重症インスリン抵抗性症候群に対しrhIGF-1で治療が行われた経験を要約すると、
(1)その有用性は、十分に確立されたものではない。
(2)rhIGF-1が効果的なのは、インスリン抵抗性の程度が比較的軽い例である可能性が高い。というのは、rhIGF-1治療で長く生存できた少数の例が、いずれも軽度の表現型を示す例だったからである[Carmodyら2016]。それでも、現時点ではrhIGF-1が治療の最良の選択肢であるように思われることから、症候群性の重症インスリン抵抗性をもつ例についても、すべてrhIGF-1治療を検討するという考え方は、十分な妥当性をもつものである。
メトレレプチン(組換え体ヒトレプチン)
メトレレプチンは、先天性あるいは獲得性の全身性脂肪異栄養症の治療薬としてFDAの承認を受けている。
レプチン欠乏を伴う各種症候群において、レプチン補充により血中脂質が正常化される(すなわち、中性脂肪の低下と高密度リポタンパク質[HDL]の上昇)とともに、インスリン値とグルコース値が低下したという実績がある。レプチン欠乏を伴う症候群は、インスリン抵抗性、高血糖、脂質異常症、内分泌攪乱、脂肪肝疾患が特徴で[Pas-Filhoら2015]、具体的には、各種脂肪異栄養症候群、視床下部性無月経、神経性食欲不振症、先天性レプチン欠損症などがここに含まれる。
メトレレプチンを用いた治療(インスリン・メトホルミン・ピオグリタゾンなど他の薬剤を併用)を1年間行ったところ、その後、RMSの複数の患者において、血清グルコース値、グリコシル化ヘモグロビン(HbA1c)値、高インスリン血症、インスリン必要量、カロリー摂取量、体脂肪量のすべての項目で改善がみられたという[Cochranら2004,Brownら2013]。
メトレレプチンは、HbA1cの上昇というRMSでみられる自然経過に変化を及ぼし、これにより長期のフォローアップ期間を通じてHbA1cの低下が得られる。メトレレプチンによる血糖症の改善は、おそらく、食欲の抑制とボディマス指数(BMI)の低下に起因するものであろうと思われる。メトレレプチン投与後に生じるBMIの低下は、同時に、RMSでみられる成長ホルモン抵抗性を悪化させ、血糖症は改善してもIGF1や成長への効果は無に帰するという結果を招く可能性も併せもつものである[Okawaら2022]。
さまざまな疾患・状況に対して進行中の臨床試験に関する情報については、アメリカの「Clinical Trials.gov」、ならびにヨーロッパの「EU Clinical Trials Register」を参照されたい。
遺伝カウンセリング
「遺伝カウンセリングは個人や家族に対して遺伝性疾患の本質,遺伝,健康上の影響などの情報を提供し,彼らが医療上あるいは個人的な決断を下すのを援助するプロセスである.以下の項目では遺伝的なリスク評価や家族の遺伝学的状況を明らかにするための家族歴の評価,遺伝学的検査について論じる.この項は個々の当事者が直面しうる個人的あるいは文化的、倫理的な問題に言及しようと意図するものではないし,遺伝専門家へのコンサルトの代用となるものでもない.」
遺伝形式
INSR関連重症インスリン抵抗性症候群(INSR-SIRS)は、常染色体潜性の遺伝形式をとる。
家族構成員のリスク
発端者の両親
- 罹患児の両親は、ともにINSRの病的バリアントのヘテロ接合体と推定される。
- 再発リスク評価の信頼性確保を目的として、発端者の両親については、INSRの病的バリアントのヘテロ接合体であることを確認する分子遺伝学的検査の施行が推奨される。
- 病的バリアントが片親からしか検出されず、かつ、両者とも真正の生物学的父・母であることが確認されている場合は、発端者で同定されている病的バリアントのうちの1つがde novoのイベントとして生じたか、もしくは、モザイクの片親において接合後のde novoのイベントとして生じた可能性が考えられる[Maassenら2003,Kawashimaら2013]。また、発端者が病的バリアントをホモ接合の形で有していると思われる場合には、次のような可能性も検討してみる必要がある。
- 発端者に存在する単一エクソンないし複数エクソンの欠失が配列解析で検出されなかったために、見かけ上、ホモ接合体であるかのような結果が生じた可能性。
- 病的バリアントを有しているほうの片親の染色体の片親性ダイソミーが生じたために、発端者が病的バリアントのホモ接合体になった可能性。
- ヘテロ接合体は、通常は無症状であるが、場合によっては同一座位アレル疾患であるA型インスリン抵抗性の症候を有していることも考えられる(「遺伝学的に関連のある疾患」の節を参照)。 INSRの病的バリアントのヘテロ接合体である女性は、妊娠糖尿病に関し高リスクである(「家族計画」の節を参照)。
発端者の同胞
- 両親とも、INSRの病的バリアントのヘテロ接合体であることが判明している場合について言うと、罹患者の同胞は、受胎の段階で、病的バリアントを両アレルとも継承してINSR-SIRS罹患者となる確率が25%、病的バリアントを1つだけ継承してヘテロ接合体となる確率が50%、家系内に存在するINSRの病的バリアントをどちらも継承しない確率が25%である。
- ヘテロ接合体は、通常は無症状であるが、場合によっては同一座位アレル疾患であるA型インスリン抵抗性の症候を有していることも考えられる(「遺伝学的に関連のある疾患」の節を参照)。 INSRの病的バリアントのヘテロ接合体である女性は、妊娠糖尿病に関し高リスクである(「家族計画」の節を参照)。
発端者の子
INSR-SIRS罹患者の生殖例は知られていない。
他の家族構成員
発端者の両親の同胞は、INSRの病的バリアントのヘテロ接合体であることに関し、50%のリスクを有している。
ヘテロ接合体の特定
有リスクの血縁者に対し、ヘテロ接合体の検査を行うには、家系内に存在するINSRの複数の病的バリアントを事前に特定しておくことが必要である。ヘテロ接合体は、通常は無症状であるが、場合によっては同一座位アレル疾患であるA型インスリン抵抗性の症候を有していることも考えられる。INSRの病的バリアントのヘテロ接合体である女性は、妊娠糖尿病に関し高リスクである(「家族計画」の節を参照)。
関連する遺伝カウンセリング上の諸事項
家族計画
- 遺伝学的リスクの確定、出生前/着床前遺伝学的検査を受けるかどうかの話し合いに最も適しているのは、妊娠前の時期である。
- ヘテロ接合体、あるいはヘテロ接合体の可能性がある若い成人に対しては、遺伝カウンセリング(子に生じる可能性のあるリスクや、子をもうける上での選択肢についての説明を含む)を提供することが望ましい。
- ヘテロ接合体であることが判明している人の生殖上のパートナーに対しては、ヘテロ接合体の検査を検討する必要がある。両者の祖先が同一の場合には、特にそれが言える。c.167T>Cの病的バリアントは、イスラエルのDruse派の人々で高頻度にみられる[Falik Zaccaiら2014]。
- INSRの病的バリアントのヘテロ接合体である女性は、妊娠糖尿病に関し高リスクであることから、妊娠前ならびに妊娠中に耐糖能のモニタリングが必要となる[Kleijerら2006]。管理上の推奨事項については、ElSayedら[2023]を参照されたい。
出生前検査ならびに着床前遺伝学的検査
家系内に存在するINSRの病的バリアントが同定されている場合は、出生前検査ならびに着床前遺伝学的検査を行うことが可能である。
出生前検査の利用に関しては、医療者間でも、また家族内でも、さまざまな見方がある。現在、多くの医療機関では、出生前検査を個人の決断に委ねられるべきものと考えているようであるが、こうした問題に関しては、もう少し議論を深める必要があろう。
関連情報
GeneReviewsスタッフは、この疾患を持つ患者および家族に役立つ以下の疾患特異的な支援団体/上部支援団体/登録を選択した。GeneReviewsは、他の組織によって提供される情報には責任をもたない。選択基準における情報については、ここをクリック。
- MedlinePlus
Donohue syndrome
- National Organization for Rare Disorders(NORD)
Leprechaunism
分子遺伝学
分子遺伝学とOMIMの表の情報はGeneReviewsの他の場所の情報とは異なるかもしれない。表は、より最新の情報を含むことがある。
表A:INSR関連重症インスリン抵抗性症候群:遺伝子とデータベース
| 遺伝子 | 染色体上の座位 | タンパク質 | Locus-Specificデータベース | HGMD | ClinVar |
|---|---|---|---|---|---|
| INSR | 19p13.2 | インスリン受容体 | INSR database | INSR | INSR |
データは、以下の標準資料から作成したものである。
遺伝子についてはHGNCから、染色体上の座位についてはOMIMから、タンパク質についてはUniProtから。
リンクが張られているデータベース(Locus-Specific,HGMD,ClinVar)の説明についてはこちらをクリック。
表B:INSR関連重症インスリン抵抗性症候群関連のOMIMエントリー(内容の閲覧はOMIMへ)
| 147670 | INSULIN RECEPTOR; INSR |
| 246200 | DONOHUE SYNDROME |
| 262190 | PINEAL HYPERPLASIA, INSULIN-RESISTANT DIABETES MELLITUS, AND SOMATIC ABNORMALITIES |
分子レベルの病原
INSRは、膜貫通型受容体チロシンキナーゼスーパーファミリーの一員であるインスリン受容体をコードしている。INSRのタンパク質前駆体は、1,382のアミノ酸から成るが、ここからタンパク質分解のプロセシングを経て、ヘテロ四量体の糖タンパク質であるINSRのαサブユニットとβサブユニットが生成される。731のアミノ酸から成るαサブユニットは、細胞膜の外側にあって、インスリン結合領域を含んでいる。このαサブユニットは、620のアミノ酸で構成されるβサブユニットとジスルフィド結合でつながっている。βサブユニットのほうは、194アミノ酸の細胞外ドメイン、23アミノ酸の膜貫通ドメイン、403アミノ酸の細胞質セグメントをもち、この細胞質セグメントに内在性チロシンキナーゼ活性がある[Seinoら1989]。
インスリンがαサブユニットに結合すると、βサブユニットが自己リン酸化を受け、これを受けてインスリンシグナル伝達経路が活性化されて、グルコースの取り込みや放出が調節されるとともに、炭水化物・脂質・タンパク質の構成と貯蔵の調節が行われることとなる。
Taylorら[1991]は、INSRの病的バリアントを5つのクラスに分類している。
- 受容体の合成を阻害するもの
- 受容体の細胞膜への輸送を阻害するもの
- インスリンに対する受容体の親和性を低下させるもの
- 受容体の細胞内ドメインのもつチロシンキナーゼ活性を低下させるもの
- 受容体の分解を促進するもの[Porter & Barrett 2005]
重症インスリン抵抗性においては、細胞内のインスリンシグナル伝達が低下することで高血糖が生じる。INSR関連重症インスリン抵抗性症候群でみられる低血糖は、インスリン様成長因子1(IGF-1)の遅発性作用に起因するものと考えられている[Kawashimaら2013]。インスリン抵抗性は、成長因子をコードする遺伝子の発現やアポトーシスにも変化をもたらすことになる[Iovinoら2014]。
疾患の発症メカニズム
機能喪失型である。
表7:INSRの注目すべき病的バリアント
参照配列 |
DNAヌクレオチドの変化 |
予測されるタンパク質の変化 |
コメント[参考文献] |
|---|---|---|---|
| NM_000208.4 NP_000199.2 |
c.167T>C | p.Ile56Thr | イスラエルDruze派にみられる創始者バリアント |
| c.3003_3012del10insGGAAG | p.Ser1001ArgfsTer37 | チュニジア起源の互いに血縁関係のない2家系3人で確認[Siala-Sahnounら2016] |
上記のバリアントは報告者の記載をそのまま載せたもので、GeneReviewsのスタッフが独自に変異の分類を検証したものではない。GeneReviewsは、Human Genome Variation Society(varnomen.hgvs.org)の標準命名規則に準拠している。命名規則の説明については、Quick Referenceを参照のこと。
更新履歴:
-
Gene Reviews著者: Aviv Mesika, Aharon Klar, MD, and Tzipora C Falik Zaccai, MD
日本語訳者:佐藤康守(たい矯正歯科)、櫻井晃洋(札幌医科大学医学部遺伝医学)
GeneReviews最終更新日: 2024.4.25. 日本語訳最終更新日: 2024.12.2.[in present]