ホモシスチン尿症 ~シスタチオニンβ合成酵素欠損を原因とする~
(Homocystinuria Caused by Cystathionine Beta-Synthase Deficiency)
[Homocystinuria, Cystathionine Beta-Synthase Deficiency]
GeneReview 著者: Jonathan D Picker, MBChB, PhD; Harvey L Levy, MD
日本語訳者: 大塚洋子(ボランティア翻訳者),櫻井晃洋(札幌医科大学医学部遺伝医学)
GeneReview 最終更更新日: 2014.11.13 日本語訳最終更更新日: 2015.3.22
原文 Homocystinuria Caused by Cystathionine Beta-Synthase Deficiency
要約
疾患の特徴
シスタチオニンβ合成酵素(CBS)の欠損を原因とするホモシスチン尿症は、発達遅滞/知的障害、水晶体偏位および/または強度近視、骨格異常(高身長、クモ状四肢)、および血栓塞栓症を特徴的所見とする。いずれの臨床徴候も重症度の個人差が大きい。ビタミンB6反応性ホモシスチン尿症とビタミンB6非反応性ホモシスチン尿症の2種類の表現型が知られている。B6反応性ホモシスチン尿症は、全例ではないが、概してB6非反応性ホモシスチン尿症よりも症状が軽い。無治療の患者の大多数は、8歳までに水晶体偏位をきたす。患者は、長身痩躯の無力体型(「マルファン様」体型)を示すことが多く、骨粗鬆症の傾向がある。血栓塞栓症が重篤化、早期死亡の主たる原因となる。無治療のホモシスチン尿症患者のIQは、10~138の広い範囲に及ぶ。IQの平均値は、B6反応性の患者が79に対してB6非反応性の患者は57である。本症の特徴としては、上記のほか、てんかん発作、精神医学的問題、ジストニアなどの錐体外路徴候、色素脱失、頬部潮紅、網状皮斑、および膵炎などが見られる。
診断・検査
ホモシスチン尿症の主な生化学的特徴は、ホモシスチン、総ホモシステイン、ホモシステイン-システイン混合ジスルフィド、およびメチオニンの各血漿中濃度の顕著な上昇、尿中ホモシスチン濃度の上昇、ならびにシスタチオニンβ合成酵素(CBS)の酵素活性の低下にある。シスタチオニンβ合成酵素をコードするCBS遺伝子の両アレルに病原性変異が検出されれば、診断が裏付けられる。
臨床的マネジメント
症状の治療: ホモシスチン尿症の合併症は、例えば、水晶体偏位の手術などにより、適切に管理する必要がある。治療は、生化学的異常の是正、とりわけホモシスチンおよびホモシステインの各血漿中濃度のコントロール、ならびに血栓症の予防を目的とする。
一次病変の予防: 新生児スクリーニングにより特定された新生児患者は、蛋白およびメチオニン制限食、場合によりベタイン摂取、および/または葉酸とビタミンB12の補給等の治療法により、血漿中総ホモシステイン濃度を正常値または正常値近傍に維持する。ビタミンB6(ピリドキシン)反応性の患者にはピリドキシン療法を行う。小児期後期以降の治療は、血漿中ホモシスチン濃度を11µmol/L未満に抑え、血漿中総ホモシステイン濃度をできるかぎり正常値に近付けことを目的とする。ベタイン療法は青年期および成人期の患者の重要な治療法である。
経過観察: ベタインを摂取している患者はいずれも総ホモシステインおよびメチオニンの血漿中濃度をモニターする必要がある。
回避すべき薬剤や治療法: 女性患者は経口避妊薬の摂取を避ける。可能な限り手術を避ける。手術を避け得ない場合は、輸液過剰に陥らないように入念にモニターしながら、患者が自由に水分を経口摂取できるようになるまで1.5倍量の維持輸液の投与を続ける必要がある。
リスクのある血縁者の評価: リスクのある同胞に対して、出生直後にアミノ酸と総ホモシステインの血漿中濃度を測定することで早期の診断と治療が可能となり、重篤化や早期死亡が確実に減る。
妊娠の管理: ホモシスチン尿症の女性患者に対しては、血栓塞栓症のリスクを下げる目的で、妊娠第3期と分娩後に低分子量ヘパリンを用いた予防的抗凝固療法が推奨される。
遺伝カウンセリング
ホモシスチン尿症は常染色体劣性形式で遺伝する。受精の時点で、患者の同胞が罹患する確率は25%、無症候性保因者となる確率は50%、罹患せず保因者ともならない確率は25%である。リスクのある患者家族を対象とした保因者診断は、家系内患者でCBS遺伝子の病原性変異が同定されていれば実施可能である。出生前診断は、リスクが高い胎児を対象として、培養羊膜細胞におけるCBS酵素活性の測定(絨毛膜絨毛組織はCBS酵素活性が非常に低いため使用しない)、無細胞羊水中の総ホモシステインの測定、あるいは家系内の両アレルの病原性変異が同定されている場合には,分子遺伝学的検査により実施可能である。
診断
臨床診断
この総説が対象とする古典的ホモシスチン尿症は、ピリドキシン(ビタミンB6)依存性酵素であるシスタチオニンβ合成酵素(CBS)の欠損を原因とする疾患である。ホモシステインは、メチオニン代謝経路内の硫黄転移経路とメチオニンへの再メチル化経路の分岐点で生成されるため、CBSの働きが阻害されることで硫黄転移反応が制限され、ホモシステインとメチオニンが増加する。メチオニンの増加は、再メチル化経路の亢進による(図1)。
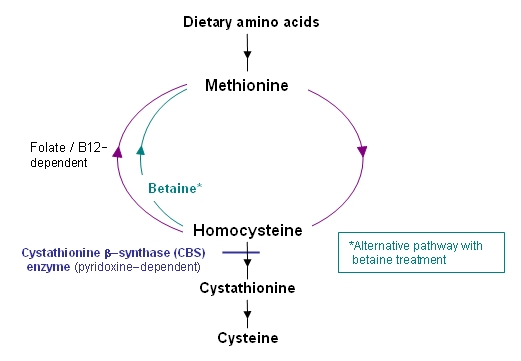
図1. メチオニン代謝経路
ホモシスチン尿症を示唆する所見
次の所見を示す患者はCBS欠損を原因とするホモシスチン尿症の診断が疑われる。
- 新生児スクリーニングの異常所見
- 乳児期~幼児期に始まる複数臓器の障害から成人早期~中期に単独発症する血栓塞栓症までの多様な臨床所見
新生児スクリーニング
新生児から採取した濾紙血検体をスクリーニングにかける。その結果、メチオニン高値を示す新生児の一部(全例ではない)に古典的ホモシスチン尿症が認められる。
メチオニンの計測には、タンデム質量分析計(MS/MS)を使用することが多くなってきている。"National Newborn Screening Status Report" (pdf形式)を参照して頂きたい。
- 初回のスクリーニング検査でメチオニン濃度がカットオフ値を超えた場合は、再検査が必要であり,以下の方法がある。
(1) 乾燥濾紙血検体を新生児スクリーニング実施機関に再度提出する。
(2) American College of Medical Genetics (www.acmg.net)のメチオニン関連のページACMG-ACT SheetとACMG Algorithmで推奨されている方法に従って血漿中アミノ酸の定量分析と血漿中総ホモシステインの特定分析を行う。
注: 乾燥濾紙血法と血漿分析のいずれを選択するかは、各スクリーニングプログラムの推奨するところに従う。通例、初回スクリーニングにおけるメチオニン濃度の上昇程度に基づき決定される。
上記 (1) の新生児スクリーニングプログラムの再検査を選び、メチオニン高値が確定した場合は、血漿中総ホモシステインの特定分析だけでなく、血漿アミノ酸の定量分析を行い、メチオニン、ホモシスチン、およびホモシステイン-システイン混合ジスルフィドの各濃度を求める。この結果を基にホモシスチン尿症の確定診断を行う(表1)。注:
(a) 少なくとも1件の新生児スクリーニングプログラムでは、検査結果の偽陽性率を抑える目的で、メチオニン高値を示す新生児検体の全数を対象としてホモシステインの二段階試験が実施されている。
(b) 新生児スクリーニングの検査対象成分はホモシスチンやホモシステインではなくメチオニンである。総ホモシステイン高値の原因には本症のほか、メチレンテトラヒドロ葉酸還元酵素欠損症、コバラミン欠乏症といった再メチル化の異常があるが(後述の「鑑別診断」の項を参照)、これらの疾患は、メチオニン濃度が正常または低値を示すため、新生児スクリーニングによって検出されることはない。
(c) 新生児スクリーニングで発見されるホモシスチン尿症の新生児患者は、ほぼ全員ピリドキシン(ビタミンB6)非反応性である(後述の「自然経過」の項を参照)。大多数のピリドキシン反応性の新生児患者は、新生児スクリーニングの検体が採取される生後2~3日まではメチオニン濃度が上昇しないものと考えられる。
臨床診断
古典的ホモシスチン尿症の主要所見を次に示す。
- 発達遅滞/知的障害
- 水晶体偏位(水晶体の脱臼)および/または強度近視
- 極度の高身長、長い四肢などの骨格異常
- 血栓塞栓症を特徴とする血管系異常
- マルファン症候群を示唆する臨床所見(ただしホモシスチン尿症では関節可動域が縮小する例が多い)
確定診断
発端者において古典的ホモシスチン尿症の診断は以下のいずれかによって確定する。
(1) 血漿中および尿中のアミノ酸の測定
(2) 培養線維芽細胞のCBS酵素活性の測定、または
(3) 分子遺伝学的検査
(1) 血漿中および尿中のアミノ酸
注: 血漿ホモシステイン濃度は、ピリドキシン(およびマルチビタミン)を2週間摂取しない状態で測定する必要がある。
主な生化学的特徴は次のとおりである(概要を表1に示す)。
- 血漿中のホモシスチン、総ホモシステイン、ホモシステイン-システイン混合ジスルフィド、およびメチオニンの各濃度の著しい上昇
- 尿中ホモシスチン濃度の上昇
表1. ホモシスチン尿症確定診断のための主な生化学的所見
| 測定項目 | 試料 | 予想される測定結果 | ||
|---|---|---|---|---|
| 新生児 ホモシスチン尿症患者 |
年長の無治療 ホモシスチン尿症患者 |
基準値(対照) | ||
| ホモシスチン1 | 血漿2 | 10~45µmol/L (0~1.2mg/dL) |
>100µmol/L (>3mg/dL) |
検出されない |
| 総ホモシステイン 1(tHcy) | 血漿2 | 50~100µmol/L | >100µmol/L | <15µmol/L |
| メチオニン | 血漿 | 200~1500µmol/L (3~23mg/dL) |
>50µmol/L (>0.7mg/dL) |
10~40µmol/L (0.2~0.6mg/dL) |
| ホモシスチン | 尿 3 | 検出される | 検出される | 検出されない |
- 血漿中および尿中のアミノ酸の測定
- 培養線維芽細胞のCBS酵素活性の測定、または
- 分子遺伝学的検査
(1) 血漿中および尿中のアミノ酸 注: 血漿ホモシステイン濃度は、ピリドキシン(およびマルチビタミン)を2週間摂取しない状態で測定する必要がある。
主な生化学的特徴は次のとおりである(概要を表1に示す)。
- 血漿中のホモシスチン、総ホモシステイン、ホモシステイン-システイン混合ジスルフィド、およびメチオニンの各濃度の著しい上昇
- 尿中ホモシスチン濃度の上昇
表1. ホモシスチン尿症確定診断のための主な生化学的所見
- 含硫アミノ酸類を示す用語については"Terms Used to Describe Sulfur Amino Acids"*1を参照のこと。
*1 このpdfページに相当する旧版中の用語解説を文末に掲載している。- 訳者注 - 血液中のチオール化合物の不安定性に対処するために、血漿試料や血清試料を輸送する際には除蛋白処理を行う。この処理を行わない場合、ホモシスチンおよび遊離形態のホモシステイン-システイン混合ジスルフィドは、試料を1日保存するだけで検出不能となる可能性がある。迅速に除蛋白処理を行えば、-20°Cの凍結保存によって、7日間以上ジスルフィドを遊離検体として保存できる。あるいは、ホモシスチン尿症の診断を的確に行うための方法として、血漿中tHcyの測定がより効果的である。ジチオスレイトールなどの還元剤を使用するなどして前処理を行えば、除蛋白処理を行わずに1週間保存した後もなお、tHcyはほぼ100%の回収率を示す。
- 尿中の蛋白質(例えば、システインなどのチオールに結合した蛋白質)が相対的に少量であるために、尿中ホモシスチンは非常に安定している。
(2) 培養線維芽細胞中シスタチオニンβ合成酵素(CBS)の酵素活性の測定 ホモシスチン尿症の患者は、CBS酵素活性が0~1.8U/mg proteinであるのに対し、健常群の酵素活性は3.7~60U/mg proteinである。
注: ピリドキシン反応性の患者は、ピリドキシン非反応性の患者よりも酵素活性が高い可能性がある。ただし、反応性の患者と非反応性の患者を信頼性高く判別することはできない。
(3) シスタチオニンβ合成酵素をコードするCBS遺伝子の分子遺伝学的検査 表2を参照のこと。CBS遺伝子の両アレルの病原性変異が同定されれば診断が裏付けられる。全世界的に、新規の病原性変異を持つ複合ヘテロ接合体患者が最も多い。
- 分子遺伝学的検査の一つの方法は、患者が属する民族で頻度が高い場合に特定の病原性変異の標的変異解析である。病原性変異が検出されない場合または片アレルの病原性変異のみ同定された場合は、シークエンス解析を行う。片アレルの病原性変異のみ同定された場合には、欠失/重複解析の実施を検討する。
- 片アレルの病原性変異のみ同定された場合には、分子遺伝学的検査のもう一つの手法として、シークエンス解析を行った後で欠失/重複解析を行うこともある。
表2 シスタチオニンβ合成酵素欠損を原因とするホモシスチン尿症の分子遺伝学的検査
| 伝子記号1 | 検査方法 | 当該検査方法により検出可能な 病原性変異を持つ発端者の割合 |
|---|---|---|
| CBS | 標的変異解析2 | 脚注3を参照 |
| シークエンス解析4 | >95%5 | |
| 重複/欠失解析6 | 脚注7を参照 |
- 染色体座位とタンパク名については(原文の)Table A "Genes and Databases"、アレル変異については(原文の)"Molecular Genetics"を参照のこと。
- 検査パネルに搭載される病原性変異の種類は検査施設によって異なる。
- CBS遺伝子内の、最も頻度の高い2種類の病原性変異p.Ile278Thrとp.Gly307Serは、エクソン8に存在する。詳細は(原文の)"Molecular Genetics"を参照のこと。
- シークエンス解析により検出される多型は,良性,おそらく良性,意義不明,おそらく病原性,病原性に分類される.病原性変異には、小規模な遺伝子内欠失/挿入およびミスセンス変異、ナンセンス変異、ならびにスプライス部位変異などがある。一般に、エクソン単位の欠失/重複や1個の遺伝子全体の欠失/重複は検出されない。シークエンス解析の結果の解釈については、GeneReviewsの"Appendix: Interpretation of Sequence Analysis Results"を参照のこと。
- CBS遺伝子の全コード領域のシークエンス解析を実施し、以下の結果を得た。(a) 血縁関係にないオーストラリアの28家系に対する解析の結果、26家系で両アレルの病原性変異が検出され、他の2家系では片アレルの病原性変異が検出された。(b) ベネズエラ人の患者7人に対する解析の結果、6人に両アレルの病原性変異が検出され、1人に片アレルの病原性変異が検出された。(c) 米国ジョージア州の患者12人に対する解析の結果、4人に両アレルの病原性変異、残りの8人に片アレルの病原性変異を認めた。
- ゲノムDNAのコーディング領域および隣接するイントロン領域のシークエンス解析では検出できないエクソン単位の欠失/重複や1個の遺伝子全体の欠失/重複を同定するための検査である。この検査で用いられる手法にはは、定量PCR法、ロングPCR法、多重連鎖反応依存性プローブ増幅法(MLPA: multiplex ligation-dependent probe amplification)、 CBS遺伝子/染色体分節を対象に含む染色体マイクロアレイ解析(CMA: chromosomal microarray analysis)などがある。
- 今までのところ、25塩基以上のヌクレオチドが関与する重複または欠失を持つ患者9人が報告されている(Kraus LabのCBS Mutation Databaseを参照)
診断確定後の検査
ピリドキシン(ビタミンB6)負荷試験
古典的ホモシスチン尿症の表現型の変異には、ビタミンB6反応性ホモシスチン尿症とビタミンB6非反応性ホモシスチン尿症の2種類がある。両者は自然経過も臨床的マネジメントも異なる。ひとたびホモシスチン尿症の診断が確定したら、ビタミンB6に対する反応性をピリドキシン負荷試験により判定する。
- 普通食摂取下で血漿を採取しアミノ酸濃度の基準値を求める。患者にピリドキシン100mgを経口投与し、24時間後に再び血漿中アミノ酸濃度を測定する。血漿中ホモシスチン(またはホモシステイン)および/または血漿中メチオニンの濃度が30%以上低下すればビタミンB6反応性ホモシスチン尿症が示唆される。
- 有意な変化が見られなければ、ピリドキシン200mgを経口投与し、24時間後に3度目のアミノ酸分析を行う。
- 依然として変化が見られなければ、小児と成人の患者にはピリドキシン500mgを経口投与する。乳児には300mgを超える投与は避ける。3度目のピリドキシン投与の後で血漿中ホモシスチン(またはホモシステイン)および血漿中メチオニンの濃度が有意に低下しない場合、その患者はB6非反応性と判断する。
注: 乳児は300mgを超えるピリドキシンを摂取すべきでない。1日当たりピリドキシン500mgを摂取した乳児数名が呼吸不全をきたし人工呼吸を必要とした例がある。呼吸器症状は、ピリドキシンの摂取中止により消失した。
- 依然として変化が見られなければ、小児と成人の患者にはピリドキシン500mgを経口投与する。乳児には300mgを超える投与は避ける。3度目のピリドキシン投与の後で血漿中ホモシスチン(またはホモシステイン)および血漿中メチオニンの濃度が有意に低下しない場合、その患者はB6非反応性と判断する。
遺伝学的に関連する疾患
CBS遺伝子の変異に関連する表現型は、このレビューに記述した疾患以外には知られていない。
臨床像
自然経過
ホモシスチン尿症は、眼、骨格系、血管系、および中枢神経系の障害を伴う点に特徴がある。これらの疾患系統のうちの1つだけを発症することも、あるいは4つすべてを発症することもある。臨床症状はいずれも重症度が様々である。生来無症候性であった患者が、成人後血栓塞栓症(多くは脳血管)のみを示すことは珍しくない。
古典的ホモシスチン尿症の表現型には、ビタミンB6反応性ホモシスチン尿症とビタミンB6非反応性ホモシスチン尿症の2種類がある。B6反応性ホモシスチン尿症は、概して(全例ではない)B6非反応性ホモシスチン尿症よりも症状が軽い。ビタミンB6に対する反応性はピリドキシン負荷試験により判定する(前述の「診断確定後の検査」を参照)。
眼系 典型例では、1歳を過ぎてから近視を発症し、これに続き水晶体偏位をきたす。無治療であれば過半数の患者が、8歳までに水晶体偏位をきたす。通例、B6非反応性の患者はB6反応性の患者よりも早期に水晶体偏位を起こす。乳児期に水晶体偏位を起こすことは滅多にない。
水晶体偏位のみられない患者で高度近視が生じることがある。
骨格系 ホモシスチン尿症の患者の多くは、高身長、痩せ型の無力体型(「マルファン様」体型)を示す。
患者は骨粗鬆症をきたしやすい(特に脊椎と長管骨)。患者の50%が10代までに骨粗鬆症の徴候を示す。骨粗鬆症は、腰椎X線側面像により最も効率的に検出できる。
脊柱側弯症、高アーチ型口蓋、凹足、漏斗胸もしくは鳩胸、および外反膝も頻繁に見られる。
血管系 重篤化や早期死亡を招く主な原因は血栓塞栓症である。血栓塞栓はいかなる血管にも生じる可能性がある。脳血管障害の乳児期発症の記録はあるが、一般にこの障害は青年期に発症する。
B6反応性の患者では、血管系イベントが青年期から成人期のホモシスチン尿症の初発症状となることが多い。小児期では脳静脈洞血栓症が主徴となる。
妊娠により,特に産褥期で血栓塞栓症のリスクが高まる。しかし多くの場合、妊娠中に合併症は出現しない。
中枢神経系 ホモシスチン尿症の患者では、発達遅延が最初の異常所見であることが多い。ホモシスチン尿症の患者のIQは10~138である。B6反応性ホモシスチン尿症の患者は、B6非反応性ホモシスチン尿症の患者に比べて、認知機能が完全に保たれるか軽度の障害に留まる傾向がある。B6反応性の患者の平均IQが79であるのに対して、B6非反応性の患者の平均IQは57である。新生児スクリーニングで発見されたB6非反応性の患者のうち、早期に治療を開始し、良好なコンプライアンスが得られた(つまり、遊離ホモシステインが11μmol/L未満に維持された)患者の平均IQは105であった。
無治療の患者の21%にてんかん発作が起きている。
患者の多くはパーソナリティ障害、不安、抑うつ、強迫行為、挿間性精神症状などの精神医学的問題をきたす。青年期に精神障害が初発症状となることがある。
ジストニアなどの錐体外路徴候を伴うことがある。
特徴的な症状には、上記の他、色素脱失、膵炎、潮紅、網状皮斑などがある。
遺伝子型と表現型との関連
p.Gly307Serアレルをヘテロで有する場合は、ほぼ確実にB6非反応性ホモシスチン尿症に罹患しているものと予測され、p.Ile278Thrアレルをヘテロで有する場合は、B6反応性ホモシスチン尿症に罹患しているものと予測される。この他の変異アレルはB6反応性またはB6非反応性ホモシスチン尿症の両方に関連する。
病名
狭義の'homocystinuria(ホモシスチン尿症)' - 次のいずれかの原因により尿中ホモシスチンの過剰生成をきたす疾病‐は、遺伝的要因によるシスタチオニンβ合成酵素(CBS)活性の低下もしくは最終的にホモシステインからメチオニンへの代謝(テトラヒドロ葉酸依存性またはメチルコバラミン依存性の代謝)が阻害される多様な遺伝的問題、例えばメチレンテトラヒドロ葉酸還元酵素欠損症、コバラミンの輸送または代謝の異常による。後者の病態についての詳細はWatkinsおよびRosenblattの論文[2014]を参照のこと。また、GeneReviewsの"Disorders of Intracellular Cobalamin Metabolism"を併読のこと。
非遺伝的な要因として、食餌からのコバラミンの大幅な摂取不足(ビタミン B12欠乏症)も、いわゆる'homocystinuria(ホモシスチン尿症)'を引き起こすことがある。
'homocystinuria(ホモシスチン尿症)'という言葉を使って厳密に疾患を特定するためには、議論の対象とする異常
'homocystinuria'に付け加えて、例えば、「homocystinuria caused by CBS deficiency(CBS欠損を原因とするホモシスチン尿症)、本疾患はclassic homocystinuria(古典的ホモシスチン尿症)とも呼ばれる」といったように定義するのもよいだろう。
このGeneReviewsの総説で論じている古典的ホモシスチン尿症とは、ピリドキシン(ビタミンB6)依存性酵素の一つであるシスタチオニンβ合成酵素(CBS)の欠損を原因とする疾患である。
頻度
発生頻度は現時点では確定されていない。新生児スクリーニングと臨床的確認のどちらも未検出例が想定され、実数よりも低く評価されるためである。発生頻度は1:200,000~1:335,000と報告されている。
- カタールの罹患率は1:1800と報告されている。おそらく世界最高率と思われる。
- アイルランドの罹患率は、1:65,000と報告されている。
- ドイツでは、健常集団における分子遺伝学的スクリーニングの結果により、古典的ホモシスチン尿症は1:17,800の頻度で発生するものと推定されている。
- ノルウェーでは、新生児を対象とした分子遺伝学的スクリーニング(6種類の病原性変異で構成される変異パネルを使用)により、古典的ホモシスチン尿症は約1:6400の頻度(ヘテロ接合体率)で発生するものと推定されている。
鑑別診断
本稿で扱われる疾患に対する遺伝学的検査の実施可能性に関する最新情報は,GeneTests Laboratory Directoryを参照のこと.―編集者注.
古典的ホモシスチン尿症と最もよく似た臨床症状を示す疾患は、マルファン症候群である。両疾患とも長身痩躯、クモ状四肢、水晶体偏位や近視の傾向といった特徴的症状を示す。亜硫酸酸化酵素欠損症の初期にも水晶体偏位をきたすことがあるが、亜硫酸酸化酵素欠損症の臨床症状はホモシスチン尿症とは異なる。また、亜硫酸酸化酵素欠損症とマルファン症候群の患者は、ホモシスチン、総ホモシステイン、およびメチオニンの血漿中濃度が正常である。
ホモシスチン/ホモシステインまたはメチオニンの濃度は、通例下記のように二大別される遺伝性の生化学的障害によっても上昇する(図2および表3を参照)。また、この他の疾患や栄養障害の二次的な症状として現れることがある。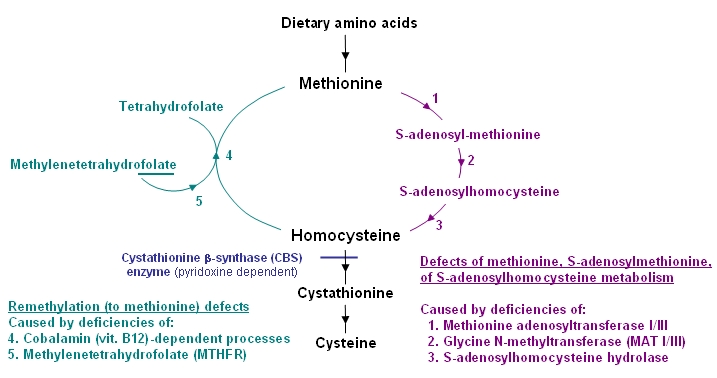
| 再メチル化(メチオニンへの代謝)の障害 | メチオニン、S-アデノシルメチオニン、または S-アデノシルホモシステインの代謝障害 |
| 4. コバラミン(ビタミンB12)欠損症 | 1. メチオニンアデノシル転移酵素(MAT) I/III欠損症 |
| 5. メチレンテトラヒドロ葉酸還元酵素(MTHFR)欠損症 | 2. グリシンN-メチル基転移酵素(GNMT)欠損症 |
| 3. S-アデノシルホモシステイン加水分解酵素欠損症 | |
| 図2に対する日本語訳 (日本語訳編集者注) |
図2. 代謝経路 - 生化学的特徴によりホモシスチン尿症と鑑別される疾患を示す
- メチオニン、S-アデノシルメチオニン、またはS-アデノシルホモシステインの代謝障害– 典型例では、メチオニン濃度が上昇するが、ホモシスチンは検出されず、総ホモシステイン濃度は正常または軽度上昇する。この種の代謝障害に分類される疾病には数種の高メチオニン血症がある(メチオニンアデノシル転移酵素I/III欠損症、グリシンN-メチル基転移酵素欠損症、S-アデノシルホモシステイン加水分解酵素欠損症など)。
- メチオニンへの再メチル化障害– 典型例では血漿中のホモシスチンと総ホモシステインの濃度が上昇するが、メチオニンの濃度は低い。新生児スクリーニングでは、(ホモシスチンやホモシステインではなく)メチオニンの濃度に基づき判定されるため、血漿中メチオニン濃度が低値(または正常値)を示す再メチル化の障害(例えば、メチレンテトラヒドロ葉酸還元酵素欠損症、コバラミン欠損症)は検出されない。なお、これらの障害は、葉酸またはビタミンB12依存性である。
- 二次性の高メチオニン血症 – 血漿中ホモシスチンは検出されず、総ホモシステインは正常または軽度上昇するに留まる。二次性の高メチオニン血症は、チロシン血症I型もしくはガラクトース血症に関連する肝疾患に続発するか、高蛋白食や乳児用のメチオニン強化調製粉乳によるメチオニンの過量摂取を原因として生じる。
表3. メチオニン代謝に影響を及ぼす疾患の生化学的特徴
| 異常のある経路 | 疾患 | 血漿中濃度 | ||
|---|---|---|---|---|
| ホモシスチン | 総ホモシステイン | メチオニン | ||
| メチオニンの メチル基転移経路 |
MAT I/III欠損症1 | 0 | ↑ (正常または 軽度異常) |
↑↑ |
| GNMT欠損症2 | ||||
| S-アデノシルホモシステイン加水分解酵素欠損症 | ||||
| 硫黄転移経路 | ホモシスチン尿症 | ↑↑ | ↑↑ | ↑↑ |
| 再メチル化経路 | MTHFR欠損症3 | ↑↑ | ↑↑ | ↓↓ (稀に正常) |
| コバラミン欠損症 | ||||
- MAT: メチオニンアデノシル転移酵素
- GNMT: グリシン-N-メチル基転移酵素
- MTHFR: メチレンテトラヒドロ葉酸還元酵素
臨床医への注: 個々の患者に適した本疾患の'simultaneous consult(並行診断)'についてはSimulConsult®を参照のこと。SimulConsult®は、患者の所見を基に鑑別診断を提供する対話型診断決定支援ソフトウェアツールである(利用には登録または関連施設からのアクセスが必要)。
臨床的マネジメント
初回診断後の評価
シスタチオニンβ合成酵素欠損を原因とするホモシスチン尿症と診断された患者すべてに対して、疾患の重症度を診断し治療ニーズを把握する目的で次のように対応することを推奨する。
- 治療を始める前にピリドキシン(ビタミンB6)の負荷試験を行う(前述の「診断確定後の検査」の「ピリドキシン(ビタミンB6)負荷試験」の項を参照)。
- 遺伝専門医とのコンサルテーション
症状に対する治療
合併症に対しては、例えば水晶体偏位の手術などを通じて適切に対処する必要がある。
一次病変の予防
治療の基本方針は、生化学的異常を改善する(とりわけ、ホモシスチンとホモシステインの血漿中濃度を極力コントロールする)こと、ホモシスチン尿症の合併症の発症を予防もしくは少なくとも減らすこと、血栓症などの更なる合併症を予防すること、である.すでに血管イベントを経験したことのある患者は、ベタイン療法単独で血管イベントの再発を予防できる可能性がある。
最良の治療結果が得られるのは、新生児スクリーニングにより発見され、出生直後に治療を開始し、血漿中ホモシスチン濃度が11µmol/L未満(望ましくは5µmol/L以下)に維持されている患者である。最良の結果を得るために、血漿中総ホモシステイン濃度をどの程度まで抑える必要があるかについては未だ明らかにされていない。
血漿総ホモシステイン濃度を制御する方法を以下に示す。
ビタミンB6(ピリドキシン)療法 B6反応性と診断された患者に対する1日あたりのピリドキシン投与量は、約200mgとする。あるいは、総ホモシステインとアミノ酸の血漿中濃度の測定値から判断して、最良の生化学的効果が得られる(つまり、ホモシステインとメチオニンの血漿中濃度を最低に抑える)必要最小限の用量とする。
B6非反応性を裏付けるエビデンスがある場合においてもなお、ピリドキシン投与を治療の一環とすることがある。一般には1日あたり100~200mgを投与するが、成人患者で1日あたり500~1000mgの投与例がある。
B6非反応性の新生児はメチオニン除去/低メチオニン粉乳~メチオニン制限食の摂取とともに、頻回の代謝モニタリングが必要である。メチオニン制限食は、生涯にわたり継続すべきである。食餌療法は、臨床的に本症と診断された患者を実施対象として検討すべきであるが、小児期中期以降に制限食を始めようとしても、患者の多くは制限食に耐えられない。
食餌療法により天然蛋白質の摂取量が制限されるためメチオニンの摂取量が減る。一方、蛋白質不足を防ぐ目的で、メチオニンを除去した特殊アミノ酸製剤が提供されている。これには、メチオニン以外のアミノ酸の他、CBS欠損症患者に不可欠なアミノ酸であるシステインが含まれる。代謝疾患専門の栄養士(metabolic dietician)がメチオニンの必要摂取量を計算し、自然の食品か特別な低蛋白食の形で投与する。また、メチオニンだけでなく、ホモシスチンと総ホモシステインの血漿中濃度をモニターする。
ベタイン療法 ベタインを用いた治療により再メチル化の代替経路が亢進し、過剰なホモシステインがメチオニンに転換される(図1を参照)。そのうえ、ベタイン療法は合併症(特に血栓症)を防ぐ助けとなることがある。ベタインの働きによりホモシステインがメチオニンに転換されることで、ホモシスチンと総ホモシステインの血漿中濃度が下がるが、メチオニンの血漿中濃度が上がる。ベタインは通例1日当たり6~9gを2回に分けて経口投与する。ただし、至適投与量は確定していない。
食餌療法に対するコンプライアンスが低い患者には、ベタイン療法を治療計画に加えることがある。食餌療法を受容できない患者はベタイン投与を主な治療手段としてもよい。食餌療法による代謝制御の効果が上がらなかったピリドキシン非反応性の患者で、ベタイン補給により血漿中ホモシステイン濃度が大幅に低下した例がある。
ベタインの副作用は少ない。ただし、(1) 感知し得る程度の体臭を生じ、コンプライアンスの低下につながった症例がいくつかある。(2) ベタインの働きによりメチオニンの生成が亢進しても通常無害であるが、1000µmol/Lを超える極度のメチオニン高値の患者で脳浮腫が起きた例がある。ベタインが排泄されると急速にメチオニン値が低下し脳浮腫は消失した。
注: マウスホモシスチン尿症モデルを用いた実験では、ベタインの治療効果は長期投与により有意に減弱した。
葉酸とビタミンB12の補給 葉酸とビタミンB12の働きにより、メチオニン合成酵素が触媒するホモシステインからメチオニンへの変換が最適化され、ホモシスチンとホモシステインの血漿中濃度を下げる助けとなる。赤血球中葉酸濃度が低い場合は1日当たり5mgの葉酸を経口投与し、血清中のB12濃度が低い場合は1か月当たり1mgのビタミンB12(ヒドロキシコバラミン)を筋肉内投与する。
経過観察
発症の恐れのあるあらゆる臨床合併症を発見するために、患者は定期的に経過観察を受ける必要がある。合併症に対する適切な治療をできるだけ早く始めるべきである。
ベタインを摂取している人はいずれも総ホモシステインとメチオニンの血漿中濃度をモニターする必要がある。
回避すべき薬剤や環境
経口避妊薬は血液凝固性の亢進および血栓塞栓症のリスク増大が危惧されるため、女性のホモシスチン尿症患者は服用を避けるべきである。
周術期とりわけ術後に、ホモシスチンとホモシステインの血漿中濃度が上昇すると、血栓塞栓イベントのリスクが高まるため、手術は可能な限り避けるべきである。手術を避け得ない場合は、術前、術中、および術後に水分を経口摂取できるようになるまでの間、1.5倍量の維持輸液を投与する。1.5倍量の投与により、過量輸液を原因とする心血管系リスクの上昇が予想される場合は、慎重に臨床観察を行いながら基本量による輸液管理を行うこともある。
リスクのある血縁者の検査
早期の診断と治療により重篤化や早期死亡を防ぐために、リスクのある同胞はいずれも、出生後できるだけ早い時期にアミノ酸と総ホモシステインの血漿中濃度を測定する必要がある。
家系内のCBS遺伝子の病原性変異が同定されていれば、分子遺伝学的検査により同胞の遺伝的状態を明らかにすることができる。
リスクを持つ血縁者に対する検査に関連した遺伝カウンセリングについては,本稿の「遺伝カウンセリング」の項を参照のこと。
妊娠の管理
女性のホモシスチン尿症患者は、とりわけ分娩後に血栓塞栓症の発症リスクが平均を上回ることがあるため、妊娠第3期および分娩後に抗凝血薬の予防的投与が推奨される。通常の処方計画では、妊娠期間最後の2週間と分娩後最初の6週間に低分子量ヘパリンを注射により投与する。妊娠全期にわたる低用量アスピリン投与も行われている。
母性フェニルケトン尿症とは異なり(GeneReviews "Phenylalanine Hydroxylase Deficiency" GRJ「フェニルケトン尿症」を参照)、ホモシスチン尿症患者の妊娠には、更なるカウンセリングを必要としたり、胎児の管理強化を必要とする重大な催奇形リスクがあるとは考えられない。とは言うものの、ピリドキシン療法およびメチオニン制限食、またはいずれか一方を妊娠全期にわたって続けるべきである。ベタインの摂取を続けることもある。ベタインに催奇性はないものと考えられる。
研究中の治療法
デンバー小児病院'the Children's Hospital, Denver'は、2010年1月、臨床試験「遺伝性ホモシスチン尿症における酸化ストレスマーカーおよびタウリンの効果」'Oxidative Stress Markers in Inherited Homocystinuria and the Impact of Taurine'を開始した。ClinicalTrials.govを参照のこと。
ClinicalTrials.govの検索により、広範囲にわたる疾患や症状に関する臨床試験の情報を入手することができる。
遺伝カウンセリング
「遺伝カウンセリングは個人や家族に対して遺伝性疾患の本質,遺伝,健康上の影響などの情報を提供し,彼らが医療上あるいは個人的な決断を下すのを援助するプロセスである.以下の項目では遺伝的なリスク評価や家族の遺伝学的状況を明らかにするための家族歴の評価,遺伝子検査について論じる.この項は個々の当事者が直面しうる個人的あるいは文化的な問題に言及しようと意図するものではないし,遺伝専門家へのコンサルトの代用となるものでもない.」
遺伝形式
シスタチオニンβ合成酵素欠損を原因とするホモシスチン尿症は、常染色体劣性形式で遺伝する。
患者家族のリスク
発端者の両親
- 患者の無症状の両親は絶対的ヘテロ接合体である。つまり、CBS遺伝子の病原性アレルを少なくとも1つ持つ。
- ヘテロ接合体(保因者)は無症候性であり、決してホモシスチン尿症を発症しない。
- 極めて稀ではあるが、親が古典的ホモシスチン尿症に罹患していながら無症候性に経過する例があり得るため、両親とも詳細に病歴を調べた上で診察を行い、さらに、血漿中および尿中のアミノ酸の分析を行うのが適切である。母親に将来妊娠の見込みがある場合には、このような対応がより一層必要となる。なぜなら、女性患者は妊娠中に血栓塞栓イベントを発症する危険性が高まるからである。
発端者の同胞
- 受精時に、患者の同胞が罹患する確率は25%、無症候性保因者である確率は50%、罹患せず保因者ともならない確率は25%である。
- リスクのある同胞は、罹患していないと診断されれば、保因者である確率は3分の2である。
- ヘテロ接合体(保因者)は無症状である。
発端者の子
古典的ホモシスチン尿症は治療可能であるため、治療が有効な患者は身体的にも知的にも正常であり、生殖可能である。
- 古典的ホモシスチン尿症患者の子は、CBS遺伝子に病原性変異を少なくとも1つ持つ。
- 発端者の配偶者が保因者である場合、彼らの子はいずれも、罹患する確率は50%、保因者となる確率も50%である。
- 発端者の配偶者が古典的ホモシスチン尿症に罹患している場合、彼らの子はいずれも、古典的ホモシスチン尿症に罹患する。
その他の血縁者
発端者の両親の同胞はいずれも、保因者である確率は50%である。
保因者診断
分子遺伝学的検査 家系内でCBS遺伝子の両アレルの病原性変異が同定されていれば、リスクのある血縁者に対して保因者診断の実施が考えられる。
生化学的遺伝学的検査 生化学的検査単独でCBS欠損症のヘテロ接合体患者と健常対照者とを判別することはできない。
- CBS欠損症のヘテロ接合体患者は、空腹時血漿総ホモシステイン濃度は正常であっても尿中ホモシスチン濃度が上昇する場合がある。
- メチオニン負荷(100mg/kg [671µmol/kg])後の血漿総ホモシステイン濃度の応答については、ピリドキシン非反応性ホモシスチン尿症のヘテロ接合体患者では73%、ピリドキシン反応性ホモシスチン尿症のヘテロ接合体患者では33%に異常が見られた。
注: 有害反応が報告されているため、メチオニン負荷試験の際には注意が必要である。
遺伝カウンセリングに関連した問題
早期の診断と治療を目的として、発症リスクのある血縁者を対象に行う検査については、「臨床的マネジメント」と「リスクのある血縁者の検査」を参照のこと。
母性フェニルケトン尿症とは異なり、母性ホモシスチン尿症には、更なるカウンセリングを必要としたり、胎児の管理強化を必要とする重大な催奇性リスクがあるとは考えられない。とは言うものの、ホモシスチンとホモシステインの血漿中濃度をコントロールするための治療を妊娠全期にわたって続けるべきである。
家族計画
- 遺伝学的リスク評価、保因状態の判定、出生前検査利用の検討は、妊娠前に行うのが望ましい。
- 年期の患者や保因者、または保因者であるリスクを持つ青年に対しては、遺伝カウンセリング(子孫に及ぶ可能性のあるリスクや妊娠出産に関連する選択肢についての話し合いなど)の機会を提供することが望ましい。
DNAバンキング とは、将来の使用に備えてDNA(一般には白血球より抽出)を貯蔵しておくことをいう。今後、検査技術の改良や遺伝子、変異、あるいは疾患の研究の進展が見込まれるため、患者のDNAの貯蔵は検討に値する。
出生前診断
生化学的検査
- 出生前診断は、CBS酵素活性の測定値を基に高リスクと判断された妊娠に対して実施できる。CBS酵素活性は、通常妊娠第15~18週頃に、羊水穿刺により採取し培養した羊膜細胞において測定する。絨毛膜絨毛はCBS酵素活性が非常に低いため使用しない。
- 無細胞羊水中の総ホモシステインの測定も実施可能である。
分子遺伝学的検査
家系内患者でCBS遺伝子の病原性変異が同定されていれば、当疾患/遺伝子の検査または検査項目を選択できる出生前検査(custom prenatal testing)を実施している臨床検査施設を通じて、リスクの高い妊娠に対する出生前診断を実施することができる。
シスタチオニンβ合成酵素欠損を原因とするホモシスチン尿症のように、有効な治療法が存在する疾患の場合は、出生前検査・診断の要望は多くはない。とりわけ出生前検査が早期診断を目的とせず妊娠中絶につながるものと考えられる場合には、医療専門家や家族の間で出生前診断に対する見解の違いがあり得る。大方の医療機関は、出生前診断を受けるかどうかの決定は両親に委ねられるものと考えるであろうが、こうした問題は議論されてしかるべきである。
着床前診断(PGD: Preimplantation Genetic Diagnosis)は、すでにCBS遺伝子の病原性変異が同定されている家系ならば選択肢の一つとなり得る。
Muddらの提案による含硫アミノ酸類の定義(2012年3月12日版日本語訳)
含硫アミノ酸類を示す用語に混乱がある。ホモシステインとは、メチオニン代謝経路(図1)で生成される、遊離硫黄と結合したチオール化合物であり、別のチオール(別のホモシステインまたはシステインなど)と容易に結合してジスルフィドを形成する。つまり、ホモシステインとは本質上、標準アミノ酸分析で測定されるジスルフィドである。Muddらは[2000]、混乱を避ける目的で、ホモシスチン尿症とこれに関連した疾患の説明に用いる主な含硫アミノ酸代謝産物を以下のように定義することを提案している。
- ホモシステイン(HcyH) - チオール化合物
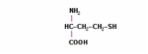
- ホモシスチン(Hcy-Hcy) - 対称ジスルフィド
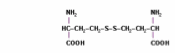
- ホモシステイン-システイン混合ジスルフィド(Hcy-Cys) - 非対称ジスルフィド
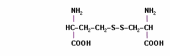
- 総ホモシステイン(tHcy) - 蛋白質結合型ホモシステインを含む、存在する全種類のホモシステインを示す。tHcyの大部分は、還元前処理を必要とする特異的分析により、ジスルフィド結合から遊離させた後、測定される。
- 総遊離ホモシステイン(tfHcy) - 次項の生化学的特徴を示すホモシスチン尿症の患者を対象として測定されることがある。tfHcyの値は、遊離ホモシスチン(Hcy-Hcy)の総数に2(Hcy)を掛けた数、およびホモシステイン-システイン混合ジスルフィド(Hcy-Cys)の総数に1(Hcy)を掛けた数を合計することにより算出される。tHcyは、前処理以前に蛋白質と結合していたHcyを含む点で、tfHcyと異なる。
更新履歴
- Gene Review著者:Jonathan D Picker, MBChB, PhD; Harvey L Levy, MD
日本語訳者: 大塚洋子(ボランティア翻訳者),櫻井晃洋(信州大学医学部附属病院遺伝子診療部)
Gene Review 最終更新日: 2011.4.26 日本語訳最終更新日: 2012.3.12. - GeneReview 著者: Jonathan D Picker, MBChB, PhD; Harvey L Levy, MD
日本語訳者: 大塚洋子(ボランティア翻訳者),櫻井晃洋(札幌医科大学医学部遺伝医学)
GeneReview 最終更更新日: 2014.11.13 日本語訳最終更更新日: 2015.3.22 (in present)
原文 Homocystinuria Caused by Cystathionine Beta-Synthase Deficiency