家族性高コレステロール血症
(Familial Hypercholesterolemia)
[Synonyms:Familial Hypercholesterolæmia,高リポタンパク質血症ⅡA型]
Gene Reviews著者: E Ison, MS, LCGC, Shoa L Clarke, MD, PhD, and Joshua W Knowles, MD, PhD.
日本語訳者: 箕浦祐子(札幌医科大学大学院医学研究科遺伝医学)、櫻井晃洋(札幌医科大学附属病院遺伝子診療科)
GeneReviews最終更新日: 2022.7.7 日本語訳最終更新日: 2022.9.24
原文 Familial Hypercholesterolemia
要約
疾患の特徴
家族性高コレステロール血症(FH)は,低比重リポタンパク質コレステロール(LDL-C)値の著しい上昇を特徴とし,冠動脈および大動脈近位部における若年からの動脈硬化性プラーク沈着や,狭心症や心筋梗塞などの早期心血管系イベントのリスクを高め,稀に脳卒中を発症する.アキレス腱や手の腱に黄色腫(腱中のコレステロール沈着)が見られることがあり,コレステロール値が極端に高いために加齢とともに悪化する.眼瞼周辺に黄色板(黄色いワックス状の沈着物)ができることがある.FH患者では,より若年で角膜輪(コレステロールの沈着による角膜縁の白色,灰色,または青色の不透明な環状所見)を生じることがある.
多くの場合,両アレル性のバリアントに起因する重度の表現型を呈する患者では,非常に顕著なLDL-C値の上昇(>500mg/dL)や,若年発症の冠動脈疾患(CAD;早ければ小児期に発症),石灰化大動脈弁疾患がみられることもある.
診断・検査
FHの臨床的診断は,発端者において特徴的な臨床所見と著しいLDL-C値の上昇(典型的には,成人で>190mg/dL,小児で>160mg/dL)で確定できる.欧米諸国では,3つの正式な診断基準が用いられている.
FHの分子遺伝学的診断は,APOB(LDL-CのLDL受容体への結合を妨げるバリアント),LDLRまたはPCSK9(機能獲得型)に,ヘテロ接合性または両アレル性の病的バリアントが同定されることで確定する.より稀な例では,LDLRAP1の両アレル性病的バリアントが同定される.
臨床的マネジメント
症状に対する治療:
成人:脂質値を下げるための薬物療法(スタチンと必要に応じて追加の薬物療法);LDL-C値を下げるために必要であれば,脂質の専門医への紹介;禁煙や習慣的な身体活動,健康的な食事,体重管理などCADリスクの低減;高血圧の治療;高リスク患者では,低用量のアスピリン.小児:脂質の専門医への紹介;食事や生活習慣の改善;8歳前後からスタチンを使用してもよい.
一次症状の予防:
心臓にやさしい食事(飽和脂肪酸の摂取低減や,水溶性食物繊維の摂取を10-20g/日に増加など);身体活動量の増加;喫煙しない.
サーベイランス:
2歳から脂質値を経過観察する;成人では非侵襲的な画像診断法を検討する;改善可能なリスク要因を見つける(喫煙,不活動,高血圧,糖尿病,肥満など).重度のFH(APOB,LDLRまたはPCSK9のホモ接合体または複合ヘテロ接合体)または常染色体潜性(劣性)FH(LDLRAP1のホモ接合体または複合ヘテロ接合体)では,推奨される様々な画像診断法(心エコー検査,CT血管造影検査,心臓カテーテル検査など)で経過観察する.
避けるべき薬剤/環境:
喫煙,飽和脂肪酸およびトランス不飽和脂肪酸の多量摂取,不活動,肥満,高血圧,糖尿病.
リスクのある血縁者の評価:
FHのリスクのある第一度または第二度近親者に対して,早期に診断・治療を行うことで,罹患率および死亡率を減少させうる.リスクのある血縁者の遺伝的状況は,以下のいずれかの方法によって明らかにすることができる:(1)罹患した家系員で病的バリアントが同定されている場合は,分子遺伝学的検査 (2)LDL-C値の測定.可能であれば,リスクのある血縁者の診断を明確にするために,遺伝学的検査を行うことが望ましい.
妊娠の管理:
妊婦は,飽和脂肪酸の摂取量を減らし,喫煙せず,水溶性食物繊維の摂取量を増やすなど,推奨されている生活習慣を取り入れることが必要である.スタチンは催奇形性の懸念があるため,妊娠中は禁忌であり,妊娠前に中止しなければならない.胆汁酸吸着レジン(コレセベラムなど)は通常安全であると考えられており(妊娠に対してClass B),LDLアフェレシスもCADが確定している場合では,適宜実施される.PCSK9阻害薬,エゼミチブ,ロミタピド,ベムペド酸については,妊娠中の使用に関して,まだよくわかっていない.
遺伝カウンセリング
APOB,LDLR,PCSK9関連FHは,常染色体顕性遺伝(優性遺伝)形式をとる.これら3つの遺伝子のいずれかに両アレル性(ホモ接合または複合ヘテロ接合)の病的バリアントを持つ患者-ホモ接合性FH(HoFH)と呼ばれる状態-では,症状がより重度になり,発症も早くなる.ヘテロ接合性の病的バリアントを,2つの異なるFH関連遺伝子上に持つFH患者もおり,FHの重症度に相加的な影響を与える可能性がある.APOB,LDLR,PCSK9にヘテロ接合性病的バリアントを持つ患者の子は,いずれも50%の確率で病的バリアントを受け継ぎ,FHとなる.ホモ接合性FH患者の子はすべて,病的バリアントを受け継ぎ,FHとなる.発端者の生殖パートナーが,発端者と同じまたは異なるFH関連遺伝子の病的バリアントのヘテロ接合体であった場合,その子は2つの病的バリアントを受け継いで,より重度のFHを呈するリスクがある.
LDLRAP1関連FHは両アレル性の病的バリアントによって発症し,常染色体潜性遺伝(劣性遺伝)形式をとる.LDLRAP1関連FH患者の両親は,病的バリアントのヘテロ接合体であると推定される.両親がLDLRAP1病的バリアントのヘテロ接合体であることが分かっている場合,罹患者の同胞はいずれも胎児の時点で,25%の確率で罹患し,50%の確率で保因者となり,25%は家系内の病的バリアントを受け継がない.リスクのある血縁者に対する保因者検査のためには,事前に家系内のLDLRAP1病的バリアントが同定されている必要がある.
家系内でFHの起因となる病的バリアントが同定されていれば,妊娠時の出生前,着床前の遺伝学的検査が可能である.
訳注:日本では,本症に対する出生前/着床前遺伝学的検査は行われない.いずれにしても次世代への遺伝に関しては細心の遺伝カウンセリングが必要である.
診断
FHが疑われる所見
以下の所見がある場合は家族性高コレステロール血症(FH)を疑うべきである.
極度の高コレステロール血症
- 成人(未治療):
- 低比重リポタンパク質コレステロール(LDL-C)値 >190mg/dL (>4.9mmol/L)
- 総コレステロール値 >310mg/dL (>8mmol/L)
- 小児(未治療):
- LDL-C値 >190mg/dL (>4.9mmol/L) [Wiegman et al 2015, de Ferranti et al 2019]
- LDL-C値 >160mg/dL,特に第一度近親者に高脂血症および/または早発性(男性55歳未満,女性65歳未満発症)冠動脈疾患の罹患者がいる場合. [Wiegman et al 2015, Sturm at al 2018, de Ferranti et al 2019]
- LDL-C値 >130mg/dL (>3.4mmol/L),第一度近親者にFH患者がいる場合.[Wiegman et al 2015]
- 総コレステロール値 >230mg/dL (>6mmol/L)
早発性冠動脈疾患(CAD)の既往歴
心筋梗塞や閉塞性CADなど介入が必要なもの,その他の心血管系疾患(虚血性脳卒中,末梢血管疾患など).早発性CADは通常,男性55歳未満,女性65歳未満の発症と定義される.
身体所見
- 黄色腫(腱のコレステロール沈着)は成人でみられることがあるが,ヘテロ接合性家族性高コレステロール血症(HeFH)の小児ではあまりみられない.
注:黄色腫は,両アレル性バリアントによるより重度な表現型として生後数年で表れる [Wiegman et al 2015].
- 黄色板(眼瞼周辺にできる黄色いワックス状の沈着物)
- 角膜輪(コレステロールの沈着による角膜縁の白色,灰色,または青色の不透明な環状所見)が45歳未満で見られる場合,FH関連である可能性が高い.
家族歴が以下のいずれかに該当する.
- FH
- LDL-C値の上昇
- 早発CAD
- 黄色腫/黄色板
注:(1) 年齢特異的LDL-Cまたは総コレステロール値は,FHの可能性を判断する上でより特異的である(年齢,性別,国籍の >95%タイル) [Nordestgaard et al 2013]. (2) 電子的アプリケーションは,正式な診断基準に基づくFHの可能性の判定を支援する(FH 診断の参照).
確定診断
FHの臨床診断は,発端者においてFHが疑われる所見があることで確定する.現在,欧米では以下の 3つの公式な診断基準が広く用いられている:MEDPED基準,Simon Broome基準,FH Dutch Lipid Clinic Network 基準(欧米以外の国で使用されている基準はHarada-Shiba et al [2012] 参照).いずれもFHに関連するさまざまな所見を確定診断のために用いている(LDL-C値,CADの既往歴,身体所見,家族歴など);LDL-C値は3ついずれの基準にも組み込まれている.
注:小児においてFHの臨床的診断を確定するために用いられる基準は,米国の内外で医療機関によって大きく異なる.専門家によっては,小児の発端者に対して,Dutch Lipid Clinic Network基準よりもSimon Broome基準を推奨している[Wiegman et al 2015].
FHの分子遺伝学診断は,発端者において以下の同定をもって確定する:
- LDLRのヘテロ接合性病的(またはおそらく病的)バリアント
- APOBのヘテロ接合性病的(またはおそらく病的)バリアント(LDL-CがLDL受容体に結合するのを阻害する)
- PCSK9の機能獲得型ヘテロ接合性病的(またはおそらく病的)バリアント
注:PCSK9の全遺伝子重複も,重度のFH患者でみつかっている [Iacocca et al 2018].
- APOB,LDLR,LDLRAP1の機能喪失型,あるいはPCSK9の機能獲得型の,両アレル性病的(またはおそらく病的)バリアント(いずれも重度FHと関連する).
注:ACMGのバリアント解釈のためのガイドラインでは,”病的バリアント”と”おそらく病的バリアント”は,臨床の場では同義として扱われており,いずれも確定診断となり,臨床的な意思決定に有用であることを意味している.ここで“病的バリアント”と記載するものは,おそらく病的バリアントも含まれると理解されたい.
分子遺伝学的検査方法には,表現型に応じて,小規模なFHマルチジーンパネル検査や,広範囲の脂質異常症マルチジーンパネル検査などがある:
- APOB,LDLR,LDLRAP1およびPCSK9の配列解析・欠失/重複解析を含む小規模なFHマルチジーンパネル検査が考慮される.
- APOB,LDLR,LDLRAP1,PCSK9に,ABCG8,ABCG5,APOE,LIPA(その他のLDL-C値の上昇や早発性CADの原因となる脂質異常に関連する遺伝子)を加えた広範囲の脂質異常症マルチジーンパネル検査も考慮される.注:(1)パネルに含まれる遺伝子と各遺伝子に用いられる試験の診断感度は検査施設により様々であり,また経年的にも変化する.(2)マルチジーンパネルには,このGeneReviewでは言及されていない症状に関連する遺伝子が含まれるものもある;つまり,医師は基本的な表現型を説明しえない遺伝子の病的意義不明および病的バリアントの同定を制御しつつ,最も症状の遺伝的要因を特定できそうなマルチジーンパネルを選択する必要がある.(3) 検査施設によっては,臨床医が指定した遺伝子を含む,カスタム設計された施設独自のパネルや,表現型に焦点を当てたエクソーム解析パネルといった選択肢もある.(4)パネルで用いられる方法には,配列解析,欠失/重複解析,他の配列に拠らない手法が含まれる.
マルチジーンパネルの概要については こちらをクリック.臨床医のための,遺伝学的検査依頼に関するより詳細な情報は こちらを参照.
表1.家族性高コレステロール血症に用いられる分子遺伝学的検査
| 遺伝子1,2 | この遺伝子の病的バリアントに起因するFHの割合 | この方法で検出される病的バリアントの割合3 | |
|---|---|---|---|
| 配列解析4,5 | 遺伝子標的欠失/重複解析5,6 | ||
| APOB | 5-10%7 | 100% | 報告なし |
| LDLR | >50%7 | ~85%8 | ~15% |
| LDLRAP1 | <1%9 | >80% | <20% |
| PCSK9 | <1%7 | ~98% | 2 家系10 |
| 不明 | ~40%11 | NA | |
FH=家族性高コレステロール血症;NA=該当なし
- 遺伝子はアルファベット順に記載
- 染色体座位およびタンパク質名は 表 A.遺伝子とデータベース の項を参照のこと.
- この遺伝子に検出されたアレルのバリアント情報については分子遺伝学の項を参照.
- 配列解析では,良性,おそらく良性,臨床的意義不明,おそらく病的,病的のいずれかのバリアントが検出される.バリアントには,小規模な遺伝子内欠失/挿入やミスセンス,ナンセンス,スプライス部位バリアントなどが含まれる.通常,エクソンや遺伝子全体の欠失/重複は検出されない.配列解析結果の解釈に関して考慮すべき問題については こちらを参照のこと.
- ヒト遺伝子変異データベース(HGMD) Professional(定額制サイト)からのデータ[Stenson et al 2020]
- 遺伝子標的欠失/重複解析は,遺伝子内の欠失や重複を検出する.定量的PCR,広域PCR,MLPA(multiplex ligation-dependent probe amplification)法や,単一エクソンの欠失や重複を検出するために設計された遺伝子標的マイクロアレイなどの多様な手法が用いられる.
- Sturm et al [2018]
- LDLRの配列解析には,調節領域(開始コドンの200塩基上流)も含むべきである.
- 現在まで,LDLRAP1の病的バリアントで同定されているのは30程度であり,そのほとんどが機能喪失型両アレル性バリアントである[Fahed & Nemer 2011, Cuchel et al 2014, Hegele 2019, Petrulioniene et al 2019, D'Erasmo et al 2020, Kamar et al 2021, Nikasa et al 2021].
- 全遺伝子重複は,血縁関係のないFHの2家系で報告された [Iacocca et al 2018].
- 臨床的にFHと診断された成人発端者の60-80%でFHの原因となる病的バリアントが同定される.臨床的に強くFHが疑われる小児発端者では,FHの原因となる病的バリアントは60-95%で同定される [Sturm et al 2018].つまり,臨床的にFHと診断される患者の40%程度は,遺伝的要因が同定されない.
疾患の特徴
臨床症状
ヘテロ接合性家族性高コレステロール血症 (FH; HeFH)
低比重リポタンパク質コレステロール(LDL-C)の上昇によって,冠状動脈や他の血管壁への動脈硬化性プラーク沈着が若年から始まり,経年的に悪化していく.FH患者はLDL-C値が生後直後から上昇する.未治療のまま放置すれば,狭心症や心筋梗塞,末梢動脈疾患などのリスクが高まり,脳卒中のリスクが高まる可能性もある[Scientific Steering Committee 1991, Versmissen et al 2008, Elis et al 2011, Raal & Santos 2012].LDL-C値が190 mg/dL (>4.9 mmol/L)を超え,かつ表 1 に掲載されている遺伝子に病的バリアントを持つ患者は,一般集団と比較して冠動脈疾患(CAD)のリスクが22倍になるが,病的バリアントがなければ,CADのリスクは6倍である[Khera et al 2016].スタチンが出る以前の自然史研究では,未治療の男性の場合,50歳までに致死的または非致死的な冠動脈のイベントが起こるリスクが50%;未治療の女性では60歳までに30%と推定されている[Slack 1969, Stone et al 1974, Civeira 2004, Goldberg et al 2011, Reiner et al 2011] (Figure 1).別の研究では,心筋梗塞の若年発症の既往歴のある患者の約10人に1人がFHであり,このリスクはCADの家族歴がある場合に増加することが判明している[Singh et al 2019].注意したいのは,標準的なフラミンガムやその他のリスク分類法は,FHの人には適していない.FH患者の脳卒中のリスクははっきりしていないが,いくつかの研究結果からは,当初考えられていたよりは強くないのではないかと考えられる [Akioyamen et al 2019, Hovland et al 2019].
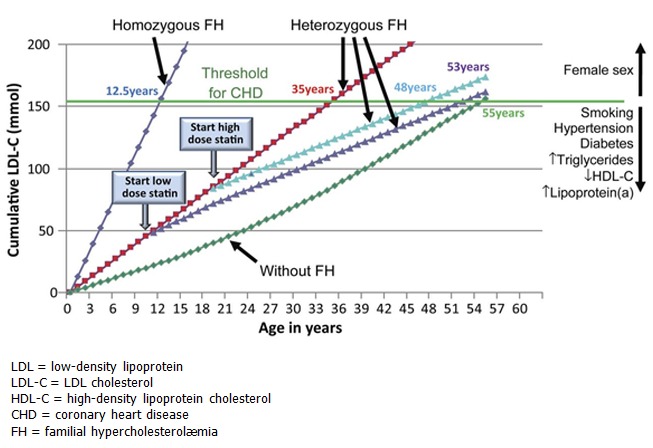
図1
スタチン治療開始年齢によるLDLコレステロール負荷の変化(家族性高コレステロール血症の有無によらない). Starr et al [2008] および Huijgen et al [2012]から提供されたデータ.図はNordestgaard et al [2013]より引用,オックスフォード大学出版局の許可を得て使用.
スタチンによる脂質低下療法(疾患の管理,症状に対する治療の項参照)によって,顕著に生存率が高まり[Nordestgaard et al 2013, Vuorio et al 2013] ,罹患率は減少した[Versmissen et al 2008, Elis et al 2011, Braamskamp et al 2016]. LDL-Cの低下を効果的に達成するために,エゼチミブや胆汁酸吸着レジン,PCSK9阻害薬,ベムペド酸などの追加の薬物が必要とされることが多い[Gidding et al 2015].LDL-C値を生活習慣の介入のみで低下させることは通常不可能である.
黄色腫は,LDL-Cが極端に高くなった結果,身体の腱にコレステロールが蓄積されたものである.未治療の場合,黄色腫は経年的に悪化する.LDL-C低下療法の治療を受けている人では,黄色腫は縮小しうる.発生しやすい部位:
- 腱黄色腫は肘,手掌,膝,脚,特にアキレス腱に発生しやすい[Tsouli et al 2005, Elis et al 2011].これまではFHの30-50%の発生率と記載されてきたが,近年の研究では,おそらくスタチン系の薬剤使用により,より低い頻度であることが示されている [Perez de Isla et al 2016].
- APOB,LDLR,PCSK9の両アレル性病的バリアントを持つ患者では,趾間(指の間の)黄色腫が発生する.
黄色板は,しばしば眼瞼周辺に発生する黄色がかったコレステロールの沈着した腫瘤である[Dey et al 2013].
角膜輪(角膜縁の白色,灰色,または青色の不透明な環状所見)は,高いLDL-C値に長期間暴露されることによって,角膜へ脂質が異常沈着することにより発症する.この所見は年齢と共に進行し,45歳未満で見つかった場合はFHを疑う.研究によって,FHの7-30%に見られると推定されている[Perez de Isla et al 2016, Rizos et al 2018].ヘテロ接合性のFH関連病的バリアントを持つ小児や,若い年齢から脂質を低下させる薬剤投与を受けている患者では,角膜輪の所見は少ない.
ホモ接合性(HoFH)および常染色体潜性(劣性)FH
APOB,LDLR,PCSK9,LDLRAP1の両アレル性病的バリアント(ホモ接合性または複合ヘテロ接合性)を持つ患者では,より重度な表現型を呈するが,原因遺伝子や残存酵素機能によって様々である(表 2参照)[McGowan et al 2019].
遺伝子と表現型の関連
表2. 家族性高コレステロール血症:遺伝子と表現型の関連
| 遺伝子 | MOI | 表現型1 |
|---|---|---|
| APOB | AD | LDLR-関連HeFHより,LDL-C値は低く,重症度も低いと考えられる |
| AR | 稀, 報告例は少数.表現型はLDLR-関連HeFHに近く,LDLR-関連HoFHよりは重症度は低い(つまりLDL-C値は低く,CADの発症が遅い)と報告されている. | |
| LDLR | AD | LDL-Cは190 mg/dLを超えることが多く, CADの若年発症リスクが高い; 身体所見(黄色腫)は経時的に発現することがある. |
| AR |
|
|
| LDLRAP1 | AR | 表現型は,LDL-C が500 mg/dLを超え,CADの若年発症,大動脈弁狭窄症など,LDLR-関連HoFH に近い.また,小児期に扁平黄色腫,結節性黄色腫,腱黄色腫が発生することが報告されている.脂質低下療法に対する反応にはばらつきがあり,1回以上のLDLアフェレシスを必要とすることも多い.2 |
| PCSK9 | AD |
|
| AR | 稀, 報告例は少数. 表現型はLDLR-関連HeFHに近く,LDLR-関連HoFHよりは重症度は低い(つまりLDL-C値は低く,CADの発症が遅い)と報告されている. |
AD=常染色体顕性(優性);AR=常染色体潜性(劣性);CAD=冠動脈疾患;FH=家族性高コレステロール血症;HeFH=ヘテロ接合性家族性高コレステロール血症;HoFH= APOB,LDLR,PCSK9の両アレル性(ホモ接合性または複合ヘテロ接合性)家族性高コレステロール血症;MOI=遺伝形式
- Moyer & Baudhuin [2015]
- LDLRAP1のバリアントに関する情報は比較的限定的であり,経時的に判明すると思われる.
浸透率
APOB. FHの浸透率はAPOBのヘテロ接合性バリアントでは減少すると考えられる[Doi et al 2021, Kamar et al 2021].
LDLR. 研究報告によると,LDLRのヘテロ接合性バリアントを持つ患者で,LDL-C値が130 mg/dLを超える人は73%しかおらず,浸透率はこれまで提唱されてきたより低いことが示唆された[Khera et al 2016].
PCSK9.
- c.381T>A(p.Ser127Arg)病的バリアントのヘテロ接合体では,浸透率は約90%である[Dullaart 2017].
- p.Asp374Tyr病的バリアントのヘテロ接合体では浸透率が高く,若年からFHの表現型がみられる[Naoumova et al 2005].
- 他のヘテロ接合性PCSK9バリアントについては,よくわかっていない [Cariou et al 2011].
病名
“ホモ接合性”は,遺伝学的には通常,当該遺伝子の両アレルに同じ病的バリアントが存在することを意味する用語として使用されるが,“ホモ接合性FH”あるいは“HoFH”は,医療の文脈ではAPOB,LDLR,PCSK9の両アレルに2つの病的バリアントが存在する(複合ヘテロ接合性またはホモ接合性)ことを意味する用語として用いられる.
“常染色体潜性(劣性)FH”という用語は,LDLRAP1の両アレル性病的バリアントに起因するFHを指す.
頻度
一般集団中のHeFHの頻度は,従来500人に1人とされてきた;しかしながら,データによれば250人に1人程度であることが示唆されている[Benn et al 2012, Nordestgaard et al 2013].この頻度は主に欧州,北アメリカ,東アジア,オーストラリアの研究に基づいている.アフリカ,アジア,南アメリカなど,残りの世界90%の国におけるHeFHの頻度は不明である [Beheshti et al 2020, Hu et al 2020].
APOB,LDLR,PCSK9の両アレル性病的バリアントによるHoFHの頻度は16万~40万人に1人と推定される[Nordestgaard et al 2013, Cuchel et al 2014, Beheshti et al 2020].
LDLRAP1の両アレル性病的バリアントに起因する常染色体潜性(劣性)FHの頻度は100万人に1人未満である[D'Erasmo et al 2020].創始者バリアントがあるため,イタリアのサルディーニャ島における常染色体潜性(劣性)LDLRAP1関連FHに頻度は143人に1人まで増加する( 表 11参照).
創始者バリアントがあるため( 表 11参照),様々な集団でFHの頻度は高まる( 表 3参照).
表3. 特定集団における家族性高コレステロール血症の頻度
| 集団 | 頻度1 |
|---|---|
| 一般集団 | ~1:250 |
| フランス系カナダ人 | 1:802,3 |
| オールドオーダーアーミッシュ | 1:104 |
| キリスト教系レバノン人 | 1:85 |
| チュニジア人 | 1:165 |
| 南アフリカのアフリカーナー(南アフリカ生まれのヨーロッパ[オランダ]系白人) | 1:72 to 1:100 |
| 南アフリカのアシュケナージ系ユダヤ人 | 1:67 |
| アイスランド人 | 1:8363 |
- Austin et al [2004]
- 共通するエクソン1を含むLDLRの10kb超の欠失(アレルの60%)および5kbのLDLRの欠失(アレルの5%)により,LDL-Cが著しく増加する [Simard et al 2004].
- Brunham & Hegele [2021]
- APOBのp.Arg3527Glnヘテロ接合性バリアント(アーミッシュの中で最も一般的な病的バリアント)を持つアーミッシュでは,平均LDL-C値がFHと診断されるための最低値以下であった.しかしながら,平均LDL-C値が低いヘテロ接合性のアーミッシュでも,冠動脈の石灰化とアテローム性動脈硬化症は起こっている[Andersen et al 2016].
遺伝的(アレル)に関連する疾患
GeneReviewに記載されている以外の,LDLRまたはLDLRAP1の生殖細胞系列病的バリアントに関連する表現型については知られていない.
APOBおよびPCSK9の生殖細胞系列病的バリアントが関連するその他の表現型については 表 4に掲載する.
表4. アレルに関連する表現型
| 遺伝子 | 表現型 | 病的バリアント | 臨床的特徴 |
|---|---|---|---|
| APOB | APOB-関連家族性低βリポタンパク質血症 | 典型的には,切断型の両アレル性またはヘテロ接合性バリアント |
|
| PCSK9 | 低LDLコレステロールを示す低コレステロール血症 (OMIM 603776) | 機能喪失型バリアント | 肝細胞表面のLDL受容体が増加し,血中からLDL-Cを取り除くため,(LDL-C値が低下し,)CADのリスクが低くなる. |
CAD=冠動脈疾患
鑑別診断
家族性高コレステロール血症(FH)と類似した臨床所見および/または検査所見を有する遺伝性疾患を表 5にまとめた.
表5.家族性高コレステロール血症に類似する所見をもつ遺伝性疾患
| 遺伝子 | 鑑別診断 | MOI | 鑑別診断にあがる所見 |
|
|---|---|---|---|---|
| FHとの類似点 | FHとの相違点 | |||
| ABCG5 ABCG8 |
シトステロール血症 | AR | 黄色腫;若年発症CAD の易罹患性.血漿コレステロール/LDL-C値の上昇がみられる人もいる(多くは小児期から). | 血液学的異常(溶血性貧血,血小板減少,有口赤血球); 小児期の黄色腫(特に両親の高脂血症がない場合);スタチンに反応しない |
| APOE | p.Leu167del-関連 AD 高コレステロール血症1 | AD | LDL高値およびCADのリスク上昇がみられる. | 脾臓腫大,海青組織球, 血小板減少症および中性脂肪値上昇が,何人かのp.Leu167delヘテロ接合体で報告されている |
| Ⅲ型高リポタンパク質血症 (familial 家族性異常βリポタンパク質血症[FD]) (OMIM 617347) | AR AD2 |
APOE バリアントを持つ人では黄色腫(多くは皮膚,結節性)および早発性CADの発症リスクがある .FDに関連する最も一般的な APOE 遺伝型はE2アレルのホモ接合体 (p.Arg176Cys)であるが; 30以上の APOE バリアントがFDに関連する. 2 | FD患者では中性脂肪値上昇のリスクがある. | |
| CYP27A1 | 脳腱黄色腫症(CTX) | AR | 黄色腫 | 認知症,運動失調症,白内障および成長LDL-C値 |
| LIPA | ライソゾーム酸性リパーゼ欠乏症 | AR | LDL-C値上昇および CADリスクの上昇 |
|
AD=常染色体顕性(優性);AR=常染色体潜性(劣性);CAD=冠動脈疾患;FH=家族性高コレステロール血症;LDL=低比重リポタンパク質;LDL-C=低比重リポタンパク質コレステロール;MOI=遺伝形式
肥満,糖尿病,閉塞性肝疾患,甲状腺機能低下症,薬剤(ステロイドなど),腎臓病などの後天性疾患による高コレステロール血症も,FHと同様の検査所見を伴うことがある[Goldberg et al 2011].
臨床的マネジメント
最初の診断時における評価
家族性高コレステロール血症(FH)と診断された患者の疾患の程度と必要事項を確立するために,(診断のための評価として実施されていなければ)表 6 にまとめた評価が推奨される:
表6. 家族性高コレステロール血症と診断された患者に対して推奨される初期評価
| 部位/関連事項 | 評価方法 | 備考 |
|---|---|---|
| 心血管 | 可能であれば治療前の脂質値の測定: TC, LDL-C, HDL-C,中性脂肪, リポタンパク質(a) | |
| FHに詳しい脂質の専門家または医師への紹介 | ||
| 治療決定のための情報を得るために,非侵襲的な画像検査(頸動脈内膜厚測定など)を考慮.特にHoFHまたはAR FHにおいて. | いくつかのガイドラインで推奨されている1 | |
| 脂質値に影響する併発疾患の評価 (腎疾患, 閉塞性肝疾患, 急性心筋梗塞, 甲状腺機能低下症) | ||
| 遺伝カウンセリング | 遺伝の専門家によって行われる2 | 罹患者やその家族に対して,医学的・個人的な意思決定を促進するために,FHの自然史や遺伝形式,関連事項について情報を提供する |
AR=常染色体潜性(劣性);FH=家族性高コレステロール血症;HDL-C=高比重リポタンパク質コレステロール;HoFH= APOB,LDLR,PCSK9の両アレル性(ホモ接合性または複合ヘテロ接合性)病的バリアントに起因するFH;LDL-C=低比重リポタンパク質コレステロール;TC=総コレステロール
- Martin et al [2013]
- 臨床遺伝専門医や認定遺伝カウンセラー,遺伝看護認定看護師
症状に対する治療
成人のFH
すべてのFH患者は冠動脈疾患(CAD)のリスクが高いと考えられ,コレステロール値を積極的に低下させる必要がある.標準的なフラミンガムまたはその他のリスク分類法は適していないことに留意したい [Goldberg et al 2011, Hopkins et al 2011, Stone et al 2014].(ここにまとめた)米国でFHの疾患管理のために用いられる最新の勧告は米国心臓協会によるもの[Gidding et al 2015] (全文)で,全米脂質学会による以前の勧告をほぼ反映している.
表7a. 家族性高コレステロール血症の成人における症状に対する治療
| 症状/関連事項 | 治療 | 注意事項/その他 |
|---|---|---|
| 高脂血症 |
|
|
| LDL-C値を50%以上または100 mg/dL (2.6 mmol/L)未満まで低下させるためのスタチン療法1投与量は数ヶ月ごとに漸増し,耐容量が最も高くなるようにすること. | 生涯にわたって高LDL-Cの状態が続くため,多くのガイドラインでは, CAD の有無によらずLDL-C値100 mg/dL未満を目標とすることが示されている.2CADまたは脳卒中の既往がある場合は,さらに低いLDL-C値を目標とするべきである (LDL-C <70 mg/dL). | |
| 6ヶ月以上の最大限の薬物療法によっても LDL-C値が50%以上または100 mg/dL (2.6 mmol/L)未満まで低下しなかった場合, FHに詳しい脂質の専門家への紹介を考慮する. | ||
LDL-C値が目標値に到達しなかった場合,治療を追加する:
|
多剤併用療法が効果的であるためには,コストの上昇や副作用,アドヒアランスの低下を抑えられるかを検討するべきである. 注: 従来,ナイアシンが用いられることがあったが,一般的には他の選択肢(表 7b)がなくなる以前に用いることは好ましくない. | |
下記のCADリスクがある場合は,より積極的な治療が必要となる:
|
||
| CVD/ 複合的リスク因子 |
|
|
|
血圧を140/90mmHg(糖尿病がある場合は130/80mmHg) 以内に抑える. |
CAD=冠動脈疾患;CVD=心血管疾患;FH=家族性高コレステロール血症;LDL-C=低比重リポタンパク質コレステロール
表7b.家族性高コレステロール血症の成人における薬物療法の最新の勧告
| 分類 | 一次的(1O) 二次的(2O) 作用機序 | LDL-低下の反応度 |
|---|---|---|
| スタチン | LDLR活性化 (1O) HMG-CoAレダクターゼを介したコレステロール生合成の阻害 |
50%1,2 |
| コレステロール吸収阻害薬 (エゼチミブ) | コレステロール吸収抑制 (1O) LDLR活性化 (2O) |
15%1,3 |
| MTP 阻害薬 (ロミタピド)4 |
ミクロソームトリグリセリド転送タンパク質の活性低下(1O) LDLの産生抑制(2O) |
50%5 |
| PCSK9 阻害薬 (アリロクマブ*訳注:日本では製造販売禁止, エボロクマブ, インクリシラン*訳注:日本未承認) |
LDLRの分解抑制 | 50%6 |
| 胆汁酸吸着剤 (コレスチラミン, コレセベラム) |
胆汁酸再吸収抑制 (1O) LDLR活性化(2O) |
15%1,3 |
| スタノールエステル | コレステロール吸収抑制(1O) LDLR活性化(2O) |
10%1,3 |
| ベムペド酸 | LDLR活性化(1O) ATP-クエン酸リアーゼの阻害によるコレステロール生合成の抑制 |
15% |
| エビナクマブ7 | リポタンパク質リパーゼの活性を高めるANGPTL3阻害薬 VLDLの低下 |
50% |
LDL-C値が管理できてもトリグリセリドが高値のままである場合,n-3系多価不飽和脂肪酸やフィブラートを追加するよう求めるガイドラインもある.
LDL=低比重リポタンパク質;LDL-C=低比重リポタンパク質コレステロール;LDLR=低比重リポタンパク質受容体
- HoFHではAPOB,LDLR,PCSK9の両アレル性病的バリアントに起因するため,効果がないことも多い.
- Kastelein et al [2008]
- Rader et al [2003]
- HoFHに対してのみ承認
- Cuchel et al [2014]
- Raal & Santos [2012]
- HoFHの成人に対してのみ承認[Rosenson et al 2020]
小児のFH
小児に対する疾患管理ガイドラインは,多くの国や国際機関によって発表されている[DeMott et al 2008, Descamps et al 2011, Martin et al 2013, de Ferranti et al 2019] (公表されているガイドライン/合意声明参照).
表7c. 家族性高コレステロール血症の小児における症状に対する治療
| 症状/関連事項 | 治療 | 注意事項/その他 |
|---|---|---|
| 高脂血症 |
|
|
多くの小児において,スタチン治療が第一選択となる1
|
|
|
| 生活習慣の改善やスタチンによってもLDL-C 値が目標に到達しない場合,付加的な脂質低下療法(エゼミチブ, エボロクマブ,胆汁酸吸着レジン) を考慮する. | ||
| 治療をしてもLDL-C 値が130 mg/dL以上の場合,FHに詳しい脂質の専門家へ紹介する.2 | ||
| 複合的リスク因子 | 喫煙しない,受動喫煙を避ける | |
| 血清リポタンパク質(a)の測定を考慮. | 推奨する専門家もいるが,臨床現場では一般的ではない.3,5 | |
|
高リスク小児における心血管系リスクの低減に関するAHAの科学的声明参照.3 |
FH=家族性高コレステロール血症;LDL-C=低比重リポタンパク質コレステロール
- 小児に対するスタチンの安全性と効果は,臨床研究および長期的な観察データにより支持されている[Kusters et al 2014, Luirink et al 2019, Vuorio et al 2019].
- NHLBI [2011]
- de Ferranti et al [2019]
- Grundy et al [2019]
- Wiegman et al [2015]
小児および成人のHoFH
APOB,LDLR,PCSK9の両アレル性病的バリアントに起因する重度のFH(HoFHとも呼ばれる; 病名の項参照)に対する米国脂質学会のガイドラインが発表されている(全文).
表7d. 重度の家族性高コレステロール血症(HoFH)の小児および成人における症状に対する治療
| 症状/関連事項 | 治療 | 注意事項/その他 |
|---|---|---|
| 高脂血症 |
|
|
| エボロクマブ, アリロクマブ*訳注:日本では製造販売禁止(PCSK9阻害薬) |
|
|
LDLR活性が残存している場合:
|
LDLRを標的とした薬物は,両アレル性機能喪失型LDLR 病的バリアントを持つ人に対しては無効であることが多い. | |
| ロミタピド | LDLR の機能が完全に喪失していても有効であり; 小児に対しては正式なFDA承認は受けていないが,強く考慮するべきである. | |
| エビナクマブ (ANGPTL3阻害薬)3 |
|
|
| LDLアフェレシス(週2回以下)も若年から必要となることが多い. | アフェレシスにより,急性期で80%,慢性期で30%のLDL-C値を減少させることができる(毎週または隔週). 米国ではアフェレシスを実施できる機関は限られている(~40-50). | |
| 肝移植 | 一部の機関で稀に実施される4 | |
| アテローム動脈硬化性 CVD | 重度のFHでは,小児からアテローム動脈硬化症の臨床症状(心筋梗塞など)がみられる.臨床的アテローム動脈硬化性CVDのある小児および成人では,心血管の専門家による評価と治療が必要である. |
CVD=心血管疾患;FH=家族性高コレステロール血症;LDL-C=低比重リポタンパク質コレステロール,LDLR=低比重リポタンパク質受容体
一次予防
一次予防として,以下のことが推奨される;
- 飽和脂肪酸の摂取量減少
- 水溶性食物繊維の摂取量増加(10-20g/日)
- 身体活動量の増加
- 喫煙しない
サーベイランス
治療中,年齢問わず;
- FHでは推奨される脂質値の経過観察が必要となる;
- 重度のFH(APOB,LDLR,PCSK9のホモ接合性または複合ヘテロ接合性病的バリアントに起因するHoFHまたはLDLRAP1のホモ接合性または複合ヘテロ接合性病的バリアントに起因する常染色体潜性[劣性]FH)では,推奨される画像診断法(心エコー検査,CT血管造影検査,心臓カテーテル検査など)による経過観察が必要となる.
その他推奨される評価方法を表 8.に示す.
表8. 家族性高コレステロール血症患者に推奨されるサーベイランス
| 部位/関連事項 | 評価方法 | 備考 |
|---|---|---|
| 心血管 | 脂質値の測定: TC, LDL-C, HDL-C, トリグリセリド, リポタンパク質(a) |
|
| 治療決定のための補助的な情報を得るために,非侵襲的な画像診断法(頸動脈内膜中膜複合体肥厚度の測定など)を検討する. | 小児: 現状では,定期的な画像評価(頸動脈内膜中膜複合体肥厚度の測定など)は推奨されていない. | |
| 可変的なリスク因子の同定: 喫煙,不活動,高血圧,糖尿病,肥満. |
HDL-C=高比重リポタンパク質コレステロール,LDL-C=低比重リポタンパク質コレステロール,TC=総コレステロール
避けるべき薬剤/環境
以下のことは避ける;
- 喫煙
- 飽和脂肪酸およびトランス脂肪酸の多量摂取
- 不活動
- 肥満
- 高血圧
- Ⅱ型糖尿病
リスクのある血縁者の評価
家族のカスケードスクリーニングを実施することで明らかな有益性があるため,CDCはFHをTier1の疾患に分類している.FH罹患者の血縁者に対して,分子遺伝学的検査の実施に関わらず,コレステロール値を検査することで,救命的な治療を提供できるFH患者を同定できる.FHのリスクのある血縁者の早期同定・早期治療により,罹患率や死亡率を減少できる[Knowles et al 2017, Sturm et al 2018].
リスクのある血縁者の遺伝的状態を明らかにする方法としては,以下のいずれかがある;
- 既知の家系内の病的バリアントがあれば,分子遺伝学的検査
- 家系内の病的バリアントが同定されていなければ,低比重リポタンパク質コレステロール(LDL-C)値の測定
FHの家族歴のある小児では,2歳から非空腹時脂質値を測定する.脂質値が境界値であれば,LDL-C値を測定する.FHの家族歴が判明している場合,小児のLDL-C値が130 mg/dLを超えていればFHが疑われ,160 mg/dLを超えていれば比較的特異的にFHとなる.
遺伝カウンセリングを目的とした,リスクのある血縁者の検査についての問題は, 遺伝カウンセリングの項を参照.
妊娠の管理
妊娠中の女性は,飽和脂肪酸およびトランス脂肪酸の摂取を控え,禁煙し,水溶性食物繊維を多く摂取するなど,推奨される他のすべての生活習慣の改善をするべきである.
妊娠中の薬物療法:
- スタチンは催奇形性の懸念があるため,妊娠中は禁忌とされている;妊娠を考えているFHの女性はこのリスクについて相談し,妊娠前にスタチンを中止しなければならない.ヒトの妊娠中のスタチンの使用は,胎児の有害な転帰と決定的な関連はない;しかしながら,胚発生におけるコレステロールの役割から,胎児への影響が理論的に懸念され,妊娠中および授乳期には代替薬を検討することが推奨される.授乳中の母親もスタチンを服用してはならない.
- 胆汁酸吸着レジン(コレセベラム,コレスチラミン)は一般的に安全と考えられている(妊娠に対してClass B).主に動物実験に基づいて,妊娠中のコレスチラミンの使用は,胎児異常のリスク増加と関連しなかった.しかしながら,コレスチラミンの使用は,理論的には母体のビタミンKを含む脂溶性ビタミンの消耗を引き起こしうる.
- LDLアフェレシスも適宜実施される.
- PCSK9阻害薬,エゼミチブ,ロミタピド,ベムペド酸については,妊娠中の使用に関して,まだよくわかっていない.
研究中の治療法
広範な疾患や症状の臨床研究に関する情報は, 米国では ClinicalTrials.gov を, ヨーロッパでは EU Clinical Trials Registerを参照のこと.
遺伝カウンセリング
「遺伝カウンセリングは個人や家族に対して遺伝性疾患の本質,遺伝,健康上の影響などの情報を提供し,彼らが医療上あるいは個人的な決断を下すのを援助するプロセスである.以下の項目では遺伝的なリスク評価や家族の遺伝学的状況を明らかにするための家族歴の評価,遺伝学的検査について論じる.この項は個々の当事者が直面しうる個人的あるいは文化的、倫理的な問題に言及しようと意図するものではないし,遺伝専門家へのコンサルトの代用となるものでもない.」
遺伝形式
APOB-,LDLR-,PCSK9-関連家族性高コレステロール血症(FH )は,常染色体顕性遺伝(優性遺伝)形式をとる.これら3つの遺伝子のいずれかに両アレル性(ホモ接合性または複合ヘテロ接合性)の病的バリアントを持つ場合 -ホモ接合性FHまたはHoFHと呼ばれる病態- は,表現型がより重度で早期に発症する.HoFHの重症度の程度は,影響を受ける遺伝子や病的バリアントのタンパク質機能に対する影響度による [Trinder et al 2020a, Trinder et al 2020b].人によっては2種類の異なるFH関連遺伝子上にヘテロ接合性病的バリアントを持つことがあり,FHの重症度に相加的な影響を与える可能性がある [Kamar et al 2021].
LDLRAP1関連FH(LDLR関連HoFHの表現型に類似すると報告されている)は両アレル性病的バリアントに起因し,常染色体潜性遺伝(劣性遺伝)形式をとる.
APOB-,LDLR-,PCSK9-関連家族構成員のリスク
発端者の両親
- APOB-,LDLR-,PCSK9のヘテロ接合性病的バリアントに起因するFH患者のほとんどすべてが,罹患した親を持つ.
- de novo(新規の)病的バリアントを持つFHの発端者の割合は不明だが,非常に稀である.
- 発端者の両親に対する推奨事項としては以下のものがある:
- コレステロール値の管理(APOB,LDLR,またはPCSK9の病的バリアントが判明している発端者または病的バリアントは同定されていないが臨床的にFHの診断のついている発端者の両親に対する推奨)[Knowles et al 2017] (疾患の管理,リスクのある血縁者の評価 の項参照)
- APOB,LDLR,またはPCSK9の病的バリアントが発端者で同定されていれば,それを対象とした分子遺伝学的検査
- 生物学的両親であることが確認されている両親で,発端者で見つかった病的バリアントが同定されなかった場合,以下の可能性が考えらえれる.
- 発端者はde novo(新規の)病的バリアントを持つ.
- 発端者は生殖細胞系列(または体細胞および生殖細胞系列)モザイクの片親から病的バリアントを受け継いだ.注:親の白血球DNAの検査では,体細胞モザイクは全例検出できない可能性があり,生殖細胞系列のみに存在する病的バリアントは検出できない.
- FHと診断される患者の多くが罹患した親を持つが,家系員が疾患を認識していなかったり,コレステロール値や心疾患の既往についての家系員の知識の欠如あるいは,罹患した親の発症が遅い等の理由により,家族歴がないように見えることがある.ヘテロ接合体の家族が長年スタチンを服用している場合,早発性CADの顕著な家族歴がない可能性がある.それゆえ,適切な評価が実施されていなければ明らかに家族歴がないことの確証にはならない.
- APOB,LDLR,またはPCSK9の両アレル性病的バリアントを持つ患者の両親は,必然的にヘテロ接合体であり,FHであることが推定される [Mabuchi et al 2014].
発端者の同胞
発端者の同胞のリスクは,発端者の両親の遺伝学的状態による.
- 発端者の片方の親が罹患している,および/または発端者で同定された病的バリアントを持つことがわかっている場合は,同胞がFHを持つリスクは50%である.
- 発端者の両親が罹患しており,FH関連病的バリアントを持つことがわかっている場合,同胞が病的バリアントを1つ受け継ぎFHを発症するリスクは50%,2つの病的バリアントを受け継ぎ,重度のFHに罹患するリスクは25%,家系内の病的バリアントを受け継がない可能性は25%である.
HoFHの重症度は様々である.ホモ接合性機能喪失型LDLR病的バリアントに起因するHoFHは,典型的に最も重症の表現型を呈する.複合ヘテロ接合性LDLR病的バリアントに起因するHoFHが次に続く [Cuchel et al 2014, Bertolini et al 2020].
- 発端者で見つかった病的バリアントが両親とも白血球DNAに同定されなかった場合,理論的には親の生殖細胞系列モザイクの可能性があるため,同胞の再発リスクは1%程度と推定される[Rahbari et al 2016].すべての同胞において,確認のための遺伝学的検査やコレステロール値の経過観察が必要である.
- 両親が臨床的に罹患しておらず遺伝学的状態が判明していない場合,ヘテロ接合体の親の浸透率が低い可能性や生殖細胞系列モザイクの理論的可能性があるため,FHのリスクがあると考えられるべきである.すべての同胞において,確認のための遺伝学的検査やコレステロール値の経過観察が必要である.
発端者の子
- APOB,LDLR,またはPCSK9のヘテロ接合性病的バリアントを持つ患者の子は,50%の確率で病的バリアントを受け継ぎ,FHに罹患する.
- HoFH(つまり両アレル性FH関連病的バリアント)を持つ患者の子はすべて病的バリアントを受け継ぎ,FHに罹患する.
- 発端者の生殖パートナーが,発端者と同じまたは異なるFH関連遺伝子にヘテロ接合性の病的バリアントを持つ場合,その子は2つの病的バリアントを受け継ぎ,重度のFHとなるリスクがある.このリスクを評価するために,生殖パートナーに対し,コレステロール値のスクリーニング,-コレステロール値と家族歴がFHらしい場合は,遺伝カウンセリングと遺伝学的検査を実施-を提供する必要がある.(FHは創始者効果により,かなり一般的である集団もある.[頻度の項参照])
他の家族構成員
他の家系員のリスクは発端者の親の遺伝的状況による:片親または両親ともFH関連病的バリアントを持っている場合,発端者の親の同胞や親は50%の確率で病的バリアントを有しており,FHである.
LDLRAP1-関連常染色体潜性(劣性)FH-家族構成員のリスク
発端者の両親
- LDLRAP1-関連FH患者の両親は病的バリアントを1つ持つヘテロ接合体と推定される.
- 両親がLDLRAP1のヘテロ接合性病的バリアントを持っていることを確認し,信頼性の高い再発リスク評価を可能にするために,発端者の両親に対して分子遺伝学的検査を行うことが推奨される.
- 生物学的両親であることが確認されている親で,病的バリアントが片親にのみ同定された場合,発端者で見つかった片方の病的バリアントは,発端者でde novo(新規)に発生したか,あるいはモザイクの親における接合後のde novo(新規)イベントである可能性がある[Jónsson et al 2017].発端者がホモ接合性(つまり同じ2つの)病的バリアントを持つ場合,以下のことが考えられる:
- 配列解析で検出できない発端者において単一または複数のエクソン欠失があり,結果として人為的なホモ接合体が見つかった;
- 病的バリアントのある親の染色体で片親性アイソダイソミーが生じ,発端者の病的バリアントがホモ接合体となった.
- LDLRAP1病的バリアントのヘテロ接合体(つまり保因者)は通常,無症状である.
発端者の同胞.
- 発端者の両親がLDLRAP1病的バリアントのヘテロ接合体であることがわかっている場合,罹患者の同胞はいずれも,受胎時に罹患者となる可能性が25%,保因者となる可能性は50%,家系内の病的バリアントを受け継がない可能性は25%である.
- LDLRAP1病的バリアントのヘテロ接合体(つまり保因者)は通常,無症状である.
発端者の子.
- LDLRAP1関連FH患者の子は,必然的にLDLRAP1病的バリアントのヘテロ接合体(保因者)である(LDLRAP1病的バリアントのヘテロ接合体は通常,無症状である).
- 発端者の生殖パートナーが, LDLRAP1病的バリアントのヘテロ接合体である場合,その子は両アレルの病的バリアントを受け継ぎ,LDLRAP1関連FHとなるリスクがある.このリスクを評価するために,生殖パートナーに対し,遺伝カウンセリングと遺伝学的検査を提供されることがある.
他の家系員.
発端者の親の同胞は,50%の確率でLDLRAP1病的バリアントの保因者である.
保因者の検出
リスクのある血縁者に対する保因者診断のためには,家系内でLDLRAP1病的バリアントを同定する必要がある.
遺伝カウンセリングに関連した問題
家系内のカスケードスクリーニング.家族のカスケードスクリーニングを実施することで明らかな有益性があるため,CDCはFHをTier1の疾患に分類している.FH罹患者の血縁者に対して,分子遺伝学的検査の実施に関わらず,コレステロール値を検査することで,救命的な治療を提供できるFH患者を同定できる.FHのリスクのある血縁者の早期同定・早期治療により,罹患率や死亡率を減少できる[Knowles et al 2017, Sturm et al 2018].
FHのリスクのある無症状の家系員に対して発症前遺伝学的検査を実施するには,家系内で病的バリアントを同定しておく必要がある.FH関連病的バリアントが家系内で判明している場合は,すべての第一度近親者に対して発症前遺伝学的検査が推奨される.
家族計画
- FHの若年女性は,妊娠中の脂質低下療法の禁忌についてのカウンセリングを受ける必要がある(疾患の管理,妊娠の管理の項参照).
- 発端者の生殖パートナーはコレステロール値のスクリーニングが提案され,FHが疑われるコレステロール値や家族歴がある場合は,遺伝カウンセリングや遺伝学的検査を実施する.理想的には,HoFHの子を持つリスクを評価するために,妊娠前に提供されるべきである.
- 遺伝学的リスクの判定や出生前/着床前診断の利用可能性の検討は,妊娠前に行うのが望ましい.
- リスクのある若年成人に対しては,遺伝カウンセリング(子どもがリスクを持つ可能性や生殖医療における選択肢に関する検討を含む)を提供するのが適切である.
DNAバンキング 検査手法や,遺伝子や発症メカニズム,疾患に対する我々の理解は,将来的に改善すると考えられるため,分子遺伝学診断が確定していない(つまり原因となる発症メカニズムが不明の)罹患者のDNAを保管しておくことを考慮するべきである.
出生前および着床前遺伝学的検査
罹患した家系員にFH関連病的バリアントが同定されれば,出生前診断と着床前遺伝学的検査を受けることが可能である。
医療の専門家の間や家族内においても,出生前診断に対する考え方の相違が存在しうる.ほとんどの施設では出生前検査の利用は個人の判断であると考えらえているが,この問題に関しては議論することが有用である.
(訳注:日本では本疾患における着床前診断および出生前診断は行われていない)
関連情報
GeneReviewsスタッフは、この疾患を持つ患者および家族に役立つ以下の疾患特異的な支援団体/上部支援団体/登録を選択した。GeneReviewsは、他の組織によって提供される情報には責任をもたない。選択基準における情報については、ここをクリック。
- 日本動脈硬化学会
- British Heart Foundation
- FH Australasia Network
AAS Secretariat
Phone: 61 3 5967 4479
Fax: 61 3 9015 6409
Email: aas@meetingsfirst.com.au
www.athero.org.au/FH
- FH Foundation
959 East Walnut Street
Suite 220
Pasadena CA 91106
Phone: 626-583-4674
Email: info@thefhfoundation.org
www.thefhfoundation.org
- FH Norway, Norwegian FH Patient Organization
- FH Portugal, Portuguese FH Patient Organization
- FHChol Austria
Austria
Phone: 43 (0) 677 6307 46 6
Email: info@fhchol.at
www.fhchol.at
- Fundación Hipercolesterolemia Familiar
Spain
Phone: 91 504 22 06; 91 557 00 71
Fax: 91 504 22 06
Email: info@colesterolfamiliar.org
www.colesterolfamiliar.org
- German FH Patient Organization
Germany
www.cholco.org
- International FH Foundation
Wien
Austria
Phone: 0664 653 59 32
Email: info@fhchol.at
www.fhchol.at
- MedlinePlus
- Preventive Cardiovascular Nurses Association
PCNA National Office
613 Williamson Street
Suite 200
Madison WI 53703
Phone: 608-250-2440
www.pcna.net
- HEART UK
United Kingdom
Phone: 0845 450 5988
Email: ask@heartuk.org.uk
www.heartuk.org.uk
- Learn Your Lipids
- National Lipid Association (NLA)
6816 Southpoint Parkway
Suite 1000
Jacksonville FL 32216
Phone: 904-998-0854
Fax: 904-998-0855
www.lipid.org
- CASCADE FH Registry
分子遺伝学
分子遺伝学とOMIMの表の情報はGeneReviewsの他の場所の情報とは異なるかもしれない。表は、より最新の情報を含むことがある。
表A.家族性高コレステロール血症:遺伝子とデータベース
データは以下の標準的参照資料をもとに作成した.遺伝子は HGNC;染色体座位はOMIM;タンパク質は UniProtを参照した.リンクが提供されたデータベース(座位特異性, HGMD,ClinVar)の詳細についてはこちらを参照のこと.
表B. 家族性高コレステロール血症に関するOMIMの登録 (OMIMですべてを見る)
| 107730 | アポリポタンパク質B; APOB |
| 143890 | 高コレステロール血症, 家族性, 1; FHCL1 |
| 144010 | 高コレステロール血症, 家族性, 2; FHCL2 |
| 603776 | 高コレステロール血症, 家族性, 3; FHCL3 |
| 603813 | 高コレステロール血症, 家族性, 4; FHCL4 |
| 605747 | 低比重リポタンパク質受容体アダプタータンパク質1; LDLRAP1 |
| 606945 | 低比重リポタンパク質受容体; LDLR |
| 607786 | 前駆体タンパク質転換酵素サブチリシン/ケキシン, 9型; PCSK9 |
分子病理学
LDLRは,低比重リポタンパク質コレステロール(LDL-C)のエンドサイトーシスに関わる細胞表面タンパク質である低比重リポタンパク質受容体(LDLR)をコードする.LDL-Cが細胞膜に結合すると細胞内に取り込まれ,ライソゾームでタンパク質部分が分解され,コレステロール分子はネガティブフィードバックによりコレステロール合成を抑制する.LDLRの病的バリアントがあると,細胞内で生成される受容体の数を減らし,受容体がLDL-Cと結合する機能が阻害されるため,血漿LDL-Cが高値となる.
APOBは,アポリポタンパク質B-100をコードする.APOBの病的バリアントがあると,アポリポタンパク質B-100がLDL-Cを細胞表面のLDLRに効果的に結合させる能力を変え,血中から除去されるLDL-C粒子の数を減少させる原因となる.
PCSK9タンパク質の産物はLDLRと結合し,細胞内の酸性区画でその分解を促進する.PCSK9の病的バリアントは,高コレステロール血症および低コレステロール血症のどちらにも関連する.機能獲得型の病的バリアントは,LDLRの分解を促進することで,血中から除去されるLDL-Cの総量を減らし,高コレステロール血症を引き起こす.機能喪失型の病的バリアントがあると,肝細胞表面のLDLRの数が増加し,通常よりも速やかに血中からLDL-Cを除去するため,低コレステロール血症となり,冠動脈疾患の発症を抑制する [Cohen et al 2006, Pandit et al 2008].
LDLRAP1タンパク質は,LDLRとそれに付着したLDL粒子を肝細胞に移動させ,再利用するために重要な役割を担う.LDLRAP1の両アレル性機能喪失型バリアントは,血中LDL-Cの除去を阻害する主な疾患メカニズムとして報告されている [D'Erasmo et al 2020].
表9. 家族性高コレステロール血症:疾患の発生機序
| 遺伝子1 | 疾患の発生機序 |
| APOB | 機能喪失型バリアントにより,LDL-CのLDLRへの結合が阻害される |
| LDLR | 機能喪失型 |
| LDLRAP1 | 機能喪失型; しかしながら,現状ではこの遺伝子のバリアントに関するデータは限定的であり,今後変化する可能性がある. |
| PCSK9 | 機能獲得型 |
- 遺伝子は 表 1から,アルファベット順に記載
表10. 家族性高コレステロール血症:遺伝子ごとの研究施設での検討事項
| 遺伝子1 | 特記事項 |
|---|---|
| APOB | APOB内のイントロンの分布は一般的ではない: 29のイントロンのうち24は , 5' 末端にある. タンパク質の50%超が,エクソン26の7,572塩基によってコードされており,ヒトゲノムの中でも最大規模のエクソンの1つである.2つの主なアイソフォームのうちの1つであるアポリポタンパク質B-100は肝臓でのみ合成され,FHの合併症に関与している[Whitfield et al 2004]. |
| LDLR | エクソン4は,リガンド結合ドメインに位置する,LDLR type A repeats 3, 4, 5をコードする. この領域はホットスポットと呼ばれ,ヌクレオチドあたり最も多くの疾患の原因となるバリアントが存在することが報告されている.エクソン2-8およびエクソン14には,合計60の高度に保存されたシステイン残基があり,タンパク質の適切な折り畳みと機能に不可欠である[Chora et al 2022]. |
| PCSK9 | PCSK9 病的バリアントは高コレステロール血症および低コレステロール血症のどちらにも関連する.機能獲得型の病的バリアントは,LDLRの分解を促進することで,血中から除去されるLDL-Cの総量を減らし,高コレステロール血症を引き起こす.機能喪失型の病的バリアントがあると,肝細胞表面のLDLRの数が増加し,通常よりも速やかに血中からLDL-Cを除去するため,低コレステロール血症となり,冠動脈疾患の発症を抑制する [Cohen et al 2006Pandit et al 2008]. |
- 遺伝子は 表 1から,アルファベット順に記載
表11. 家族性高コレステロール血症:遺伝子ごとの注目される病的バリアント
| 遺伝子1 | 参照配列 | DNAヌクレオチドの変化 (別名 2) |
予測されるタンパク質の変化 (別名 2) |
備考 [参照] |
|---|---|---|---|---|
| APOB | NM_000384.3 NP_000375.3 |
c.10580G>A3 (9775G>A) |
p.Arg3527Gln (Arg3500Gln) |
アーミッシュの創始者バリアント; ヨーロッパに祖先を持つ人に共通するバリアント[Shen et al 2010] |
| c.10579C>T (9774C>T) |
p.Arg3527Trp (Arg3500Trp) |
アジア人に共通のバリアント [Calandra et al 2011] | ||
| LDLR | NM_000527.5 NP_000518.1 |
c.655_657delGGC | p.Gly219del | アシュケナージ系ユダヤ人の創始者バリアント;リトアニア出身のアシュケナージ系ユダヤ人の67人に1人がこのバリアントのヘテロ接合体[Durst et al 2001]. |
| c.564C>G | p.Tyr188Ter | ゴラン高原のドルーズ派に共通のバリアント[Landsberger et al 1992] | ||
| c.925_931delCCCATCA | p.Pro309LysfsTer59 | フィンランド人の創始者バリアント [Lahtinen et al 2015] | ||
| c.1784G>A | p.Arg595Gln | |||
| NG_009060.1 | g.39215_47749del8535 | -- | ||
| >10-kb del 2 [incl exon 1] |
-- | フランス系カナダ人の創始者バリアント[Hobbs et al 1987] | ||
| LDLRAP1 | NM_015627.3 NP_056442.2 |
c.431dupA (c.432_433insA) |
p.His144GlnfsTer27 | サルディーニャ人の創始者バリアント[Fellin et al 2015] |
| c.65G>A | p.Trp22Ter | |||
| PCSK9 | NM_174936.4 NP_777596.2 |
c.381T>A | p.Ser127Arg | ヘテロ接合体の浸透率は~90% [Dullaart 2017]. |
| c.1120G>T | p.Asp374Tyr | ヘテロ接合体の浸透率が高く,若年発症 [Naoumova et al 2005]. |
表に掲載されているバリアントは著者らから提供された.GeneReviewsのスタッフはバリアントの分類分けの検証はおこなっていない.
GeneReviews はHuman Genome Variation Societyの標準的な命名規則に従っている(varnomen.hgvs.org).命名法の解説については,Quick Referenceを参照のこと.
- 遺伝子は 表 1から,アルファベット順に記載
- 現在の命名規則に適合しないバリアントの名称.この場合,番号付けはシグナルペプチドと対応するヌクレオチドが切断される前の成熟ペプチドを基準としている.
- rs5742904
更新履歴:
-
Gene Reviews著者: E Ison, MS, LCGC, Shoa L Clarke, MD, PhD, and Joshua W Knowles, MD, PhD.
日本語訳者: 箕浦祐子(札幌医科大学大学院医学研究科遺伝医学)、櫻井晃洋(札幌医科大学附属病院遺伝子診療科)
GeneReviews最終更新日: 2022.7.7 日本語訳最終更新日: 2022.9.24 [ in present]