CLCN7関連大理石骨病
(CLCN7-Related Osteopetrosis)
Gene Reviews著者: Cristina Sobacchi, MS, Anna Villa, MD, PhD, Ansgar Schulz, MD, and Uwe Kornak, MD, PhD.
日本語訳者: 佐藤康守 (たい矯正歯科),櫻井晃洋(札幌医科大学医学部遺伝医学)
GeneReviews最終更新日: 2022.1.20 日本語訳最終更新日: 2023.1.6
原文: CLCN7-Related Osteopetrosis
要約
疾患の特徴
CLCN7関連大理石骨病のスペクトラムは、常染色体潜性CLCN7関連「大理石骨病,重症新生児型/乳児型」(infantile malignant CLCN7-related autosomal recessive osteoporosis;ARO)、常染色体性「大理石病,中間型」(intermediate autosomal osteoporosis;IAO)、常染色体顕性「大理石骨病,遅発型2型」(autosomal dominant osteoporosis typeⅡ;ADOⅡ;Albers-Schönberg disease)から成る。(訳注:「」で示した日本語病名は、「骨系統疾患国際分類(2019)和訳」に従ったものである。)
- ARO
症状の初発は出生時で、生じうるものとしては、
- 骨折
- 成長不良
- 視神経圧迫,顔面神経麻痺,難聴を惹起することになる頭蓋底の骨硬化(これにさらに後鼻孔閉鎖や水頭症が重なることあり)
- 重度の貧血,血小板減少症を惹起する骨髄腔の消失
- 歯の異常,歯牙腫,下顎骨骨髄炎のリスク
- 強縮性痙攣発作や二次性の副甲状腺機能亢進症を伴う低カルシウム血症
などがある。
治療を行うことなく経過した場合のAROの寿命は、10年以内である。
- IAO
症状の初発は小児期で、生じうるものとしては、
- 軽微な外傷での骨折
- X線写真で偶然見つかる特徴的な骨格変化
- 軽度の貧血
- 視神経圧迫に伴って時に二次性に生じる視覚障害
などがある。
IAOの寿命は、多くの場合、正常である。
- ADOⅡ
症状の初発は小児期後期ないし思春期で、生じうるものとしては、
- 骨折(どの長骨にも、また椎弓にも起こりうる)
- 脊柱側彎
- 変形性股関節症
- 下顎骨骨髄炎、ないし、その他の部位の化膿性骨炎や変形性関節症
などがある。
脳神経圧迫は稀である。
診断・検査
発端者におけるCLCN7関連大理石骨病の診断は、これを示唆する所見がみられることに加えて、分子遺伝学的検査でCLCN7の両アレルの病的バリアント、あるいはヘテロ接合性の病的バリアントが検出されることで確定する。
臨床的マネジメント
症状に対する治療:
- ARO
- 低カルシウム血症性の痙攣に対するカルシウム補給
- 個々のニーズに従った形でのカルシウムホメオスタシスの管理
- 必要に応じ、赤血球輸血あるいは血小板輸血
- 白血球減少症に対する抗生剤投与
- 低γグロブリン血症に対する免疫グロブリン投与
- ADOⅡ
を行う。
新規にAROの診断がなされた罹患者については、可能な限り早期に、本疾患の同種造血幹細胞移植に関し経験が豊富な医療機関に送る必要がある。
小児科医、小児神経科医、眼科医、精神科医が協力し合って、神経や眼の問題に対する最良の治療法を模索する必要があり、具体的には、視神経圧迫に対する外科的減圧術や補聴器の使用といったことが考えられる。
経験豊富な整形外科医による骨折の治療、ならびに、歯の萌出障害、骨性癒着、膿瘍、嚢胞、瘻孔に留意しつつ歯科的な管理を行う。
術後合併症(骨折後の遷延癒合や骨癒合不全,感染)に注意しつつ、骨折や関節炎に対する整形外科的治療を進める。
骨折部位が関節に近接している場合は、関節全置換術が必要になるようなこともある。
関節炎に対して抗炎症薬を用いた治療、貧血や血小板減少症に対して輸血、視神経圧迫に対して外科的減圧術、その他に補聴器の使用や、定期的な歯の管理や口腔衛生管理を行う。
一次症状の予防:
AROについては、造血幹細胞移植(HSCT)が奏功することがあるものの、脳神経機能障害はふつう不可逆的で、神経障害型の子どもについては、仮にHSCTがうまくいったとしても、その後、進行性の神経後遺症が生じることになる。
定期的追跡評価 :
全血算、眼科的診査、聴覚評価については、少なくとも年に1度行い、歯の評価は6-12ヵ月ごと、もしくは指示された頻度で実施する。
AROについては、HSCT施行後、これを行った医療機関の指示に従ってフォローを行う。
避けるべき薬剤/環境 :
ADOⅡにおいては、骨折リスクの高い活動を避ける。
整形外科手術は、絶対的に必要な場合以外は避けるようにする。
遺伝カウンセリング
CLCN7関連大理石骨病は、常染色体潜性、もしくは常染色体顕性の遺伝形式をとる。
AROは常染色体潜性遺伝、IAOは約40%が常染色体潜性遺伝、約60%が常染色体顕性遺伝で、ADOⅡは常染色体顕性遺伝である。
- 常染色体潜性遺伝
- 常染色体顕性遺伝
両親とも、CLCN7関連大理石骨病関連の病的バリアントをヘテロで有していることがわかっている場合、その子どもは、受胎の段階で、両アレルとも病的バリアントを継承して罹患者となる可能性が25%、無症状の保因者となる可能性が50%、家系内に存在するCLCN7の病的バリアントをどちらも継承しない可能性が25%である。
リスクを有する血族に対して保因者の検査を行うにあたっては、家系内に存在するCLCN7の複数の病的バリアントを事前に同定しておくことが必要である。
常染色体顕性型のCLCN7関連大理石骨病と診断された罹患者の大多数は、罹患者である片親からの継承例である。
常染色体顕性型大理石骨病罹患者の子にCLCN7の病的バリアントが継承される可能性は50%である。
家系内に存在するCLCN7の病的バリアントがすべて判明している場合には、CLCN7関連大理石骨病に備えた出生前診断や着床前遺伝子検査を行うことが可能である。
GeneReviewsの視点
CLCN7関連大理石骨病:ここに含まれる表現型
| 表現型1 | 別名 |
|---|---|
| 常染色体潜性型大理石骨病(ARO) | 常染色体潜性型CLCN7関連大理石骨病,重症新生児型/乳児型 |
| 常染色体性大理石骨病,中間型(IAO) | |
| 常染色体顕性型大理石骨病Ⅱ型(ADOⅡ) | Albers-Schönberg病 |
- これらの表現型を引き起こすその他の遺伝子については、「鑑別診断」の項を参照のこと。
診断
CLCN7関連大理石骨病のスペクトラムには、以下のものが含まれる。
- 常染色体潜性型大理石病(ARO;大理石骨病,重症新生児型/乳児型)
- 大理石病,中間型(IAO)
- 常染色体顕性型大理石骨病,遅発型2型(ADOⅡ;Albers-Schönberg病)
本疾患を示唆する所見
X線写真で骨硬化が認められ、低カルシウム血症とそれに伴う痙攣、貧血、血小板減少症、視覚障害、中枢神経症状が併存しうるような状況がみられた場合には、CLCN7関連大理石骨病を疑う必要がある(表1)。
表1:CLCN7関連大理石骨病の各サブタイプで現れる症候
| 所見 | CLCN7関連大理石骨のサブタイプ | ||
|---|---|---|---|
| ARO | IAO | ADOⅡ | |
| X線写真上の変化 | 疾患特異的1 | 特徴的2 | 特徴的3 |
| 低カルシウム血症 | 重度からなしまで | なし | なし |
| 貧血 | 重度から中等度まで | 軽度からなしまで | なし |
| 血小板減少症 | 重度からなしまで | なし | なし |
| 視覚障害 | 頻発 | 稀 | きわめて稀 |
| 中枢神経症状 | 重度からなしまで4 | なし | なし |
| 症候の初発年齢 | 出生時 | 2歳に達する前 | 10歳に達する前 |
| 遺伝形式 | 常染色体潜性 | 常染色体潜性もしくは常染色体顕性 | 常染色体顕性 |
- 全身性の骨硬化、棍棒型の長骨、頭蓋底の骨硬化、骨内骨様像;こうした所見はAROの全タイプでみられる。
- ARO類似の所見で、幼児期には存在するものの、重症度はAROの場合より低い。
- 以下のような所見がみられる。
- 脊椎の骨硬化(いわゆる「サンドイッチ椎体」)
- 主として腸骨翼にみられる骨内骨様像
- 三角フラスコ形の大腿骨骨幹端
- 頭蓋底の軽度の骨硬化
- 長骨に現れる骨硬化を示す横帯
- 代表的な中枢神経症状は以下の通り。
- 精神運動発達遅延
- 機能喪失
- 発作(低カルシウム血症に起因する場合あり)
- MRIでみられる全体的脳萎縮,皮質異常,ならびに稀に異所性灰白質
診断の確定
発端者におけるCLCN7関連大理石骨病の診断は、これを示唆する所見を示すことに加え、分子遺伝学的検査で両アレル性もしくはヘテロ接合性のCLCN7の病的バリアントが同定されることで確定する(表2参照)。
注:CLCN7に意義不明のバリアントが両アレルにみられた場合、片アレルに既知の病的バリアント、他方のアレルに意義不明のバリアントがみられた場合、意義不明のバリアントがヘテロでみられた場合、これらは本疾患の診断を確定させるものでも除外するものでもない。
CLCN7関連大理石骨病の表現型は、破骨細胞の機能障害に起因して生じるその他の遺伝性の骨硬化性骨異形成症と区別が難しいことがあるため、分子遺伝学的検査としては、マルチ遺伝子パネルあるいは網羅的ゲノム検査を用いることが推奨される。
注:単一遺伝子検査(CLCN7の配列解析、ならびにそれに続いて行う遺伝子標的型欠失/重複解析)が有用になることは稀であり、ふつうは推奨されない。
大理石骨病用マルチ遺伝子パネル
意義不明のバリアントや、いま問題にしている表現型と係わりのない遺伝子の病的バリアントの検出を抑えつつ、疾患の遺伝的原因の特定に最もつながりやすいと考えられるものは、CLCN7その他の関連遺伝子(「鑑別診断」の項を参照)を含む大理石骨病用マルチ遺伝子パネルである。
注:
(1)パネルに含められる遺伝子の内容、ならびに個々の遺伝子について行う検査の診断上の感度については、検査機関によってばらつきがみられ、また、経時的に変更されていく可能性がある。
(2)マルチ遺伝子パネルによっては、今このGeneReviewで取り上げている状況と無関係な遺伝子が含まれることがある。
(3)検査機関によっては、パネルの内容が、その機関の定めた定型のパネルであったり、表現型ごとに定めたものの中で臨床医の指定した遺伝子を含む定型のエクソーム解析であったりすることがある。
(4)ある1つのパネルに対して適用される手法には、配列解析、欠失/重複解析、ないしその他の非配列ベースの検査などがある。
マルチ遺伝子パネル検査の基礎的情報についてはここをクリック。
遺伝子検査をオーダーする臨床医に対する、より詳細な情報についてはここをクリック網羅的ゲノム検査
網羅的ゲノム検査の場合は、関与している遺伝子について臨床医のほうで事前に目星をつけておく必要はない。
エクソームシーケンシングが最も広く用いられるが、ゲノムシーケンシングを選択することも可能である。
網羅的ゲノム検査の基礎的情報についてはここをクリック。
ゲノム検査をオーダーする臨床医に対する、より詳細な情報についてはここをクリック。
表2:CLCN7関連大理石骨病で用いられる分子遺伝学的検査
| 遺伝子1 | 手法 | その手法で病的バリアント2が検出される割合 |
|---|---|---|
| CLCN7 | 配列解析3 | 99%近く4,5 |
| 遺伝子標的型欠失/重複解析6 | 稀7 |
- 染色体上の座位ならびにタンパク質に関しては、表A「遺伝子とデータベース」を参照。
- この遺伝子で検出されているバリアントの情報については、「分子遺伝学」の項を参照のこと。
- 配列解析を行うことで、benign、likely benign、意義不明、likely pathogenic、pathogenicといったバリアントが検出される。
- ヒト遺伝子変異データベース(HGMD)[Stensonら2020]の購読ベースの専門家向けデータより引用したもの。
- 常染色体潜性型大理石骨病を引き起こすCLCN7の深部イントロンの非コード領域のバリアントが、ゲノムシーケンシングで見逃されていた例の報告がみられる[Chorinら2020]。
- 遺伝子標的型欠失/重複解析では、遺伝子内の欠失や重複が検出される。
- CLCN7のエクソン7-25を含む101kbの隣接遺伝子欠失のホモ接合が報告されている[Pangrazioら2012]。
バリアントの種類としては、遺伝子内の小さな欠失/挿入、ミスセンス・ナンセンス・スプライス部位バリアントなどがあるが、通常、エクソン単位あるいは遺伝子全体の欠失/重複については検出されない。 配列解析の結果の解釈に際して留意すべき事項についてはこちらをクリック。
具体的手法としては、定量的PCR、ロングレンジPCR、MLPA法、あるいは単一エクソンの欠失/重複の検出を目的に設計された遺伝子標的型マイクロアレイなど、さまざまなものがある。
臨床的特徴
臨床像
CLCN7に病的バリアントが同定された例が、これまでに約300例報告されている[Stensonら2020]。
ここからのセクションで、3種類の異なるCLCN7関連表現型について説明を加える。
常染色体潜性型CLCN7関連大理石骨病,重症新生児型/乳児型(ARO)
AROは、全身性で生命に危険が及びかねない疾患である。
症状の初発は出生時で、治療を行わなかった場合の寿命は、おおむね10年である(ただ、それより大幅に長く生きた例外も複数存在する)。
注:AROについてなされた詳しい臨床報告は、その多くが原因遺伝子の発見前に公表されたものである。
AROの臨床症候として起こりうるものには、次のようなものがある。
骨格所見
- 骨折 破骨細胞による骨吸収がほぼ完全に失われているため、生後数ヵ月以内に、全骨格にわたって骨硬化症が生じる(図1)。
微小構造が失われるため、骨は脆弱になり、反復性の骨折をきたす(通常は長骨)。
- 成長障害 線的成長が進んでいく上では、成長板において軟骨や骨の吸収が生じることが前提である。
これが生じない場合は、さまざまな程度の成長遅延となって現れる。
重度罹患児については、生後12ヵ月時点での身長が、3パーセンタイルをさらに5cmほど下回る。
- 頭蓋骨 重度罹患児では、満1歳に達するまでに大頭症と前額部突出が出現する。
これは、必ずしも頭蓋冠に生じる骨硬化と並行した形で現れるわけではない。
頭蓋底の骨硬化により、しばしば後鼻孔閉鎖が生じることになる。
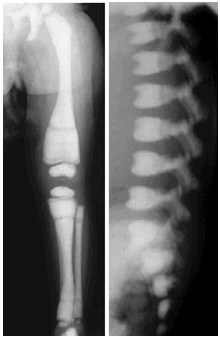
図1:常染色体潜性大理石骨病のX線写真
カルシウムと血液細胞の所見
- 低カルシウム血症 低カルシウム血症により、強縮性痙攣発作や二次性の副甲状腺機能亢進症が生じることがある。
- 貧血ならびに血小板減少症 骨髄腔が欠損するため、髄外造血、肝脾腫、貧血、血小板減少症が生じる。
血小板減少症に伴う出血は、特に中枢神経系(CNS)においては、重篤で生命に係わるようなことがありうる。
- 免疫機能 免疫機能に障害が生じることがある。
疾患の初期段階でみられる白血球増多症が、その後、白血球減少症に移行するようなこともありうる。
しばしばみられる後鼻孔閉鎖と免疫機能障害とが相まって、慢性鼻炎を惹起することもある。
AROで生じた顆粒球や単球によるスーパーオキシド産生障害の報告がみられる[Wilson & Vellodi 200]。
中枢神経系の障害
- 神経学的合併症
- 視覚障害が、生後ほどなくから多くみられる。
- 頭蓋骨の変化により水頭症が生じる場合がある。
- 大泉門の突出と拡大が多みられ、時に水頭症を伴うこともある。
- 顔面神経絞扼に起因する顔面神経麻痺は、症候としてはあまり多くはない。
- 低カルシウム血症から発作が生じることがある。
- 神経障害型 血清カルシウム濃度が正常で、かつ発達遅滞がみられるような例で発作が生じるような場合は、神経障害型を考慮する必要がある。
こうした例で現れる神経関連の表現型は、神経セロイドリポフスチン症のそれに類似している[Steward 2003]。
子どもで非常に重篤な症候が出現するこうしたサブセットにおいては、網膜とCNSに原発性の変性が生じる。
発症がごく早期であった場合は、脳の発生に障害が及び、脳の器質的異常や異所性灰白質が生じる可能性がある[Rösslerら2021]。
神経系の症候が原発性に現れるこうした稀なタイプの神経障害型ARO(予後不良)については、頭蓋底の骨増殖症に起因して二次性に神経症状が現れるタイプのもの(こちらのほうが多くみられる)と明確に区別することが重要である。
神経変性の臨床症状やMRIの所見が出現する前の段階で、病的EEG変化として、通常、極高周波多焦点性棘波・鋭波が出現するという点は注目に値する[A Schulzの未発表データ]。
その原因は、ほとんどの場合、頭蓋底の骨硬化部位で生じる視神経圧迫である。
水頭症の原因は、おそらく、骨増殖症の結果として脳血流や脳脊髄液の循環に閉塞が生じることにあるものと思われる。
その他
- 聴覚に関する症候 Dozierら[2005]は、ARO罹患者の78%に、さまざまな程度の難聴がみられたとしている。
乳突蜂巣の低含気、ならびに外耳道・耳管・内耳道の狭窄により、しばしば中耳炎、伝音性・感音性難聴、顔面神経麻痺が生じる[Dozierら2005]。
- 歯 AROでみられる口腔内の症候としては、歯の萌出遅延、部分性無歯症、歯の形態異常、エナメル質形成不全、エナメル質・象牙質の低石灰化、歯牙腫、重篤な下顎骨骨髄炎などがある。
幹細胞移植が成功を収めた例については、乳歯列に異常がみられたのに、永久歯列のほうは異常なしということが起こりうる[Kantaputraら2012,Wangら2016,Zhangら2019]。
大理石骨病,中間型(IAO) IAOは、小児期に発症し、AROより軽度の経過をとることが特徴である。
寿命は、大多数の例については正常である。
軽度の外傷により骨折をきたしたことでこれが判明する子どももいれば、別の治療上の必要から撮ったX線写真でたまたまこの疾患の特徴的変化が見つかる子どももいる。
血液の徴候はAROの場合より軽度で、貧血のみということが多い。
CNSへの影響はみられないことが多いものの、視神経圧迫に伴う二次性の視覚障害が生じることがある[Campos-Xavierら2003,Frattiniら2003]。
常染色体顕性の大理石骨病,遅発型2型(ADOⅡ) ADOⅡは、時に「良性大理石骨病」と呼ばれるものの、ADOⅡのX線写真徴候を有する罹患者の60%-80%ほどは、何らかの臨床的な問題を併せもっている(図2)。 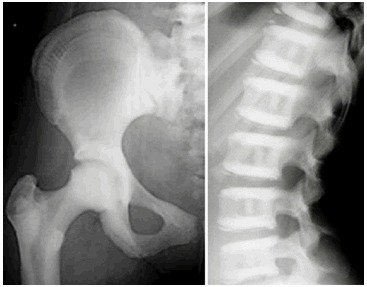
図2:常染色体顕性の大理石骨病,遅発型2型のX線写真
Elsevier社の許可を得てBénichouら[2000]より転載。
ADOⅡのX線写真症候・臨床症候の初発年齢は、通常、小児期後期もしくは思春期であるが、それ以前の年齢で発生をみた例の報告もみられる。
ADOⅡの診断基準の1つにもなっている「サンドイッチ椎体」のような脊椎の骨硬化が主体である。
ほとんどの罹患者は、「骨内骨」様外観を呈する部位を有する。
部位的には腸骨翼に最も多くみられるものの、他の骨にも現れることがある。
長骨については、長軸に対して垂直に、骨硬化を示す横帯がしばしば現れる。
頭蓋底の骨密度上昇がみられることもある[Bénichouら2000,Cleirenら2001]。
臨床症候は、同一家系内にあってさえ大きなばらつきの幅を示す[Waguespackら2007]。
家系内のほとんどの罹患者が軽度型のADOⅡであるものの、一部の罹患者が、低い初発年齢、貧血、視神経圧迫に起因する失明を示した3家系が存在する。
なお、後者の表現型については、AROの中の軽度な例と重なる部分がみられることから、「中間型大理石病」と呼ばれている。
合併症の中心は骨格である。
- 骨折 骨折は罹患者の60%-80%にみられ、1人あたりの平均骨折回数は3回である[Bénichouら2000,Waguespackら2007]。
中には10回を超える骨折を生じた例もみられる。
最も高頻度に生じるのは大腿骨であるが、長骨であればどの骨にも生じる可能性がある。
また、椎弓に生じることもあり、これにより脊椎すべり症が誘発されることになる。
- 脊柱側彎 脊柱側彎は、数多くの罹患者でみられる。
- 変形性股関節症 変形性股関節症も多くみられる(27%近く)。
原因は、軟骨下骨の靱性過大にある可能性が考えられる。
- 骨髄炎 歯の膿瘍や齲蝕が原因となった下顎骨骨髄炎がしばしばみられる[Bénichouら2000,Waguespackら2007]。
他の部位に化膿性骨炎や変形性関節症が生じることもある。
頭蓋底の骨硬化に起因する脳神経圧迫がみられることは稀である。
難聴と視覚障害が罹患者の19%近くにみられる。
遺伝型-表現型相関
今のところ、遺伝型-表現型相関は確認されていない。
浸透率
ADOⅡの家系における浸透率は、60%から90%の間にある[Waguespackら2007]。
発生頻度
ADOⅡの発生頻度は20,000人に1人と推定されている[Bénichouら2000]。
ただ、本疾患は、表現型が軽度の例については、診断がなされないままになっているように思われる。
AROはそれより少なく、250,000人に1人と推定されている。
遺伝子の上で関連のある疾患(同一アレル疾患)
「低色素沈着,臓器肥大,髄鞘形成遅延,発達遅延(OMIM 618541)」の子どもで、CLCN7の生殖細胞系列病的バリアントのヘテロ接合が確認されたとの報告がみられる。
現在までに報告されているこの疾患の2人の患児では、大理石骨病はみられていない[Nicoliら2019]。
鑑別診断
CLCN7の病的バリアントは、常染色体潜性遺伝の大理石骨病,重症新生児型/乳児型(ARO)の13%、潜性遺伝の大理石病,中間型(IAO)の40%、顕性遺伝の大理石病,中間型(IAO)の60%、常染色体顕性の大理石骨病,遅発型2型(ADOⅡ)の99%を占めている[著者個人の観察データ]。
常染色体潜性の大理石骨病(ARO)
表3:他のタイプの常染色体潜性の大理石骨病
| 遺伝子 | 疾患名 | 疾患の特徴 | CLCN7関連AROと異なる症候 |
|---|---|---|---|
| CA2 | 腎細管性アシドーシスを伴う大理石骨病 (RTA) (OMIM 259730) |
全身性の骨硬化症。 脳の石灰化が特徴で、これが知的障害と関連している可能性あり1。 |
初発年齢は、重症新生児型/乳児型より遅いことが多く、疾患の経過もより軽度。 |
| OSTM1 | OSTM1関連ARO*1 (OMIM 259720) |
AROの4%近くがOSTM1の病的バリアントに起因するもの。 中枢神経系への影響2を伴う極度に重度型のAROで、CLCN7関連AROの最重度型との区別は困難。 |
OSTM1関連AROは、しばしば器質的脳奇形を伴う。 |
| PLEKHM1 | PLEKHM1関連ARO*2 (OMIM 259720) |
きわめて稀。 ADOⅡに類似する場合あり。 |
PLEKHM1関連AROは非常に軽度で、年齢とともに消退していくことあり3。 PLEKHM1のヘテロ接合性病的バリアントに起因して生じた1例の報告あり4。 |
| SNX10 | SNX10関連ARO*3 (OMIM 615085) |
AROの4%近くがSNX10の病的バリアントに起因するもの。 この「Västerbotten*4型大理石骨病」はSNX10の病的バリアントに起因して生じる。 視力喪失,貧血,骨の脆弱性がしばしばみられ、造血幹細胞移植が必要5。 |
SNX10関連AROのほうがCLCN7関連AROよりわずかに軽症であるように思われる。 |
| TCIRG1 | TCIRG1関連ARO*3 (OMIM 259700) |
AROの50%超がTCIRG1の病的バリアントに起因するもの。 | CLCN7関連AROのほうがTCIRG1関連AROより神経発達遅延や発作の出現頻度が高い6。 TCIRG1のノンコーディングバリアントにより、ADOⅡ類似の軽度型表現型が生じる可能性あり。 |
| TNFRSF11A | 大理石骨病,乳児型,免疫グロブリン欠乏を伴う破骨細胞減少型(OMIM 612301) | 満1歳以前の発症と、典型的なAROの症候が特徴。 確実な診断には骨の生検が必要。 |
TNFSF11の病的バリアントにより、わずかなT細胞の障害が、TNFRSF11Aの病的バリアントにより分類不能型免疫不全症が生じる可能性あり7。 TNFSF11,TNFRSF11A関連AROでは造血幹細胞移植が奏功しないので、これを除外しておくことが重要。 |
| TNFSF11 | 破骨細胞減少型ARO*2 (OMIM 259710) |
訳注*1:「骨系統疾患国際分類(2019)和訳」では「大理石骨病,乳児型,神経系の罹患を伴う」という病名になっている。
訳注*2:「骨系統疾患国際分類(2019)和訳」では「大理石骨病,中間型」に含まれ、特定の名称はつけられていない。
訳注*3:「骨系統疾患国際分類(2019)和訳」では「大理石骨病,重症新生児型/乳児型」に含まれ、特定の名称はつけられていない。
訳注*4:このタイプが多くみられるスウェーデンの地方名。
- Jacqueminら[1998]
- Pangrazioら[2006]
- Van Wesenbeeckら[2007]
- Boら[2016]
- Akerら[2012],Pangrazioら[2013]
- Frattiniら[2000],Kornakら[2000]
- Sobacchiら[2007],Guerriniら[2008]
軽度型AROについて
TCIRG1の深部イントロンのバリアント、あるいはスプライス部位バリアントにより、AROの軽度型が生じる可能性がある(OMIM 259700)[Sobacchiら2014,Palagonoら2015]。
このタイプは、CLCN7関連のIAOやADOⅡと非常によく似た表現型を示すことがある。
常染色体顕性の大理石骨病(ADO)
LRP5のヘテロ接合性病的バリアントにより、ADOⅠ型(ADOⅠ)(OMIM 607634)が生じる。
ADOⅠでは、頭蓋冠に最も顕著な骨硬化が生じ、サンドイッチ椎体が生じることはない。
ADOⅠでは、骨折率の上昇をきたすことはない。
注:本疾患については、「骨内膜性骨増殖症」あるいは「高骨量疾患」とすべきではないかとの議論がある。
というのは、「大理石骨病」という病名は、破骨細胞関連の疾患に限定して使用されるべきものだからである。
その他
表4:CLCN7関連大理石骨病との鑑別診断を検討すべき他の疾患
| 遺伝子 | 疾患/表現型名 | 遺伝形式 | コメント |
|---|---|---|---|
| ANKH | 常染色体顕性頭蓋骨幹端異形成症 | AD |
|
| CSF1R | 脳奇形-神経変性-硬化性骨異形成症(BANDDOS) (OMIM 618476) |
AR | 脳奇形と原発性神経変性表現型を特徴とする。 他のタイプの硬化性骨異形成症と同様、罹患者に扁平椎がみられる。 |
| CTSK | 濃化異骨症 | AR |
|
| FERMT3 | 大理石骨病,白血球接着不全を伴う中等症型(OMIM 612840) | AR | 罹患者には、血小板数・白血球数とは無関係に、反復性感染症や出血性素因がみられる。 破骨細胞を介した骨吸収にはフェルミチンファミリーホモログ3シグナル伝達が必要であるため、一部の例で骨密度の上昇がみられる2。 |
| GJA1 | 常染色体潜性頭蓋骨幹端異形成症 (OMIM 218400) |
AR |
|
| LRP6 | 高骨量表現型4 | AD | ADOⅠ類似の骨内膜性骨増殖症を示すものの、部分性無歯症も伴う。 |
| LRRK1 | 骨硬化性骨幹端異形成症(OSMD)5 | AR |
|
| SLC29A3 | 異骨性骨硬化症6 | AR |
|
| SOST | van Buchem病と硬化性骨症を含むSOST関連硬化性骨異形成症 | AR | 脳神経機能異常,下顎骨拡大,全身性骨硬化に至るような中等度から重度の頭蓋骨増殖症。 硬化性骨症は合指や高身長を伴うことがあり、頭蓋内圧の上昇のため致死性となる場合がある。 |
AD=常染色体顕性,AR=常染色体潜性
1.Pangrazioら[2014]
2.Crazzolaraら[2015]
3.Huら[2013]
4.Branceら[2020]
5.Howaldtら[2020]
6.Howaldtら[2019]
臨床的マネジメント
診断、治療、フォローアップに関する一般的ガイドラインは、いずれのタイプの大理石骨病に関するものも入手可能である。
「著者情報」の項を参照されたい。
常染色体潜性CLCN7関連大理石骨病,重症新生児型/乳児型(ARO)と、常染色体顕性大理石骨病,遅発型2型(ADOⅡ)とでは、重症度に違いがあるため、評価・治療・追跡評価に関する推奨事項も異なってくる。
常染色体性CLCN7関連大理石病,中間型(IAO)の表現型は、上記2つの中間にあり、症候の現れ方も予後もさまざまである。
したがって、CLCN7関連IAOの管理法については、個別に評価していく必要がある。
最初の診断に続いて行う評価
AROと診断された罹患者については、疾患の範囲やニーズを把握するため、診断に至る過程ですでに実施済ということでなければ、表5にまとめたような評価を行うことが推奨される。
表5:常染色体潜性のCLCN7関連大理石骨病,重症新生児型/乳児型(ARO)罹患者において最初の診断後に行うことが推奨される評価
| 系/懸念事項 | 評価項目 | コメント |
|---|---|---|
| 骨硬化症 | 治療開始時点の記録としてのX線写真による骨格評価 | |
| 後鼻孔閉鎖 | 頭蓋底の硬化に起因する後鼻孔閉鎖に関する耳鼻咽喉科的評価 | |
| 低カルシウム血症と二次性の副甲状腺機能亢進症 | 血液と尿中のカルシウム濃度 | |
| 貧血と血小板減少症 | 網赤血球数を含む全血算 | |
| 腹部超音波検査 | 髄外造血に伴う肝脾腫の評価 | |
| 神経関連の合併症 | 神経障害型大理石骨病でみられる神経孔狭小化・水頭症・脳奇形を調べるための脳頭蓋のMRIないしCT | |
| 脳波 | 神経変性の有無に関する評価 | |
| 治療開始時点の記録としての神経発達評価 | ||
| 視覚障害 | 頭蓋底部での視神経圧迫に起因する視神経萎縮の評価を目的として行う視覚誘発電位を含む眼科検査 | |
| 難聴 | 治療開始時点の記録としての聴覚評価 | |
| 遺伝カウンセリング | 遺伝の専門職1の手で行う。 | 医学的・個人的決断に資するよう、罹患者とその家族に対し、CLCN7関連AROの本質・遺伝形式・そのもつ意味について情報提供を行う。 |
| 家族への支援/情報資源 | 以下の諸点に関し評価を行う。 ・地域の情報資源、あるいはParent to Parentのようなオンラインの情報資源の必要性 ・親への支援を目的としたソーシャルワーカーの関与の必要性 ・在宅看護の必要性 |
- 臨床遺伝医,認定遺伝カウンセラー,認定上級遺伝看護師をいう。
ADOⅡと診断された罹患者については、疾患の範囲やニーズを把握するため、診断に至る過程ですでに実施済ということでなければ、表6にまとめたような評価を行うことが推奨される。
表6:常染色体顕性のCLCN7関連大理石骨病,遅発型2型罹患者において最初の診断後に行うことが推奨される評価
| 系/懸念事項 | 評価項目 | コメント |
|---|---|---|
| 骨硬化症 | 治療開始時点の記録としてのX線写真による骨格評価 | |
| 貧血と血小板減少症 | 網赤血球数を含む全血算 | |
| 神経関連の合併症 | 神経孔狭小化を調べるための脳頭蓋のMRIないしCT | |
| 視覚障害 | 頭蓋底部での視神経圧迫に起因する視神経萎縮の評価を目的として行う視覚誘発電位を含む眼科検査 | |
| 難聴 | 治療開始時点の記録としての聴覚評価 | |
| 遺伝カウンセリング | 遺伝の専門職1の手で行う。 | 医学的・個人的決断に資するよう、罹患者とその家族に対し、CLCN7関連ADOⅡの本質・遺伝形式・そのもつ意味について情報提供を行う。 |
- 臨床遺伝医,認定遺伝カウンセラー,認定上級遺伝看護師をいう。
症候に対する治療
AROとADOⅡとでは重症度に違いがあるため、治療のための戦略も異なったものとなる。
IAOはこれら2つの中間に位置し、予後には大きな幅がみられる。
そのため、治療上の選択肢については、個々の状況に合わせて評価を行う必要がある。
表7:常染色体潜性のCLCN7関連大理石骨病,重症新生児型/乳児型(ARO)罹患者の症候に対する治療
| 症候/懸念事項 | 治療 | 考慮すべきこと/その他 |
|---|---|---|
| 低カルシウム血症性痙攣 | カルシウム補給1 | |
| 骨髄機能不全 | 必要に応じ、赤血球・血小板輸血(X線照射済のもの) | 白血球減少症や低γグロブリン血症を示すサブセットがある。 そうした例については、予防ないし治療の手段として、抗生剤や免疫グロブリンを投与することがある。 |
| 新規にAROと診断された罹患者は、可及的早期に、AROの同種造血幹細胞移植の経験を有する小児医療機関に送るようにする。 | 「一次症候の予防」の項を参照。 | |
| 神経系関連 | 小児科医、小児神経内科医、眼科医、心理士が協力して、最適な治療法を決定する。 | |
| 視覚障害 | 視神経の外科的減圧術は、技術的な困難さはあるものの、全般的にみると、ARO罹患者の視力喪失防止に一定の成果を収めている[Hwangら2000]。 | |
| 難聴 | 補聴器の使用 | |
| 骨折 | AROの経験を有する整形外科医が、担当の小児科医と協力して治療を行う。 | |
| 歯科関連 | 必要に応じ、歯科医による治療 | 歯の萌出障害、骨性癒着、膿瘍、嚢胞形成、瘻孔について、口腔外科的処置が必要になることがある。 |
- カルシウムホメオスタシスの管理は容易でないことがあり、相反する推奨がなされることがある。
くる病を伴う大理石骨病の子どもの治療には生理的な量のカルシウムとビタミンDが使用される一方、造血幹細胞移植後の疾患の進行防止、高カルシウム血症クリーゼ防止の観点からは、カルシウム、ビタミンDの抑制策がとられる。
治療は、罹患者個々の状況を考慮しつつ進める必要がある。
表8:常染色体顕性のCLCN7関連大理石骨病,遅発型2型(ADOⅡ)罹患者の症候に対する治療
| 症候/懸念事項 | 治療 | 考慮すべきこと/その他 |
|---|---|---|
| 骨折 | ADOⅡの経験を有する整形外科医による治療 | 関節近傍の骨折については、関節全置換術を要することあり[Strickland & Berry 2005]。 |
| 関節炎 | 抗炎症剤による治療 | |
| 貧血と血小板減少症 | 輸血 | |
| 視覚障害 | 視神経の外科的減圧術 | |
| 難聴 | 補聴器の使用 | |
| 歯科関連 | 定期的歯科受診と口腔衛生管理 |
一次症候の予防
CLCN7関連常染色体潜性の大理石骨病,重症新生児型/乳児型(ARO)
造血幹細胞移植(HSCT)
大理石病でみられる破骨細胞の問題の起源は造血にある。
そのため、同種造血幹細胞移植で問題が解決する可能性がある。
ほとんどの症候(骨硬化,骨髄機能不全,髄外造血)は、HSCTで予防ないし好転させることが可能である。
- 高カルシウム血症予防の観点から、HSCTの直前、施行中、施行後については、カルシウムとビタミンDの摂取を制限することが推奨される。
- 神経圧迫に起因する二次性の感覚神経障害についていうと、早期の移植によりこれを予防することは可能であるものの、すでに生じてしまっているものを回復させる効果は期待できない。
- なお、神経障害型AROでみられる原発性の神経障害や網膜変性は、骨の疾患とは独立した形で生じるものであるため、HSCTによる改善や予防といったことは期待できない。
- HSCTを成功裏に終えた罹患者の中に、進行性の神経関連後遺症、発達遅滞、反復性発作が生じるサブセットが存在する[Steward 2003]。
脳神経の機能障害(視神経圧迫に起因する視覚障害)は、大多数の例では不可逆的である。
著者らの経験した30症例についていうと、約3分の2は、移植が成功した後も視覚障害が残存していた[A Schulzの未公表データ]。
Even-Orら[2022]は、種々の遺伝子の変異に起因して生じたARO症例群中の26%が失明者であったと報告している。
一方、CLCN7の病的バリアントを有するARO罹患者の中に、神経関連の合併症を生じない例がみられたとの報告がある[Pangrazioら2010,Gaytán-Moralesら2021,A Schulz & U Kornakの未公表データ]。
神経障害型の罹患者がこの侵襲の大きな治療を受けなくてよいようにすることは、非常に重要なことではあるが、困難でもある[Rösslerら2021]。
一方で、原発性の神経障害を有しない例の大多数については、視覚障害をはじめとする不可逆的な二次的合併症を予防する観点から、可及的早期にHSCTを実施する必要がある。
そうしたことから、罹患者の評価やHSCTによる治療は、経験豊富な小児医療センターにおいて、疾患の重症度や予後を左右する罹患者ごとの要因といったものを多方面から評価した上で行うようにすべきである。
著者らの経験した症例について言うと、造血幹細胞移植後、約10%に、重度の視覚障害以外の神経関連症候が確認されている[A Schulzの未公表データ]。
そうであったとしても、CNSに原発性の問題を有しないARO罹患者については、HSCTを行うことで治癒の可能性があるのだという点は強調しておく必要がある[Gaytán-Moralesら2021]。
・HSCTの転帰に関する報告
- HSCT施行後の重度の合併症発生頻度は高く、とりわけ、代替ドナー幹細胞が用いられた場合に多くみられる。
- AROにおけるHSCTの転帰については、これまでにヨーロッパ免疫不全学会(ESID)やヨーロッパ骨髄移植学会議(EBMT)の手で後ろ向き研究による分析が行われている[Sobacchiら2013]。
- シクロホスファミドを使用したやり方で移植が行われた多施設にまたがる193例の報告によると、5年生存率は、HLA合致同胞ドナー移植で62%、代替ドナー移植で42%であったという[Orchardら2015]。
- 3つの大規模移植医療センターから、フルダラビンを使用して前処置を行った移植により、さらに良好な成績が得られたことが報告されている[Natshehら2016,Schulz & Moshousからの個人通信]。
- HLA半合致HSCTにおいて、改良ボルチモア法に従って移植後にシクロホスファミドを使用することで、有望な結果が得られている。
- これを受けて、このプロトコルは、最近更新されたEBMT/ESIDの先天免疫不全作業部会の治療ガイドラインに盛り込まれた[Lankesterら2021]。
具体的には、拒絶反応、造血機能再構築の遅延、静脈閉塞性疾患、肺高血圧、高カルシウム血症クリーゼなどがある[Stewardら2004,Corbaciogluら2006,Shroffら2012]。
5年無病生存率は、HLA適合ドナー移植で88%、HLA合致非血縁ドナー移植で80%、HLA半合致血縁ドナーで66%と推定されている[Sobacchiら2013]。
注:AROの原因としては、CLCN7の病的バリアントよりTCIRG1の病的バリアントの頻度のほうが高い。
そのため、HSCTが行われた乳児の大部分は、CLCN7ではなくTCIRG1の病的バリアントを有する例である。
ただ、TCIRG1の病的バリアントとCLCN7の病的バリアントとで治療成績に有意の差はない模様である[A Schulzらの未公表データ]。
定期的追跡評価
表9:常染色体潜性のCLCN7関連大理石骨病,重症新生児型/乳児型罹患者で推奨される定期的追跡評価
| 系/懸念事項 | 評価法 | 実施頻度 |
|---|---|---|
| 骨髄機能不全 | 全血算 | 少なくとも年に1度 |
| 視覚障害 | 眼科的評価 | |
| 難聴 | 聴覚評価 | |
| 歯科関連 | 歯科的評価 | 6-12ヵ月ごと、もしくは担当医の指示に従って |
| 造血幹細胞移植後の移植失敗の可能性 | 移植医療センターによる追跡評価 | 専門担当者の指示に従って |
表10:常染色体顕性のCLCN7関連大理石骨病,遅発型2型罹患者で推奨される定期的追跡評価
| 系/懸念事項 | 評価法 | 実施頻度 |
|---|---|---|
| 貧血と血小板減少症 | 全血算 | 少なくとも年に1度 |
| 視覚障害 | 眼科的評価 | |
| 難聴 | 聴覚評価 | |
| 歯科関連 | 歯科的評価 | 6-12ヵ月ごと、もしくは担当医の指示に従って |
避けるべき薬剤/環境
ADOⅡ
- 骨折リスクの高い活動は控えるべきである。
- 整形外科的手術は、絶対的に必要なものについてのみ行うこととする。
また、大理石骨病の骨を取り扱うに際しては、合併症の発生が考えられ、取り扱いが難しいことを、外科医のほうで認識しておく必要がある。
リスクを有する血縁者の評価
治療や予防措置を迅速に開始することで利益が得られる人を可能な限り早期に特定するため、一見無症状と思われる同胞については、罹患者より年上であるか年下であるかを問わず、CLCN7の病的バリアントに関する分子遺伝学的検査を行って、その遺伝的状態を明らかにしておくことが望ましい。
造血幹細胞移植のドナーとなることについて(CLCN7関連AROの発端者の血族)
幹細胞のドナーとなることを検討している血族については、分子遺伝学的検査を行って、その遺伝的状態を明らかにしておくことが求められる。
可能であれば、ドナーとなる親族は、家系内にあるCLCN7の病的バリアントを有していないことが望ましい。
リスクを有する血族に対して行う遺伝カウンセリングを目的とした検査関連の事項については、「遺伝カウンセリング」の項を参照されたい。
研究段階の治療
さまざまな疾患・状況に対して進行中の臨床試験に関する情報については、アメリカの「Clinical Trials.gov」、ならびにヨーロッパの「EU Clinical Trials Register」を参照されたい。
注:現時点で本疾患に関する臨床試験が行われているとは限らない。
遺伝カウンセリング
「遺伝カウンセリングは個人や家族に対して遺伝性疾患の本質,遺伝,健康上の影響などの情報を提供し,彼らが医療上あるいは個人的な決断を下すのを援助するプロセスである.以下の項目では遺伝的なリスク評価や家族の遺伝学的状況を明らかにするための家族歴の評価,遺伝学的検査について論じる.この項は個々の当事者が直面しうる個人的あるいは文化的、倫理的な問題に言及しようと意図するものではないし,遺伝専門家へのコンサルトの代用となるものでもない.」
遺伝形式
CLCN7関連大理石骨病は、常染色体潜性ないし常染色体顕性の遺伝形式をとる。
- 常染色体潜性CLCN7関連大理石骨病,重症新生児型/乳児型(ARO)は、常染色体潜性遺伝を示す。
- CLCN7関連大理石病,中間型(IAO)については、約40%が常染色体潜性遺伝、約60%が常染色体顕性遺伝を示す。
- 常染色体顕性CLCN7関連大理石骨病,遅発型2型は、常染色体顕性遺伝を示す。
常染色体潜性遺伝 ― 血縁者の有するリスク
発端者の親
- 罹患児の両親は、CLCN7の病的バリアントをヘテロで有しているものと推定される。
- 発端者の両親については、両者ともCLCN7の病的バリアントのヘテロ接合者であることを確認して、再発リスク評価の信頼性を上げることを目的に、分子遺伝学的検査を行うことが望ましい。
- 発端者で同定された病的バリアントのうちの1つが、発端者において新生のイベントとして生じたか、もしくは、モザイクの片親において接合後の新生のイベントとして生じた可能性[Jónssonら2017]。
- 片親の、病的バリアントを伴っているほうの染色体の片親性アイソダイソミーが生じた結果、発端者がその病的バリアントをホモ接合でもつことになった可能性。
- AROを引き起こすCLCN7の病的バリアントをヘテロで有する例は、通常、無症状である。 ただ、そうした例における骨量の微妙な変化を評価することを目的とした系統立った研究は、今のところ行われていない。
病的バリアントが片親からしか検出されず、しかも、親子鑑定の結果、両親とも真正の生物学的父母であることが確認されているといった場合であれば、可能性として以下のことを考える必要がある。
発端者の同胞
- 常染色体潜性大理石骨病の原因となる病的バリアントについて、両親ともヘテロでこれを有していることがわかっている場合であれば、罹患者の同胞は、受胎の段階でCLCN7の病的バリアントを両アレルとも継承して罹患者となる可能性が25%、無症状の保因者となる可能性が50%、家系内にあるCLCN7の病的バリアントをどちらも継承しない可能性が25%ということになる。
- 限られたデータではあるものの、ARO罹患者が存在する場合、その罹患者と同一家系にあってCLCN7の両アレルの病的バリアントを共有する例には、やはり同じような症候が生じることが示唆されている。
特に、発端者が神経障害型である場合は、発端者にみられる中枢神経系の原発性の変化が、他の罹患同胞においても同様にみられる可能性が高い[Sobacchiの未公表観察データ]。
- 常染色体潜性大理石骨病のCLCN7の病的バリアントをヘテロで有する例は、無症状である。
ただ、そうした例における骨量の微妙な変化を評価することを目的とした系統立った研究は、今のところ行われていない。
発端者の子
- 常染色体潜性のCLCN7関連大理石骨病罹患者の子は、CLCN7の病的バリアントに関し、絶対ヘテロ接合者(絶対保因者)となる。
- 一般に、ARO罹患者が子を儲けることができるのは、造血幹細胞移植が成功した場合のみである。
他の血族
発端者の両親の同胞は、いずれも、CLCN7の病的バリアントの保因者であることに関し、50%のリスクを有する。
保因者の特定
保因者としてのリスクを有する親族に対して、これを調べる検査を行うためには、家系内に存在するCLCN7の病的バリアントを事前に特定しておく必要がある。
常染色体顕性遺伝 ― 血縁者の有するリスク
発端者の親
- 常染色体顕性のCLCN7関連大理石骨病と診断された罹患者の大多数は、罹患者である片親からの継承例である。
- 常染色体顕性のCLCN7関連大理石骨病の発端者は、新生の病的バリアントに起因して本疾患を有するに至った可能性がある。
- 発端者が家系内における唯一の罹患者(すなわち、孤発例)と思われる場合であっても、その両親に対しては、骨格の状態を調べるX線写真撮影、ならびに発端者で同定された病的バリアントの有無を調べる分子遺伝学的検査を行うことが推奨される。
両親の評価を行うことで、初めてその遺伝的状態が明らかになり、再発リスクに関し、信頼性をもったカウンセリングが可能となる。 - 発端者で同定された病的バリアントが両親いずれからも検出されず、なおかつ親子鑑定の結果、生物学的意味における真正の父母であることが確認された場合には、可能性として次のことを考慮する必要がある。
- 発端者に生じた新生の病的バリアントという可能性
- 生殖細胞系列モザイク(もしくは体細胞・生殖細胞系列両方のモザイク)の片親から発端者が病的バリアントを継承した可能性
CLCN7関連大理石骨病罹患者に占める新生の病的バリアントの比率については、よくわかっていない。
注:親の白血球DNAを検査したとしても、体細胞モザイクの全例で病的バリアントが検出できるわけではなく、また、生殖細胞系列のみに存在する病的バリアントについては、一切検出することができない。
- 両親の評価を行ってみると、実際はそのうちの1人が罹患者であるにもかかわらず、浸透率が低下していた、医療者側が本症候群を見逃してしまっていた、あるいはまた、表現型がごく軽度であったといった理由で、診断をすり抜けていたことがわかるような例もみられる。
したがって、見かけ上、家族歴陰性と思われる場合であっても、両親に対して適切な臨床評価を行う、ないし、分子遺伝学的検査を行って発端者で同定された病的バリアントを両親ともヘテロで有していないことを確認するといったことがない限り、家族歴陰性の確認はできない。
発端者の同胞
発端者の同胞の有するリスクは、発端者の両親の遺伝的状態によって変わってくる。
- 発端者の片親が罹患者である、ないし、発端者で同定されたCLCN7の病的バリアントを同じく有しているといった場合であれば、同胞がその病的バリアントを継承するリスクは50%ということになる。
- 発端者の有するCLCN7の病的バリアントが両親いずれの白血球DNAからも検出されない場合、同胞への再発リスクは1%と推定される。
- 両親ともCLCN7の病的バリアントに関する検査を受けていないものの、臨床的には非罹患者と目されるといった場合であれば、発端者の同胞の有するリスクは低いように思われる。
ADOⅡは家系内におけるばらつきの幅が大きく、また、浸透率の低下もみられるため(「浸透率」の項を参照)、常染色体顕性のCLCN7関連大理石骨病を引き起こすCLCN7の病的バリアントを継承した同胞に現れる症候は、発端者より重度である場合もあれば、軽度である場合もある。
それは、理論上、親の生殖細胞系列モザイクの可能性が残っているからである[Rahbariら2016]。
それでも、臨床的に非罹患者と目される両親から生まれる発端者の同胞は、CLCN7関連大理石骨病に関して、一定のリスクの高まりをもつことになると考えられる。
それは、片親がヘテロ接合者であったにもかかわらず浸透率が低下していた可能性、ならびに、親の生殖細胞系列モザイクの可能性が理論上残っているからである。
発端者の子
常染色体顕性のCLCN7関連大理石骨病を有する罹患者の子は、病的バリアントの継承に関し、50%のリスクを有する。
他の血族
他の血族の有するリスクは、発端者の両親の状態によって変わってくる。
もし片親がCLCN7の病的バリアントを有しているということになれば、その血族にあたる人はすべてリスクを有することになる。
関連する遺伝カウンセリング上の諸事項
早期診断・早期治療を目的としてリスクを有する血族に対して行う評価関連の情報については、「臨床的マネジメント」の「リスクを有する血縁者の評価」の項を参照されたい。
家族計画
- 遺伝的リスクの確定、出生前/着床前遺伝子検査を受けるかどうかの話し合いといったことに最も適しているのは、妊娠前の時期である。
- 罹患者、保因者、ならびに保因者である可能性のある若い成人に対しては、遺伝カウンセリング(子に生じる可能性のあるリスクや、子を儲ける上での選択肢についての説明を含む)を提供することが望ましい。
出生前検査ならびに着床前遺伝子検査
家系内に存在するCLCN7の病的バリアントが同定されている場合は、CLCN7関連大理石骨病に関する出生前検査や着床前遺伝子検査を行うことが可能である。
出生前検査の利用に関しては、医療者間でも、また家族内でも、さまざまな見方がある。
現在、多くの医療機関では、出生前検査を個人の決断に委ねられるべきものと考えているようであるが、こうした問題に関しては、もう少し議論を深める必要があろう。
関連情報
GeneReviewsスタッフは、この疾患を持つ患者および家族に役立つ以下の疾患特異的な支援団体/上部支援団体/登録を選択した。GeneReviewsは、他の組織によって提供される情報には責任をもたない。選択基準における情報については、ここをクリック。
- The OsteoPETrosis Society (OPETS)
Phone: 980-292-3921
Email: osteopetrosispatient@gmail.com; janecastello.opets@gmail.com
www.osteopetrosis.org
- MedlinePlus
- National Institute of Arthritis and Musculoskeletal and Skin Diseases (NIAMS)
1 AMS Circle
Bethesda MD 20892-3675
Phone: 877-226-4267 (toll-free); 301-565-2966 (TTY)
Fax: 301-718-6366
Email: niamsinfo@mail.nih.gov
www.niams.nih.gov - Network for Rare Osteopathies (NetsOs)
CeSER
Alexandrinenstraße 5
Germany
Phone: 49 (0)234 509-2601
Fax: 49 (0)234 509-2688
Email: ceser@klinikum-bochum.de
Netzwerks für Seltene Osteopathien
- European Society for Immunodeficiencies (ESID) Registry
Dr. Gerhard Kindle
University Medical Center Freiburg Centre of Chronic Immunodeficiency
Engesserstrasse 4
79106 Freiburg
Germany
Phone: 49-761-270-34450
Email: esid-registry@uniklinik-freiburg.de
ESID Registry
- International Skeletal Dysplasia Registry
UCLA
615 Charles E. Young Drive
South Room 410
Los Angeles CA 90095-7358
Phone: 310-825-8998
Fax: 310-206-5266
Email: Salon@mednet.ucla.edu
International Skeletal Dysplasia Registry
分子遺伝学
分子遺伝学とOMIMの表の情報はGeneReviewsの他の場所の情報とは異なるかもしれない。表は、より最新の情報を含むことがある。
表A:CLCN7関連大理石骨病:遺伝子とデータベース
| 遺伝子 | 染色体上の座位 | タンパク質 | Locus-Specificデータベース | HGMG | ClinVar |
|---|---|---|---|---|---|
| CLCN7 | H+/Cl-交換トランスポーター7 | CLCN7 database | CLCN7 | CLCN7 |
データは、以下の標準資料から作成したものである。
遺伝子についてはHGNCから、染色体上の座位についてはOMIMから、タンパク質についてはUniProtから。
リンクが張られているデータベース(Locus-Specific,HGMD,ClinVar)の説明についてはこちらをクリック。
表B:CLCN7関連大理石骨病関連のOMIMエントリー(閲覧はすべてOMIMへ)
| 166600 | OSTEOPETROSIS, AUTOSOMAL DOMINANT 2; OPTA2 |
| 602727 | CHLORIDE CHANNEL 7; CLCN7 |
| 611490 | OSTEOPETROSIS, AUTOSOMAL RECESSIVE 4; OPTB4 |
分子レベルの病原
CLCN7関連大理石骨病は、破骨細胞の機能障害によって引き起こされる。
破骨細胞は、高度に特異的な分化を遂げた細胞で、石灰化した骨組織を大量に吸収するというユニークな能力を有する。
骨表面に付着した後、吸収窩を細胞外環境から遮断するための明帯(sealing zone)が形成される。
そして、大量の酸性小胞が骨表面側の形質膜と融合し、波状膜が形成される。
こうした構造は破骨細胞だけにみられるもので、これにより大量の酸が吸収窩に分泌される。
こうしたことから、吸収窩は「細胞外リソソーム」とも呼ばれる[Sobacchiら2013]。
pHを低い状態にもっていくことは、骨塩を溶解する上でも、また、骨基質を分解する酸性加水分解酵素を理想的な活性化状態に維持する上でも必要である。
CLCN7は、ClC-7型Cl-チャンネルをコードする。
ClC-7型Cl-チャンネルは、リソソーム小胞内ならびに波状膜内に存在して、波状膜のV型H+ATPアーゼによる吸収窩へのプロトンの送り込みと並行する形で、負電荷を吸収窩へ運ぶ2Cl-/1H+交換体として作用する[Kornakら2001,Leisleら2011]。
疾患発症のメカニズム
CLCN7の病的バリアントにより、Cl-チャンネルの機能がさまざまな程度で失われることになる。
最も重篤なタイプである常染色体潜性大理石骨病においては、ClC-7型Cl-チャンネルは欠失してしまっているが、常染色体顕性の大理石骨病Ⅱ型を引き起こす病的バリアントの場合は、必ずしもCl-の流れが阻害されるわけではなく、イオンチャンネルのゲーティング機能に異常をきたすのみである[Leisleら2011]。
表11:CLCN7の注目すべき病的バリアント
| 参照配列 | DNAヌクレオチドの変化 | 予測されるタンパク質の変化 | コメント[参照文献] |
|---|---|---|---|
| NM_001287.6 NP_001278.1 |
c.643G>A | p.Gly215Arg | ADOⅡでみられる反復性の病的バリアント |
| c.856C>T | p.Arg286Trp |
表中のバリアントは、著者の提供したものをそのまま載せたもので、GeneReviewsのスタッフが独立した立場でバリアントの分類を確認したものではない。
GeneReviewsは、Human Genome Variation Society(varnomen.hgvs.org)の標準命名規則に準じた表記を行っている。
命名法の説明に関しては、「Quick Reference」を参照されたい。
更新履歴:
-
Gene Reviews著者: Cristina Sobacchi, MS, Anna Villa, MD, PhD, Ansgar Schulz, MD, and Uwe Kornak, MD, PhD.
日本語訳者: 佐藤康守 (たい矯正歯科),櫻井晃洋(札幌医科大学医学部遺伝医学)
GeneReviews最終更新日: 2022.1.20 日本語訳最終更新日: 2023.1.6 [in present]