多施設共同研究実施手順
日本胸腺研究会で多施設共同臨床研究を企画されるかたへ日本胸腺研究会は胸腺、胸腺腫、胸腺癌に興味をもつ基礎、臨床の研究家、医師が一堂に会する場所です。特にまれな疾患である胸腺腫、胸腺癌についてはわれわれが臨床研究を行い、Evidenceを発信して行く責務があります。
胸腺、胸腺腫や胸腺癌などについて日本胸腺研究会の参加施設による多施設共同臨床試験を企画されるかたは次の手順に従ってください。
- おおまかな企画を練る
- 必要症例数のおおまかな概算を行い実行可能かどうかを考える(統計専門家が手近におられず、わからないときは必要症例数についてはプロトコール委員会にご相談いただいても結構です)
- 下記日本胸腺研究会臨床試験プロトコール委員会(プロトコール委員会)規約を参照いただき、必要な項目を箇条書きにして臨床試験の提案書をプロトコール委員会に提出する
- プロトコール委員会から問い合わせや助言があります
- プロトコール委員会から承認があれば、詳しい実施計画書を作成してプロトコール委員会に提出する(JART02などの実施計画書を参考にしてください)
- このとき下記の内容を実施計画書に加えてください
(ア) 臨床試験の実行にあたってgrade 4以上の副作用や死亡(すべての原因による)などが生じた場合は臨床試験実施責任者(その施設)とともに日本胸腺研究会事務局、日本胸腺研究会臨床試験安全委員会へ報告する(試験の中止、変更などは安全員会の指示に従ってください)。
(イ) 中間解析を行う試験にあたっては中間解析時点でのデータを日本胸腺研究会臨床試験安全委員会へ報告する(中間解析を行って試験を続行あるいは中止するかどうかは安全員会の判断によります)。
(ウ) 他臨床試験の実施にあたり予測されない事態が生じた場合は日本胸腺研究会事務局、日本胸腺研究会臨床試験安全委員会へ報告する。 - プロトコール委員会で実施計画書が認められれば御施設のIRBに提出して承認を受け、臨床試験を開始する(IRB審査に時間がかかることが予測されるため、実施計画書をプロトコール委員会と貴施設IRBに同時に申請し、プロトコール委員会での修正事項をあとで貴施設IRBに変更申請することが時間の節約になると思います)
- 同時にUmin Clinical Trial Registryに登録する(開始まえにほとんどの項目を入力しておくことが可能です)
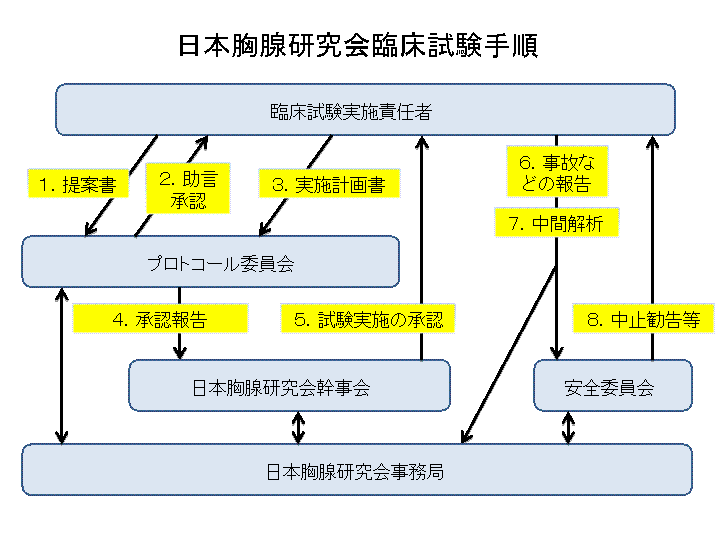
臨床試験フローチャート
日本胸腺研究会臨床試験安全評価委員会規則
- 本委員会は日本胸腺研究会臨床試験安全評価委員会(以下委員会)と称する。
- 目的
本委員会は日本胸腺研究会において行われる臨床試験の評価と監視を行い、主として試験に参加する患者の安全面から臨床試験の遂行、中止、変更などについて評価と助言を行うことを目的とする。中間解析が求められる場合は効果判定を行い、試験続行、中止などの助言を行う。 - 構成員、任期
本委員会は日本胸腺研究会の幹事以外の臨床試験の経験のある医師または医療関係者数名によって構成する。委員が日本胸腺研究会の主催する臨床試験に試験担当者として参加した場合は委員を辞する。委員の任期は2年とし再任を妨げない。 - 委員長
委員長は委員の互選によって選任する。 - 委員会の開催
委員会の開催は次の場合とする。
5.1 委員長が必要と認めたとき
5.2 日本胸腺研究会代表幹事の要請があったとき
5.3 未知の重篤な有害事象の発生など臨床試験の続行に関して重大な影響を及ぼす事態が
発生したとき
5.4 臨床試験に参加した患者に臨床試験との関係が否定できない死亡例が発生したとき
5.5 臨床試験の実施計画書による中間解析の評価が必要なとき - 持ち回り委員会
委員長は場合により手紙または電子メールによる持ち回り委員会によって議決することができる。 - 臨床試験中止に関する委員会の議決
委員会は必要と認めたとき出席者の全員一致をもって、文書をもって臨床試験の中止を求めることができる。 - 臨床試験に関する委員会による助言
委員会は出席者の多数をもって日本胸腺研究会の臨床試験の実施方法の変更や中止について助言を行うことができる。
近藤晴彦(静岡県がんセンター呼吸器外科)、多田弘人(大阪市立総合医療センター呼吸器外科)
日本胸腺研究会臨床試験プロトコール委員会規則
- 本委員会は日本胸腺研究会臨床試験プロトコール委員会(以下委員会)と称する。
- 目的
委員会は日本胸腺研究会において行われる臨床試験の計画にあたり、実施計画書などを審査して、試験の実施が安全に、また科学的、倫理的に妥当と認められる方法で行われるようにすることを目的とする。 - 構成員、任期
委員会は臨床試験の経験のある医師または医療関係者数名によって構成する。委員が臨床試験の実施計画書作成に関わった場合はその臨床試験の審査に加わることができない。委員の任期は2年とし再任を妨げない。 - 委員長
委員長は委員の互選によって選任する。 - 臨床試験の審査
日本胸腺研究会での臨床試験を計画するものは、実施計画書、症例報告書、患者への説明書の案を作成し、日本胸腺研究会代表幹事および委員会委員長に提出し委員会の審査を経なければ試験を開始することができない。 - 審査の内容
委員会は申請された臨床試験について下記の項目について審査する。
1)試験によって期待される結果が当該疾患の診断・治療などにとって有意義であるか
2)実施計画書などが科学的、倫理的に妥当であるか
3)試験が安全に施行される体制があるか
4)試験に参加する患者に著しく不利とならないか
5)試験の予定参加者の数が充分で有意義な結論がでるだけの統計的Powerをもっているか - 持ち回り委員会
本委員会は場合により手紙または電子メールによる持ち回り委員会によって議決することができる。 - 臨床試験に関する委員会の承認
日本胸腺研究会の臨床試験を承認するには委員の過半数の賛成を必要とする。委員会が臨床試験の実施を承認した場合は直ちに日本胸腺研究会代表幹事に報告する。 - 臨床試験に関する委員会による助言
委員会は出席者の多数をもって審査中の臨床試験の実施方法の変更について助言を行うことができる。
日本胸腺研究会臨床研究手順
日本胸腺研究会参加施設による臨床試験を計画しているものは次の手順にしたがって日本胸腺研究会臨床試験プロトコール委員会(以下プロトコール委員会)および日本胸腺研究会幹事会の承認を得ること。- 臨床研究提案書(Proposal)の提出
臨床試験を計画するものは実施計画書を作成する前に、下記の項目を明らかにした提案書をプロトコール委員会に提出する。提案書は実施計画書のように細部にわたる必要はない。
a.臨床試験を計画するにいたった背景
過去に行われた臨床試験などの論文のReviewとともに問題点を明らかにすること。
b.臨床試験の目的、その性格
何をどこまで明らかにするか。
Primary endpoint、Secondary endpoint
Phase I, Phase II, Phase IIIのいずれに該当するか。
優位性の証明、非劣性の証明のいずれを目指しているか。
c.方法
1)研究代表者
2)研究を統括する施設
3)Inclusion criteria、Exclusion criteria
4)目標症例数
5)Randomizationの有無
6)Double blind/Blind/Openの別
7)治療(Intervention)の内容(観察研究の場合は不要)
8)観察(検査)項目、頻度
9)検定方法、必要症例数の概算とその根拠(生物統計家に相談することが望ましい)
10)試験参加の意思を表明している施設のリスト、必要症例数が達成される見込みと必要な期間
11)中間解析を行うかどうか
12)中止基準を設けるかどうか
13)倫理的な問題の有無(会社などとのConflict of Interestも含め)
d. 予測される結果とそれが研究対象疾患の診断、治療などに与える影響
- プロトコール委員会での提案書の審議
プロトコール委員会は提出された提案書に基づき、その臨床研究の実行が妥当かどうかを審議し、必要な助言を行う。プロトコール委員会は委員会に提案者の出席を求めることができる。プロトコール委員会はその出席者の多数をもって提案書を承認する。 - 日本胸腺研究会幹事会での承認
プロトコール委員会が妥当と認めた臨床試験の提案書が日本胸腺研究会の幹事会で認められれば、日本胸腺研究会幹事会は提案者に対し、実施計画書の作成とプロトコール委員会への正式申請を許可する。幹事会は提案書の承認に関する審議を持ち回りで行うことができる。 - プロトコール委員会での実施計画書の審議
プロトコール委員会は提出された実施計画書を日本胸腺研究会臨床試験プロトコール委員会規則にもとづいて審議する。 - 日本胸腺研究会幹事会での承認
プロトコール委員会にて承認された臨床試験は直ちに日本胸腺研究会代表幹事に報告される。代表幹事は直ちに幹事会あるいは持ち回り幹事会にてこれを審議する。 - 臨床試験のIRB承認
臨床試験の研究代表者はプロトコール委員会および日本胸腺研究会幹事会で認められた臨床試験を所属施設のIRBに提出してその承認を得る。 - 臨床試験の登録
研究代表者はプロトコール委員会の承認が得られた臨床試験をUminのCTRあるいはClinicaltrial.govに登録する。 - 臨床試験の開始
研究代表者者は臨床試験の日本胸腺研究会会員にホームページなどで周知し、試験を開始する。
| 委員(敬称略) | ||
| 委員長 | 九州がんセンター呼吸器科 | 瀬戸貴司 |
| 委員 | 近畿大学 | 岡本勇 |
| がんセンター東病院 | 後藤功一 | |
| 大阪大学呼吸器外科 | 奥村明之進 | |
| 徳島大学 | 近藤和也 | |
| 統計相談役 | 九州がんセンター 臨床研究部 | 山中武春 |

