胚細胞腫瘍 germ cell tumors
- 頭蓋内原発(脳)胚細胞腫瘍の病理はすごく複雑です
- 治療はこの病気にとっても詳しい専門家にしかできません
- 平均年齢は15歳くらいで子供に多い腫瘍です
- 90%が20歳未満に発生します
- 下垂体,視床下部,松果体という場所にできます
- ジャーミノーマが7割くらいで最も多いです
- ついで,混合性胚細胞腫瘍,成熟奇形腫と未熟奇形腫です
- 成熟奇形腫以外は悪性腫瘍です
- 診断はMRIでほとんどわかります
- 血液の中のAFPとHCGという腫瘍マーカーで悪性度が分かります
- 手術は,予想される病理組織型によって全く違う計画になります
- 悪性度が高いタイプでは髄液にのって脊髄に播種(転移)することがあります
- 化学療法を用いるので,基本的に小児科病棟で治療する疾患です
- AFPやHCGがとても高い値で悪性度が高い腫瘍は,まず放射線と化学療法をしてから残った腫瘍を手術で取り除きます(生塩博士の考え)
- 日本での化学療法(制がん剤)は,CAREあるいはICE化学療法というのが多いです
- 放射線治療のかけかたは,病理組織によって全く違ってきます
- 播種しやすい腫瘍では全部の脳と脊髄に放射線治療をしなければならないことがあります
- 後遺症は手術と放射線できまりますから,それをできる限り低侵襲に押さえるのが治療のコツです
- 内分泌(ホルモン)障害を持つ患者さんが多いので内分泌の専門家に診てもらう必要があります
- 尿崩症,GHDなどの内分泌障害がある場合に,MRIで視床下部下垂体に腫瘍が見えないことがあります,それはジャーミノーマです,occult germinomaといいます
- 水頭症を改善するのには様々な方法がありますがシャント手術をしないコツがあります
- ちなみに澤村はこの腫瘍の研究で米国脳神経外科学会のマハレー賞をもらいました(^O^)
- 地域差があり,アジア人の発生頻度は欧米人の数倍です
2021年WHO分類:大まかな治療方針
上から順番に治りやすい腫瘍です,下線をクリックするとそれぞれのページに飛びます
成熟奇形腫 mature teratoma
手術で完全摘出すれば治ります,逆に放射線治療も化学療法も効きません、外科医の高度な技術が求められます
胚腫 ジャーミノーマ germinoma
できれば生検手術を行って病理診断をして,化学療法をしてから低線量全脳室照射します、それで治ります
未熟奇形腫 immature teratoma
病理診断をして,放射線化学療法をしますが,残った腫瘍を摘出しないと高率に再発(再燃)します、この群だけでも、低悪制度のものから高悪制度のものまであります、生検術のみでは判断できない悪性度があり、治療選択に苦慮します
混合性胚細胞腫瘍,mixed germ cell tumor
(奇形腫とジャーミノーマの混合型 teratoma mixed with germinoma)
どのような腫瘍が混じっているか,病理診断が最も大切です。混じっているものの中で最も悪性度の高い病理所見にあわせて治療計画を立てます。ジャーミノーマと未熟奇形腫の混合型が多いです
卵黄嚢腫 yolk sac tumor AFP産生腫瘍
AFPが非常に高いときは生検手術は必要ありません,とりあえず化学療法を1コースして化学療法反応性を見極めて,追加の化学療法や脳脊髄照射(局所追加照射)をしてから,残った腫瘍を開頭手術で全部取ります
悪性転化を伴う奇形腫 teratoma with somatic type malignancy
めったにない腫瘍です,手術摘出と放射線化学療法をしますが,高線量の局所照射が必要です
胎児性癌 embryonal carcinoma
これが疑われた時にはまず強力な放射線治療,それから化学療法が必要です,生存割合がとても低いのでできる治療は何でもします
絨毛癌 choriocarcinoma
純型はものすごく珍しく混合性胚細胞腫瘍の一部像として見られることの方が多いです,HCGが数千から数万の値になります,これが疑われた時には強力な放射線治療と化学療法が必要です,生存割合がとても低いのでできる治療は何でもします
これらの腫瘍が混じっているものが多いのでとても複雑になります
悪性度の高い方の腫瘍に焦点を当てて治療法を選択します
ジャーミノーマを除けば,大部分が混合性胚細胞腫瘍という診断になります
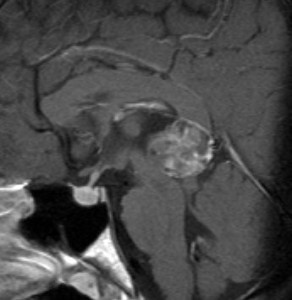
14歳の少年に発生した松果体未熟奇形腫です
AFP 130ng/ml, HCG-beta 30mIUでした
化学療法はICE (CDDP, VP-16, IFO)
放射線治療は全脳室と局所照射
奇形腫なので,放射線化学療法の後で残った腫瘍には,開頭手術で全摘出が必要です
全般的に小児脳腫瘍の治療研究体制は欧米に遅れていますが,東南アジアでの胚細胞腫瘍の発生頻度は欧米の3から5倍にあたるために,治療に関しては日本が欧米をリードしています。私もこの腫瘍に対してはたくさんの論文を書きました
腫瘍マーカー 血液と髄液の AFP と HCG
- 高いレベルのAFPは,卵黄嚢種から産生されます
- 胎児性癌と未熟奇形腫でも低レベルのAFPが測定されます
- 極めて高いレベルのHCGは,絨毛癌の存在を示します
- 胎児性癌でも高レベルのHCGが検出されることがあります
- ジャーミノーマは,低レベルのHCGを産生します
- 治験において,ジャーミノーマのカットオフレベルは,AFPで10-25 ng/ml,HCGで50-100 IU/Lと仮定されることがあります
- 病理診断や治療方針を分けるAFPとHCGのカットオフレベルは明らかではありません
ジャーミノーマ(胚腫)germinomaはここをクリック
診断と治療はとても難しいです,ジャーミノーマがほとんどなので,まずジャーミノーマのところを読んで勉強して下さい,その後にもどって下の項目を読んでください
治療選択のための分類
胚細胞腫瘍といってもいろいろな腫瘍の集まりですから,WHO病理分類によって適切な治療方針を決めるさえ難しいです。治療法のおよその選択のために,組織型によって予後良好群,予後中間群,予後不良群の3群に分類して「およそ」の目安としました。
この分類は1995年に澤村が世界で初めて作成したものです。当時のImpact Factor 5.3のCurrent Opinion in Neurologyにきちんと英文発表していますので確かめてください (*^o^*)
原著の発表からもう20年以上たちますのでmodificationしています。2022年時点では,この分類よりさらに細かく分けて考えて治療法を選択するべきだと考えています。
Sawamura Y: Current diagnosis and treatment of central nervous system germ cell tumors. Curr Opin Neurol 419-423, 1996
- 1. 予後良好群 Good Prognostic Group
- germinoma (elevated serum HCG-beta < 100mIU)
- mature teratoma
- 2. 中間群 Intermediate Prognostic Group
- immature teratoma
- mixed germ cell tumors consisted of germinoma with either mature or immature teratoma
- 3. 予後不良群 Poor Prognostic Group
- embryonal carcinoma
- yolk sac tumor
- choriocarcinoma
- immature teratoma with high malignancy
- mixed germ cell tumors including a component of embryonal carcinoma, yolk sac tumor, choriocarcinoma, or teratoma with malignant transformation
- teratoma with malignant transformation including a component of such as squamous cell carcinoma, adenocarcinoma, or other sarcomas
-
予後良好群
- 胚腫(ジャーミノーマ)と成熟奇形腫です
- 80-90%の10年生存割合が期待できる群ですから,治癒を目指すとともに治療後遺症をできうる限り最小限度となるような治療方針を作成します
- ジャーミノーマは胚細胞腫瘍の約70%を占めますから,成熟奇形腫を入れると4分の3くらいになります
- また15歳をピークとして思春期に多い腫瘍ですが,奇形腫は5歳以下の小児にも稀ではありません
- 成熟奇形腫は,開頭手術による摘出のみが治療方法で他の治療選択肢はありませんから,脳神経外科医の手術技術だけがたよりです
- かつてジャーミノーマの標準治療は,全脳室あるいは全脳脊髄を含む領域に腫瘍線量として45~55Gyを用いるものでした。この大量の放射線を使う治療法では,長期生存例において精神発達遅滞(知能低下・認知機能の低下),間脳下垂体機能障害,放射線誘発二次腫瘍,脳主幹動脈閉塞などの遅発性放射線障害の発生が問題となりました
- ジャーミノーマは化学療法への感受性が非常に高くて,組織診断確定後に化学療法を行えば,大きなものであっても例外なく腫瘍はほぼ消失します
- でも,化学療法単独治療ではかなり高頻度に再発が起ってしまいます
- MRIで一見したところ限局性腫瘍に見えますが,病理組織学的には脳室壁などにかなり広範に浸潤 脳室上衣下浸潤 subependymal infiltration しているので少なくとも全脳室領域 whole ventricle に照射野を設定する必要があるということがはっきりしてきました
- 生検術で組織診断を確定した後に,カルボプラチンとエトポシドを用いるCARE化学療法か,ICE化学療法を3コース行ってから全脳室系に低線量照射(24Gy/12分割あるいは25.2Gy/14分割)をします
- 松谷班の発表では,追跡期間中央値5年の時点にて治療評価可能な130例において,無増悪生存割合91%,全生存割合98%という良い成績を出し,さらにこのうち120例(86%)が社会復帰をしています (ほんとかなーー?? こんなに高くないかも–??)
-
予後中間群
- 5年生存割合は70%程度です
- 未熟奇形腫と治りやすいタイプの混合性胚細胞腫瘍(ジャーミノーマと成熟あるいは未熟奇形腫との混合型のみ)です
- 悪性度の高い未熟奇形腫は時として髄液播種などもしますから安易に考えて治療を進めないほうがいいです
- 長期でみれば30%が死亡するというのはおそらく悪性度が高いタイプの未熟奇形腫のためで,未熟奇形腫にはさまざまな悪制度のものがあるということを念頭に治療を進めていきます
- かつて,ジャーミノーマの病理組織診でみられるHCG陽性巨細胞を含むものを germinoma with STGC (germinoma with syncytiotrophoblastic giant cells)として予後中間群に分類していました,それ以外をpure germinomaと呼びました,1990年代までは,HCGを産生するジャーミノーマが再発しやすいと信じられていたからです。しかし,多少HCGが高値を示すジャーミノーマはきちんとした治療ができれば再発割合は高くないということも判りました。ですから,2000年ころからは全てのgerminomaは予後良好群となりました
- 予後中間群には軽度の血清AFP上昇例(数百ng/ml)も含まれます。低悪性度の未熟奇形腫がAFPを産生するからです
- 放射線化学療法後に残る奇形腫は,可能な限り開頭手術で全摘出します second look surgery
-
予後不良群
- 胚細胞腫瘍の10%以下で珍しいものです。死亡割合がとても高い群です
- 機能予後の損失(ある程度の後遺症)よりも生命予後に重点をおいて,個々の患者において与えられる限りの初期治療をします
- 生検術や腫瘍摘出手術のリスクは高いです
- 松果体や視床下部という深部にあり脳組織に浸潤し,かなりの腫瘍出血を伴いますから全摘出できるものではありません
- 胎児性癌,卵黄嚢腫,絨毛癌など致死率が高い予後不良群で,HCG-betaあるいはAFPという腫瘍マーカーがかなりの高値を示す例では,手術摘出や生検術なしで放射線化学療法を開始することも多いです
- これらのマーカーが極めて高値の場合には,生検手術をせずにまず放射線化学療法を先行させて,腫瘍が小さくなったところで全摘出します(これは熊本大学にいた生塩先生が提案した治療法です)
- また,手術で取り残した残存腫瘍が病理診断をまっている2週間くらいの間に増大してしまうこともありますから,初段階治療としては積極的な手術摘出はしません
- さらに,手術で腫瘍を崩せば腫瘍細胞が髄液中に散って,髄液播種を誘発します
- AFPが1000ng/mlを超える腫瘍では,通常化学療法を開始して大量化学療法を用いることがあります
- 何れにしても強力な化学療法と放射線治療をしなければ助からないので,生検による病理組織診断や摘出術そのものに意義が見出せないのです
- 手術による播腫(転移)の誘発を防ぐという利点がありさらに,neo-adjuvant chemoradiaiton therapyによって出血の減少と腫瘍の縮小で最終的な腫瘍摘出術を容易にするのも目的です
- 私は予後不良群に,イホスファミド,シスプラチン,エトポシドを用いるICE化学療法を使用してきました
- 放射線治療は,脳脊髄照射と腫瘍局所照射を用います
- 脳脊髄照射は,限界量に近い36グレイが用いられますが,ここの症例によって減量されることも多いです
化学療法
CDDP シスプラチンか CBDCA カルボプラチンを基剤とした併用化学療法が用いられれます。エトポシド,シクロフォスファミド,イフォスファミドが多くのレジメンで併用されます。
再発例や初期治療に抵抗性の高悪性度腫瘍には,チオテパ,エトポシド,カルボプラチンを用いる大量化学療法が使用されることがありますが,治癒割合は低いです。
ICE化学療法
ICE化学療法の効果はJ Clin Oncolという権威ある雑誌に発表していますので見てください。Aoyama H, Sawamura Y, et al.: Induction chemotherapy followed by low-dose involved-field radiotherapy for intracranial germ cell tumors. J Clin Oncol 20: 857-865, 2002。
注意していただきたいのは,胚細胞腫瘍に対するオリジナルのICE化学療法というのはシスプラチンを使用するものであって,カルボプラチンは使いません。もっとも早期の原著は,1998年にJ Neurosurgという米国脳神経外科学会の機関誌にきちんと発表しています。
このレジメンでは,シスプラチンを1日 20mg/m2で5日間使用します。高濃度のシスプラチン投与とならないので,腎毒性や聴毒性はかなり低いものです。3−4コース以内にであれば,遅発性有害事象はほとんど問題とならないです。1日あたりのシスプラチン投与が多いレジメンを用いるとと,カルボプラチン使用よりも有害毒性は高くなります。尿崩症を合併するときには,デスモプレッシンで尿崩症をコントロールしながらhydrationをします。5日間分割投与レジメンなのでhydrationは必要ですが,hyper-hydrationは必要がないということを理解して用いてください。
手術
- 外科的干渉は,診断と治療の目的をはっきり分けて判断します
- ジャーミノーマであれば生検術のみ,これは診断です
- 成熟奇形腫であれば,開頭手術による完全摘出が初回手術となります,これは治療です
- 手術前診断で,成熟奇形腫とジャーミノーマが混じっている混合性胚細胞腫瘍では,開頭手術で全摘出して,病理診断を慎重に行います,その後にジャーミノーマに焦点をあてた治療をおこないます,これは成熟奇形腫に対する根治治療とジャーミノーマに対する診断となります
- 腫瘍マーカーが高値の場合は生検手術さえしないケースが多いです
- 例えば,AFPが6,000を超えていたら,生検術もしません,まず卵黄嚢腫として放射線化学療法を開始します
放射線治療の照射野(領域)
IF-RT involved field radiotherapy 局所照射
腫瘍のある部位だけに限局した照射です,一連の治療後にわずかに部分的に残った腫瘍に追加照射するときなどに用いられます。摘出できない成熟奇形腫や悪性度の低い奇形腫には定位放射線治療を用いて行います
WVI whole ventricular irradiation 全脳室照射
ジャーミノーマに用いられます
WBRT whole brain radiation therapy 全脳照射
大脳基底核ジャーミノーマに用いられます,側頭角から再発するから HA-WBRT (hippocampus-avoidance whole-brain radiation therapy)は用いません
CSI craniospinal irradiatioin 脳脊髄照射
高悪性度胚細胞腫瘍に用いられます。胎児性癌,絨毛癌,卵黄嚢種,高悪性度未熟奇形腫,他の癌や肉腫を含む奇形腫,髄液播種が確定的なジャーミーノーマヤ未熟奇形腫
分類と治療アルゴリズム
- 胚細胞腫瘍の病理,マーカー値,発生部位,年齢,腫瘍サイズ,髄液播種の有無,脳室壁浸潤の程度によって必要な治療方法と,加えることの可能な放射線線量はかなり異なってきます。複雑すぎて,胚細胞腫瘍の治療選択肢のアルゴリズムは書くことができません。
-
米国での臨床試験による誤謬
- 米国では頭蓋内胚細胞腫瘍を,germinomatous germ cell tumors (GGCTs) と nongerminomatous germ cell tumors (NGGCTs) に分けてなんでも考えます。ジャーミノーマとそれ以外の胚細胞腫瘍といいう意味です。ここでは,ジャーミノーマ以外の2-3割を占める胚細胞腫瘍を一緒くたにして治療方針が立てられます。なぜなら登録症例が少ないとまとまった成績が出ないからです。母集団数を大きくするためにひっくるめるヽ(゚Д゚;)ノ!! 例えば,ジャーミノーマと成熟奇形腫というとても治りやすい混合性胚細胞腫瘍も,胎児性癌と卵黄嚢腫を含む未熟奇形腫からなる混合性胚細胞腫瘍も同じ群になります。そんな馬鹿な—-(ノ゚ο゚)ノ オオオオォォォォォォ-.
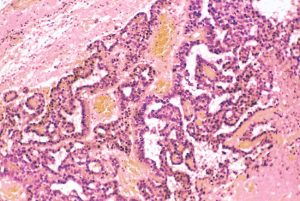
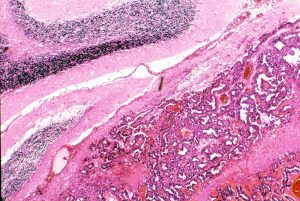
卵黄のう腫 yolk sac tumor AFP産生腫瘍
- yolk sac tumorは,胎生初期の卵黄嚢 (embryonic yolk sac)を囲む胎生内胚葉 (embryonic endoderm)由来の腫瘍と考えられています
- 稀な腫瘍であり,視床下部よりも松果体に好発する傾向があります
- 純粋型はとてもまれです
- 血液中あるいは髄液中のAFPが1000ng/mlを越え,時には数万の値をとることもあります
- 未熟奇形腫の中にこの組織型が混在する,混合性胚細胞腫瘍の一部として見られることが多いです
- AFPが1000ng/mlを越える混合性胚細胞腫瘍あるいは未熟奇形腫は,どこかにyolk sac tumorの組織像が部分的に混在することと考えて治療します
- 髄液播種する性質がありますから,MRIのT1強調ガドリニウム増強画像にて,全脳脊髄を検索する必要があります
- 発症1年以内の死亡率は高いです
- ですから,強力な放射線治療と化学療法が欠かせません
- 生検術による確定診断をまず考慮しますが,AFPがかなりの高値であれば病理診断なしで治療に踏み込むことも多いです
- 治療効果は血中のAFPを測定することで的確に判断されます
- AFPの値が正常化しても,MRIで腫瘍サイズの縮小が見られないときには,teratomaとの混合腫瘍を疑うべきです
- 高悪性度胚細胞腫瘍の中では,化学療法反応性は高いと言えます
- 術前化学療法 (neoadjuvant chemotherapy)や術前照射を行って腫瘍サイズを縮小させてから,腫瘍の全摘出を行うという手段も有効です
- AFP産生腫瘍細胞は,HCG産生性のchoriocarcinomaやembryonal carcinomaと比べて,比較的高い放射線化学療法感受性を有しています
- 長期生存例の報告は多いです
- 髄液播種で発症した例や播種が制御できなかった例では,患児は高率に死の転帰をたどります
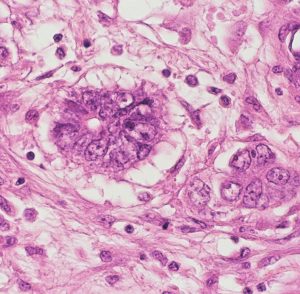
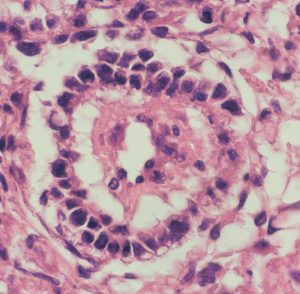
組織学的には,円柱様ないし楕円形の上皮様細胞の網状配列構造を示す腫瘍であり,一部にSchiller-Dubal bodyと呼ばれる血管周囲に集族する特徴的な細胞配列が見られます。これは,一層あるいは多層の上皮様細胞が,中心となる血管をやや離れて取り囲むように並ぶ構造です。また,PAS陽性の好酸性球状体が見られAFPが強陽性となります
絨毛癌 choriocarcinoma
大まかなこと
- とてもめずらしい悪性腫瘍です
- 頭痛や嘔吐,おしっこがたくさん出て水をたくさん飲む,小さい子供なのに性早熟するなどでみつかります
- 血液の中のホルモン HCG エイチシージー human chorionic gonadotropin ヒト絨毛性ゴナドトロピンというのがとても高い値になります
- HCGが1,000を超えたときには疑うべきでしょう
- 純粋な絨毛がん choriocarcinomaは,頭蓋内胚細胞腫瘍の中で最も稀な腫瘍です
- 混合性胚細胞腫瘍 mixed germ cell tumorの部分像として見られることの方が多いです
- 未熟奇形腫でもHCGが1,000程度に上昇しますので,HCGが高くても絨毛がんと断定できません
- 未熟奇形腫と絨毛がんでは治療も予後もかなり異なりますので注意!
- 男児に多く発生します
- 約4分の3が松果体原発腫瘍です
- 腫瘍内出血で急激で高度の頭痛,あるいは突然の意識障害となることもあります
- 治療は,放射線,制がん剤,開頭手術であらゆる可能な限りの手段をつくします
- でも長期生存率はとても低くて10%以下です
症状
- 松果体腫瘍は水頭症による頭痛と嘔吐,視床下部腫瘍は尿崩症で発症します
- 腫瘍内出血で発症したり,あるいは治療中に出血で症状の悪化を見ることも多いのが特徴です
- この場合には,脳卒中のような急激な症状の悪化を生じます
- 視力視野障害や皮膚の色素沈着などみることもあります
- 血清中HCGが高値となるために思春期早発症で発症した報告も散見されますが,みな男児です
診断
- 検査所見で最も重要な点は,血清あるいは髄液中のHCGが極めて高値を示すことです
- 血清中HCGは10,000 mIU/mlほどにもなります,髄液中では数百という値です
- CTとMRIをします
- 腫瘍の内部で出血を生じているのが最大の特徴です
- 腫瘍周辺浮腫は強いです
- 血管に富むですからMRA, CTAで腫瘍血管と腫瘍濃染像が見られます
- 脳血管撮影 DSAを行わなくても結果は見えていますのでしません
- 若年成人男性あるいは男児の松果体か視床下部に発生した腫瘍で,腫瘍内出血を伴いHCGが1,000 mIU/ml以上の高値を認める場合には絨毛がんを強く疑います
- 一つの胚細胞腫瘍に,germinoma, teratoma, choriocarcinoma, embryonal carcinomaがすべて混在する例もありますので,腫瘍のごくわずかな部分しかとれない時の病理診断は慎重に考えます
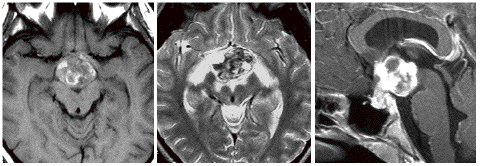
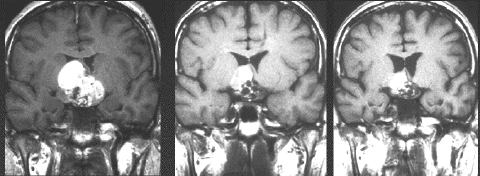
女児の視床下部に発生したchoriocarcinomaのMRI:T1強調像(左側)では腫瘍内出血が高信号域として捉えられ,T2強調像(中央)では視索から大脳基底核,中脳の腫瘍周辺浮腫が見られます。ガドリニウム増強像(右側)では,視床下部からトルコ鞍へ伸展する不均一な腫瘍部分増強を認めます。悪性度の高い胚細胞腫瘍の特徴的なMRI像といえます。血清HCG-betaは20,000 mIU/mlを超える値であり,検査値のみでchoriocarcinomaといえるような典型例でした。
注意
- 純粋な絨毛がん,あるいは絨毛がんの要素が大部分を占める混合性胚細胞腫瘍(HCGのレベルが1,000を超える)は,難治性でほとんど助からないと考えます,ですから治療の副作用を考えないでなんでもします
- しかし,未熟奇形腫や混合性胚細胞腫瘍の一部分だけ,絨毛がん組織がわずかに混じるものは治る確率が高い腫瘍と言えます,ですから高線量照射による認知機能低下(高次脳機能障害)が高度にならないように,放射線照射野と線量を可能な限り抑えて治療します
治療
- 確立されたあるいは信頼に足る治療法は文献を探してもありません,手探りでします
- 共同研究でnon-germinomatou germinomaとか,混合性胚細胞腫瘍とか,予後不良群廃細胞腫瘍とかのプロトコールがありますが,それはなにも超難治性とも言える絨毛がんを目的としたレジメンではないのであてにはなりません
- 治療関連有害事象をあまり考えずに,生命予後を第一義に考慮して,完全緩解導入を目的とした密度の高い初期治療計画を立てるべきです
- HCGが数千-10,000を超えるような時には病理診断の必要がないので,診断あるいは腫瘍減荷の目的での外科手術という手段は不要です
- 化学療法も放射線治療もしないで,開頭手術で摘出に入ると,ものすごく出血して収拾がつかなくなります
- また,完全摘出することは不可能で,外科手術で治癒するものではありません
- ですから放射線化学療法の開始を急ぐためにも,初期治療で侵襲的な開頭術をする意味がありません
- どのような化学療法を用いても,放射線治療は欠かせません
- 脳脊髄照射と腫瘍局所照射をします
- 腫瘍線量は膠芽腫相当の60Gyがほしいのですが,視床下部にはそのような大きな線量は使えません
- 導入化学療法は,cisplatin, carboplatin, etoposide, ifosfamide, bleomycine, vinblastineなどが用いられます
- 子宮に発生する絨毛癌には多剤併用化学療法が有効で長期生存割合も高いのですが,頭蓋内原発絨毛癌に同じ治療はできません
- 対して,genitourinary tract (尿路性器癌)としてのrefractory germ cell tumor 高悪性度(化学療法抵抗性)胚細胞腫瘍への化学療法は伝統的に頭蓋内悪性胚細胞腫瘍へ応用されてきました
- シスプラチンを基剤とする併用化学療法ですが,代表的なものに,BEP (bleomycin, etoposide, cisplatin) 4コースなどがあります
- 1990年代から日本ではICE (ifosfamide, cisplatine, etoposide)化学療法 6コースが最も広く用いられてきました
- 近年は,末梢血幹細胞救援を行う大量化学療法が行われることが多いです
- それでも長期生存例の報告はほとんどありませんので,大量化学療法の真の有用性はいまだ不明と言えます
- 尿路性器の絨毛がんと同様の考え方ですが,放射線化学療法の後で腫瘍が残存している場合には,開頭手術で摘出します (second-look surgery)
- 寛解が得られず進行したときあるいは再発を認めたときに有効な治療手段はありません
- 髄液播種が生じた場合も救命の手段はありません
予後
- 純型の頭蓋内原発絨毛癌の予後は不良で,生存例は症例報告として稀に記載される程度です
- 寛解導入できても短期間のうちに再発をみる可能性は極めて高いといえます
- HCGの値とMRIで経過観察します
- 悪性度の高い胚細胞腫瘍に対する強力な補助療法は,患児に大きな精神的・身体的負担を与えます,退院後の復学のための精神面でのケアが大切です
- 放射線治療による遅発性認知機能低下,腫瘍あるいは治療合併症としての視床下部下垂体障害,化学療法に起因する原発性性腺機能低下症や2次癌(白血病の発症)など考慮しながら経過を見ます
病理
- trophoblastに由来する悪性度の高い腫瘍であり,syncytiotrophoblastやcytotrophoblastが混合する異型細胞増殖からなります
- synchtiotrophoblastは,抗HCG抗体を用いる染色で濃染します
- 多くの核分裂像を含み,血管に富む易出血性の腫瘍であり,腫瘍内には新旧の出血巣や壊死が認められます
視床下部に発生したchoriocarcinomaの病理像(左からHE染色, HCG染色, PLAP染色):腫瘍の大部分にHCG陽性細胞が認められますが,一部ではPLAP陽性のgerminoma細胞様の腫瘍細胞も散見されます。
妊娠によって生じる胎盤由来の絨毛癌 gestational trophoblastic disease (GTD)
性腺原発(子宮胎盤)の絨毛がんが脳転移を来す頻度は,脳原発絨毛がんの発生頻度を遙かに上回るために,女性で頭蓋内絨毛がんの診断を得た場合には,脳原発腫瘍よりも転移性脳腫瘍を考えます。視床下部,松果体,大脳基底核以外の絨毛がんは転移性です。逆に稀ですが, 脳原発絨毛癌のうち約1/3が肺に転移します。ほとんどの絨毛がんは妊娠性ですが,化学療法で90%くらいに寛解が得られます。でも脳転移を生じると治療が成功することはほとんどありません。
choriocarcinoma syndrome
絨毛癌の転移巣からの重篤な出血のことを言います。同時に,HCG-betaの高度の上昇が生じます。脳に転移した絨毛癌はこのような病態で発症します。
胎児性がん embryonal carcinoma
- embryonal carcinomaは,胎生初期のembryonic ectoderm (胎生外胚葉) のembryonic pluripotential stem cellが癌化した細胞配列に類似した組織形態をとる悪性腫瘍とされています
- 極めて稀に純粋な脳原発のembryonal carcinomaの報告があという程度の頻度です
- 中枢神経系においては睾丸に発生するような純粋なembryonal carcinomaの診断を得られることはほとんどありません
- 神経組織に浸潤性増殖をし,出血や壊死像を含み多数の核分裂像を有し特徴的な細胞配列を示さないことも多く,immature teratomaの悪性型やchoriocarcinomaと混在することがあります
- CK(cytokeratin),PLAP,AFP,HCGは,部分的に陽性所見を示すことがあります
- AFP強陽性の部分があれば,yolk sac tumorとの合併を考慮します
- 松果体に発生することが多く,腫瘍増大速度がかなり早く,MRIでは1週間ですごく大きくなったというようなことがあります
- 境界明瞭な腫瘍で,石灰化を伴うこともあり,T1強調ガドリニウム増強像では強く増強されます
- germinomaとの鑑別診断が難しいこともありますが,増大速度が全然違います
- 高率に髄液播種するので,embryonal carcinomaを疑ったときには必ず全脳脊髄を含むガドリニウム増強MRIを撮像します
- 髄液播種の出現と進行も早いので,治療経過中も脳から腰仙椎までを含むMRIを頻回に反復する必要があります
- 5年生存割合は10-40%とされています
- たとえ初回治療に成功して完全緩解を得たとしても高率に再発します
- 原発部位周辺脳への直接浸潤と髄液を介した転移で致死的経過をたどることが多いです
- 全脳脊髄を含む放射線治療と強力な化学療法をしますが,標準治療と言われるものはありません
- 病勢の進行が早いので,放射線照射は病理組織診断がつき次第早急に開始します
- 手術摘出の意義はほとんどありません
- また,放射線化学療法の後に小さな摘出可能病変が残存する場合には再手術を計画します
松果体部と視床下部に発生したmixed germ cell tumorの増強MRI(左側)。定位的生検術によりimmature teratomaとembryonal carcinomaの混じる病理像がみられました。1コースのICE化学療法と放射線治療 54Gy により腫瘍は著明に縮小し(中央),治療8ヶ月後には更に退縮している像が認められます(右側)。teratomaにおいて,放射線化学療法の後に腫瘍の完全消失を認めることはほとんどありませんから,残存腫瘍は摘出したいのですが,視床下部ゲ発生なので逡巡します。
松果体の胎児性がんです(左),播種して小脳表面に結節を作りました(右)
概論
- 胚細胞腫瘍 germ cell tumors は,小児期と青年期に,生殖器(精巣,卵巣)と体中心線に当たる部位,すなわち縦隔,後腹膜,松果体,神経下垂体部などに発生します
- primordial germ cells (原生殖細胞)を起原として発生する腫瘍であると考えられています
- 胎生初期にprimordial germ cellsは様々な臓器に分布しますが,なぜ縦隔と間脳松果体部(diencephalopineal region)において停留し腫瘍化するかは不明です
- 中枢神経系(頭蓋内)原発胚細胞腫瘍 (primary CNS (intracranial) germ cell tumors) は生殖器原発のものと較べると頻度はかなり低いです
- 性殖器あるいは他臓器に発生する胚細胞腫瘍とは,病理組織学的にも生物学的にもほぼ同様の性質を示します
- ですから,数の多い泌尿生殖器系統に発生した多くの悪性胚細胞腫瘍の治療を参考にして,頭蓋内胚細胞腫瘍の治療が発展してきました
- 特に悪性度の高い腫瘍 refractory germ cell tumorsに対しての化学療法が参考になります
- しかし大きな違いもあって,生殖器原発腫瘍が高頻度にリンパ節あるいは多臓器に転移することに対し,中枢神経系原発胚細胞腫瘍の最大の特徴は中枢神経外への転移が例外的なことです
WHOの分類 (2021年)
Mature teratoma 成熟奇形腫
Immature teratoma 未熟奇形腫
Teratoma with somatic type malignancy 悪性転化を伴うもの
Germinoma 胚腫 ジャーミノーマ
Embryonal carcinoma 胎児性癌
Yolk sac tumor 卵黄嚢腫瘍
Choriocarcinoma 絨毛癌
Mixed germ cell tumors 混合性胚細胞腫瘍
胚細胞腫瘍の発生頻度
中枢神経系胚細胞腫瘍の発生頻度は,東アジアでは欧米の3~5倍です。germinomaとmature teratomaを除けば純型は少なく,詳細に組織像を検討すればmixed germ cell tumorの頻度が高くなります。例えば,immature teratomaにgerminomaが混在する症例では,mixed germ cell tumorと病理診断されるべきであり,診断と治療は,germinomaとimmature teratomaの両者の性質を踏まえて行うことになります。また純粋なembryonal carcinoma,choriocarcinomaの頻度極めて低いものです。malignant teratomaとされるものの定義は明らかではありません。発生頻度と部位には性差があり,松果体原発腫瘍は男児に多く女児に少ないです。発生部位は,80%以上が第三脳室近傍すなわち,視床下部・下垂体後葉 (neurohypophyseal germ cell tumors) と松果体 (pineal germ cell tumors) の2つの部位に集中します。両部位に同時に発生する (synchronous tumor, bifocal tumor) ことはめずらしくありません。女児に発生するgerminomaは,視床下部に多く松果体部は極めて稀です。大脳基底核,視床,脳幹部,脊髄,小脳にも原発することがあります。
時を経て胚細胞腫瘍が中枢神経系に2度発生することがあり,これをmetachronous germ cell tumorと呼称します。例えば,小児期に松果体部teratomaが発生しそれが治癒し,10年を経て思春期に神経下垂体部にgerminomaが新たに発生する場合などです。このmetachronous germ cell tumor と再発との厳密な意味での鑑別は難しいです。
臨床症状
- 臨床症候は腫瘍の発生する脳の部位に依存しますが,それぞれの腫瘍型によっても若干異なります
- 松果体の胚細胞腫瘍の大部分は,第三脳室後方から中脳水道の閉塞による閉塞性水頭症を生じます。頭痛と嘔吐,軽度の複視,軽度の意識障害が初発症状となります。かつては高度の水頭症のためParinoud症候などを呈して入院する例もありましたが,最近では中脳被蓋の圧迫症状である眼球運動障害まで進行している例は少ないです
- 視床下部から下垂体後葉を発生母地とする胚細胞腫瘍は,多飲・多尿(中枢性尿崩症)で発症すること最も多いです。下垂体前葉まで腫瘍が浸潤すれば,成長ホルモンの分泌低下による低身長などの前葉不全で発見される例もあります。前葉不全による副腎機能低下で尿崩症が不顕化している場合は,副腎皮質ステロイドホルモンの補充で尿崩症が顕在化して尿比重が低下し尿量の著明な増加が生じます。高度の間脳下垂体不全でのナトリウム調節障害,意識障害,知能低下などの重症例も時に遭遇します。HCG産生腫瘍では,思春期早発症が初発症状となることがあります
- germinomaは本来浸潤性の腫瘍で,視神経交叉を侵すことがあり,視力・視野障害を合併していることも稀ではありません。視力が保たれている例においても,様々な視野欠損を呈する症例があるので,大きな腫瘍では視野検査は必ず行っておいた方がよいでしょう。また,germinomaは中枢神経組織を破壊性に浸潤して,視力・視野障害が不可逆性となるので,診断と治療を遅らせてはなりません。
- 大脳基底核の腫瘍は高次脳機能低下,錐体路障害による片麻痺,知的機能の障害,性格変化などを呈します。初期には局所症候に乏しいこともありかなり進行してからでないと発見されないことがあります。脊髄に生じたものでは横断性対麻痺や膀胱直腸障害もあり,視床や延髄などであればそれらの部位特有の局所症候で発症します。
血液・髄液検査
- 血液と髄液中のAFP (alpha-feto protein)とHCG-beta (human chorionic gonadotoropin-beta subunit) の測定をします。髄液検査は必須ではありませんが参考となります。これらの腫瘍マーカーを多く分泌するものほど悪性度が高い傾向があります。choriocarcinomaでのHCG-betaは10,000 ng/ml前後,yolk sac tumorでのAFPは4,000 mIU/ml前後とかなりの高値を示す腫瘍もあり,それだけで病理組織診断が不要となります。germinoma例でのHCG-betaは,精度の高い検査法を用いればほとんどの例で陽性(異常高値)となります。
- HCG-betaは必ずしも胚細胞腫瘍特異的ではなく,頭蓋咽頭腫などの鞍上部腫瘍でも例外的に陽性となる症例があることに注意しなければなりません。髄液中でのc-kit, PLAPの測定も病態と関連して胚細胞腫瘍の診断に有用です。HCG-betaの値は血清値よりも髄液中の方が高いのでできれば髄液の測定も行った方がよいでしょう。
- 髄液の腫瘍マーカー測定と伴に,髄液細胞診で腫瘍細胞の有無をみることもあります。しかしながら,この髄液細胞診は疑陽性あるいは偽陰性の頻度が高いので,安易に髄液播種と診断してはなりません。脳せき髄MRIで脳室系以外の脳せき髄表面に結節性病変が認められた時のみに播種転移と判断した方がいいでしょう。髄液中に明らかな腫瘍細胞の浮遊がある時には,放射線治療を全脳脊髄領域に拡大することが必要となります。
- 胚細胞腫瘍が間脳下垂体に発生した場合には,ほとんどの例で尿崩症や下垂体前葉障害を生じているので,負荷試験を含めた内分泌学的な検査が必要です。また,必要に応じて治療開始前からホルモン補充療法を行います。視床下部障害あるいは尿崩症に続発する低ナトリウム血症も治療中に生じることが少なくないので,電解質検査とその補正も念頭に入れます。例え松果体にのみ腫瘍が存在する例でも,MRIではみえない腫瘍 (occult germinoma) が神経下垂体部に存在することもあるので内分泌検査は全例に行われることが推賞されます。
画像診断
- 画像診断はMRIで行います。MRIでジャーミノーマを疑ったときに,初期診断ではCT検査をしてはなりません。CT検査を行うことでジャーミノーマ細胞が消失して,生検術での病理誤診を招くことがあるからです
- 病理像が様々であるため,その所見にも一定のものはありません。mature teratomaを除く全ての胚細胞腫瘍は髄液を介して髄腔内播種する可能性があるので,治療を開始する前には必ずガドリニウム像強を加えた全脳全脊髄のMRI診断を行ないます。ただし,teratomaにおける石灰化は診断的価値を有するために,MRIでteratomaを強く疑えばCT scanも行った方がよいでしょう。画像上での診断名で鞍上部 germinoma (suprasellar germinoma)という用語が長く使用されてきましたが,この用語は適切ではありません。灰白隆起,下垂体後葉や下垂体柄を含むneurohypophysisに発生するものが多く,neurohypophyseal germinomaと呼称するのが正しいです。
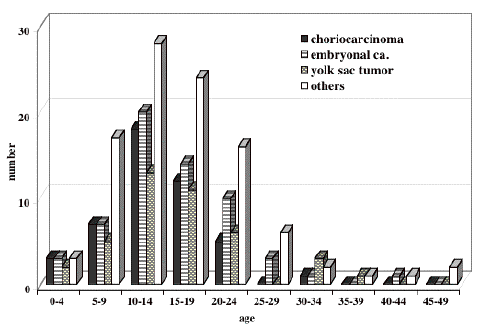
珍しい腫瘍型の年齢分布
下図に見られるように,embryonal carcinomaとyolk sac tumorとchoriocarcinomaの年齢分布は類似します。germinomaよりはいくらか年齢層が低いです。
文献情報
ヨーロッパでのコンセンサス
EANO, SNO and Euracan consensus review on the current management and future development of intracranial germ cell tumors in adolescents and young adults. Neuro Oncol 2021
診断から治療までのコンセンサスを概論しています。
放射線治療後の再発は放射線治療計画の不正確性ではない
A Phase 2 Trial of Response-Based Radiation Therapy for Localized Central Nervous System Germ Cell Tumors: Patterns of Failure and Radiation Dosimetry for Nongerminomatous Germ Cell Tumors. Int J Radiat Oncol Biol Phys. 2022
導入化学療法と手術によってCR/PRとなった患児に30.6Gyの全脳室照射と54Gyまでの腫瘍床照射がなされました。66例でこの治療が可能でした。脊髄6例,脳脊髄2例で再発が生じていましたが,それは放射線治療計画のミスのためではありませんでした。この66例の群の中に脊髄播種をする性質を有していた腫瘍があるためだとしています。
化学療法反応性をみて放射線治療を抑える
Fangusaro J: Phase II Trial of Response-Based Radiation Therapy for Patients With Localized CNS Nongerminomatous Germ Cell Tumors: A Children’s Oncology Group Study. Neuro Oncol, 2019
ジャーミノーマ以外の患者さんが6コースの化学療法 (CBDCA, VP-16, IFO/VP-16)を受けます。CRあるいはPRでsecond-look surgeryを受けた患者さんは,30.6Gyの全脳室照射と54Gyまでの局所照射が加えられます。その他の例では,36Gyの脳脊髄照射と54Gyの腫瘍床照射を受けます。年齢中央値11歳で107例の患者さんが治療を受けました。66例(62%)でCR/PRが得られ,3年PFSが88%, OSが92%でした。10例に再発が生じ,8例 (12%) で病勢進行しました。6例が脊髄播種,2例が局所再発と播種でした。
「解説」化学療法と残存腫瘍摘出に持って行けた患児に30.6Gyの全脳室照射と54Gyまでの腫瘍床照射は,そもそも放射線治療を減量 reduced RT しているとは言えません。この線量が全脳室と視床下部下垂体,視床に入れば,看過できない遅発性障害は残ります。組織型の詳細を分析すれば,over treatmentを受けた患児が多くいることでしょう。
導入化学療法と摘出手術を放射線治療前に行う
Goldman S, et al.: Phase II Trial Assessing the Ability of Neoadjuvant Chemotherapy With or Without Second-Look Surgery to Eliminate Measurable Disease for Nongerminomatous Germ Cell Tumors: A Children’s Oncology Group Study. J Clin Oncol 33: 2464-2471, 2015
ジャーミノーマ以外の胚細胞腫瘍に6コース18週間の導入化学療法 (交互にCBDCA/VP-16, Cycles 1, 3, and 5, IFO/VP-16, Cycles 2, 4, and 6)を行い,この導入化学療法後に残った腫瘍は積極的に摘出が行われました(second-look surgery)。CR/PR (65%以上の腫瘍サイズ縮小)となった患者さんには放射線治療 (daily 5 days a week for 5-6 weeks) がされました。PR 不完全奏効以下の例では,大量化学療法 consolidation chemotherapy (PBSCR, thiotepa/VP-16)を加え,その後に放射線治療が加えられています。
2002年から2008年に,年齢中央値12歳,102人の患者さんが治療を受けました。松果体が54%,鞍上部が24%です。導入化学療法のみで,69%の患者さんがCR/PRとなりました。5年無増悪生存割合は84%,全生存割合は93%でした。再発は16人で,7人が死亡しています。原発部位で10例の再発,遠隔再発が3例でした。画像所見がなく腫瘍マーカーで進行が確認されたものは2例でした。
「解説」確かに良い成績です。でもしかし,Histologically confirmed germinoma with elevation of serum/CSF beta human chorionic gonadotropin (HCG) levels greater than 50 mIU/mLが含まれています。この腫瘍群は,単なるジャーミノーマへの治療だけで治る可能性がある予後良好群です。これに対してかなりの強度の高い治療がなされています。また全員が放射線治療を受けていますが,知能予後にもっとも影響のある照射野の規定がはっきりしません。またさらに,45Gy-54Gyもの照射線量が用いられていて,長期生存を得た場合の2次腫瘍,認知機能低下,脳血管障害(動脈閉塞)などの可能性はとても高いものとなるでしょう。治療後10年生存した患児にの多くがとても困った状態になっていると予測されます。20年前からそうですが,欧米ではHCGの値がかなり低いgerminoma以外の胚細胞腫瘍をみんな一緒くたにして治療しようとします。そうしないと研究のための数 Nが集まらないのでしょうが,それでは長期生存した患児の社会的な自立が得られません。
注意して読まなければならない有名な論文
Kellie SJ, et al.: Primary chemotherapy for intracranial nongerminomatous germ cell tumors: Results of the Second International CNS Germ Cell Study Group protocol. J Clin Oncol 22: 846-853, 2004
20人の胚細胞腫瘍(germinomaを除く)の患者さんが,regimen A (CDDP, VP-16, CPM, BLM)とregimen B (CBDCA, VP-16, BLM)の化学療法を受けています。 完全寛解とならなかった患者さんで手術か放射線治療がなされました。
論文の要旨を読むと,評価できた17人の患者さんの内で16人 (94%奏功率) が有効 (CR/PR) になっています。6.3年の追跡期間中央値で20人中の14人(60%)が生存していました。5年全生存割合は75%,無増悪生存割合は36%です。
「解説」2004年に発表されていますが,1994年に計画された治療法の成績です。この論文に書かれている治療方針は現在では全く誤ったものと言えますので,この治療方針を模倣してはなりません。論文をよく読むと治療中と後の再燃(増悪)が20例中の14例(70%)にもなります。これらの患者さんでは予定された化学療法を継続せずに手術や放射線治療でrescueされているのです。明らかにここに書かれている化学療法のみでは腫瘍を抑えきれないです。死亡した6人の患者さんでは,3人(HCG/AFP異常高値)が放射線治療を受けておらず,1人(HCG>3000)が局所放射線治療です。14名の生存者の内で9人が放射線治療を受けています。このことは多くの患者さんで結果的には放射線治療を避け得ないということなので,最初から治療計画に組み込むべきです。この20例の中にはAFPが正常値でyolk sac tumorの組織診断であったり,組織診断がgerminomaの例も含まれていて,そもそも正確に診断されているかどうかも考えさせられます。
germinomaでさえ化学療法のみで放射線治療を加えなければ再発を抑制できないことは知られていますのに,さらに悪性度の高い胚細胞腫瘍群で,化学療法に反応すれば放射線を加えないという初期治療方針を立てることはできません。悪性度の高い胚細胞腫瘍には放射線治療を優先的に考慮しなければなりませんが,どの程度の脳脊髄照射(あるいは第3脳室照射)を用いるかということで,生存の質(認知機能の予後)が決まります。
文献
- Aoyama H, Shirato H, Ikeda J, Fujieda K, Miyasaka K, Sawamura Y: Induction chemotherapy followed by low-dose involved-field radiotherapy for intracranial germ cell tumors. J Clin Oncol 20: 857-865 2002
- Balmaceda C, Heller G, Rosenblum M, Diez B, Villablanca JG, Kellie S, Maher P, Vlamis V, Walker RW, Leibel S, Finlay JL: Chemotherapy without irradiation – a novel approach for newly diagnosed cns germ cell tumors – results of an international cooperative trial. J Clin Oncol 14: 2908-2915, 1996
- Balmaceda C, Modak S, Finlay J: Chemotherapy for the central nervous system germ cell tumors. (in) Intracranial Germ Cell Tumors. Sawamura Y, Shirato H, de Tribolet N (eds), Springer-Verlag, Wien, 1998, pp243-281
- Bamberg M, Kortmann RD, Calaminus G, Becker G, Meisner C, Harms D, Gobel U: Radiation therapy for intracranial germinoma: Results of the German cooperative prospective trials MAKEI 83/86/89. J Clin Oncol 17: 2585-2592, 1999
- Brain Tumor Registry of Japan (1969-1996), 11th edition, Neurol Med Chirur 43: 1-49, 2003 (Suppl)
- Calaminus G, Andreussi L, Garre ML, Kortmann RD, Schober R, Gobel U: Secreting germ cell tumors of the central nervous system (CNS). First results of the cooperative German/Italian pilot study (CNS sGCT). Klin Padiatr 209:222-227, 1997
- Chen LP, Cai SM, Fan JX, Li ZT: PEBA regimen (cisplatin, etoposide, bleomycin, and adriamycin) in the treatment of drug-resistant choriocarcinoma. Gynecol Oncol 56: 231-234, 1995
- Cho DY, Wang YC, Ho WL: Primary Intrasellar Mixed Germ-Cell Tumor With Precocious Puberty And Diabetes Insipidus. Child Nerv Syst 13:42-46, 1997
- de Wit R, Roberts JT, Wilkinson PM, de Mulder PH, Mead GM, Fossa SD, Cook P, de Prijck L, Stenning S, Collette L: Equivalence of three or four cycles of bleomycin, etoposide, and cisplatin chemotherapy and of a 3- or 5-day schedule in good-prognosis germ cell cancer: a randomized study of the European Organization for Research and Treatment of Cancer Genitourinary Tract Cancer Cooperative Group and the Medical Research Council. J Clin Oncol 19: 1629-1640, 2001
- de Wit R, Stoter G, Sleijfer DT, Neijt JP, ten Bokkel Huinink WW, de Prijck L, Collette L, Sylvester R :Four cycles of BEP vs four cycles of VIP in patients with intermediate-prognosis metastatic testicular non-seminoma: a randomized study of the EORTC Genitourinary Tract Cancer Cooperative Group. European Organization for Research and Treatment of Cancer. Br J Cancer 78: 828-832, 1998
- Freilich RJ, Thompson SJ, Walker RW, et al: Adenocarcinomatous transformation of intracranial germ cell tumors. Am J Surg Pathol 19: 537-544, 1995
- Furuhata S, Yamada F, Fukuda S, Otani M, Toya S: Mixed germ cell tumor of the basal ganglia: a case report. Surg Neurol 41:490-493, 1994
- Goldman S, et al.: Phase II Trial Assessing the Ability of Neoadjuvant Chemotherapy With or Without Second-Look Surgery to Eliminate Measurable Disease for Nongerminomatous Germ Cell Tumors: A Children’s Oncology Group Study. J Clin Oncol 33: 2464-2471, 2015
- Haddock MG, Schild SE, Scheithauer BW, Schomberg PJ: Radiation therapy for histologically confirmed primary central nervous system germinoma. Int J Rad Oncol Biol Phy 38: 915-923, 1997
- Hinton S, Catalano PJ, Einhorn LH, Nichols CR, David Crawford E, Vogelzang N, Trump D, Loehrer PJ Sr: Cisplatin, etoposide and either bleomycin or ifosfamide in the treatment of disseminated germ cell tumors: final analysis of an intergroup trial. Cancer 97:1869-1875, 2003
- Hinton S, Catalano P, Einhorn LH, Loehrer PJ Sr Kuzel T, Vaughn D, Wilding G: Phase II study of paclitaxel plus gemcitabine in refractory germ cell tumors (E9897): A trial of the eastern cooperative oncology group. J Clin Oncol 20:1859-1863, 2002
- Jennings MT, Gelman R, Hochberg F et al: Intracranial germ cell tumors. Natural history and pathogenesis. J Neurosurg 63: 155-167,1985
- Kawakami Y, Yamada O, Tabuchi K, Ohmoto T, Nishimoto A: Primary intracranial choriocarcinoma. J Neurosurg 53:369-374, 1980
- Kato T, Sawamura Y, Tada T, Murata J, Abe H, Shirato H, Fujieda K: Occult neurohypophyseal germinomas in patients presenting with central diabetes insipidus. Neurosurg Focus 5: 1-6, 1998
- Koyama S, Tsubokawa T, Katayama Y, Hirota H: Choriocarcinoma of the septum pellucidum: case report. Surg Neurol 35:478-482, 1991
- Ikeda J, Sawamura Y, Tada M, Abe H: Metachronous neurohypohyseal germinoma occuring eight years after total resection of mature teratoma. Surg Neurol 49: 205-209, 1998
- Kida Y, Kobayashi T, Yoshida J, Kato K, Kageyama N: Chemotherapy with cisplatin for AFP-secreting germ-cell tumors of the central nervous system. J Neurosurg. 65: 470-475, 1986
- Kochi M, Itoyama Y, Shiraishi S, Kitamura I, Marubayashi T, Ushio Y: Successful treatment of intracranial nongerminomatous malignant germ cell tumors by administering neoadjuvant chemotherapy and radiotherapy before excision of residual tumors. J Neurosurg 99: 106-114, 2003
- Merchant TE, Sherwood SH, Mulhern RK, Rose SR,- Thompson SJ, Sanford RA, Kun LE: CNS germinoma: Disease control and long-term functional outcome for 12 children treated with craniospinal irradiation. Int J Rad Oncol Biol Phys 46: 1171-1176, 2000
- Meagher-Villemure K: Pathology. Sawamura Y, Shirato H, de Tribolet N (eds), Springer-Verlag, Wien, 1998, pp. 17-36
- Matsutani M, Sano K, Takakura K, Fujimaki T, Nakamura O, Funata N, Seto T: Primary intracranial germ cell tumors – a clinical analysis of 153 histologically verified cases. J Neurosurg 86:446-455, 1997
- Miyanohara O, Takeshima H, Kaji M, Hirano H, Sawamura Y, Kochi M, Kuratsu J: Diagnostic significance of soluble c-kit in the cerebrospinal fluid of patients with germ cell tumor. J Neurosurg 97: 177-183, 2002
- Nichols CR, Catalano PJ, Crawford ED, Vogelzang NJ, Einhorn LH, Loehrer PJ: Randomized comparison of cisplatin and etoposide and either bleomycin or ifosfamide in treatment of advanced disseminated germ cell tumors: an Eastern Cooperative Oncology Group, Southwest Oncology Group, and Cancer and Leukemia Group B Study. J Clin Oncol 16: 1287-1293, 1998
- O’Callaghan AM, Katapodis O, Ellison DW, Theaker JM, Mead GM: The growing teratoma syndrome in a nongerminomatous germ cell tumor of the pineal gland: a case report and review. Cancer 80: 942-947, 1997
- Packer RJ, Sutton LN, Rorke LB, et al: Intracranial embryonal cell carcinoma. Cancer 54: 520-524, 1984
- Piamsomboon S, Kudelka AP, Termrungruanglert W, Vanbesien K, Edwards CL, Lifshitz S, Schomer DF, Champlin R, Mante RP, Kavanagh JJ, Verschraegen CF: Remission of refractory gestational trophoblastic disease in the brain with ifosfamide, carboplatin, and etoposide (ice) – first report and review of literature. Eur J Gynaecol Oncol 18:453-456, 1997
- Sawamura Y, Shirato H, Ikeda J, Tada M, Ishii M, Kato T, Abe H, Fujieda K: Induction Chemotherapy Followed by Reduced-Volume Irradiation for Newly Diagnosed CNS Germinoma. J Neurosurg 88: 66-72, 1998
- Sawamura Y: Current diagnosis and treatment of central nervous system germ cell tumours. Curr Opin Neurol 9 (6): 419-423, 1996
- Sawamura Y, Ikeda J, Shirato H, Tada M, Abe H: Germ Cell Tumors of The Central Nervous System: Treatment Consideration Based on 111 Cases and their Long-Term Clinical Outcomes. Eur J Cancer 34: 104-110, 1998
- Sawamura Y, Shirato H, de Tribolet N: Recent advances in the treatment of central nervous system germ cell tumors. Adv Tech Stand Neurosurg 25: 141-159, 1999
- Sawamura Y, de Tribolet N, Ishii N, Abe H: Surgical Management of Primary Intracranial Germinomas: Diagnostic Surgery or Radical Resection ? J Neurosurg 87: 262-266, 1997
- Sawamura Y: Overview for management. in Intracranial Germ Cell Tumors. Sawamura Y, Shirato H, de Tribolet N (eds), Springer-Verlag, Wien, 1998, pp169-191
- Sawamura Y: Prognosis of central nervous system germ cell tumors. in Intracranial Germ Cell Tumors. Sawamura Y, Shirato H, de Tribolet N (eds), Springer-Verlag, Wien, 1998, pp155-168
- Sawamura Y, Ikeda J, Ishii N, Kato T, Tada T, Abe H, Shirato H: Combined irradiation and chemotherapy using ifosfamide, cisplatin, and etoposide for children with medulloblastoma/posterior fossa primitive neuroectodermal tumor. Neurol Med Chirur (Tokyo) 36: 632-638, 1996
- Sawamura Y, Kato T, Ikeda J, Tada M, Shirato H: Teratomas of The Central Nervous System: Treatment Consideration Based on 34 Cases. J Neurosurg 89: 728-737, 1998
- Schechter NR, Mychalczak B, Jones W, Spriggs D: Prognosis of patients treated with whole-brain radiation therapy for metastatic gestational trophoblastic disease Gynecologic Oncology 168:183-192, 1998
- Schneider DT, Schuster AE, Fritsch MK, Calaminus G, Gobel U, Harms D, Lauer S, Olson T, Perlman EJ: Genetic analysis of mediastinal nonseminomatous germ cell tumors in children and adolescents. Genes Chromosomes Cancer 34: 115-25, 2002
- Shirato H, Nishio M, Sawamura Y, Myohjin M, Kitahara T, Nishioka T, Mizutani Y, Abe H, Miyasaka K: Analysis of long-term treatment of intracranial germinoma. Int J Radiation Oncology Biol Phys 37:511-515, 1997
- Sievers EL, Berger M, Geyer JR: Long-term survival of a patient with primary sellar choriocarcinoma with pulmonary metastases – a case report, Med Pediat Oncol 26:293-295, 1996
- Sudo A, Shiga T, Okajima M, Takano K, Terae S, Sawamura Y, Ohnishi A, Nagashima K, Saitoh S. Links: High Uptake on (11)C-methionine Positron Emission Tomographic Scan of Basal Ganglia Germinoma with Cerebral Hemiatrophy. AJNR Am J Neuroradiol. 24: 1909-1911, 2003
- Tapper D, Lack EE: Teratomas in infancy and childhood. Ann Surg 198: 398-410, 1983
- Ushio Y, Kochi M, Kuratsu J, Itoyama Y,- Marubayashi T: Preliminary observations for a new treatment in children with primary intracranial yolk sac tumor or embryonal carcinoma. Report of five cases. J Neurosurg 90:133-137, 1999
- Yoshida K, Sawamura Y: Clinical Findings and Diagnosis, Ophthalmological manifestations. Sawamura Y, Shirato H, de Tribolet N (eds), Springer-Verlag, Wien, 1998, pp137-145
- Yoshida J, Sugita K, Kobayashi T, Takakura K, Shitara N, Matsutani M, Tanaka R,Nagai H, Yamada H, Yamashita J: Prognosis of intracranial germ cell tumours: effectiveness of chemotherapy with cisplatin and etoposide (CDDP and VP-16) Acta Neurochir (Wien) 120: 111-117, 1993
1998年にSpringerから出版した英文の成書です。