皆様のご意見を募集します
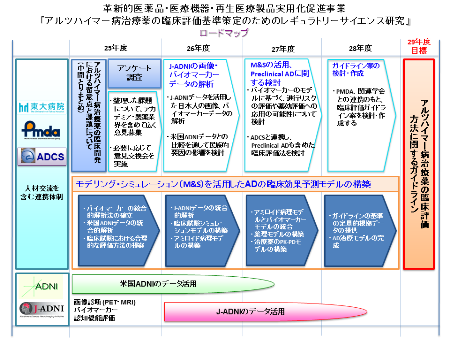
私たちは、「アルツハイマー病治療薬の臨床評価基準策定のためのレギュラトリーサイエンス研究」において、PMDAの全面的な協力のもと、アルツハイマー病の疾患修飾薬の臨床評価および臨床開発に関して、現時点での考え方・留意すべき事項と今後の課題を中間的にとりまとめました。
バイオマーカーを活用した臨床試験の実施については、まだ多くの課題が残されていますが、今後も研究を進め、集積されたエビデンスをもとに検討を重ねた上で、平成29年度を目標に最終的なアルツハイマー病治療薬の臨床評価基準を確立したいと考えています。
この中間とりまとめに関して、アカデミアや製薬業界の方を初めとして、できるだけ多くの方から広くご意見を伺いたいと考えております。
いただいたご意見に対する回答の公表などは予定しておりませんが、必要に応じて個別に意見交換させていただき、今後の研究や最終的なガイドライン作成に反映させていただきます。
応募方法
皆様のご意見を、下記の「意見提出様式」をご参照の上、平成26年 1月 24日までに、下記のいずれかの方法でお送りいただけると幸いです。
- 当ホームページの「意見提出フォーム」
- 電子メール
「意見提出様式」(PDF、Word)にご記入の上、ueecd-office[アット]umin.net宛にお送りください。 ([アット]は、@に置き換えてください。)
なおPDFファイルへの記入にはAdobe(R) Acrobat(R)が必要です。 - 郵送
〒113-0033
東京都文京区本郷7-3-1
東京大学医学部附属病院 早期・探索開発推進室 意見収集係 - Fax
03-5800-9097