学会員論文紹介
近著論文の解説
肺胞形成における血管の新たな役割を発見!
-血管内皮細胞は肺胞の形作りに必要な足場を作る-
高野晴子 福原茂朋
日本医科大学 先端医学研究所 病態解析学部門
対象論文
- Endothelial cells regulate alveolar morphogenesis by constructing basement membranes acting as a scaffold for myofibroblasts
- Haruko Watanabe-Takano*, Katsuhiro Kato, Eri Nakamura-Oguri, Tomohiro Ishi,
Koji Kobayashi, Takahisa Murata, Koichiro Tsujikawa, Takaki Miyata,
Yoshiaki Kubota, Yasuyuki Hanada, Koichi Nishiyama, Tetsuro Watabe,
Reinhard Fässler, Hirotaka Ishii, Naoki Mochizuki, Shigetomo Fukuhara* (*共同責任著者) - Nature Communications 15: 1622, 2024
- DOI:10.1038/s41467-024-45910-y
- URL:https://www.nature.com/articles/s41467-024-45910-y
論文サマリー
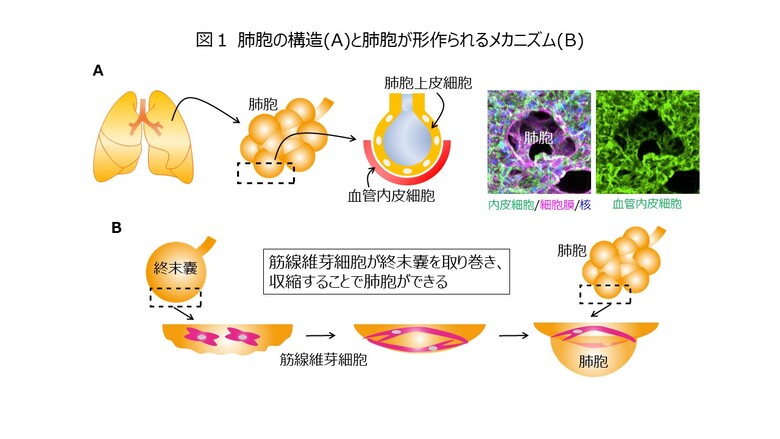
肺は、呼吸における酸素と二酸化炭素の交換を担う生命維持に欠かせない臓器であり、このガス交換を担う場が、「肺胞」です。肺胞は小さな袋状の構造をしており、その内面を覆う肺胞上皮細胞と裏打ちする血管内皮細胞が密に接着することにより、空気-血液関門を形成し、肺胞内の空気と血液の間のガス交換を担っています(図1A)。感染性呼吸器疾患や慢性閉塞性肺疾患などの難治性の呼吸器疾患では、肺胞が破壊され呼吸が困難となり、死に至ることもあります。しかし、壊れた肺胞を効率的に再生させる方法は、これまでに確立されておらず、その実現には複雑な構造を有する肺胞が形作られる仕組みを理解する必要があります。肺胞の形成には、強い収縮力を持つ「肺胞筋線維芽細胞」が関与することが知られています。成長期の肺では、筋線維芽細胞が終末嚢と呼ばれる袋状の構造に巻き付き、収縮することで、肺胞を形成すると考えられています(図1B)。しかし、筋線維芽細胞の収縮や肺胞形成のメカニズムについては不明な点が多く残されていました。特に、肺胞の血管内皮細胞の役割は全く明らかにされていませんでした。
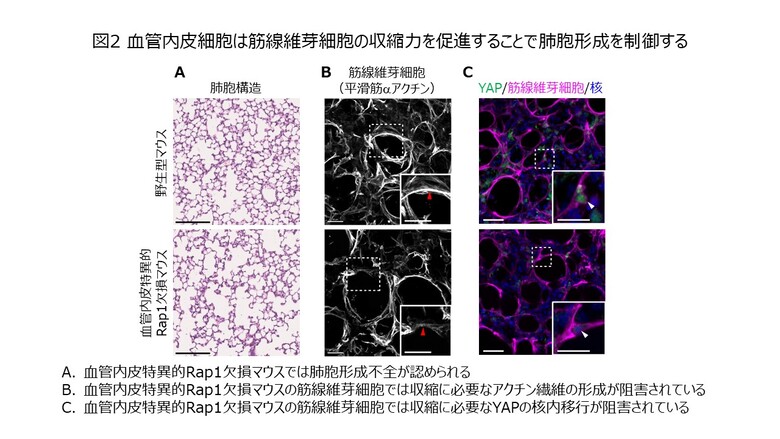
Rasファミリーに属する低分子量GTP結合タンパク質の一つであるRap1は、細胞内のシグナル伝達に関わる分子で、細胞と細胞外マトリックスの接着を担うインテグリン接着と細胞同士の接着を担うカドヘリン接着を増強します。今回、われわれは、血管内皮特異的Rap1欠損(Rap1iECKO)マウスを作出し、同仔マウスでは肺胞形成が阻害されていることを発見しました(図2A)。マウスの肺胞は、筋線維芽細胞が出生後直後の未熟な肺胞様構造である終末嚢にリング状に取り巻き、収縮することで分割し、作られると考えられています(図1B)。Rap1iECKOマウスでは、終末嚢を取り巻く筋線維芽細胞は存在するものの、収縮力を発揮するのに必要なメカノトランスダクション(機械的なシグナル伝達系)が異常であり、肺胞が作られないことが分かりました(図2B, C)。このことから、血管内皮細胞は筋線維芽細胞の収縮とそれに伴う肺胞形成を制御していることが示されました。
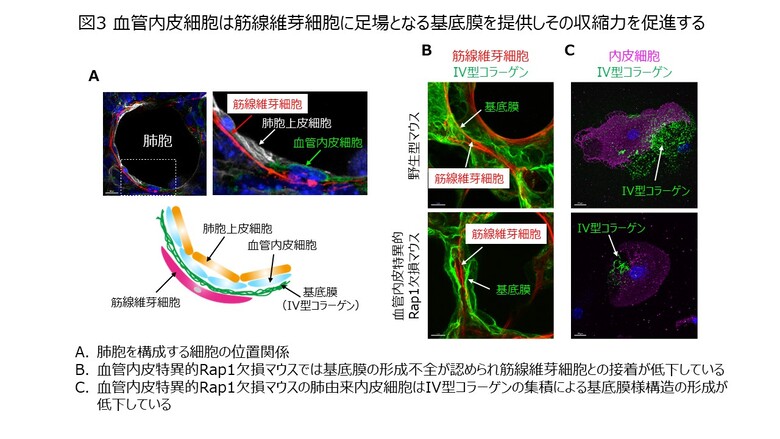
次に、血管内皮細胞が筋線維芽細胞の収縮を制御するメカニズムを明らかにするために、肺胞の形成時における、これら細胞の位置関係を3次元組織染色法により調べました。すると、図3Aに示すように、肺胞(終末嚢)の内側から肺胞上皮細胞、血管内皮細胞が存在し、さらにその外側を筋線維芽細胞が覆っていました。通常、血管では、内腔側を血管内皮細胞が覆い、その外側には基底膜が存在します。そこで、基底膜の構成成分であるIV型コラーゲンを観察すると、野生型マウスでは血管内皮細胞と筋線維芽細胞は基底膜を介して密に接していたのに対し、Rap1iECKOマウスでは、基底膜が正常に作られず、筋線維芽細胞と基底膜の接着異常が認められました(図3B)。さらに、血管内皮細胞が基底膜の形成に関与するか知るため、肺胞形成時期の肺から取り出した血管内皮細胞をディッシュ(培養用容器)上で培養し観察したところ、野生型マウス由来の血管内皮細胞はIV型コラーゲンを集積し、基底膜様の構造を形成したのに対し、Rap1iECKOマウスから取り出した血管内皮細胞では、IV型コラーゲンの集積が低下しており、基底膜様の構造があまり形成されませんでした(図3C)。このことから、血管内皮細胞はIV型コラーゲンを集積し、筋線維芽細胞の足場となる基底膜を形成することで、筋線維芽細胞の収縮と肺胞形成を制御していることが示されました。
さらに、血管内皮細胞が筋線維芽細胞の足場となる基底膜を形成する仕組みについて研究しました。Rap1は、インテグリンを活性化することで細胞と細胞外マトリックスの結合を高めることが知られています。そこで、Rap1によって活性化したインテグリンが、IV型コラーゲンを集積し、基底膜を形成しているのか調べることにしました。すると、Rap1iECKOマウスの肺胞における血管内皮細胞では、野生型マウスに比べ、インテグリンの活性が低下していました。また、Rap1iECKOマウスと同様に、血管内皮細胞でのみインテグリンを欠損したマウスでは、基底膜の形成不全により筋線維芽細胞が収縮できず、肺胞の形成が阻害されていました。このことから、血管内皮細胞は、Rap1依存性にインテグリンを活性化し、IV型コラーゲンを集積することで基底膜を形成すること、また、筋線維芽細胞は血管内皮細胞が作った基底膜を足場として収縮力を発揮し、肺胞を形成していることが示されました(図4)。
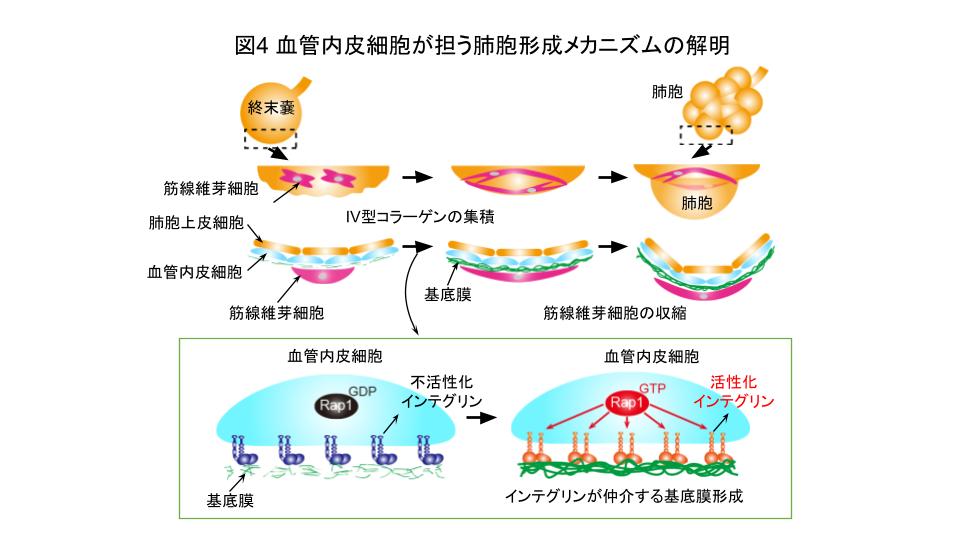
以上の結果から、血管内皮細胞は、Rap1依存性にインテグリンを活性化し、IV型コラーゲンを集積することで基底膜を形成すること、また、筋線維芽細胞は血管内皮細胞が作った基底膜を足場として収縮力を発揮し、肺胞を形成していることが示されました(図4)。即ち、血管内皮細胞は、基底膜形成という細胞機能を介して、肺胞の形態形成を制御していることが明らかになりました。
本研究では、長らく明らかにされてこなかった肺胞形成における血管内皮細胞の役割を明確にしました。これまでにも、血管内皮細胞が肺胞の形態形成に重要であることは分かっていましたが、その役割は酸素や栄養を含む血液成分の運搬やアンジオクラインファクターによるパラクライン作用である、と漠然と考えられてきました。本研究では肺の血管内皮細胞が基底膜を形成することで、筋線維芽細胞の足場を提供し筋線維芽細胞のメカニカルシグナルを制御していることが明らかになりました。以上のような内皮細胞自身の細胞機能が形態形成を制御している例は未だ報告がなく、新しい概念であると考えています。
一方で、近年では血管内皮細胞は単純な管ではなく、それぞれの臓器に特化した役割を担っていると考えられています。肺にも肺胞を被覆する扁平巨大なAerocyte(aCap)が発見され、肺胞機能のガス交換をサポートする役割があると考えられています。また、私たちのグループはセブラフィッシュを用いて、内皮細胞が腎臓の形態形成に積極的に関与する可能性も見出しています。すなわち、血管内皮細胞は臓器特異的な血管形成の過程で、積極的に臓器の形態形成を制御する可能性が考えられます。今後は臓器特異的な内皮細胞が誘導される仕組みを明らかにし、iPS細胞へと広げていくと共に、臓器特異性が如何にして破綻するかについても検討していく予定です。
著者コメント
本研究は、私が国立循環器病研究センター研究所に所属していた時に始まりました。当初、福原先生が独立されてまもなくの事で福原先生から、「どうも肺がおかしくなるマウスがいる」との連絡を受けました。福原先生は、私がポスドク時代に肺胞形成の研究をしていた事を、覚えていて下さり、このRap1ノックアウトマウスの話をご連絡下さったのだと思います。その後、解析担当の研究者の方が辞められたこともあり、是非、Rap1ノックアウトを研究させて欲しいと福原先生に伝え、望月 部長もこれを了承してくださり、この研究が本格的に始まりました。福原先生は毎週のように、数時間もディスカッションにつきあって下さり、また、絶妙なタイミングで指示を出して下さるなど、本研究を終始楽しく導いて下さいました。私はこの研究の途中でドイツへ留学したのですが、この留学期間にマウスを十分に準備して下さり、本研究を最大限に素早く形にできたのは、福原先生のご協力があってこそ達成できたと思います。
望月部長は、肺胞の血管は三次元で解析しないと分からない、という事にいち早く気づいて下さり、肺の三次元染色法の開発者である名古屋大学の加藤勝洋先生に連絡をして下さいました。振り返ると、本研究ではほとんど全ての解析に、三次元染色法を採用しており、その結果として、合理的な仮説を立てることができました。望月部長には本当に感謝が尽きない思いです。三次元染色法や肺血管内皮細胞の採取をサポートして下さった、加藤先生にもこの場をお借りして、お礼を申し上げます。加藤先生とはこの論文以外でも協力して、日本の肺研究を盛り上げていきたいと思います。
また、論文共著者の先生方をはじめとして、多くの方のサポートにより本研究成果を仕上げることができました。この場を借りて、御礼申し上げます。



