学会員論文紹介
近著論文の解説
管腔内圧の変動に伴う内皮組織のリモデリングを介した細胞間隙での物質輸送制御
佐野 貴規 末弘 淳一 松永 行子
対象論文
- Endothelial tissue remodeling induced by intraluminal pressure enhances paracellular solute transport
- Jean Cacheux, Aurélien Bancaud*, Daniel Alcaide, Jun-Ichi Suehiro, Yoshihiro Akimoto, Hiroyuki Sakurai, Yukiko T. Matsunaga* (*共同責任著者)
-
iScience 26, 107141, July 21, (2023)
URL: https://doi.org/10.1016/j.isci.2023.107141
論文サマリー
血管は、体内の物質輸送器官としてだけでなく、血液と周辺組織との間の物質透過の関門となる物理的バリアとしての機能も司っています。水、酸素、タンパク質などの物質交換を仲介し、組織の恒常性維持に寄与しています。バリア機能の破綻は、がんや感染症を含む多くの疾患を惹起します。このような物理障壁を挟んだ物質輸送は、細胞内を通過する輸送と細胞間隙を通過する輸送の2つのメカニズムによって起こります。細胞内を通過する場合は、頂端膜または基底膜において小胞のエネルギー依存的な輸送であるトランスサイトーシスから始まり、能動的に物質が輸送されます。対照的に、細胞間隙を通過する場合は受動的な輸送であると考えられており、密着結合タンパク質と接着結合タンパク質を介する細胞間接合、あるいはその構造の再配置によって物質輸送が制御されます。能動的輸送または受動的輸送のバランスや選択性は組織により異なり、in vivoでの物質輸送を理解する上での重要な研究対象です。一般に、密着結合が最も多く存在する脳毛細血管を除けば、他の微小血管では親水性の低分子は細胞間隙を通過すると考えられています。
本研究では、血管壁における細胞間隙輸送の強さを、管腔内圧の有無にかかわらず比較するために、組織工学的手法に基づいた評価法が開発されました (図1)。評価にあたり、血管研究全般に用いられ、機械的刺激への応答を示すヒト臍帯静脈内皮細胞(HUVEC)をモデルとし、ポリジメチルシロキサン (PDMS) 製デバイス上で人工血管を再構成しました (図1A、1B)。続いて、管腔内への圧力負荷刺激を実現するために、付属部品を別途成型し、PDMSデバイスに接続しました (図1C)。管腔内に蛍光標識デキストランを導入し (図1D)、管腔内外で圧力勾配のない静置条件での輸送を基準として、管腔内へ圧力刺激を負荷し、蛍光デキストランの移動現象を共焦点顕微鏡により時空間的に観察しました。加圧条件下では、管腔外への物質輸送が増加し、より遠くへ物質移動が確認されました (図1E)。
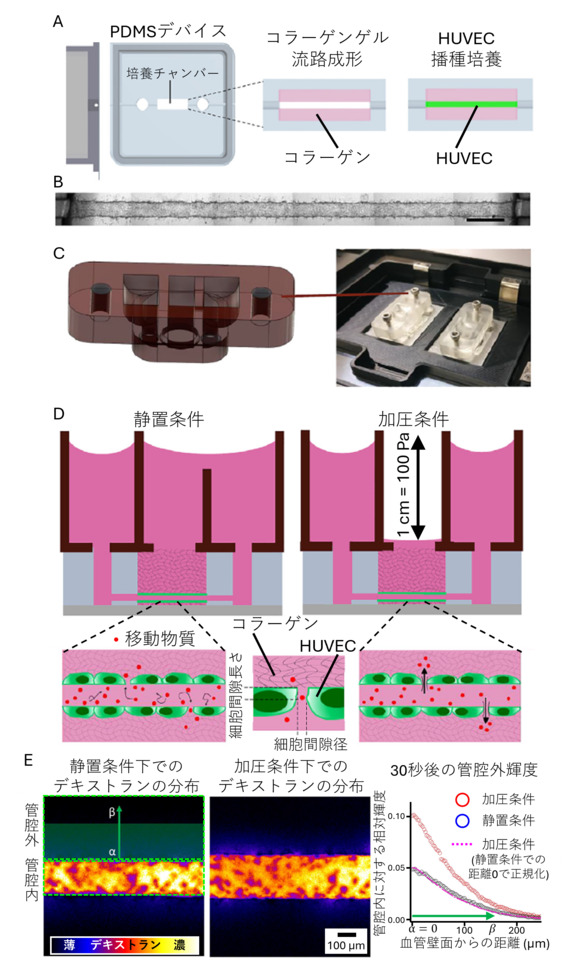
図1
(A) 微小血管の再構成に用いたPDMSデバイスおよび血管再構成の流れ
(B) 作製から二日間培養した再構成血管の例
(C) 倒立顕微鏡上でPDMSデバイス上部に固定可能な追加パーツを用いて血管バリア機能を評価する様子
(D) 異なるデザインの追加パーツを用いた静置条件および加圧条件下でのバリア機能評価方法の原理
(E) 静置条件および加圧条件下にて蛍光デキストランが漏出する様子
加圧条件ではさらに、血管拡張が生じ(図2A)、F-アクチンによるストレスファイバーの形成を伴った細胞骨格再編成が起こることで (図2B)、血管組織における物質輸送に血管構造のリモデリングが関与することが示唆されました。透過電子顕微鏡による血管断面の血管内皮細胞間結合の観察では、組織の伸展領域では管腔内外を繋ぐ細胞間隙の厚さが50%減少することが示されました (図2C)。加圧条件では伸展領域の細胞間結合が部分的に剥離することで、血管内外を結ぶ細胞間隙の物質移動距離が短縮され、血管透過性の亢進が確認できました (図2D)。
先行研究ではしばしば、経内皮電気抵抗 (TEER) 法によって物質輸送を評価してきました。TEER法では、電場印加時に細胞組織を横切るイオン電流を記録し、そこから血管バリア機能と相関する数値指標が得られます。しかし、この値は電位勾配により駆動される流れを観測しているにすぎず、生体内でみられる圧力勾配は考慮されていません。このように血管系においてTEER法から得られた知見が血管壁を横切る物質輸送にそのまま適用できるかは議論がありましたが、本研究によって構築された評価モデルによって管腔内圧の変動に伴う内皮組織のリモデリングを再現でき、細胞間隙での物質輸送をより生体内により近い条件で評価することが可能となりました。
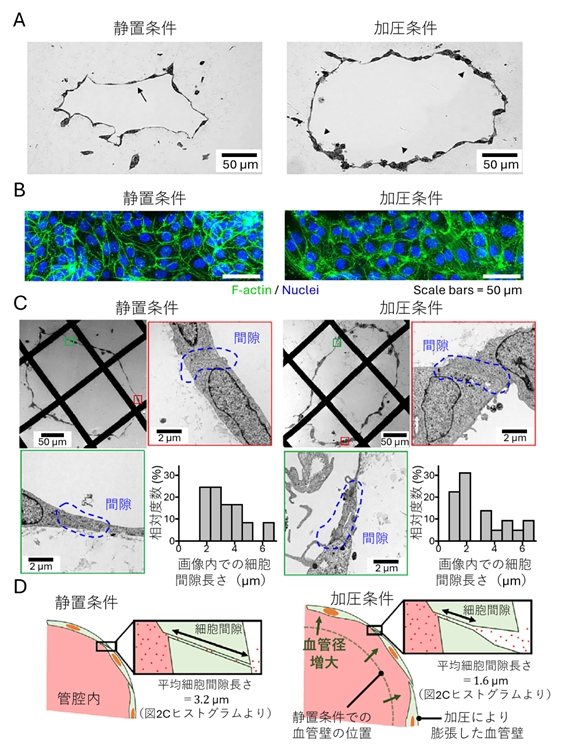
図2
(A) 静置条件および加圧条件下での再構成血管の形態断面図
(B) 静置条件および加圧条件下での再構成血管の免疫染色像
(C) 静置条件および加圧条件下での再構成血管の切片を透過電子顕微鏡
(D) 静置条件および加圧条件下での再構成血管のバリア機能が変わるしくみ
著者コメント
「管腔内圧変動がある場合に物質輸送はどのように変化するのだろうか?」という疑問に答えた論文です。フランスから松永研究室に出向してきたBancaud博士(LAAS, CNRS), Cacheux博士(当時JSPS外国人特別研究員)が発案し手掛けたもので、生物物理学者でもある彼らのアイデアがたくさんつまっています。管腔内圧変動が内皮細胞の形態や接着に影響し、さらに物質輸送へ影響することは容易に想像できると思いますが、実験的にその様子を観察、評価するにはいくつか難しさがあります。それらのハードルを乗り越えるため、本研究では松永研究室が有する組織工学的手法を用いて数百μm径の血管を再現し、そこに内腔圧を負荷することが可能な機構を組み合わせることで、内皮細胞の形態と物質輸送を捉えることに成功しました。本研究の成果によって、物理的バリアとしての血管の生理的機能が明らかとなり、将来は薬物動態研究などへ応用できると考えられます。

東京大学生産技術研究所(松永研)のメンバー(左)と当時在籍したLIMMS/CNRS-IISのBancaud博士(右上段、LAAS-CNRS)とCacheux博士(右下段、当時JSPS外国人特別研究員、現所属トゥールーズがん研究所)
活用したデータベースにかかわる
キーワード
血管透過性
組織リモデリング
圧力勾配


