網膜芽細胞腫
(Retinoblastoma)
GeneReview 著者:Dietmar R Lohmann, MD; Brenda L Gallie, MD.日本語訳者: 島田咲(京都大学大学院医学研究科),山田崇弘(京都大学医学部附属病院遺伝子診療部)
GeneReview最終更新日: 2018.11.21 日本語訳最終更新日: 2020.10.18.
要約
疾患の特徴網膜芽細胞腫(Rb)は通常5歳までの小児に発症する、発達中の網膜におこる悪性腫瘍である。RbはRB1遺伝子の両コピーに発癌の素因となる変異が生じた細胞から発症する。Rbは単発性または多発性の場合がある。Rb患児の約60%は片側性で診断時の平均月齢は24ヶ月、約40%は両側性で診断時の平均月齢は15ヶ月である。遺伝性RbとはRb易罹患性が常染色体優性で遺伝するものである。遺伝性Rbの患者においては、眼以外の腫瘍を発症するリスクも増加する。
診断・検査Rbの臨床診断は、間接的検眼鏡を用いた眼底検査によってなされる。画像診断は臨床診断を支持し、病期を評価する目的で行われる。遺伝性Rbは、Rbまたは網膜細胞腫(レチノーマ)の発端者で家系内にRbの既往歴がある場合や、RB1遺伝子におけるヘテロ接合性に生殖細胞系列の病的バリアントが検出された場合に診断される。
Rbおよび/または遺伝性Rbのリスクがある個人に対して、RB1の生殖細胞系列病的バリアントを有する個人の遺伝的リスクを示すために、”H”を含んだ、以下の分類が推奨されている。
- HX. 不明または十分なエビデンスがない、生来の(生殖細胞系列の)RB1病的バリアント
- H0. 精度管理された高感度アッセイで検査された、血中の正常なRB1アレル
- (H0*. モザイクの残留リスクが1%未満の血液における正常RB1)
- H1. 両側性Rb、三側性Rb(頭蓋内CNS正中線胎児性腫瘍を伴うRb)、Rbの家族歴、血中にRB1の病的バリアントが同定されている場合
臨床的マネジメント
症状の治療:
Rbおよび眼以外の腫瘍の早期診断と治療により罹病率を減少させ、寿命を延ばすことができる;
眼科学、小児腫瘍学、病理学、放射線腫瘍学を含む集学的専門家チームによる治療が最善である。治療法は、腫瘍のステージ、病巣の数(単一または片側性、多発性または両側性か)、眼球中の腫瘍の位置やサイズ、硝子体播種の有無、視力を残存できる可能性の有無、眼以外への侵襲の程度および種類、および利用可能な資源によって異なる。治療の選択肢には、眼球摘出術、凍結療法、レーザー、全身性または局所性の眼化学療法(レーザーまたは凍結療法との併用またはそれに続く動脈内化学療法を含む)、強膜上のプラークを利用した放射線療法、そして最後の手段としての外部からの放射線療法がある。
二次発症の予防:
晩発性の二次がんを発症するリスクを最小限にとどめるために、H1患者に対する放射線照射(X線、CTスキャン、外部照射を含めて)は可能であれば避けるべきである。
サーベイランス:
RB1遺伝子の生殖細胞系列病的バリアントが同定されている患児(H1)には、Rbを可能な限り早期かつ小さいうちに見つけるために、生後6ヶ月までは3~4週間ごとに麻酔下で眼の検査を行い、その後3歳まではそれよりはやや間隔を置いて検査を行う。協力的な患児の臨床検査は7歳までは3~6ヶ月毎に、その後は毎年、最終的には隔年での検査が生涯続けられる。片側性RbでRB1遺伝子の生殖細胞系列病的バリアントが同定されていない患児(H0*)は低レベルのモザイクである可能性があり、超音波検査を含めた定期的な眼の検査を受けるべきである。網膜細胞腫患者は網膜の検査を1~2年ごとに行う。H1のRb患者は肉腫や他の腫瘍のリスクが高いので、眼以外におこる二次がんの発見のためには、担当医や親は骨の痛みや腫れがあるという訴えがあったら、すみやかに対処すべきである。しかし、効果的なスクリーニング・プロトコールはまだ確立されていない。
避けるべき環境:
DNA損傷因子(放射線、たばこ、紫外線)への暴露を制限することによって、遺伝性Rbのサバイバーsurvivor(H1)における高い発がんリスクが減少する可能性がある。
リスクのある血縁者の検査:
家系内でリスクはあるが症状のない子を早期に同定するための分子遺伝学的検査は、病的バリアントを受け継いでいない家族(H0)へのコストのかかるスクリーニングの必要性を減少させる。
遺伝カウンセリング
遺伝性Rbは常染色体優性遺伝形式で受け継がれる。遺伝性Rb(H1)の患者は、ヘテロ接合性のde novo変異または親から受け継いだ生殖細胞系列のRB1病的バリアントを持つ。H1患者の子は50%の確率で病的バリアントを受け継ぐ。リスクのある妊娠における出生前検査は家系におけるRB1遺伝子の病的バリアントが同定されている場合、可能である。
診断
Rbに罹患した子とその家族に対する診断と治療のガイドラインが出版されている[Canadian Retinoblastoma Society 2009]。
疑い所見
以下のいずれかに該当する小児では、Rbが疑われるべきである。
- 白色瞳孔
- 斜視
- 眼の外見的な変化
- 視力の低下
以下のいずれかに該当する患者では、遺伝性のRbが疑われるべきである。
- 片側性(単発性、多発性を問わず)と両側性を含め、Rbの診断を受けた患者
- 網膜細胞腫患者
臨床診断
発端者におけるRbの診断は、眼科医か検眼医(optometrist)による完全散瞳後の検査によってなされる。診断の確認、病気の進行度の確認は麻酔下の検査で行われる。眼の画像診断は診断の確定に役立つ。病理診断は必要ない。注:生検によって腫瘍が眼以外に拡大することがあり、患者の生命を脅かすことがある。
遺伝性Rbは、Rbや網膜細胞腫の発端者において、Rbの家族歴がある場合に診断される。しかしながら、Rb患者の大部分は家族歴がない。そのため、Rbが遺伝性かどうかを調べるために、分子遺伝学的検査により生殖細胞系列にヘテロ接合性RB1遺伝子の病的バリアントを同定する必要がある(表1参照)。発端者におけるRB1病的バリアントの同定により、リスクのある血縁者の早期診断及びスクリーニングが可能となる。
生殖細胞系列由来のRB1病的バリアントの遺伝的リスクを明らかにするために、以下の分類が推奨されている[Mallipatna et al 2017, Soliman et al 2017a]。
- HX. 不明または十分なエビデンスがない、生まれつきの(生殖細胞系列の)RB1病的バリアントを保有する患者
- H0. 分子遺伝学的検査により既知の生殖細胞系列由来の家族性RB1病的バリアントを受け継いでいないと確認された患者
- (H0*. Rbか網膜細胞腫を発症し、分子遺伝学的検査の結果、生殖細胞系列由来のRB1病的バリアントが同定されていない患者;モザイクの残留リスクは1%未満)
- H1. 両側性Rb、三側性Rb(頭蓋内CNS正中線胎児腫瘍を伴うRb)、Rbを発症し、Rbの家族歴がある、もしくは生殖細胞系列由来のRB1病的バリアントが同定された患者
遺伝性Rbの診断のための分子遺伝学的検査には、単一遺伝子の検査と染色体マイクロアレイ(CMA)検査とがある。
単一遺伝子の検査
- 両側性、片側性で家族性、片側性で多発性Rbの患者
RB1遺伝子のシークエンス解析と遺伝子特異的な欠失/重複解析を、末梢血DNAを用いて行う。注:一部の検査施設では、(高頻度に)繰り返し検出される病的バリアントの標的解析を提供していることがある(表1参照)。
- 片側性で単発性のRbで家族歴がない患者
- 腫瘍組織が得られない場合は、末梢血DNAを用いてRB1遺伝子のシークエンス解析と遺伝子特異的な欠失/重複解析を行う。
- 腫瘍組織が入手可能な場合は、RB1遺伝子のシークエンス解析と遺伝子特異的な欠失/重複解析を腫瘍DNAで行う。病的バリアントが同定された場合は、血液DNAにおいても当該バリアントの有無を検査する。病的バリアントが同定されなかった場合、RB1遺伝子のプロモーター領域における高メチル化によってRB1遺伝子のエピジェネティックな不活性化がないか確認するために、RB1遺伝子プロモーターのCpGアイランドのメチル化解析を行う。プロモーター領域に高メチル化が見られなかった場合、腫瘍DNAを用いて、MYCNの増幅がないか検査する、これは孤発性の片側性Rb患者の約1.5%においてRB1遺伝子の病的バリアントが見られない場合のRbの原因となっている。
CMAは、オリゴヌクレオチドまたはSNPアレイを用いて、シークエンス解析では検出できないゲノムワイドな大規模欠失/重複(RB1を含む)を検出する。CMAは、発達遅延および/または他の先天性異常を伴うRbを有する個体で考慮されることがある[Mitter et al 2011, Castéra et al 2013]。
表1 遺伝性のRbにおいて用いられる分子遺伝学的検査
| 遺伝子1 | 検査方法 | 試料 | 生殖細胞系列に病的バリアント2を持つ発端者における変異検出率 |
|---|---|---|---|
| RB1 | シークエンス解析3 | 生殖細胞系列 腫瘍 |
80%-84% |
| 当該遺伝子の欠失/重複解析4 | 生殖細胞系列 腫瘍 |
16%-20% | |
| CMA5 | 生殖細胞系列 | 6%-8%6 | |
| 病的バリアントのターゲット解析 | 生殖細胞系列 腫瘍 |
25%7 | |
| メチル化解析 | 腫瘍 | 注8参照 | |
| アレル欠失解析 | 腫瘍 | 注9参照 | |
| MYCN | 当該遺伝子の欠失/重複解析4 | 腫瘍 | 注10参照 |
- 染色体位置とタンパク質については表A参照
- この遺伝子で同定されたバリアントについては「分子遺伝学」の項目を参照
- シークエンス解析によって得られる結果は、benign(良性)、likely benign(おそらく良性)、 of uncertain significance(意義不明)、likely pathogenic(おそらく病的)、pathogenic(病的)がある。病的バリアントには微小欠失/重複、ミスセンス変異、ナンセンス変異、スプライスサイトの変異が含まれ、通常、エクソン単位や遺伝子レベルでの欠失/重複は検出されないのが特徴である。シークエンス解析の結果の解釈時に考慮すべき事項についてはここ( https://www.ncbi.nlm.nih.gov/books/NBK6851/ )を参照。
- 一遺伝子をターゲットとした欠失/挿入解析によって遺伝子内の欠失/重複を検出することがある。検出法には定量PCR、ロングPCR、MLPA法、単一のエクソンの欠失/重複の検出のためにデザインされたマイクロアレイ法がある。当該遺伝子の欠失/重複解析は、単一エクソンから遺伝子全体までの欠失を検出するが、大きな欠失および/または隣接遺伝子の欠失(例えば、Mitterら[2011]、Castéraら[2013]によって記載されたもの)の切断点は、これらの方法では検出されない場合がある。
- 染色体マイクロアレイ解析(CMA)は、オリゴヌクレオチドまたはSNPアレイを用いて、シークエンス解析では検出できないゲノム全体の大きな欠失/重複(RB1を含む)を検出する。欠失/重複の大きさを決定できるかどうかは、使用するマイクロアレイの種類および13q14領域におけるプローブの密度に依存する。現在臨床で使用されているCMAデザインは13q14領域を標的としている。
- Rb患者の約6~8%は13q14の染色体欠失を有する。このような染色体異常は、しばしば発達遅滞および先天奇形と関連している[Mitter et al 2011; Castéra et al 2013; 著者、未発表データ
- CpG変換による早期の転写終止による病的バリアントが、病的バリアント全体の25%を占めている[Rushlow et al 2009; 著者、未発表データ]。
- RB1遺伝子プロモーター領域の高メチル化(遺伝子発現を抑制する)は孤発性、片側性Rb患者の腫瘍の約15%にみられる[Zeschnigk et al 2004; 著者、未発表データ]。このような患者では、腫瘍の発生の引き金となった2つの不活性RB1アレルを同定するために、腫瘍由来DNA中のプロモーター領域のメチル化状態の解析が必要である。
- 腫瘍におけるヘテロ接合性の消失(LOH)の検査。末梢血または腫瘍由来DNAからのRB1遺伝子内または隣接領域における多型部位の競合的タイピングによって、変異アレルの重複を伴う(ホモ接合性)または伴わない、正常遺伝子の欠失(ヘミ接合性)が体細胞における病的バリアントを構成していることが判明する。孤発性の片側性Rb患者の腫瘍において、60%-70%で認められる。
- 散発性の片側性Rb患児の約1.5%では、腫瘍組織の検査においてMYCN遺伝子の高レベルの増幅が見られるが、RB1遺伝子の不活化をもたらす病的バリアントは検出されない[Rushlow et al 2013]。日常的な遺伝学的検査での高レベルMYCN増幅の遺伝的解釈はまだ確立されていない。
表2 家族歴と腫瘍の性質に基づくRb患者におけるRB1遺伝子の生殖細胞系列病的バリアントの有無の可能性
| 家族歴 | Rbの表現形 | RB1の生殖細胞系列病的バリアントの可能性 | ||
|---|---|---|---|---|
| 片側性 | 両側性 | |||
| 多発性 | 単発性 | |||
| あり1 | + | 100% | ||
| + | 100% | |||
| + | 100% | |||
| なし2 | + | ほぼ100%3 | ||
| + | 14〜95% | |||
| + | 〜14% | |||
- あり=家族内に複数の患者(Rbの10%)
- なし=家族内に一人のみの患者(Rbの90%)
- RB1遺伝子の病的バリアントは従来の分子遺伝学的検査で、両側性を含む単独のケースの90-97%が証明されるが、残りの5%では、転座、イントロン内部でのスプライス変異、生殖細胞に存在するかどうかわからない低レベルのモザイクを有する可能性がある。
注:(1)腫瘍細胞において検出された病的バリアントが非腫瘍細胞(生来のDNA)では検出されなかった場合、患者がRB1遺伝子に生殖細胞系列病的バリアントを持つ可能性は低い。(2)シークエンス解析のような従来の分子解析では、20%程度の低い割合のモザイクであっても検出できるため、RB1遺伝子の病的バリアントが白血球細胞に検出されないということは、その患者が生殖細胞系列に病的バリアントを持つ可能性が低いということはできるが、その可能性を完全に否定はできない。
臨床的特徴
臨床像
網膜芽細胞腫(Rb)
最も頻度の高い初発症状は白色瞳孔反射(leukocoria)である。斜視は次に頻度の高い初発症状であり、白色瞳孔に随伴したり白色瞳孔より早期に見られたりする[Abramson et al 2003]。まれな初発症状として、緑内障、眼窩蜂巣炎、ぶどう膜炎、前房出血、硝子体出血がある。患児のほとんどは5歳までに診断される。非典型的な症状は年長の患児で見られることが多い。
Rbの発端者は通常、以下のいずれかの臨床像を呈する。
- 家族歴のない片側性Rb(発端者の60%)
- 家族歴のない多発性 Rb(発端者の30%)
- 家族歴のある片側性または両側性のRb(発端者の~10%)。家族歴があり、網膜の検査による臨床サーベイランスを実施しているH1の人(「臨床診断」の項目を参照)では、腫瘍は多くの場合、生後1ヶ月の間に発見される。
- 13q14を含む染色体欠失。単発性 Rbの発端者の最大5%および多発性 Rbの発端者の7.5%は、13q14を含む染色体欠失を有する。このような染色体異常を伴う患者はしばしば発達遅滞や先天奇形を伴う[Mitter et al 2011, Castéra et al 2013]。
Rbは以下に分類される。
- Unilateral(片側性) 片眼だけがRbに罹患している場合。罹患者の約60%は片側性のRbで、平均診断年齢は24ヶ月である。片側性Rbはたいてい単発性である、つまり、単一の腫瘍のみが存在する。片方の眼に複数の腫瘍を生じる場合もある(片側性(unilateral)多発性(multifocal)retinoblastoma)。眼球内播種は多発性の腫瘍増殖に類似している。片側性Rb患者のほとんどは家族歴がなく、腫瘍が大きいために、単一の腫瘍かどうか診断できない。
- Bilateral(両側性) 両眼がRbに罹患している場合。罹患者の約40%は両側性のRbで、平均診断年齢は15ヶ月である。両側性の腫瘍を持つ患児のほとんどは最初の診断時に両眼に腫瘍が発生している。両眼に両側性Rbを持つ患者は、複数の腫瘍を発症することがある。初診時に片側性Rbと診断された患児のなかには後に反対の非罹患眼に腫瘍が発生することもある。
- Trilateral 両側性(ごくまれに片側性)のRbに松果体芽腫が合併したもの(「松果体芽腫」の項目を参照)。
網膜細胞腫と関連眼病変
自発的な成長が停止した良性の網膜腫瘍(網膜細胞腫と呼ばれる)が、網膜瘢痕内に現れることがある [Dimaras et al 2008]。血管閉塞に伴うRbの自然退縮により石灰化した眼球瘻が生じることがある [Valverde et al 2002]。Rbの家族歴がある網膜細胞腫患者、および片眼に網膜細胞腫があり、もう一方の眼に網膜細胞腫またはRbのいずれかがある患者における、RB1病的バリアントのスペクトルは、両側性Rb患者の病的バリアントのスペクトルと違いがないようである[Abouzeid et al 2009]。
松果体芽腫
松果体芽腫は、松果体にある“網膜様組織”に発生する。松果体芽腫または原始神経外胚葉性腫瘍とRbの同時発生は、三側性Rbと呼ばれる。眼に発生するRBが通常治癒可能であるのに対して、松果体芽腫はまれであり、通常致死的である[de Jong et al 2014]。
その他の腫瘍
他の特定の眼以外の腫瘍(総称して第二の原発腫瘍と呼ぶ)の発生リスクも上昇する。ほとんどの場合、骨肉腫、軟部組織肉腫(ほとんどは平滑筋肉腫、横紋筋肉腫)、または黒色腫である[Kleinerman et al 2007, Marees et al 2008, Kleinerman et al 2012]。これらの腫瘍は思春期か成人期に発症することが多い。第二の原発腫瘍の発生頻度は外部からの放射線照射治療を受けた患児では50%以上に増加する[Wong et al 1997]。高容量の放射線照射治療を受けていない遺伝性Rb患者も、晩発性のがんを発症する生涯リスクが高い[Fletcher et al 2004, Kleinerman et al 2012, Dommering et al 2012b, Temming et al 2015]。
遺伝型と臨床型の関連
大多数の遺伝性Rb家系では、生殖細胞系列の病的バリアントを持つ全ての血縁者において両眼に複数の腫瘍が発生する。しかし、発端者(家系内における最初のRb罹患者)が片側にしかRbを発生しないことは珍しくはない。こうした家系のほとんどでは、フレームシフトやナンセンス変異によって生じたRB1の“null”アレルを受け継いでいる。ごく少数の例外を除いて、RB1遺伝子の“null”アレルは浸透率99%以上の完全浸透の形で受け継がれる[Taylor et al 2007, Dommering et al 2014, Frenkel et al 2016]。
表現型が軽くなることによって浸透率が一見低く見える家系(片側性Rbに多い)や不完全浸透(25%以下)の家系もあるが、全体の10%以下である。このように浸透率の低い家系は、変異RB1アレルが、明らかなインフレーム変異、ミスセンス変異、特定のスプライスサイトの変異、エクソン1の特定のindel変異、プロモーター領域の病的バリアントと関連しているといわれている。
第3のカテゴリーの家系では、どちらの親由来の病的バリアントかで、家系内で異なる浸透率を示す(片親起源効果;一方の親家系でのみ連鎖が見られる遺伝) [Klutz et al 2002, Eloy et al 2016, Imperatore et al 2018]。
通常の染色体検査で検出される13q14の欠失は、同領域にあるRB1以外の遺伝子群の欠失も伴うが、これを有する患児は発達遅滞[Castéra et al 2013]と軽度~中等度の顔面奇形徴候を呈する。13q14のかなりの大きさの欠失では表現型は軽くなる。こうした欠失を有する患児の多くは片側性のRbを呈し、腫瘍を発症しない場合もある[Mitter et al 2011]。RB1遺伝子のセントロメア側に隣接したMED4遺伝子の欠失によって、RB1遺伝子とMED4遺伝子の両方にまたがる大きな欠失をもつ患者における症状の軽症化が説明される[Dehainault et al 2014]。
浸透率
「遺伝型と臨床型の関連」の項目を参照
病名
Rbの古くからの別名はGlioma retinaeである.
頻度
Rbの頻度は1人/15,000〜20,000出生児と推定されている[Moll et al 1997, Seregard et al 2004]。
遺伝学的に関連している(アレリックな)疾患
本GeneReviewで述べられている以外の表現型で、RB1の病的バリアントとの関連が知られているものはない。
遺伝性Rbの他の所見が認められずに単一の腫瘍として発生した膀胱尿路粘膜がん、子宮内膜がん、肉腫、肺扁平上皮がん、および肺腺がん(portal.gdc.cancer.gov)を含む散発性腫瘍は、生殖細胞系列には存在しないRB1の体細胞由来の病的バリアントを保有していることが多い。このような状況においては、上記の腫瘍罹患は遺伝性素因によるものではない。
鑑別診断
小児期に見られる以下のような眼疾患は臨床的にRbと類似している。
- 持続性原発性硝子体過形成やCoats病(OMIM 300216)を含む孤発性の先天性疾患。
- 結節性硬化症、ノリエー病(OMIM 310600)、色素失調症、家族性滲出性硝子体網膜症(原文のこの部分に注釈のある、Phenotypic Series: Exudative vitreoretinopathyを参照)、von Hippel-Lindau病などの遺伝性疾患。
- 眼におけるイヌ回虫の外寄生。
臨床的マネジメント
網膜芽細胞腫(Rb)治療のガイドラインが策定されている(Canadian Retinoblastoma Society 2009)。
最初の確定診断後の評価
Rbと診断された患者の病気の程度を確定するために以下の評価が推奨されている。
- 治療計画をたてる前に眼内外の腫瘍の範囲を見極めるべきである。罹患した眼は、病変の程度、腫瘍が眼球外に拡がる可能性に応じて、がんのステージが割り当てられる[Mallipatna et al 2017]。腫瘍の広がりは、特に腫瘍と視神経との関係に焦点を当てた、麻酔下での臨床検査と超音波またはMRIによって推定される。頭部MRIは三側性腫瘍を意味する松果体芽腫の検出の上で有用である。放射線により誘発されるかもしれない二次がん発症リスクが増加するため、CT スキャンは推奨されない。
- 眼外症状のリスクを伴う非常に大きな腫瘍の場合は、診断時や摘出した眼球が視神経への浸潤を伴う場合や脈絡叢への浸潤が発見された場合に、骨髄穿刺および脳脊髄液の検査が行われる場合もある。
- Rbが眼外に拡がっている場合は、患児への最適なケア決定のために癌のステージを評価する。
- 稀に、Rbの家族歴があり、患児が斜視か視力低下を呈している時には、網膜腫瘍が小さく、光干渉断層撮影(optical coherent tomography)で発見されることがある[Soliman et al 2017b]。
- 臨床遺伝専門医、遺伝カウンセラーへの紹介が推奨される。
病変の治療
治療の目標は第一に生命、そして視力を守ることである。最適な治療は多岐にわたっているため、Rbの治療経験が豊富な眼科、小児腫瘍、病理、放射線など各分野の専門家がチームで診療する。
治療法の選択には、腫瘍の程度(眼内、眼外)、腫瘍の病期に加えて、腫瘍の数(単発性か、片側性で多発性か、両側性か)、眼内腫瘍の位置や大きさ、硝子体播種の有無、視力を残す可能性、眼外への拡散の程度および種類、および利用可能な資源など、あらゆる情報を加味して行う。
治療の選択肢には、眼球摘出術;冷凍凝固療法;レーザー、レーザーか凍結療法との併用、またはその後に行われる、動脈内化学療法を含めた眼球限定もしくは全身にわたる化学療法;放射線療法(アイソトープ強膜上癒着照射);そして最後の手段としての外部からの放射線照射療法がある。
二次発症の予防
晩発性の二次がん発症の生涯リスクを最小限にとどめるために、放射線照射(X線、CTスキャン、外部照射を含めて)は可能な限り避けるべきである。これらの検査は絶対的に必要な場合にのみ行われるべきである。
サーベイランス
Rbを発症した患者またはリスクのある患者へのサーベイランスに関する情報は網膜芽細胞腫診療ガイドラインに記載されている。発症のリスクがある小児の臨床的スクリーニングに関するガイドラインが公表されている[Skalet et al 2018]。
最初の診断後のRbの検出
Rbの治療に成功してからも、定期検診を続け新しい眼内腫瘍の早期発見につとめる必要がある[Skalet et al 2018]。
- RB1遺伝子の生殖細胞系列病的バリアントが同定されている患児(H1)は、生後6ヶ月までは3~4週間ごとに麻酔下での眼の検査が、その後3歳まではそれよりはやや間隔を置いての検査が推奨される。臨床検査は、協力的な患児では7歳までは3~6ヶ月毎に、その後は毎年、最終的には隔年での検査が生涯続けられる。
- 片側性のRbを持ち、生殖細胞系列でヘテロ接合性の病的バリアントが検出されない患児は、低レベルモザイク(H0*)の可能性があり、もう一方の眼にも腫瘍が発生する可能性がある[Temming et al 2013]。しかしそのリスクは小さいので、麻酔下の検査の代わりに超音波検査(簡単で非侵襲的な検査)を含む眼の定期的な臨床検査に変更することも可能である。
- 網膜細胞腫(Rb関連の前癌性の網膜疾患)患者では、早期に病変を発見するために、1~2年ごとに網膜の検査と画像検査を行う。
Rb患者における眼外の二次がんの検出
肉腫、メラノーマ、その他の特異的ながんを含む二次がんのリスクが高いため、兆候や症状があれば速やかに対応することが推奨される。定期的な全身のMRI検査が、生殖細胞系列にヘテロ接合性のRB1遺伝子病的バリアントを持つ患者における、二次がんのスクリーニングに有効であるかについての検証が進行中である。
避けるべき薬/環境
Fletcherら[2004]によると、DNA損傷因子(放射線、たばこ、紫外線)への暴露を最小限にとどめることによって、遺伝性Rbサバイバーsurvivorの発がんリスクを減らすことが出来る。こうした人においては、化学療法への暴露を制限することで発がんリスクを減少させる可能性がある。
リスクのある血縁者への対応
米国臨床腫瘍学会 (American Society of Clinical Oncologists: ASCO)は遺伝性Rbをグループ1(遺伝学的検査がリスクのある血縁者の標準的マネジメントの一部である遺伝性疾患)と判定している[American Society of Clinical Oncology 2003]。明らかな症状のないリスクのある血縁者は、なるべく早期に、経験豊富な眼科医による眼の検査を受け、Rbの早期発見につなげることが適切である。
以下の項目を実施する:
- 家系内で病的バリアントが特定されている場合は、分子遺伝学的解析を行う、これによって病的バリアントを受け継いでいない血縁者は多大なコストのかかるスクリーニングを省略することができる[Noorani et al 1996, Richter et al 2003]。
- 上述のように、出生後すぐにRbの治療経験のある眼科医による眼の検査を行う(「サーベイランス-最初の診断後のRbの検出」参照)。幼い、非協力的な子どもには麻酔下での検査が必要になることもある。
リスクのある血縁者の検査の遺伝カウンセリングのための情報は、「遺伝カウンセリング」の項目を参照。
研究中の治療法
広範囲にわたる疾患や病態の臨床試験に関する情報は、ClinicalTrials.gov(米国)(https://clinicaltrials.gov)とEU Clinical Trials Register(ヨーロッパ)(https://www.clinicaltrialsregister.eu/ctr-search/search)より入手できる。
注:この疾患に関する臨床試験はあまり多くない。
遺伝カウンセリング
「遺伝カウンセリングは個人や家族に対して遺伝性疾患の本質,遺伝,健康上の影響などの情報を提供し,彼らが医療上あるいは個人的な決断を下すのを援助するプロセスである.以下の項目では遺伝的なリスク評価や家族の遺伝学的状況を明らかにするための家族歴の評価,遺伝子検査について論じる.この項は個々の当事者が直面しうる個人的あるいは文化的な問題に言及しようと意図するものではないし,遺伝専門家へのコンサルトの代用となるものでもない.」
遺伝形式
遺伝性Rbは常染色体優性遺伝である。
血縁者のリスク
患児の親
- 遺伝性Rbと診断された患児の中には、RB1病的バリアントを罹患もしくは非罹患の親から受け継いでいる場合がある。
- 孤発例(家系内で唯一の罹患者)でヘテロ接合性の生殖細胞系列由来RB1病的バリアントを持つ発端者の約5%が、発端者の非罹患親も同じ病的バリアントを保有している。ほとんどの場合、ミスセンス変異でモザイクもしくはヘテロ接合性の“浸透率の低い”病的バリアントである[Rushlow et al 2009, Skalet et al 2018]。
- 発端者はde novoの生殖細胞系列由来RB1病的バリアントにより、遺伝性Rbを発症していることもある。家族歴のない遺伝性Rb患者の多くは、de novo変異で発生した病的バリアントにより発症している。
- 見かけ上、de novo変異により病的バリアントをもつ発端者の両親は分子遺伝学的検査が推奨される。発端者のRB1遺伝子における病的バリアントがわかっていない場合、発端者の両親にはRb、網膜細胞腫、Rb関連眼疾患の経験豊富な眼科医による診察が推奨される。
- 発端者で同定された病的バリアントが両親のどちらの白血球DNAからも検出されない場合、発端者の生殖細胞系列におけるde novo変異、または両親どちらかの生殖細胞系列のモザイク、の2つの可能性が考えられる。MLPAまたはサンガーシークエンシングで親がモザイクであると検出される確率は>2%である[著者, 未発表データ]。アレル特異的PCR [Rushlow et al 2009]あるいは次世代シークエンサー[Chen et al 2014]のような高感度の方法では、>4%の家系で親のモザイクが検出される。
- 家系内の疾病(網膜細胞腫)の認識不足、低レベルのモザイク、浸透率の低下のために、遺伝性Rbと診断された患者において家族歴がないように見える可能性がある。そのため、発端者の両親の適切な臨床検査および/または、分子遺伝学的検査を行うことなしに家族歴がないと判断することはできない。
- 発端者がRB1遺伝子病的バリアントの体細胞モザイクによってRbに罹患した場合(つまり、発端者の胚発生時に生じたバリアントが原因のとき)、両親は病的バリアントを持たない。
注:病的バリアントが親ではじめて発生している場合、その親は体細胞性モザイクを持つ可能性があり、親はまれに片側性のRbに罹患するか、もしくはRb非罹患である。
患児の同胞
同胞のリスクは親の表現型と遺伝的状態による。
- 親の表現型
- 発端者の親と発端者が両側性Rbに罹患している場合、患児の同胞がRB1遺伝子病的バリアントを受け継ぐ確率は50%となる。まれに”家族性で低浸透率のRb”家系があり、その家系では病的バリアントを持つ同胞が腫瘍を発生する可能性は低くなる。
- 両親が臨床的に罹患していない場合、発端者の同胞のリスクは低い(1-2%、表3参照)。臨床的に罹患していない両親を持つ発端者の同胞であっても、遺伝性Rbのリスクは依然として高い、なぜなら、両親が低浸透率の変異をもつ可能性や生殖細胞系列モザイクの可能性があるからである。
- 両親の遺伝的状態
- 発端者で同定された病的バリアントについて親がヘテロ接合である場合、同胞がその病的バリアントを受け継ぐ可能性は50%で、同胞のRB1病的バリアントの検査が正当化される。まれにみられる”家族性で低浸透率のRb”家系では、病的バリアントを持つ同胞が腫瘍を発症する可能性は低くなる。
- 発端者にみられるRB1遺伝子の病的バリアントが両親のどちらの白血球DNAからも検出されない場合、同胞の再発率は低い(<5%)が生殖細胞系列のモザイクの可能性があるため、一般集団よりは高くなる。そのため、それぞれの同胞が発端者にみられるRB1遺伝子の病的バリアントを持つか検査をすることが推奨される。もし、既知の家族性RB1病的バリアントが同定されない場合、同胞は”H0”である[Mallipatna et al 2017, Soliman et al 2017a, Skalet et al 2018]。
- 発端者が、白血球DNAのような非腫瘍細胞において、腫瘍を発生しうるRB1遺伝子の変異を明らかにモザイクで持つ場合、病的バリアントは受精後に発生し、両親は生殖細胞系列にRB1遺伝子の病的バリアントを持たないと推定される。この場合同胞のリスクは高くならないため、発端者にみられるRB1遺伝子の病的バリアントの検査を正当化するものではない。
- 分子遺伝学的検査が実施できなかったり、有意な結果が得られない場合は、腫瘍の発生状況(単発性か多発性か)や家族歴に基づいた経験的リスクが用いられる(表3)[Skalet et al 2018]。家族歴がない患児の同胞における、低いが無視できないリスクは、おそらく1人の親が浸透率の低いRB1遺伝子の生殖細胞系列病的バリアントを有していること、または1人の親が生殖細胞系列を含むRB1遺伝子病的バリアントの体細胞モザイクを有していること、を反映していると推測される。
- 一方の親が細胞学的検査で検出されうるレベルの13番染色体の均衡型の転座や再構成を持つ場合、同胞は不均衡型の染色体再構成を受け継ぐ可能性が高い。
発端者の子
遺伝性Rb患者の子は50%の確率でRB1遺伝子の病的バリアントを受け継ぐ。
- 発端者が孤発性であるが両側性のRbを有する場合、生殖細胞系列由来のがん発症の素因となるRB1病的バリアントの存在が考えられ(H1)、子が病的バリアントを受け継ぐ可能性は50%である[Mallipatna et al 2017]。発端者の病的バリアントが判明している場合は子の発症前検査が可能である。
- 発端者が孤発性で、片側性であるが多発性のRbを有していたら、子の再発率は低い[Rushlow et al 2009]。
- 単発性で片側性でありまた家族歴がない患者の子のリスクは、6%であり、これは患者が低浸透率のRB1遺伝子の生殖細胞系列病的バリアントを持っている、または患者が生殖細胞系列を含む体細胞モザイクを持っている可能性を示唆している。“家族性で低浸透率のRb”家系における発がんのリスクは、高浸透率のRB1遺伝子nullアレル家系における95%よりは低い。
- 発端者の白血球DNAにおいて、腫瘍細胞で検出されたRB1遺伝子の病的バリアントが検出されない場合、発端者が腫瘍細胞で検出された病的バリアントを生殖細胞系列のモザイクで持つ可能性は推定で1.2%ある。子に生殖細胞系列の病的バリアントを受け継ぐリスクは0.6%である[Richter et al 2003]。子の分子遺伝学的検査では、発端者の腫瘍で検出された2つの変異アレル両方を検査する。
- 腫瘍で検出された病的バリアントのうち1つが発端者の白血球DNAにおいてモザイクであった場合、生殖細胞系列にそのバリアントを含む割合は不明である。すべての子において白血球DNAで検出された病的バリアントの有無を調べる必要がある。
表3 RB1の生殖細胞系列病的バリアントが同定されていない場合における、同胞や子のRb発生の経験的リスク
| 患者の腫瘍発生状況 | 家族歴 | 患者の同胞 | 患者の子 | ||||
|---|---|---|---|---|---|---|---|
| 両側性 | 片側性 | ||||||
| 多発性 | 単発性 | ||||||
| × | なし | 2%1 | 50% | ||||
| × | なし | 1-2%1 | 6-50% | ||||
| × | なし | 〜1% | 6% | ||||
| × | あり | Variable2 | Variable2 | ||||
| × | あり | 50% | 50% | ||||
- 他に罹患した同胞がいない場合[Musarella & Gallie 1987, Draper et al 1992, Skalet et al 2018]。
- 片側性Rbの家系では浸透率が大きく異なる。
発端者の他の家族
他の家系員のリスクは発端者の親の遺伝的状況により異なる。すなわち、親がRB1遺伝子の生殖細胞系列病的バリアントを持つならば、その家系員はリスクがある可能性がある。
遺伝カウンセリングに関連した問題
早期の診断と治療を目的としたリスクのある血縁者への対応は、「マネジメント」と「リスクのある血縁者への対応」の項目を参照。
発症前検査
未発症のリスクのある血縁者の発症前検査を行うには、家系内のRB1遺伝子の病的バリアントが明らかになっている必要がある。
見かけ上、de novo変異によるように見える病的バリアントを持つ家系における注意点
遺伝性Rbの発端者の両親がどちらも病的バリアントを持たず、臨床的に罹患していない場合、RB1遺伝子の病的バリアントはde novo変異によるものである[Skalet et al 2018]。しかし、医学的ではない理由によることも考えられる。例えば、父親か母親が違う(生殖補助医療による場合など)、非公開の養子縁組の場合などである。
遺伝的発がんリスクとカウンセリング
分子遺伝学的検査の受検に関わらず、発がんリスクの評価を通じてリスクのある者を明らかにすることの、医学的、心理社会的、倫理的な影響についての包括的な記述については、cancer genetics risk assessment and counseling-for health professionals (part of PDQ®, National Cancer Institute)を参照。
家族計画
- 遺伝的なリスクを決定し、出生前/着床前遺伝学的検査の実施可能性を議論するのに最適なタイミングは、妊娠前である。
- 罹患している、または遺伝的リスクがある若い血縁者には遺伝カウンセリング(子への遺伝の可能性と生殖に関する選択肢についての話し合いを含む)を推奨する[Dommering et al 2012a]。
DNAバンキング
DNAバンキングは、将来使用する可能性を見越してDNAを保存しておくことである。検査方法や遺伝子、バリアント、疾患に対する理解が将来的に改善されることが予想されるので、罹患者のDNAバンキングを考慮すべきである。可能であれば、白血球から抽出したDNAと腫瘍から抽出したDNAを保存しておく(これは米国の状況であり、日本では基本的にこうしたサービスを行っていない。訳者注)。
出生前検査と着床前検査
Rbの家族歴が認められた場合、ハイリスク妊娠を最適に管理するために様々な選択肢がある[Canadian Retinoblastoma Society 2009, Soliman et al 2016]。
- 罹患した家族のRB1遺伝子病的バリアントが判明している場合、ハイリスク妊娠に対する出生前検査や着床前遺伝学的検査が可能である(日本では現時点では対象ではないが、2020年秋現在,着床前診断の対象となるか日本産科婦人科学会を中心に検討が行われている。訳者注)。
- RB1遺伝子病的バリアントが胎児で検出されたら、通常サイズの眼内腫瘍を発見するために胎児超音波検査を行うこともある。もし発見されれば、早期治療のために早期産で分娩させるという選択肢もありうる[Sahgal et al 2006]。超音波検査で腫瘍が観察されない場合にも、RB1遺伝子に病的バリアントをもつ新生児の30%は視力を脅かしうる微細な腫瘍を持つことから、36週での出産が推奨されることがある。
- 家系におけるRB1遺伝子の病的バリアントが明らかでない場合、出生前超音波検査またはMRIによって罹患した胎児における比較的大きなRbを検出しうるが、こうした検査は、微小なRb腫瘍を検出するのに十分な感度ではない。
検査の目的が早期診断(そして早期治療)ではなく妊娠中絶である場合には、医療専門家と家族の間に出生前検査の使用についての認識の違いがあるかもしれない。ほとんどのセンターで出生前検査をするかどうかは両親が選択するべきものと考えているが、このような事例では議論することは有用であろう。
関連情報
GeneReviewsスタッフは患者とその家族のために、以下の疾病ごとあるいは包括的なサポート組織を選定した。GeneReviewsは他の組織が提供する情報に責任を負うものではない。選択基準については、原文のこの部分にリンクがある。
- Childhood Eye Cancer Trust (CHECT)
The Royal London Hospital
Whitechapel Road
London E1 1BB
United Kingdom
Phone: +44 020 7377 5578
Fax: +44 020 7377 0740
Email: info@chect.org.uk
www.chect.org.uk
- My46 Trait Profile
Retinoblastoma
- National Library of Medicine Genetics Home Reference
Retinoblastoma
- National Retinoblastoma Parents Group
PO Box 317
Watertown MA 02471
Phone: 800-562-6265
Fax: 617-972-7444
Email: napvi@perkins.pvt.k12.ma.us
- NCBI Genes and Disease
Retinoblastoma
- World Eye Cancer Hope (WE C Hope)
- American Childhood Cancer Organization (ACCO)
6868 Distribution Drive
Beltsville MD 20705
Phone: 855-858-2226 (toll-free); 301-962-3520
Fax: 301-962-3521
Email: staff@acco.org
www.acco.org
- National Cancer Institute (NCI)
BG 9609 MSC 9760
9609 Medical Center Drive
Bethesda MD 20892-9760
Phone: 800-4-CANCER
Email: NCIinfo@nih.gov
Children with Cancer: A Guide for Parents
- National Federation of the Blind (NFB)
200 East Wells Street
(at Jernigan Place)
Baltimore MD 21230
Phone: 410-659-9314
Fax: 410-685-5653
Email: pmaurer@nfb.org
www.nfb.org
- eyeGENE - National Ophthalmic Disease Genotyping Network Registry
Phone: 301-435-3032
Email: eyeGENEinfo@nei.nih.gov
www.nei.nih.gov/eyegene
分子遺伝学
本項目とOMIM tablesの情報は、GeneReviewの他の情報とは一部異なる可能性がある。最新の情報はOMIM tablesを参照。-ED.
表A.
Retinoblastoma: Genes and Databases
| Gene | Chromosome Locus | Protein | Locus-Specific Databases | HGMD | ClinVar |
|---|---|---|---|---|---|
| RB1 | 13q14.2 | Retinoblastoma-associated protein | RB1 database rb1-lsdb |
RB1 | RB1 |
データは下記の基準を参照して編集した。遺伝子表記はHGNC、染色体上の位置はOMIM、タンパク質名はUniProtより。データベース(Locus Specific, HGMD, ClinVar)の説明は原文のこの部分をクリック。
Table B.
OMIM Entries for Retinoblastoma (View All in OMIM)
| 180200 | RETINOBLASTOMA; RB1 |
| 614041 | RB TRANSCRIPTIONAL COREPRESSOR 1; RB1 |
分子病理学
ごくまれな例外を除いて、腫瘍の発生は、正常なRB1アレルを持たない細胞ではじまる[Rushlow et al 2013](図1参照)。
遺伝子の構造
27個のエクソンが転写され、4.7kbのmRNAにスプライスされる。他の機能しうるスプライス構造はない。よく使用される参照配列はNM_000321.2(LRG_517, t1)である。遺伝子とタンパク質の詳細な情報については、表AのGeneを参照。
多型(Benign variants)
2.7kbのORF中に多型が多くみられる部分はないが、イントロンの変異、2つの高度に多型を持つマイクロサテライト(Rb1.20, Rbi2)、1つのミニサテライト(RBD)を有する。
病的バリアント(Pathogenic variants)
Rb患者の白血球DNAまたは腫瘍DNAから2,500以上の一塩基変異が検出されており、そのうち1,700について記録されている(表A, Locus Specific参照)。RB1の病的バリアントの大部分は、通常、一塩基置換、フレームシフト、またはスプライス部位のバリアントによるout-of-frameとなるエキソンスキッピングにより、早期の終止コドンをもたらす。病的バリアントはRB1遺伝子のエクソン1から25とプロモーター領域に散在している。1家系においてエクソン27に病的と思われるバリアントが検出されている[Mitter et al 2009]。繰り返し検出される病的バリアントは、CGAコドンの一部のメチル化されたCpGジヌクレオチド、またはイントロン12のスプライスドナー部位にも認められた。他の重要なタイプの病的バリアントは複雑な再構成および欠失である[Albrecht et al 2005, Rushlow et al 2009, Castéra et al 2013]。
通常の遺伝子産物
RB1遺伝子は細胞周期調節(G1期からS期への移行)機能をもち、普遍的に発現する核タンパク質をコードする。RBタンパク質はS期に入る前にCyclin-dependent kinase (cdk) 系因子によってリン酸化される。リン酸化されると、ポケット部分への結合活性が失われ、結果として細胞タンパク質の放出が起こる。レビューはDick & Rubin [2013], Dimaras et al [2015]and Dyson [2016]を参照。
異常な遺伝子産物
RB1遺伝子の病的バリアントは、細胞周期調節機能を失ったタンパク質の発現を引き起こす。低浸透率Rbに関連する病的バリアントによりコードされるたんぱく質では、部分的な活性の保持がみられている[Bremner et al 1997, Otterson et al 1997, Sánchez-Sánchez et al 2007]。
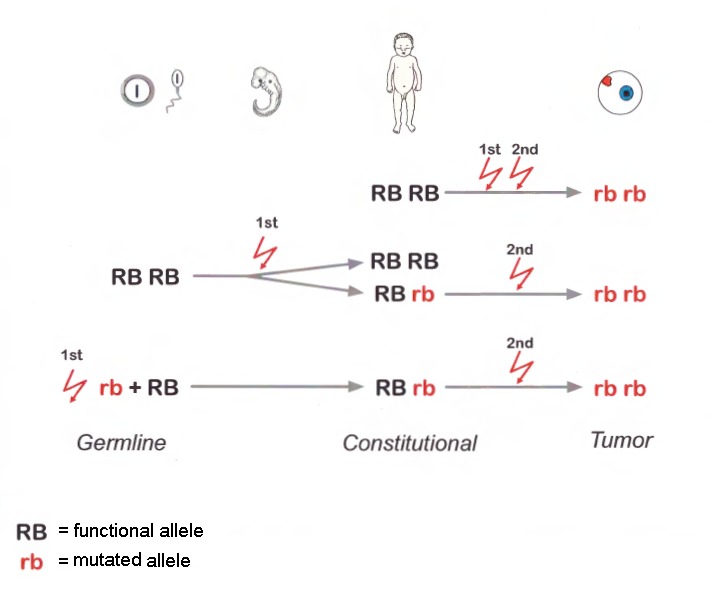
図1
遺伝性と孤発性の網膜芽細胞腫(Rb)の分子遺伝学的機構の模式図。RbはRB1遺伝子の両アレルが変異したところから始まる。
孤発性のRbでは、二つの変異(最初と2番目)は体細胞で起こる(体細胞変異)。
注)体質性細胞(例;末梢血)DNAでは変異は検出されない(2つとも正常アレルRB RB)
遺伝性のRbでは、2番目の変異のみが体細胞性変異である。それぞれの2番目の変異がそれぞれの病巣での腫瘍を誘発する(多発性Rb腫瘍)。1番目の変異は生殖細胞を通じて受け継がれる(生殖細胞系列でのde novo変異であっても親から受け継いだ変異であっても)
注)罹患者の体質性細胞では、変異はヘテロ接合性である(Rb rb)
時に、罹患児の最初の病的バリアントは受精後の胚の成長期に起こることもある。
注)罹患児は最初の病的バリアントを体細胞モザイクで持つ。最初の病的バリアントが発生した細胞が属する幹細胞系列の細胞から腫瘍が発生することがある。
更新履歴
-
GeneReview 著者:Dietmar R Lohmann, MD; Brenda L Gallie, MD.
日本語訳者: 福島久代(札幌医科大学大学院修士課程遺伝カウンセリングコース),櫻井晃洋(札幌医科大学 医学部遺伝医学)
GeneReview 最終更新日: 2013.3.28. 日本語訳最終更新日: 2015.11.17 - GeneReview 著者:Dietmar R Lohmann, MD; Brenda L Gallie, MD.
日本語訳者: 福島久代(札幌医科大学大学院修士課程遺伝カウンセリングコース),
櫻井晃洋(札幌医科大学 医学部遺伝医学)
GeneReview 最終更新日: 2015.11.19 日本語訳最終更新日: 2016.9.7 - GeneReview 著者:Dietmar R Lohmann, MD; Brenda L Gallie, MD.
日本語訳者: 島田咲(京都大学大学院医学研究科),山田崇弘(京都大学医学部附属病院遺伝子診療部)
GeneReview最終更新日: 2018.11.21 日本語訳最終更新日: 2016.9.7[in present]