FMR1関連疾患
(FMR1-Related Disorders)
[Includes: Fragile X Syndrome, Fragile X-Associated Tremor/Ataxia Syndrome, FMR1-Related Premature Ovarian Failure]
Gene Review著者: Robert A Saul, MD, FACMG, Jack C Tarleton, PhD, FACMG
日本語訳者: 和田敬仁(信州大学医学部社会予防医学講座遺伝医学分野)
Gene Review 最終更新日: 2005.12.2. 日本語訳最終更新日: 2006.2.14.
要約
疾患の特徴
FMR1関連疾患には脆弱X症候群,脆弱X関連振戦・失調症候群(FXTAS),FMR1関連早期卵巣機能不全症(POF)が含まれる.脆弱X症候群はFMR1遺伝子のfull mutationをもつ患者で発症し,男性患者では中等度精神遅滞,女性患者では軽度精神遅滞が特徴である.男性では特徴的顔貌(大頭,長頭,前額や顎の突出,目立つ耳),組織結合所見(関節の弛緩),大きい精巣(思春期後)を呈することがある.行動異常は,時に自閉症関連疾患を含み,よく認める所見である.FXTASはFMR1遺伝子のpremutationを持つ男性で発症し,成人期発症,進行性の小脳失調,企図振戦を特徴とする.POFはFMR1遺伝子のpremutationを持つ女性の約20%で発症する.
診断・検査
FMR1関連疾患の診断はFMR1遺伝子の変異を検出することによる.FRXの99%以上の患者はFMR1遺伝子の異常なメチル化を伴う,CGGの3塩基繰り返し配列の伸長(200以上)によるfull mutationを持つ.FRXの原因となる他のFMR1遺伝子変異は欠失,RNAスプライシングに異常をきたす点変異,ミスセンス変異である.FXTASの全患者,およびPOFの女性全患者はFMR1遺伝子のpremutation(3塩基繰り返し配列が59-200)をもつ.FMR1遺伝子の3塩基繰り返し配列の伸長とメチル化の異常の両者が臨床的に利用可能な分子遺伝学的検査により検出可能である.
遺伝カウンセリング
FMR1遺伝子のfull mutation (CGGの3塩基繰り返し配列の伸長200以上)を持つ患者の母親は,皆,伸長したFMR1遺伝子変異の保因者である.母親や母親の家系はFRXやFXTASに罹患した子孫を持つリスクがある.FXTASの男性患者はFMR1遺伝子のpremutationを息子に伝えることはなく,娘には必ず伝わり,premutationの保因者となる.出生前診断は絨毛採取あるいは羊水穿刺による胎児細胞のDNAを用いた分子遺伝学的検査により,臨床的に検査可能である.(訳者注:日本ではこの疾患に対する出生前診断は,コンセンサスが得られていないと考えられる.)
診断
臨床診断
脆弱X症候群(Fragile X syndrome: FRX) FRXの診断は中等度精神遅滞の男性や軽度精神遅滞の女性で疑われる.患者は正常の発育で,疾患に関連した奇形はない.FRXの臨床症状は非特異的である.診断はFMR1遺伝子変異の検索による.
脆弱X関連振戦・失調症候群 (Fragile X-associated tremor/ataxia syndrome: FXTAS) FXTASの確定診断にはFMR1遺伝子のpremutationがあることと,企図振戦や失調歩行(2つの大臨床所見)を伴い,MRIで中小脳脚や脳幹(1つの大神経放射線学的所見)に白質病変を認めることが必要である.その他の,小神経放射線学的所見にはMRIの小脳白質の白質病変や中等度~広汎な萎縮所見がある.その他の小臨床的基準はパーキンソニズム,中等度から重症の記憶障害,あるいは行動認知障害である.
1つの大神経放線学的所見と1つの小臨床的所見,あるいは2つの大臨床的所見があれば,FXTASの診断が疑われる.(probable diagnosis)
1つの小神経放線学的所見と1つの大臨床的所見があれば,FXTASの診断の可能性がある.(possible diagnosis)
FMR1関連早期卵巣機能不全症(FMR1-related premature ovarian failure:POF)FMR1遺伝子のpremutationを持つ女性で40歳前に月経がなくなることで定義される.
検査
染色体分析 脆弱部位を誘導するために特別の培養液を用いた染色体検査法はもはや,FRXの診断には使われていない.それは,敏感度が低く,また分子遺伝学的検査よりもコストがかかるからである.
蛋白分析 蛋白分析は,多くの臨床検査では日常的には行われていないが,FMR1遺伝子産物であるFMRP(FMR1蛋白)の測定を行っている研究所は数カ所ある.FMRP解析が役に立つのは,精神遅滞患者のスクリーニングや,非典型的な臨床症状を呈する患者における細胞でのFMRP産生を解析する時である.FRX重症度はFMRP発現の程度に関連していると考えられているので,罹患者におけるFMRP 産生の解析は疾患の重症度の予後指標として,考えられる.
分子遺伝学的検査
遺伝子 FMR1遺伝子はFMR1関連疾患の唯一の責任遺伝子である.
対立遺伝子のサイズ FMR1遺伝子の対立遺伝子はその繰り返し配列の長さで分類される.しかし,その分類は絶対的なものではなく,家族歴と繰り返し配列の不安定さの療法を考慮して判断されるべきである.
- 正常対立遺伝子 約5-40リピートである.このサイズの対立遺伝子はリピート数の増減なしに,安定して受け継がれる.安定した正常対立遺伝子では,CGG領域は9か10個のCGGリピートごとにAGGの3塩基が入る.このAGGは複製時のDNA2重鎖の滑りを起こりにくくしてリピートを安定させる役割があると考えられている.
- 変異する(伸長する)可能性のある正常対立遺伝子
- 中間対立遺伝子(グレイゾーン) この中間対立遺伝子(intermediate alleles)の定義についてはコンセンサスが得られていないが,おおよそ41-58リピート数と大まかに定義される.歴史的に,中間対立遺伝子に分類される最大のリピート数は54である.実際,現時点で58以下のリピート数の対立遺伝子が患者に受け継がれたという報告はないので,この中間に属するリピート数のレンジは少し高いかもしれない.
注:1)多くの臨床検査機関ではリピート数の計測はプラス・マイナス2-3リピート数として報告されるので,55-58リピート数はpotential premutationとして考える方が賢明かもしれない.2)41-49リピート数の対立遺伝子が親から子どもへ受け継がれた時の不安定性のリスクは小さい.リピート数の変化は非常に小さい.(+/- 1または2リピート) 3)50以上のリピート数を持つ対立遺伝子ではリピート数の不安定さの頻度やその大きさがお増加する.4)Nolinらは,59リピート数の対立遺伝子が母親から受け継がれた時にfull mutationになった症例を2例報告した.これは,1世代の遺伝によりfull mutationをきたした最小のリピート数である.5)大きい中間対立遺伝子のリピート数の不安定さの予測因子は途中にAGGを介在していない,純粋のCGGリピート数である.この純粋のリピート数が増加すると,とくに35以上の場合,不安定になる傾向がある.
- Premutation 対立遺伝子 約59-200リピート数である.このサイズの対立遺伝子は精神遅滞(MR)とは関係ないが,FXTASやPOFのリスクが高くなる.Premutation対立遺伝子の世代間の伝達時のリピート数の不安定さのため,このサイズの対立遺伝子を持つ女性はFRXに罹患した子どもをもつリスクがあると考えられる.
注:Premutationの上限は時々230となっていることもある.200も230も,サザン法により推定された数字であり,この方法ではリピートサイズは厳密に測定できない.
- Full mutation 対立遺伝子 リピート数は200以上であり,数100から数1000リピートであることがふつうである.リピート数が200を超えると,CGGリピートに含まれるシトシンの異常なメチル化が起こっている.
分子遺伝学的検査:臨床的利用
- 診断
- 保因者検査
- 出生前診断
分子遺伝学的検査:臨床的検査法
- PCR FMR1遺伝子の3塩基リピートに特異的なPCR法は正常あるいはpremutationのなかで少ないリピート数の検出に感度が高い.PCR法だけでも多くの対立遺伝子のリピート数を正確に推測できるが,premutationのなかでリピート数が多いものやfull mutationの対立遺伝子を検出することは出来ない.もし,FMR1リピート領域のPCRが,男性で正常あるいはpremutationを示した時,あるいは女性で2つの対立遺伝子がともに正常あるいはpremutationを示した場合,これ以上の検査は必要ない.しかし,まれではあるが,FMR1遺伝子のモザイクを持つ患者では,実際に偽陰性の誤診につながるような複雑なFMR1遺伝子変異を持っている時でも,PCR法では正常,中間型,あるいはpremutationのシグナルしか示さないかもしれない.サザン法を用いれば,このような複雑な変異でも検出可能である.
- サザンブロッティング サザン法はfull mutationや長いpremutationを含んだすべてのリピートの伸長を検出できるが,3塩基リピート数の解像度は低い.より正確なリピート数を計測するにはPCR法が用いられる.
- メチル化テスト FMR1遺伝子のメチル化状態の解析にサザン法が用いられる.メチル化状態を解析するのに用いられる最近のPCR法はいくつかの研究室で開発中であり,より迅速な検査法になるかもしれない.
- シークエンス解析 1%以下のFRXの患者で,FMR1遺伝子の欠失や,RNAのスプライシング異常あるいはミスセンス変異の原因となる一塩基置換の変異をもつ.
分子遺伝学的検査:研究
- FRXの患者の1%以下で,FMR1遺伝子の一部,あるいは全部の欠失をもつ.遺伝子のCGGリピート領域以外の欠失は,3塩基リピートの伸長を検出する通常臨床現場で行われている検査法では見逃される可能性がある.
- AGGリピートの数や部位がCGGリピートの安定性に重要であることが知られている.しかし,この検査は研究レベルで行われているのみである.
表1 FMR1関連疾患に用いられる分子遺伝学的診断
| 検査法 | 検出される変異 | 変異の検出率 | 検査の利用 |
|---|---|---|---|
| 目的とする変異の解析 | PCR: FMR1遺伝子のCGG伸長 | >99% | 臨床的に可能 |
| (正常のすべてのサイズと短いpremutation) | |||
| サザン法:FMR1遺伝子のCGGの伸長 | |||
| (すべてのリピート数);メチル化の状態 | |||
| シークエンス | FMR1遺伝子シークエンス変異 | <1% | 臨床的に可能 |
| Direct DNA | FMR1遺伝子の欠失 | <1% | 研究目的のみ |
Direct DNAとは,特定の疾患に関わる遺伝子変異を検出するために,変異解析,変異のスクリーニング,シークエンス解析の使用,あるいはその他の分子遺伝学的検査を意味する.
検査結果の解釈 略
発端者の検査手順
FMRの家族歴のある患者に対する検査の進め方は,原因不明の非特異的なMRを持つ患者のそれとは異なる.臨床現場におけるFRXの検査の複雑を考慮して,the American College of Medical Genetics はpolicy statement やガイドラインを出し,FRXの診断検査,スクリーニング検査,検査までの手順を推奨している.以下に,その要点を示す.
分子遺伝学的検査が勧められる患者
- 性別に関係なく,精神遅滞,発達の遅れ,自閉症を持つ患者で,特にa)FRXの何らかの身体的あるいは行動的特徴を呈する場合 b)FRXの家族歴がある場合 c)診断されていない精神遅滞を持つ男性あるいは女性が家系にいる場合
- FRX あるいはb)診断されていないMRの家族歴を持つものが,妊娠に関するカウンセリングを求めた時
- 保因者と分かっている母親の胎児
- 臨床症状に一致しないFRXの細胞遺伝学的検査の結果を示した患者.これには,(保因者であるリスクを含む)臨床的に強く適応があるものや,細胞遺伝学的検査の結果が陰性あるいは曖昧であるもの,細胞遺伝学的検査が陽性であるが臨床症状が非典型的であるものを含む.
2001年のガイドラインの推奨ではないが,最近の情報に基づくと,以下のグループに対して,分子遺伝学的検査が考慮される.
- 進行性の小脳失調症あるいは企図振戦をもつ50歳以上の男性患者
検査への手順
- DNA解析は,患者がFRXとFMR1遺伝子の3塩基リピートの伸長に関連する疾患かどうかを調べるための特異的な検査法である
- もし,MRの原因が不明の場合,FRXに対するDNA分析は通常行われる細胞遺伝学的検査を含む包括的な遺伝状態の評価の一つとして行われるべきである.細胞遺伝学的異常はFMRの検査が求められたMR患者において,FMR1の変異が見つかり頻度よりも同等か高い.
- FMRの家族歴が確定している,リスクのあるものに患者に対しては,DNA分析だけで十分である.しかし,もし,罹患者の診断がFMRの以前行われていた細胞遺伝学的検査のみに基づいているものであれば,診断を確定するために,罹患者の少なくともひとりはDNA分析を受けるべきである.
- 胎児の出生前診断は母親の保因者検査が陽性であった場合に,適応がある.もし,母親が保因者であるならば,胎児がFMR1遺伝子の正常あるいは異常対立遺伝子をもっているかどうかを確認するために,DNA分析が行われる.
- FMR1遺伝子のメチル化状態は採取の時期の絨毛細胞では確立していないので,CVSを用いた検査結果には注意が必要である.CVSは,胎児診断の標準的な技法であるが,曖昧な検査結果を確認するために羊水穿刺検査が必要になることがある.
FMR1遺伝子の3塩基リピートの伸長やそれに伴うメチル化の問題の複雑さから,医師はFMR1遺伝子の分子遺伝学的検査において十分な能力のある研究室を選ぶべきである.
検査のアルゴリズム
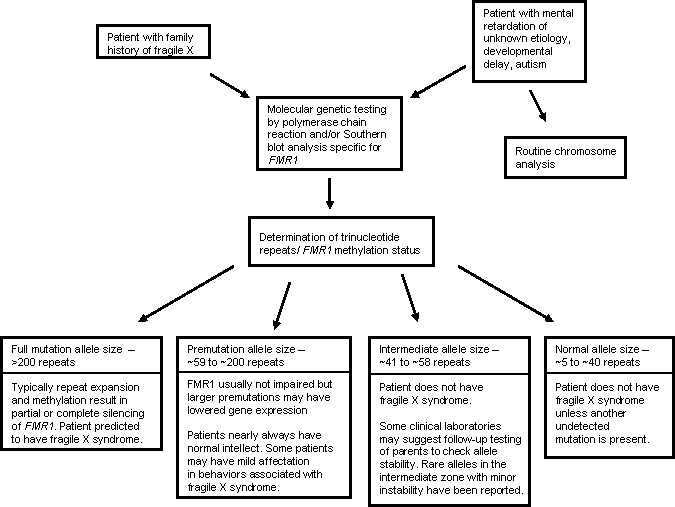
臨床像
自然経過
脆弱X症候群(FRX)
- Full mutationをもつ男性 Full mutationを持つ男性患者の臨床的特徴,すなわち,FMRは思春期に関して,多様である.思春期前の男性は正常発達を示すが,後頭前頭頭囲が大きい(>50パーセンタイル).就学前の患者では明らかではないその他の身体症状は,年齢と共に明らかとなる.これらは,頭部や顔(長頭,前額の突出,大きな耳,目立つ顎),や外性器(巨大精巣),運動や言語発達の遅れ,性格の異常(多活動性,手をぱたぱたさせる,手を噛む,癇癪発作,自閉症)である.思春期後の男性患者の行動には,触覚に対して神経過敏である,視線を合わせようとしない,反復言語,衝動行動,取り乱した行動がある.眼科,整形外科,循環器,皮膚科的問題も注意すべきである.
表2 FMR男性患者の臨床症状
| 運動発達の遅れ (罹患男児が獲得する年齢) |
お座り(10ヶ月) |
| 一人歩き(20.6ヶ月) | |
| 初めての有意語(20ヶ月) | |
| 思春期以前の特徴 | 発達の遅れ,特に言語 |
| 特有の基質:癇癪,多動,自閉症 | |
| 精神遅滞(IQ 30-50) | |
| 特徴的顔貌(長い顔,全額の突出,大きな耳,目立つ顎) | |
| 思春期以降の特徴 | 大きな精巣 |
| 行動の特徴(恥ずかしがり屋,視線を合わせない) | |
| 眼科的:斜視 | |
| 整形外科的:関節の過伸展,扁平足 | |
| その他の特徴 | 心臓:僧帽弁逸脱症 |
| 皮膚:柔らかくなめらかな皮膚 |
- Full mutationをヘテロにもつ女性 Full mutationをヘテロにもつ女性で,男性のFMR患者に認めるような身体的あるいは行動特徴を示す例が報告されているが,その頻度は低く症状も軽い.
FXTAS 脆弱X関連振戦失調症候群は,premutationを持つ男性で成人期発症,進行性小脳失調と企図振戦を特徴とする.他の神経学的所見は,短期記憶の喪失,実行機能の障害,認知障害,パーキンソニズム,末梢神経障害,下肢近位筋の筋力低下,自律神経障害である.浸透率は年齢に関連する.50-59歳の男性の17%,60-19歳の38%, 70-79歳の47%,80 歳以上の75%で症状が出現する.Premutationをもつ女性保因者でも,振戦や失調を呈すことがある.
FMR1関連卵巣早期機能不全(POF) POFはpremutationを持つ女性保因者で40歳前に閉経を呈する疾患である.Shermanらのreviewによると,premutationの保因者のPOFを発症するリスクは,一般人口で1%なのに対して,21%(推定で15-27%)とされている.POFは11歳で発症することもある.対照的に,full mutationの保因者ではPOFのリスクは高くならない.遺伝子型と臨床型の関連
FMR1遺伝子変異をもつ男性の臨床型は変異の性質による.FMR1遺伝子変異を持つ女性の表現型はFMR1遺伝子変異の性質とX染色体不活化による.
表3.FMR1遺伝子のリピート伸長変異のタイプ| 変異のタイプ | CGGリピートの数 | FMR1遺伝子 のメチル化 |
臨床状態 | |
|---|---|---|---|---|
| 男性 | 女性 | |||
| premutation | 59~200 | メチル化していない | 通常,罹患しない FXTASのリスクがある1 |
通常,罹患しない1 POF2とFXTAS3のリスクがある |
| full mutation | >200 | 完全にメチル化 | 100%罹患 | 50% 罹患 50%非罹患 |
| リピートサイズモザイク | 細胞により,premutationとfull mutationの間で様々 | premutationの細胞では非メチル化 full mutationの細胞では メチル化 | 100%罹患 full mutationの男性より高機能のことがある | 多様である 知的に正常から精神遅滞 |
| メチル化モザイク | >200 | メチル化,非メチル化のモザイク | 100%罹患 full mutationの男性より高機能のことがある | 多様である 知的に正常から精神遅滞 |
| メチル化していないfull mutation | >200 | 非メチル化 | ほとんどが罹患 しばしば高機能精神遅滞から知的に正常 | 多様である 知的に正常から精神遅滞 |
- Premutationをもち,FRXの症状をいくつか持つ女性や男性症例も報告されている.
- Premutationをもつ21%の女性はPOFを発症する.
- Premutationをもつ男性も女性もFXTASのリスクが高くなる.FXTASの頻度は50歳以上の premutationをもつ男性の40%と推定されている.女性におけるリスクは分からないが,男性よりは低いと考えられている.
Premutation FMR1遺伝子のpremutationを持つ男性も,女性も,知的にも身体的にも正常である.表3 の脚注1に示したように,premutationをもつ患者の中に,学習障害や社会不安といった,微細な知的あるいは行動上の症状を呈することがある.その問題は,通常,社会生活に問題となることはなく,彼らは結婚し,子供をもうけている.
Premutation保因者の20%がPOFを呈する.POFのオッズ比はリピート数が増えるにつれて高くなる.女性のpremutation保因者ではリピートサイズが41-58ならオッズ比は2.5, 59-79なら6.9,80-99なら25.3,100以上なら16.4である.
Full mutation FMR1遺伝子のfull mutationをもつ男性は通常,中等度あるいは重度の精神遅滞を呈し,特徴的身体症状は伴うこともある.Full mutationをもつ女性の50%は精神遅滞を呈する.しかし,男性に較べ,症状は軽い.逆に,full mutationをヘテロにもつ女性の50%は知的に正常である.女性における症状の幅の広さは,FMR1遺伝子のfull mutationのある活性化したX染色体と, 正常のFMR1遺伝子のある不活化したX染色体の比によると考えられている.
モザイク モザイクはFMR1遺伝子変異を持つ患者の15-20%で見られる.このモザイクは1)full mutationとpremutationの両者が存在する「リピートサイズのモザイク」,あるいは2)full mutationをもつが,メチル化の程度が様々であるメチル化モザイクである.いくつかのデータによると,リピートサイズ,あるいはメチル化のモザイクは完全にメチル化したfull mutationをもつ患者に較べて,知的程度が高いと,と報告されているが,通常は精神遅滞を呈する.まれに,メチル化のモザイクか全くメチル化していないfull mutationの患者で,知的に正常である症例が報告されている.症状が軽い症例では,メチル化していない対立遺伝子からの転写によるFMRP蛋白が関連していると考えられる.おそらく,このような患者では,FMR1遺伝子はメチル化されていないので,少なくとも少量のFMR1蛋白は産生されている.このような例外的な症例がいるので,リピートの延長とメチル化の関係は完全には一致しない.
促進現象
FMRはトリプレットリピート病であり,いくつかの家系でanticipationが示されている.典型的には,anticipationは症状の軽いpremutationあるいはモザイクの保因者から子孫に不安定なFMR1遺伝子が伝わる時に起こる.例えば,premutationをもつ祖父から母親にpremutationが伝わり,その罹患した孫にfull mutationが伝わる.しかし,FMRに罹患した家系でみとめるanticipationは筋強直性ジストロフィー1型にみとめるような古典的なものではない.多くの家系では,臨床症状をわずかか,全く呈することなく何世代も FMR1対立遺伝子を伝え,full mutationが現れると,罹患者が出現することになる.
頻度
FRX FRXの男性患者の頻度は1991年にFMR1遺伝子が発見されて以来,低い方向へ修正されている.最初,男性10万人中80人が罹患すると見積もられていたが,これは精神遅滞のある男性患者でFRXの診断のためにFRAXAの細胞遺伝学的検査法に基づいていた.偶然合併していたFRXAX 近傍の脆弱部位(FRAXD, FRAXE, FRAXF)をもつ精神遅滞の患者は,この数字に含まれていた.(これらは,Xq27-q28領域に近接して存在しているため,細胞遺伝学的方法で区別することは難しかった.)最近の研究によると, FMR1遺伝子の分子遺伝学的検査を用いることにより, 男性10万人に16-25人がFRXに罹患していると推測されている.
FRXに罹患している女性の頻度は男性の約半分と推測される.罹患したアフリカ系アメリカ人男性の集団調査によると,より高い数値(10万人に39人)に推測され,以前報告された白人の頻度よりも高い.しかし,両者の信頼区間はオーバーラップしている.
FMRに罹患していない女性保因者の頻度は極めて高い.フランス系カナダ人の調査では,10624人の女性のうち41人がFMR1遺伝子のpremutationを持つ(1/259, 10 万人中386人).最近の出産年齢にあるイスラエル人女性14334人の調査によると,54リピート以上の保因者女性が127名いて,これらには,full mutationを持つ症状のない女性も含まれていた.(1/113, 10万人に885人)
FXTAS 家系内で孤発例の成人発症の小脳失調をもつ男性の4.2%はFMR1遺伝子のpremutationを持つ.
鑑別診断
発達遅滞・精神遅滞 小児早期のFRXの徴候は非特異的で,発達の遅れが罹患者のもっとも良く認める症状である.男児,女児に関わらず,原因不明の発語・言語の遅れ,運動発達の遅れのある子どもに対しては,FRXの検査をすべきであり,とくに,MRの家族歴,FRXに一致する身体・行動的所見,脳の構造異常や先天奇形がない場合はそうである.大規模で緩い基準で選択された精神遅滞の男性に対してのFRXの分子遺伝学的検査では,その陽性率は低い(約3-6%)
鑑別診断として考慮すべき病態 は,Sotos症候群,Prader-Willi症候群,自閉症,ADHDである.分子遺伝学的検査が可能になる前は,頭部顔面の特徴が似ていることから,FRXの患者でSotos症候群と誤診されていた者がいる.自閉症様行動や多動症はFRXの患者で良く認める所見である.
FRAXE 特に一定した身体的特徴を伴わない,軽度精神遅滞 (FRXに典型的に認めるほど重症ではない)が,FRAXE脆弱部位のFMR2遺伝子のCCGリピートの伸長のある男性で認められている.FRAXAとFRAXEは,X染色体上で近接しているが,別の脆弱部位である. 2つの脆弱部位にひろがる遺伝子はFMR1遺伝子(FRAXA), FMR2遺伝子(FRAXE)と呼ばれる.しかし,これらの遺伝子はDNAレベルで相同性はなく,その臨床症状は区別される.
臨床的マネジメント
最初の診断時における評価
FRX
- 発語・言語の評価,OT/PTの評価,精神的・教育的評価を含めた,詳細な発達・教育評価が教育の計画に重要である
- 行動・精神学的評価は集中・注意障害,不安,強迫症,攻撃性,うつが存在するかどうかに重点を置くべきである.
- もし,診断されるのが幼児期であれば,胃食道逆流症をふくめた摂食障害があるかどうか,それはよくみられる所見かどうか,pHモニタリングを用いて,評価されるべきである.
- 診察により,筋緊張低下,結合織の問題,とくに関節の過伸展や扁平足がないか,評価されるべきである.
- 僧帽弁逸脱症の可能性に注意が必要である.聴診,そして,もし雑音やクリック音があるならば,心エコーを行うべきである.
- 痙攣の既往があるかどうか,確認されるべきである.
- 患者の25-50%で眼科的問題があるので,眼科的に評価されるべきである.
- 中耳炎を繰り返すことは良く認める所見であり,既往歴や診察時には注意が必要である.
症状に対する治療
FRX 特別な治療法はない.FRXの小児に対する支持療法は,現時点で以下の通りである.
- 特殊教育や過剰な刺激を避けるといった先を見こしての対応が,可能な時にはいつでも,必要となることを分かっていると,行動の異常を改善させることが出来るかもしれない.
- 社会での相互関係に影響を及ぼすような行動異常に対する薬物療法は有効である.特別に効果のある薬物療法はない.薬物療法は個人個人で異なり,注意深い観察が必要である.
- 教育的介入は,よく知られた学習障害に対して特異的な目的で行われ,早期の介入,特殊教育,職業訓練が含まれる.FRXのこどもを持つ両親や教師は一対一の対応,小さい教室サイズ,急激な変化を避けるといったことが必要であることを認識する必要がある.より特異的なガイドラインが教育リソースを通して,入手可能である.
- 眼科的,耳科的,結合組織の問題は通常通り対応されるべきである.
- 痙攣は通常の治療反応する.
- 僧帽弁逸脱症は,もしあれば,通常の治療で対応可能である.
FXTAS 特別の治療はない.歩行あるいは認知障害に対する補助療法は日常生活の援助を必要とする.
POF 特別の治療はない.婦人科的あるいは妊娠のための内分泌学的評価は妊娠を考えるための適切な治療やカウンセリングに役に立つ.
回避すべき薬物や環境
葉酸は痙攣を悪化させるかもしれない.
研究中の治療法
種々の疾患に対する臨床研究の情報は ClinicalTrials.gov を参照のこと.
遺伝カウンセリング
「遺伝カウンセリングは個人や家族に対して遺伝性疾患の本質,遺伝,健康上の影響などの情報を提供し,彼らが医療上あるいは個人的な決断を下すのを援助するプロセスである.以下の項目では遺伝的なリスク評価や家族の遺伝学的状況を明らかにするための家族歴の評価,遺伝子検査について論じる.この項は個々の当事者が直面しうる個人的あるいは文化的な問題に言及しようと意図するものではないし,遺伝専門家へのコンサルトの代用となるものでもない.」
遺伝形式
X連鎖優性遺伝型式
患者家族のリスク
発端者の両親
- FMR1遺伝子のfull mutation(リピート数>200)の母親は,premutationあるいはfull mutationの保因者であり,罹患していることもある.
- 罹患していないpremutationの保因者女性はpremutation保因者(transmitting male)である父親を持っているか,premutation保因者の母親を持っている.
- Premutationをもつ男性の母親はpremutationを持つ.
- Premutationを持つ女性はPOFかFXFASを発症するリスクを持つ
- Premutationをもつ男性はFXTASを発症するリスクがある.
発端者の同胞 同胞のリスクは,その性別,保因者が父親か母親か,保因者である親の伸長したリピートの数による
Full mutationを持つ者の子
- full mutationをもつ男性は精神遅滞を呈し,一般的にこどもを持たない.
- Full mutationを受け継いだ女性は,MRを発症するリスクが50%である.女性の症状のあるなしにかかわらず,その子どもはfull mutationを受け継ぐ可能性は50%である.
Premutationを持つ者の子
- Premutationを持つ男性は”transmitting males”と呼ばれる.Premutationはすべての娘に受け継がれるが,息子に受け継がれることはない.Premutationが父親から受け継がれた時,リピート数が少し増えるかもしれないが,full mutationになることはない.(性格には,premutationが父親から娘に受け継がれた時,リピート数はしばしば少し減少する)すべての娘は発症しないpremutationの保因者となる.
- Premutation保因者の女性は異常な対立遺伝子(permutation あるいはfull mutation)を50%の確率でこどもへ受け渡すリスクがある.Premutationのサイズによる,女性保因者が罹患した子ども(full mutationをもった)を持つリスクは,表4にある.CGGリピート数が増加するほど,リピート数の不安定性は高くなるが,表4のリスクは,少数の患者のデータとリピート数のみに基づいているため,大まかな目安として考えられるべきである.極めて稀ではあるが,母親のpremutationのリピート数110が,娘に受け継がれ44に減った,という例も報告されている.
表4 母親のpremutationサイズに基づいた,こどもがFRXを発症するリスク
| 母親のpremutationのリピート数 | 息子がFRXに罹患するリスク(%) | 娘がFRXに罹患するリスク(%) |
|---|---|---|
| 56-59 | 7 | 3.5 |
| 60-69 | 10 | 5 |
| 70-79 | 29 | 15 |
| 80-89 | 36 | 18 |
| 90-99 | 47 | 24 |
| >100 | 50 | 25 |
Intermediate対立遺伝子を持つ者の子 Intermediate 対立遺伝子をもつもののこどもは,リピートサイズの小さな変化を持つことがあるが(1あるいは2リピートの変化),罹患者となるリスクは無視できる.50-58リピート数であるintermediate対立遺伝子は50以下のリピート数に較べると,いくらか不安定かもしれないし,premutation(>58)になる可能性もある.よって,より大きいintermediate対立遺伝子をもつものからpremutationを子どもが引き継ぐリスクは低いが,一般人口よりは高い.
発端者の他の家族 発端者の母親側の叔母やその子孫は保因者である,あるいは罹患者であるリスクがある.(その性別と家系による)
保因者の同定
保因者のリスクのある女性に対する検査は,臨床所見にもとに可能であり,FMR1遺伝子のリピート数とメチル化状態の解析による.
遺伝カウンセリングに関連した問題
家族歴 家族内にpremutation保因者がいると,世代を飛び越えた家系図を呈するか,あるいは明らかな罹患者がいないのに,FRXが自然に発症したように見えることになる.
Transmitting malesの孫 Transmitting malesの娘はpremutationの保因者であり,その子どもはFRXを発症するリスクを持つ.
FRXの早期診断 家族内でFRXの診断を最初にうけるのは,罹患児であるのが普通である.最近の,罹患児の診断と家族の遺伝カウンセリングの時期に関する調査によると,調査された家族の約半数で,患児の診断は,発達や行動が問題となってから1年以上経って診断された.家族の半数は,最初の罹患児の診断がつく前に,次子の妊娠をしている.これらの事実から,子どもと家族が,遺伝カウンセリングや介入サービスを含めたあらゆる利益を受けるために,早期に診断される機会を増やす必要がある.
Premutationをもつ男性のFXTAS 子どもがFRXと診断され,母親がpremutationを持っている場合,母方の祖父はFXTASに罹患する可能性がある.
Premutationをもつ女性のPOF Premutationを持つ女性のPOFのリスクが高くなることを,遺伝カウンセリングを行う時に考慮されるべきである.
家族計画
遺伝的リスクの評価や遺伝カウンセリングは妊娠前に行われるのが望ましい.患者家族が遺伝子検査を受ける場合も同様である.
DNAバンキング
DNAバンクは主に白血球から調製したDNAを将来の使用のために保存しておくものである.検査法や遺伝子,変異あるいは疾患に対するわれわれの理解が進歩するかもしれないので,DNAの保存は考慮に値する.
出生前診断
FMR1遺伝子のfull mutationのリスクを持つ胎児の出生前診断は,在胎15-18週での羊水検査,あるいは10-12週での絨毛組織から得られるDNAを用いて,可能である.羊水検査から得られるDNAを用いたサザンブロット法は,成人の組織での結果と一致するが,絨毛組織から得られたDNAでのメチル化パターンは異なっている可能性があり,長めのpremutationと短めのfull mutationの区別は難しくなる.よって,CVSにより評価された妊娠に対しては,フォローアップの羊水検査やPCR法を用いた解析が,メチル化の状態によらない解析方法によるFMR1遺伝子のサイズを決定するのに必要かもしれない.
(訳者注:日本での出生前診断はコンセンサスが得られていないと考えられる.)
着床前診断は,家族内の罹患者が研究あるいは臨床検査室に於いて疾患の原因となる変異が同定されている場合は可能である.
(訳者注:日本での着床前診断はコンセンサスが得られていないと考えられる.)
更新履歴:
- Gene Review著者: Robert A Saul, MD, FACMG, Jack C Tarleton, PhD, FACMG
日本語訳者: 和田敬仁(信州大学医学部社会予防医学講座遺伝医学分野)
Gene Review 最終更新日: 2005.12.2. 日本語訳最終更新日: 2006.2.14.[in present]