さまざまな線虫が教えてくれる生命現象
さまざまな線虫が教えてくれる生命現象
線虫は線形動物門に属する生物の一般的な名称で、現在までに約3万種が報告されており、いまだ多くの未記載種が存在すると推定されています。土壌中や湖水、海水に生息する線虫や、動物や植物に寄生する線虫など、その生息域は非常に幅広く、また、大規模な国際調査により、土壌中の線虫は世界中で約4×1020匹存在することが報告されています。
このように多様な線虫ですが、主にモデル生物であるC. elegansを用いて分子生物学の研究が進められてきました。近年では、様々な線虫種を活用しC. elegansでは見られない現象に関する研究や、線虫を用いた進化研究が行われています。また、植物や動物に寄生する線虫の研究を通じて、農業被害の軽減や寄生虫疾患の治療法開発が期待されています。
ここでは、石垣島で発見されたC. elegansの姉妹種、捕食性の線虫、植物寄生性線虫、極限環境で生息する線虫など多様な線虫の生きざま、また、それらの多様な種が生まれてきた原因について紹介します。
参考資料
Van den Hoogen et al.,”Soil nematode abundance and functional group composition at a global scale”, 2019年, Nature, 572, 194-198
監修者
奥村 美紗子
愛知県生まれ。2015年東京大学大学院薬学系研究科博士課程修了。2015-2017年マックス・プランク研究所にてポスドク研究員。2017年広島大学理学研究科 助教。2021年広島大学統合生命科学研究科 准教授。
研究室HP
https://chihara-lab.hiroshima-u.ac.jp/
©2026 虫の集い(線虫研究者コミュニティ)「序論」CC BY
1. C. elegansの最も近縁な種、 C. inopinata(C.イノピナータ)
多様な線虫の世界
線虫は、地球上で最も成功した生物群のひとつであり、その総種数は昆虫を大きく上回る100万種にのぼると考えられています。線虫は多くの場合、独立して生息する自由生活性の生物ですが、一方で動物や植物に寄生し、病気を引き起こす寄生性の種もたくさんいます。たとえば、ヒトの腸管に寄生する回虫や蟯(ぎょう)虫、刺身を介して感染するアニサキス、農作物に被害を与えるネコブセンチュウ、松枯れの原因となるマツノザイセンチュウなどはすべて線虫の仲間です。
線虫は体の大きさも多様で、1mmほどの小型のものから、回虫のような数十センチに及ぶ大型のものも存在します。線虫は数千個の細胞でできている、比較的シンプルな動物ですが、多様なライフスタイルや形態をもっていることが、研究材料としての大きな魅力のひとつです。
C. elegansの近縁種
C. elegansは優れたモデル生物で、これまでに生命科学の多くの重要な発見をもたらしてきましたが、実際にはきわめて多様な線虫の中の1種に過ぎません。生命現象の深い理解には、生活史の中で積み重ねられてきた進化的視点からのアプローチが有用であり、不可欠です。C. elegansと同じCaenorhabditis属には、Caenorhabditis briggsae(C.ブリグシ)やCaenorhabditis remaneiなど数十種が記載されていました。が、これらの種は、C. elegansとは遺伝的にヒトとネズミほどの違いがあり、C. elegansで得られた研究結果を、進化学的に十分に理解することが難しい状況にありました。そのため、C. elegansに極めて近い姉妹種の発見が強く求められていました。
最近縁種 C. inopinataの発見
近年、沖縄県石垣島でC. elegansの姉妹種が見つかり、Caenorhabditis inopinata(C. inopinata)と命名されました。 姉妹種がいないというC. elegans研究の制約を解消する重要な発見です。C. inopinataはC. elegansと共通点を持つ一方、体が2倍以上大きく、雌雄異体であること、イチジクの実を生活環境とするなど、顕著な違いも見られます。また、C. inopinataはイチジクコバチを介して移動するという特異な生態を持っています。

全ゲノム解析では、C. elegansとよく似た遺伝子構成を持ちながらも、トランスポゾンが多いこと、受容体遺伝子が減っていることなど、独自の進化的特徴が明らかになりました。さらに、C. elegansの遺伝学的ツールや研究リソースがC. inopinataにも利用できることがわかり、比較進化研究の新たな可能性が広がっています。C. inopinataはC. elegansとともに、生命現象解明のための有力なモデル生物として期待されます。
新しい線虫モデル
従来のモデル生物では解明できなかった生命現象に迫るため、C. inopinataをはじめとする特殊な能力を持つ線虫、たとえば、寄生性、単為生殖と有性生殖の切り替え、染色体削減といったユニークな特徴を持つ、動物寄生性線虫のStrongyloides属などを新たな研究モデルとして確立しようとする研究が盛んになってきています。
これらの生物をモデルとして活用することで、線虫の多様性に基づいた新しい視点から、生命の基本原理に迫ることができます。こうした研究は、C. elegansの知見と組み合わせることで、進化や生態、環境適応のメカニズムを深く理解する道を開くと期待されます。
参考資料
1)Kanzaki N, Tsai IJ, Tanaka R, Hunt VL, Tsuyama K, Liu D, Maeda Y, Namai S, Kumagai R, Tracey A, et al. Biology and genome of a newly discovered sibling species of Caenorhabditis elegans. Nat Commun. 2018;9:3216.
2) Hunt VL, Tsai IJ, Coghlan A, Reid AJ, Holroyd N, Foth BJ, et al. The genomic basis of parasitism in the Strongyloides clade of nematodes. Nature genetics. 2016;48:299
監修者
菊地 泰生
現在、東京大学教授として、線虫や寄生虫のゲノムバイオロジー、システムバイオロジー研究を行っている。特に、ゲノム進化、寄生性と免疫、線虫の特殊能力分子メカニズムに興味がある。
研究室HP
https://webpark2391.sakura.ne.jp/parasite/
©2026 菊地泰生「1. C. elegansの最も近縁な種、 C. inopinata(C.イノピナータ)」CC BY NC
2. 線虫を食べる線虫Pristionchus pacificus
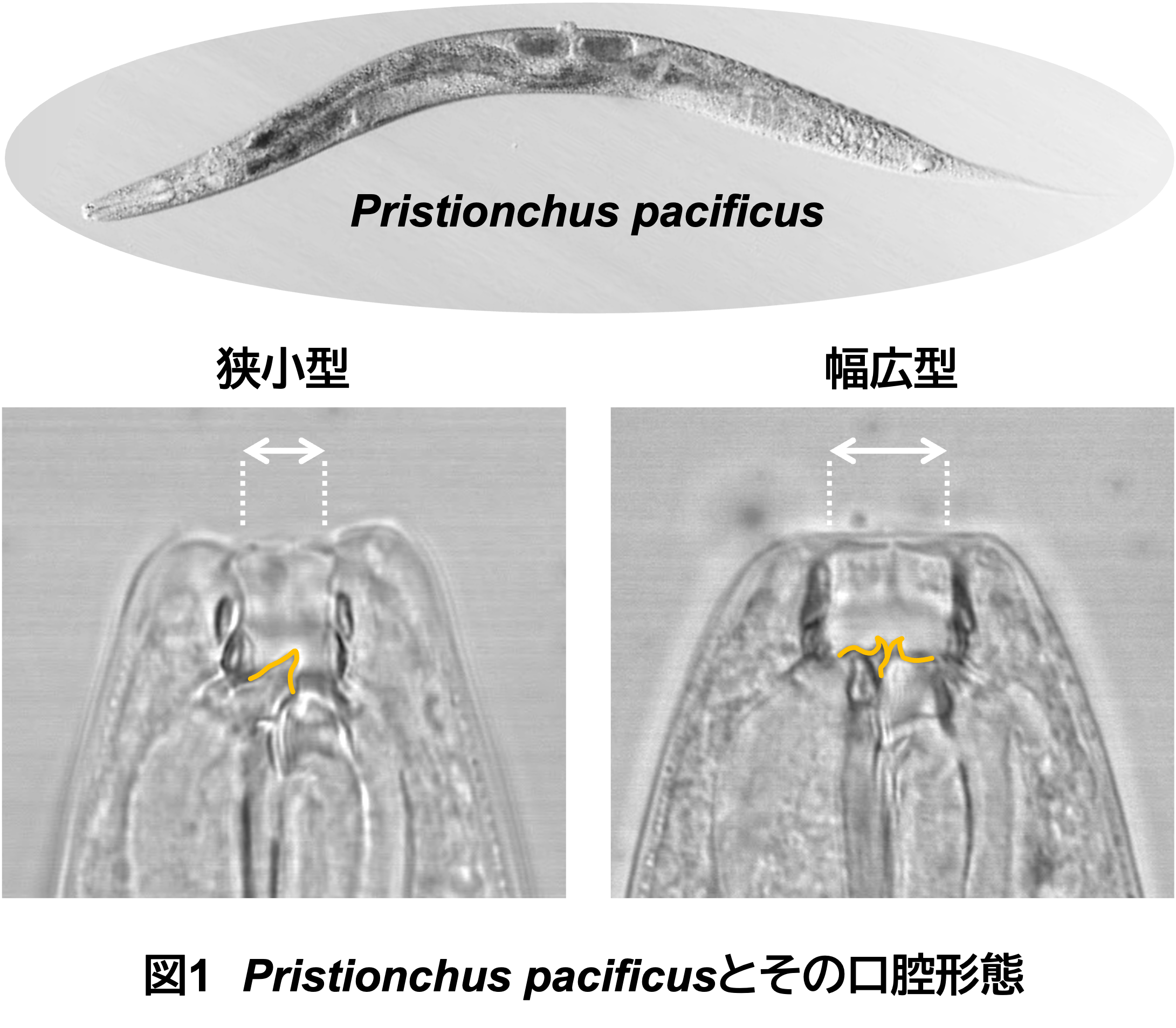
「線虫Pristionchus pacificusとは」
線虫Pristionchus pacificus(プリスティオンクス・パシフィクス)はDiplogastridae科に属する線虫の一種で、土の中もしくは昆虫の表面に生息しています。モデル線虫C. elegansと比較解析が可能でありながら、両者は異なる特徴をもっています。その進化的背景や遺伝的多様性を理解するため、ラルフ・ゾマー(Ralf Sommer)教授らによって研究に用いられてきました。
標準的な野生型であるPS312系統は、1988年に米国カリフォルニア州の土壌から単離されました。C. elegansと同じく体長約1 mmの透明な体をもち、ほとんどの個体が雌雄同体です。20℃で飼育した場合、卵から成虫になるまでが約4日と世代時間が短く、寒天培地上で大腸菌をエサとして簡単に飼育することができます。
これまでにゲノムの塩基配列が解読されており、遺伝子の機能解明に必要なゲノム編集技術や外来遺伝子の導入法といった主要な遺伝学的手法が確立されています。また、世界各地で2500以上のP. pacificusの野生型系統や50種以上のPristionchus属線虫が単離されています。このようなフィールドワークと実験室内での機能研究を組み合わせることで、生物が多様な表現型を生み出すしくみとその進化について明らかにすることが可能です。こうした特徴から、P. pacificusは進化発生生態学におけるモデル生物として用いられています。
育った環境に応じて口の形が変わる!
生物は、同じ遺伝子型から環境の変化に応じて形態や性質を変化させる能力(表現型可塑性)をもっています。P. pacificusの成虫では、この表現型可塑性として「幅広型」と「狭小型」という2種類の口の形が見られます。幅広型は2本の歯状突起と幅広な口腔をもつことで、細菌と他の線虫種の両方を捕食することができます。一方で、狭小型は狭い口腔で歯状突起が1本のみであり、他の線虫を捕食することはできません。どちらの口の形になるかは、幼虫時期の外部環境(栄養状態や温度、フェロモン、培地環境など)に依存しています。これまでに順遺伝学的手法やゲノム編集技術を用いた研究により、スルファターゼ(脱硫酸化酵素)を規定する遺伝子eud-1が口の形の決定を担うスイッチ遺伝子として関与していることが明らかになっています。また、世界各地で採取されたP. pacificus野生型系統は、それぞれ遺伝子型が少しずつ異なり、この違いが口の形の表現型可塑性にも影響します。よって、P. pacificus野生型系統同士を比較することは表現型可塑性のメカニズムを明らかにする重要なアプローチの一つです。
他の線虫に対する捕食行動
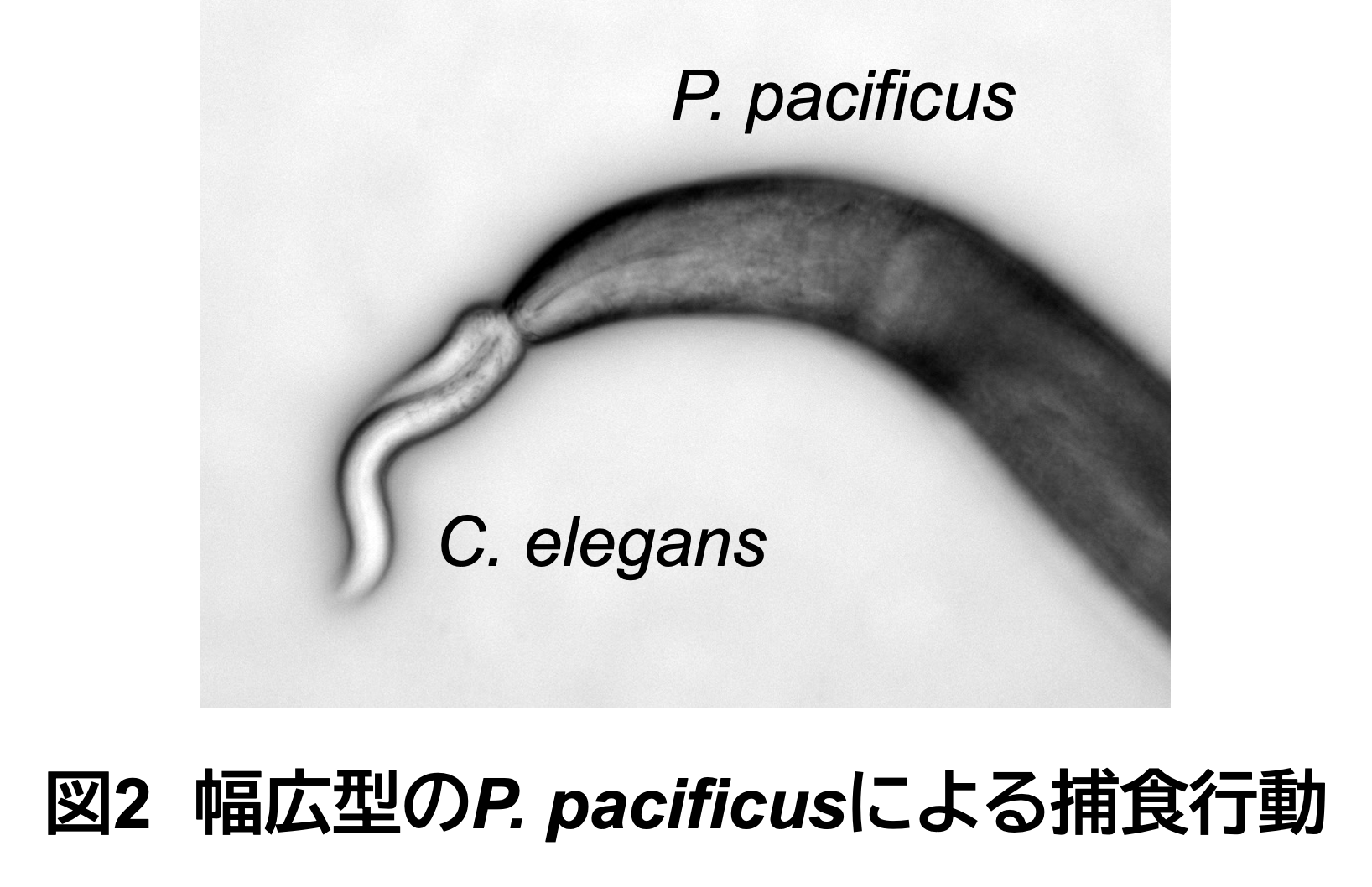
幅広型のP. pacificusは2本の歯状突起を動かすことで、他の線虫の体表に穴を開けて捕食することができます。C. elegansには見られないこの捕食行動は、進化の過程で新たに獲得されたものであると考えられており、歯状突起の動きと咽頭筋肉の収縮が協調的に行われることで成り立っています。この一連の動きの制御には、神経伝達物質であるセロトニンとその神経回路が関与しています。
興味深いことに、P. pacificusは自身と遺伝的に近い個体に対しては共食い行動を示しません。すなわち、他の線虫種や異なる野生型系統に対してのみ捕食行動を行います。この「自己・非自己」の識別には、P. pacificusの体表に存在するSELF-1という自己認識ペプチドが関与しており、これが捕食者の血縁とそれ以外の線虫を区別しています。
このようにP. pacificusは、口の形の表現型可塑性や捕食行動という独自の特性に加え、実験室内での飼育環境の操作や遺伝的操作が容易です。また、数多くの野生型系統と近縁種を用いた比較解析が可能であるといった利点から、環境因子と神経回路、発生スイッチ、エピジェネティクス、および進化メカニズムとの関係を解明する上で優れた研究モデルとして活用されています。
参考資料
1)Sommer, RJ編、「Pristionchus pacificus, A Nematode Model for Comparative and Evolutionary Biology」、2015年、BRILL
2)Sommer, RJ著、「Pristionchus pacificus」、2006年、WormBook、DOI:10.1895/wormbook.1.102.1
3)Pristionchus系統のゲノム情報データベース、http://pristionchus.org
4)Ragsdale, EJら著、「A developmental switch coupled to the evolution of plasticity acts through a sulfatase」、2013年、Cell、DOI:10.1016/j.cell.2013.09.054
5)Dardiry, Mら著、「Divergent combinations of cis-regulatory elements control the evolution of phenotypic plasticity」、2023年、PLOS Biology、DOI:10.1371/journal.pbio.3002270
6)Okumura, Mら著、「Serotonin Drives Predatory Feeding Behavior via Synchronous Feeding Rhythms in the Nematode Pristionchus pacificus」、2017年、G3、DOI:10.1534/g3.117.300263
7)Lightfoot, JWら著、「Small peptide-mediated self-recognition prevents cannibalism in predatory nematodes」、2019年、Science、DOI:10.1126/science.aav9856
監修者
平賀 裕邦
広島県生まれ。広島大学理学部生物科学科卒業,同大学院博士課程。
奥村 美紗子
愛知県生まれ。2015年東京大学大学院薬学系研究科博士課程修了。2015-2017年マックス・プランク研究所にてポスドク研究員。2017年広島大学理学研究科 助教。2021年広島大学統合生命科学研究科 准教授。
研究室HP
https://chihara-lab.hiroshima-u.ac.jp/
©2026 平賀裕邦・奥村美紗子「2. 線虫を食べる線虫Pristionchus pacificus」CC BY
3. C. elegansとは似て非なる生き物、植物寄生性線虫
植物寄生性線虫とは?
植物寄生性線虫は、C. elegansと同じ「線虫」の仲間ですが、その名の通り、植物に「寄生」する線虫です。現在、約4100種が知られており、農作物や森林に甚大な被害を与えています。これらの線虫は、特殊な「口針」と呼ばれる注射針のような器官を持っています。この口針を使うことで、固い植物細胞を突き刺し、中の栄養を吸い取ることができます。植物寄生性線虫は長きにわたって植物と攻防を続けてきたため、C. elegansではみられないような、植物との「共進化」の痕跡を観察することができます。

Illustrated by Hiroko Uchida
最も成功した寄生性線虫「ネコブセンチュウ」と「シストセンチュウ」
植物寄生性線虫は様々な寄生のしかたをしますが、その中で最も成功した寄生者といわれているのが、ネコブセンチュウとシストセンチュウです。これらの線虫は、植物の根の中に侵入し、そこから移動しない(内部定着性)寄生のしかたをします。たとえばネコブセンチュウは、宿主の根内に侵入すると、特定の植物細胞をターゲットにし、「口針」を使ってエフェクタータンパク質という特殊な物質を注入します。このタンパク質は主に
- 宿主植物の免疫を抑制する
- 線虫の餌場となる「巨大細胞」の形成を誘導する
という2つの役割を果たすと考えられています。巨大細胞は、多核化した特殊な細胞で、線虫に必要な栄養素を旺盛に生産する、いわば「えさ場」です。これを作ることで、ネコブセンチュウは土壌中に存在する天敵の脅威も免れて、巨大細胞が作ったタンパク質を吸い、ぬくぬくと成長することができるのです。寄生を成功させるために重要なエフェクタータンパク質の機能には、まだまだわからない点が多く、現在も盛んに研究が行われています。
Shounak Jagdale, Uma Rao, Ashok P. Girl著 「Effectors of root-knot nematodes: an arsenal for successful parasitism」、2021年 Frontiers in Plant Science、12:800030. doi: 10.3389/fpls.2021.800030
Satoru Nakagamiら著 「Root-knot nematode modulates plant CLE3-CLV1 signaling as a long-distance signal for successful infection」、2023年 Science Advances、9(22)、eadf4830. doi: 10.1126/sciadv.adf4803
を参照
植物寄生性線虫がもつ独自の感覚ニューロン
線虫は、からだの作りがシンプルな生き物なので、感覚(われわれでいうところの五感)においても、種が違っても線虫どうし似たようなしくみをもっていると思われるかもしれません。しかしながら、植物寄生性線虫には、C. elegansにはみられないような特殊な感覚ニューロンがあることがわかっています。
また、近年の研究では、植物寄生性線虫では、アンフィドとよばれる感覚器において、その特殊な感覚ニューロンが半数近くを占めていることがわかってきました。この特殊な感覚ニューロンによって、植物寄生性線虫はC. elegansとは大きくことなる方法で、まわりの世界を感じとっていると考えられます。 また、C. elegansと同じように、植物寄生性線虫においても遺伝学的解析手法や、神経細胞機能解析手法の開発が進んでいます。これらの技術が確立できれば、植物寄生性線虫がもつ特殊な感覚ニューロンが、植物に寄生する上でどのような役に立っているのかが明らかになっていくと期待できます。
Ryoji Shinyaら著 「Evidence of hermaphroditism and sex ratio distortion in the fungal feeding nematode Bursaphelenchus okinawaensis」、2014年 G3、4(10)、1907-1917. doi: 10/1907/6025569?login=true
を参照
参考資料
1)長谷川浩一 著 「線虫 1ミリの生命ドラマ」 2023年 dZERO
2)寄生と共生 石橋信義、名和行文 編著 「寄生と共生」 2008年 東海大学出版部
3)二井一禎 著 「私たちの知らない線虫の世界」 2020年 農業新時代 第1号、https://www.nippon-soda.co.jp/nougyo/wp-content/uploads/2023/03/001_038.pdf
監修者
浴野 泰甫
1989年熊本県生まれ。鹿児島大学大学院博士課程修了。現在、帯広畜産大学の助教として「植物寄生性線虫の外部認識機構」の研究を行っている。また「植物病理学」の講義を担当している。
研究室HP
https://www.sites.google.com/view/ekinolab
©2026 浴野泰甫「3. C. elegansとは似て非なる生き物、植物寄生性線虫」CC BY
4. 極限環境で進化した線虫 Tokorhabditis tufaeの生存戦略
線虫は地球上で最も成功した動物のひとつです。たとえば極地の超低温環境や砂漠の乾燥地帯、深海の高圧環境など、過酷な「極限環境」も含め、地球のあらゆる環境に適応した仲間がいます1)。
その一例が、極限環境にある湖から発見された「Tokorhabditis tufae(トコラブディティス・トゥファエ)」という線虫です。この線虫は、猛毒ヒ素に耐える力と、赤ちゃんを母体で育てる「胎生」という特別な繁殖方法を持っています。
猛毒ヒ素もなんのその!極限環境でのサバイバル術
T. tufaeが発見されたモノ湖は、アメリカ・カリフォルニア州にある特殊な塩湖です。この湖は、塩分濃度が高く、強アルカリ性、さらにヒ素という猛毒を多量に含んでおり、生物にとって非常に過酷な環境です。そのため、これまでこの湖内での棲息が確認されていた動物はわずか2種、アルカリミギワバエとアルテミアだけでした。しかし、そんな「死の湖」を調査してみると、なんと8種類もの線虫が発見されました 2)。この8種のうちの1種が、新属新種の線虫 T. tufaeだったわけです3)。

詳しく調べたところ、T. tufaeはヒトの致死量の500倍もの濃度に耐えられることがわかりました。この驚異的な耐性は、一般的な線虫(たとえば、C. elegans)には見られない特徴です。
さらに興味深いのは、この耐性がモノ湖という特殊な環境でのみ獲得されたわけではないという点です。ヒ素がほとんど存在しない環境に住むT. tufaeの近縁種もまた同様に高いヒ素耐性を持っていることが判明したのです。つまり、この耐性はモノ湖に進出する前から備わっており、のちに極限環境での適応に役立てられた、と考えられます。
遺伝子レベルの解析を進めた結果、T. tufaeとその近縁種は、代謝に関わる酵素(DBT-1)の構造に共通の変化があることがわかりました。この変化がヒ素耐性にどう関わっているのかはまだわかりませんが、極限環境での生存戦略だけでなく、毒物の代謝や進化のしくみを理解する手がかりにもなりそうです。
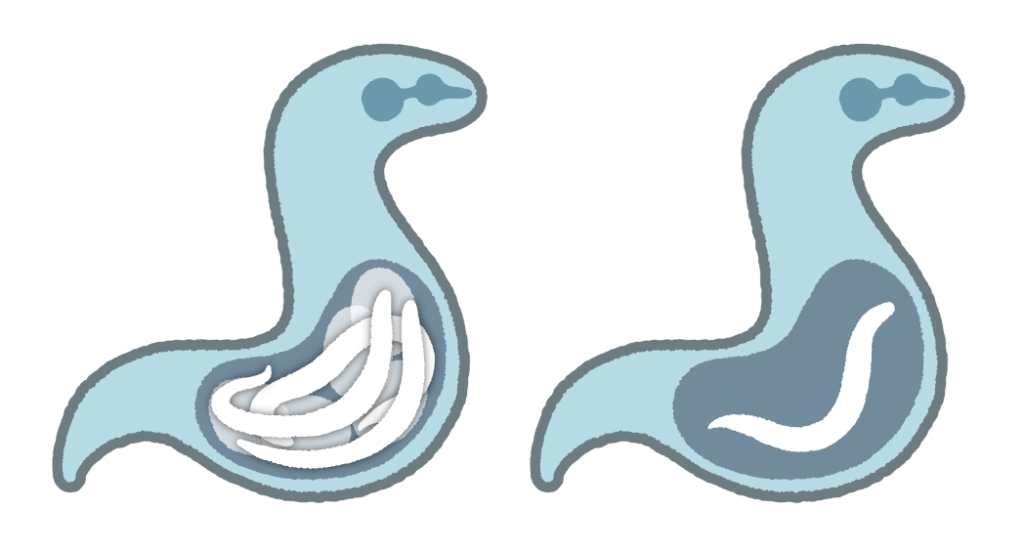
赤ちゃんを出産する線虫!ユニークな子育て術
一般に線虫は卵を産んで繁殖する「卵生動物」として知られています。しかし、「T. tufae」は少し特別です。この線虫は、母体内で赤ちゃんを育て、ある程度成長した幼虫を出産する「胎生動物」だったのです。
これまでの研究で、T. tufaeの胚には他の卵生線虫には必須である「硬い卵殻」が形成されないことがわかりました4)。さらに、この胚は母体外に取り出すと成長が止まってしまいます。つまり、胚は母体の中で保護され、そこでしか正常に発生を続けることができません。また、胚の構造を調べた結果、物質を通しやすい特徴を持つことが明らかになり、これは胚が母体から何らかの栄養を受け取る仕組みを示していると考えられます。この特性は、私たちヒトが母体内で胎児に栄養を送る仕組みに似たものかもしれません。
もう一つ驚くべき点は、T. tufaeの赤ちゃん線虫が「耐久型幼虫」という特別な状態で生まれることです。この耐久型幼虫は、乾燥や毒物など過酷な環境ストレスにも耐えられる能力を持っており、適した環境になるまで耐え抜くことができます。母体内で赤ちゃんを守り、環境に適応する準備を整えた状態で出産するというこの戦略は、極限環境での生存に大きな役割を果たしていると考えられます。
Illustrated by Hiroko Uchida
極限環境を生き抜く線虫の未来
この「胎生」の繁殖様式はどのように進化し、極限環境への適応にどれほど役立っているのでしょうか。たとえば、母体がどのような栄養を提供しているのか、その具体的な物質の特定が進められています。また、この特性が他の線虫や極限環境に住む生物とどのように違うのかも、解明がのぞまれます。
T. tufaeの「毒への耐性」や「胎生」という、極限環境で生き抜く線虫の驚異的な能力は、極限環境での生存戦略を理解する上で重要な手がかりになるとともに、私たちの環境問題や毒物耐性に関する知見を深める可能性も秘めています。
参考資料
1)Wharton, D.A.著「極限環境の生命: 生物のすみかのひろがり」、2004年シュプリンガー•ジャパン
2)Shih, P.-Y. et al. 「Newly Identified Nematodes from Mono Lake Exhibit Extreme Arsenic Resistance」、2019年 Current Biology 29: 3339-3344.e4、doi:org/10.1016/j.cub.2019.08.024
3)Kanzaki, N. et al. 「Tokorhabditis n. gen. (Rhabditida, Rhabditidae), a comparative nematode model for extremophilic living」、2021年 Scientific Reports 11: 16470、doi:org/10.1038/s41598-021-95863-1
4)Yamashita, T. et al. 「The developmental and structural uniqueness of the embryo of the extremophile viviparous nematode, Tokorhabditis tufae」、2023年 Frontiers in Physiology 14: 1197477、doi:org/10.3389/fphys.2023.1197477
監修者
山下 達矢
1997年東京都生まれ。明治大学大学院博士後期課程在籍中(2024年現在)。現在、明治大学農学部助手を務め、「胎生線虫の進化」「線虫の胎生の仕組み」を研究している。極限環境に棲む生物への興味から、研究者の道を鋭意邁進中。
新屋 良治
1982年兵庫県生まれ。京都大学大学院博士課程修了。現在、明治大学准教授として「線虫学」、「生物多様性進化学」、「極限環境生物学」の研究・講義・演習を担当している。寄生線虫や生物多様性に関する話題でYoutubeやテレビなどへ出演。日本線虫学会評議委員やNematological Research誌の編集委員長なども務める。
研究室HP
https://nemalab-meiji.weebly.com
©2026 山下達矢・新屋良治「4. 極限環境で進化した線虫 Tokorhabditis tufaeの生存戦略」CC BY
5. 多様な線虫がどのようにうまれてきたのか:種分化の研究
種分化の繰り返しで生じた多様な線虫
地球上には100万種におよぶ様々な線虫が存在すると推定されていますが、その祖先は、たった1種類であると考えられています。すなわち、1つの共通祖先から種が分かれて、また分かれてということが何度も繰り返されて、多様性が生まれてきたのです。 このように種が1つの種から複数の種に分かれる過程を「種分化」といいます。種分化の原因を知ることで、線虫がどうして多様化できたのかを知ることができるでしょう。
種分化の原因となる生殖的隔離の進化
分類学上の種は形態などの指標にしたがって判断されますが、それらの指標は種の系統が実際に分かれた後にそれぞれ獲得された可能性があり、種分化の直接的な原因ではないことがよくあります。種分化を研究するとき、一般的に種のアイデンティティを決めているのは、遺伝的に決められた生殖的隔離の有無だと考えられています。生殖的隔離とは、他のグループの個体と交雑して繁殖ができないことを言います。
生殖的隔離の一つの例は、オスがメスを見つけて交配するなどの繁殖行動の基盤が違うために別グループの個体とは交配しない場合で、「行動隔離」と言います。行動隔離は交配が行われる前に繁殖が阻害されるので、交配前隔離の一つとされます。もうひとつは、交配しても生まれたこどもが致死であったり不稔であったりして、交配しても繁殖につながらない「交配後隔離」です。
生殖的隔離がないと、交雑により遺伝子が混じり合い、種のアイデンティティが失われますので、生殖的隔離は種の維持に重要だと言えます。なお、ただ生息地が離れていて繁殖しない場合を「地理的隔離」と言い、この場合は地理的な変化でもう一度混ざってしまう可能性があるので違う種とは考えません。
このようなことから、種分化とは生殖的隔離が1つの種のグループの間でだんだんと進化してくるプロセスであると考えられます。生殖的隔離には様々な種類があり、1つの生殖的隔離の進化で種分化を説明できることはまれです。多くの生殖的隔離の蓄積の結果として種分化が完結すると考えられています。
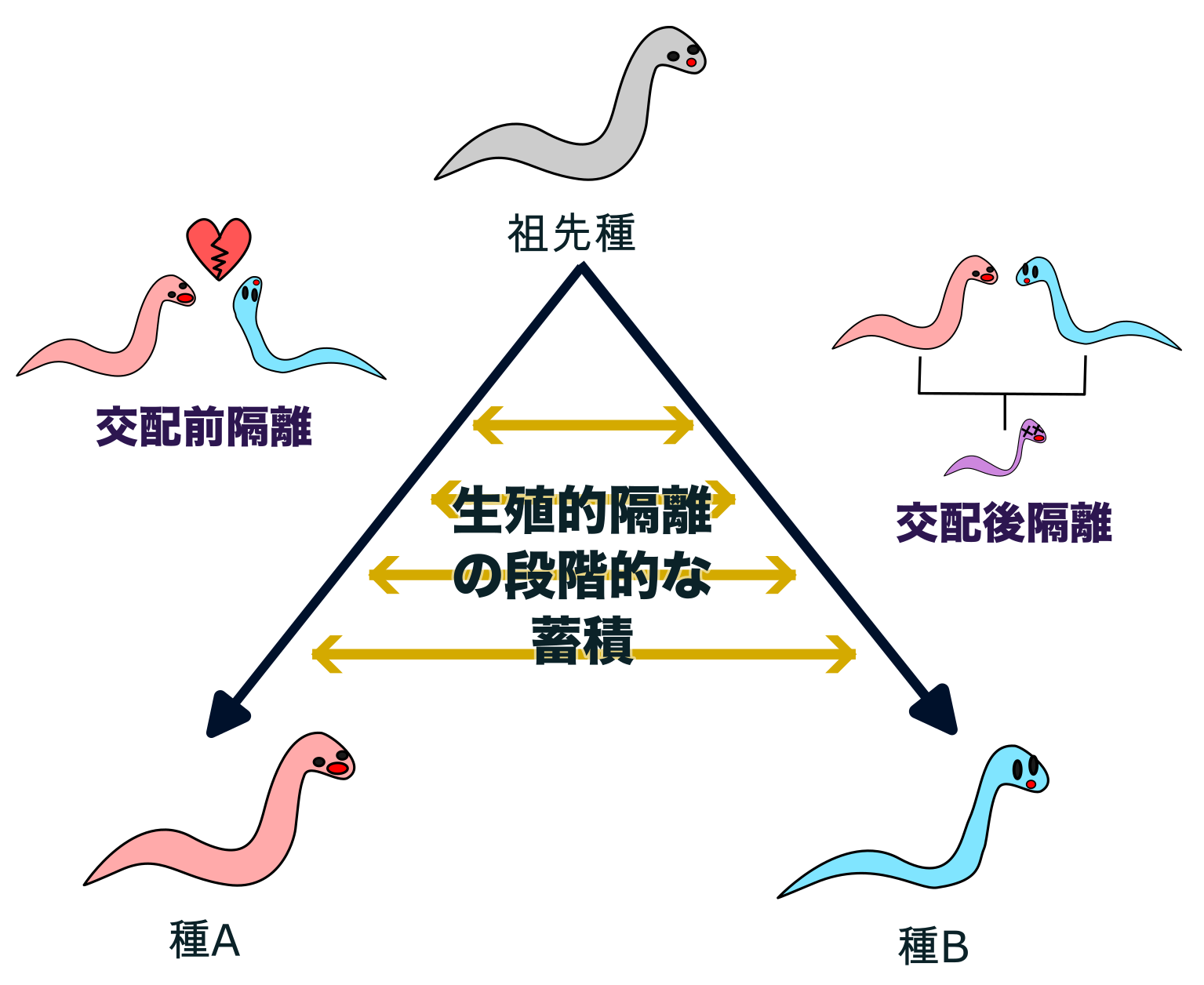
線虫の生殖的隔離の分子機構の解明
生殖的隔離というのは、個体が子どもを残せなくなることなので、一般的に個体にとって有利ではありません。したがって、それが進化する原因は古くから謎でした。しかし、昨今では遺伝子の解析が進み、色々な生物種において、生殖的隔離を生み出している遺伝因子が特定され、それらがどのように進化してきたのかが議論されています。特に、交配後隔離は雑種で同じような異常が生じるケースが多いので、遺伝的解析が比較的容易で、多くの研究が進められています。
線虫については、種分化研究に必要な、比較的最近種分化した種や、種分化途上にあるグループがあまり見つかっていなかったため、種分化研究はあまり進んでいませんでした。つい最近になって、多くの線虫種が同定されたことをきっかけに研究が発展してきています。
Caenorhabditis属線虫ではCaenorhabditis briggsae(C.ブリグシイ)とCaenorhabditis nigoni(C.ニゴニ)という二種が近縁で、交雑することができるので、遺伝子の解析が進んでいます。一つの例は重複した遺伝子の進化です。C. nigoniのCni-neib-1という遺伝子はC. nigoniだけで重複を繰り返し、多くの遺伝子のコピーが違う機能を持つように進化してきました。この遺伝子がコードするタンパク質は、C. briggsaeがもつSHLS-1という生存に必須なタンパク質を分解するため、雑種は初期発生を失敗してしまうということがわかりました。一方で、Pristionchus(プリスティオンクス)属線虫では、種間で大きなゲノムの再構成が起きていることがわかりました。Pristionchus pacificus(P.パシフィクス)とPristionchus exspectatus(P.エクスペクタトゥス)は交雑して稔性のある雑種を残すことができるものの、雑種同士では子どもをつくることができない、という非常に近縁な2種です。この2種の系統それぞれで、2つの染色体が1つに融合する染色体融合が独立に起こっていることがわかりました。遺伝的な解析の結果、雑種の減数分裂期の染色体の不分離や雑種での染色体の組換えの異常により、雑種が不稔になっていることがわかりました。
以上のように、種特異的な遺伝子レベルやゲノムレベルの進化が生殖的隔離の進化を加速していることがわかりました。このような分子レベルの進化がどうして生じたのか、進化的な機構を明らかにするためには、将来の研究が待たれます。
参考資料
1)Jerry A. Coyne, H. Allen Orr 著 「Speciation」、2004年、Sinauer
2)Kohta Yoshida, Ralf J. Sommer 著 ”How can a small animal provide new tools for speciation genetics?” 2023年、Research Communities、Springer Nature、https://communities.springernature.com/posts/how-can-a-small-animal-provide-new-tools-for-speciation-genetics
監修者
吉田 恒太
1984年東京都生まれ。東京工業大学大学院博士課程修了。現在、新潟大学脳研究所の特任教授として、線虫を使ったゲノム多様性の分子機構の研究とゲノム多様性学を応用した疾患関連遺伝子の進化の研究を進めている。
研究室HP
https://sites.google.com/view/evobrainpathol
©2026 吉田恒太「5. 多様な線虫がどのようにうまれてきたのか:種分化の研究」CC BY
