線虫も年老いたり病気になったりするの?
線虫も年老いたり病気になったりするの?
目次
Illustrated by Hiroko Uchida
線虫は、老化、疾患、損傷や感染症などのような、私たちの健康をおびやかすさまざまな現象についても多くの示唆を与えてくれます。本項目では、線虫の抗老化研究の歴史を概説したのち(4-1)、老化研究のために個体の寿命を測る方法や最新の抗老化研究(4-2)、老化に伴って生じるからだの変化(4-3)と行動・神経細胞の変化(4-4)について説明します。さらに、線虫を疾患、損傷や感染症のモデルとして利用する試みとして、神経変性疾患モデル(4-5)、軸索損傷モデル(4-6)、感染症モデル(4-7)を紹介します。
監修者
野間 健太郎
1982年香川県生まれ。京都大学 大学院博士課程修了。現在、名古屋大学准教授として、行動老化の遺伝的メカニズムの研究を行っている。
©2026 虫の集い(線虫研究者コミュニティ)「序論」CC BY
1. 線虫から見る抗老化研究の歴史
抗老化研究の萌芽
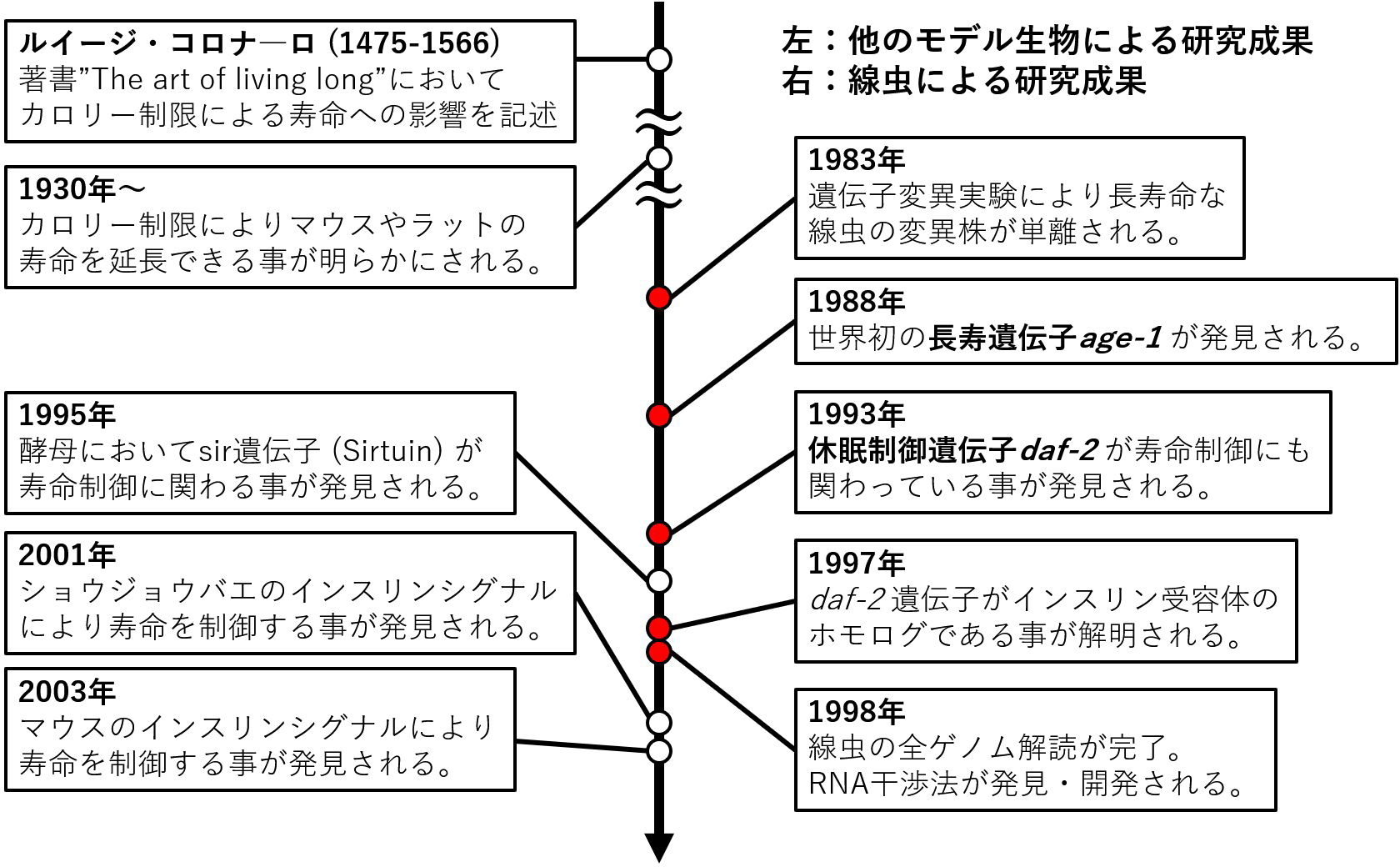
人類は大昔から老化に抗う方法を模索し続けてきた歴史がある。古代メソポタミアのギルガメシュ叙事詩には不老不死に関する記述があり、東洋では始皇帝が不老長寿の薬を探し求めた徐福伝説などが有名である。しかしこれらは伝承・伝説でしかなく、現代まで続く科学的な抗老化研究の起点は十六世紀のルイージ・コルナーロの著書”The art of living long”の『カロリー制限が長寿に有用である』という記述にあると考えられている。そして1930年代にはカロリー制限でマウスやラットの寿命が延ばせる事が実験的に実証され、この発見が現代的な抗老化研究の萌芽だといえるだろう。一方、この発見は『カロリー制限がどのようなメカニズムで寿命を制御するのか』という新しい謎を生みだす事となった。
寿命制御遺伝子の発見
二十世紀前半当時、寿命を制御するメカニズムの候補と遺伝子が考えられていたが、このアイデアは賛否渦巻くものであったために研究者たちは『遺伝子によって寿命が決まるのか、遺伝子の働きで寿命が延ばせるのか』という問いに挑む事となった。この挑戦で重要な役割を果たした生物が線虫(C. elegans)である。線虫は雌雄同体なので親と子供が遺伝的クローンの関係にあり、産卵数が多く、個体サイズも小さいために遺伝子の影響を多数の個体を用いて同時に調べやすいという利点がある。また研究室環境での線虫の寿命は最大で一か月程度と比較的寿命が短い事も研究に有利な点である。そして1983年にマイケル・クラースらによって線虫に遺伝子変異を誘導する事で長寿変異株が得られる事が報告され、すなわち遺伝子の働きで寿命が延ばせる事が実証された。続く1988年にはデイビッド・フリードマンらによってクラースらが単離した長寿変異株の解析により世界で初めて寿命延長に関わる遺伝子としてage-1遺伝子(線虫PI3Kホモログ)が同定された。この様に『寿命/老化を制御する遺伝子』という実態の発見により、抗老化研究は新しいパラダイムに入った。そして、研究者たちはさらなる寿命制御遺伝子の探索に舵を切る事となった。
寿命制御遺伝子の探索
寿命研究においてage-1遺伝子の次に大きな転換点となったのは、1993年のシンシア・ケニオンらのdaf-2遺伝子変異による寿命延長の発見であった。daf-2遺伝子はもともと耐性幼虫(dauer)とよばれる線虫の休眠に関わる遺伝子として発見されており(daf: abnormal dauer formation)、この発見は休眠と寿命に共通の制御メカニズムが存在する事を意味するだけでなく、休眠という寿命より短期間で観察可能な表現型を利用すればより効率的に寿命制御メカニズムを調べられるという可能性を示すものであった。そして1995年にはパメラ・ラーセンらによって耐性幼虫を指標にする事で寿命制御遺伝子の相互作用を明らかに出来る事が報告された。また、この頃と前後してゲノム解析などの遺伝学的手法が飛躍的に発展する事で1997年には木村幸太郎らによってdaf-2遺伝子がヒトまで進化的に保存されたインスリン受容体である事が明らかにされ、2001年にはタタール・コペルマンやデビッド・クランシーらによってショウジョウバエのインスリンシグナルが、2003年にはマルティン・ホルツェンベルガーらによってマウスのインスリン様受容体が寿命延長に関わっている事が明らかにされるなど、線虫で発見された寿命制御メカニズムは線虫から哺乳類まで進化的に保存されている事が明らかにされた。
これらの発見によって抗老化研究における線虫の有用性が広く知れ渡った結果、線虫を用いた抗老化研究に関する論文は2000年に年間約50報程度だったものが、2020年には年間400報を超えるまでに増加しており、線虫は今日でも抗老化研究において重要な役割を担っている。
参考資料
1)Judith Campisi他, “From discoveries in ageing research to therapeutics for healthy ageing”(2019) Nature, 571(7764):183-192
2)石井 直明, 老化研究のモデル動物としての線虫, Canorhabditis elegans (総説) (2017) 東海大学先進生命科学研究所紀要 第1巻
監修者
堀川 誠
1982年大阪府生まれ。筑波大学大学院博士課程修了。現在、奈良医科大学講師として「線虫の冬眠様現象の研究および冬眠様現象の抗老化研究への応用」に関する研究を進めている。
©2026 虫の集い(線虫研究者コミュニティ)「1. 線虫から見る抗老化研究の歴史」CC BY
2. 線虫を用いた寿命測定と抗老化研究
線虫C. elegansの寿命測定方法
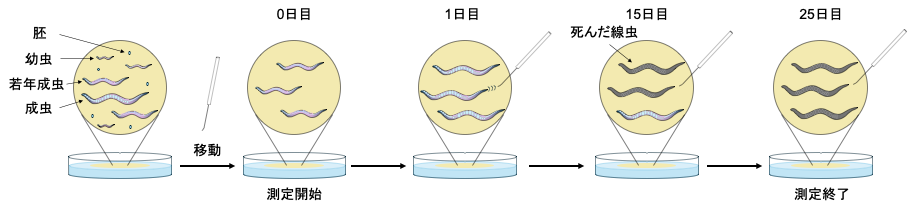
線虫(C. elegans)は寿命が20日程度と他のモデル生物より短く、遺伝学的操作がしやすいため、老化・寿命を対象とした研究にとても向いている生物です。線虫の寿命は、簡単に言えば、線虫の生存した日数で測定します。
寿命測定では、まず幼虫から成虫へと成長しようとしているタイミングの線虫(若年線虫)を新しい培地に移動させます。このとき、成虫になった線虫が卵を産んで子や孫にまぎれてしまわないように、卵を産む期間が終わるまで毎日移動させるか、産卵抑制剤を培地に添加するかしておきます。
次に、線虫が死んで動かなくなるまで毎日観察します。線虫が動いているかどうかを確認するには、顕微鏡で注意深く観察したり、白金耳などの専用の道具で軽く触れて動くかどうかを調べたりします。反応がなければその線虫は死んだと判断されます。これをすべての線虫について記録し、最後にデータをまとめると「平均寿命」や「最大寿命」を計算することができます。
線虫を用いた抗老化研究
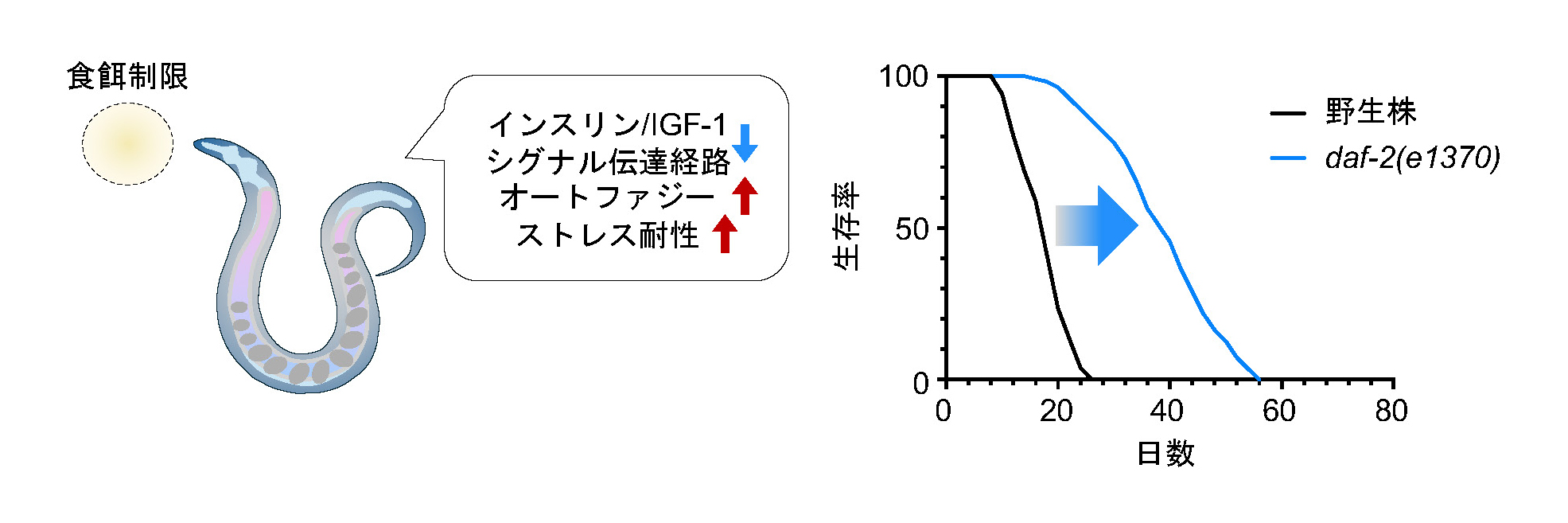
寿命の研究において、栄養失調にならない程度に栄養摂取量を減らす「食餌制限(Dietary Restriction)」で寿命が延びることが見出されました。この効果は単細胞生物の酵母から多細胞生物の線虫、ハエ、マウス、霊長類まで幅広い生物で確認されており、進化的に保存されたしくみがはたらくと考えられています。線虫において食餌制限が寿命を延ばすしくみを解明すれば、人類の健康増進や長寿にもつながりそうです。
線虫は解剖学的に単純な構造を持ちながらも、ヒトと共通する機能を持つ遺伝子が数多く存在し、線虫を用いた研究によって、寿命を制御するための、生物に共通したしくみが解明されてきました。
これまでに、インスリン/IGF-1シグナル伝達経路と呼ばれる、細胞が栄養を感知する機能の低下が、食餌制限による寿命延長に重要であることが明らかになりました。さらに、食餌制限や遺伝子の変異によりこの経路の機能が低下すると、代謝やストレス応答を調節して、体の不要な成分を分解してエネルギーを得るための「オートファジー」と呼ばれるしくみを活性化したり、ストレスを軽減するようなタンパク質をつくりだしたりすることによって、老化を遅らせることが示されています。
線虫による最近の抗老化研究
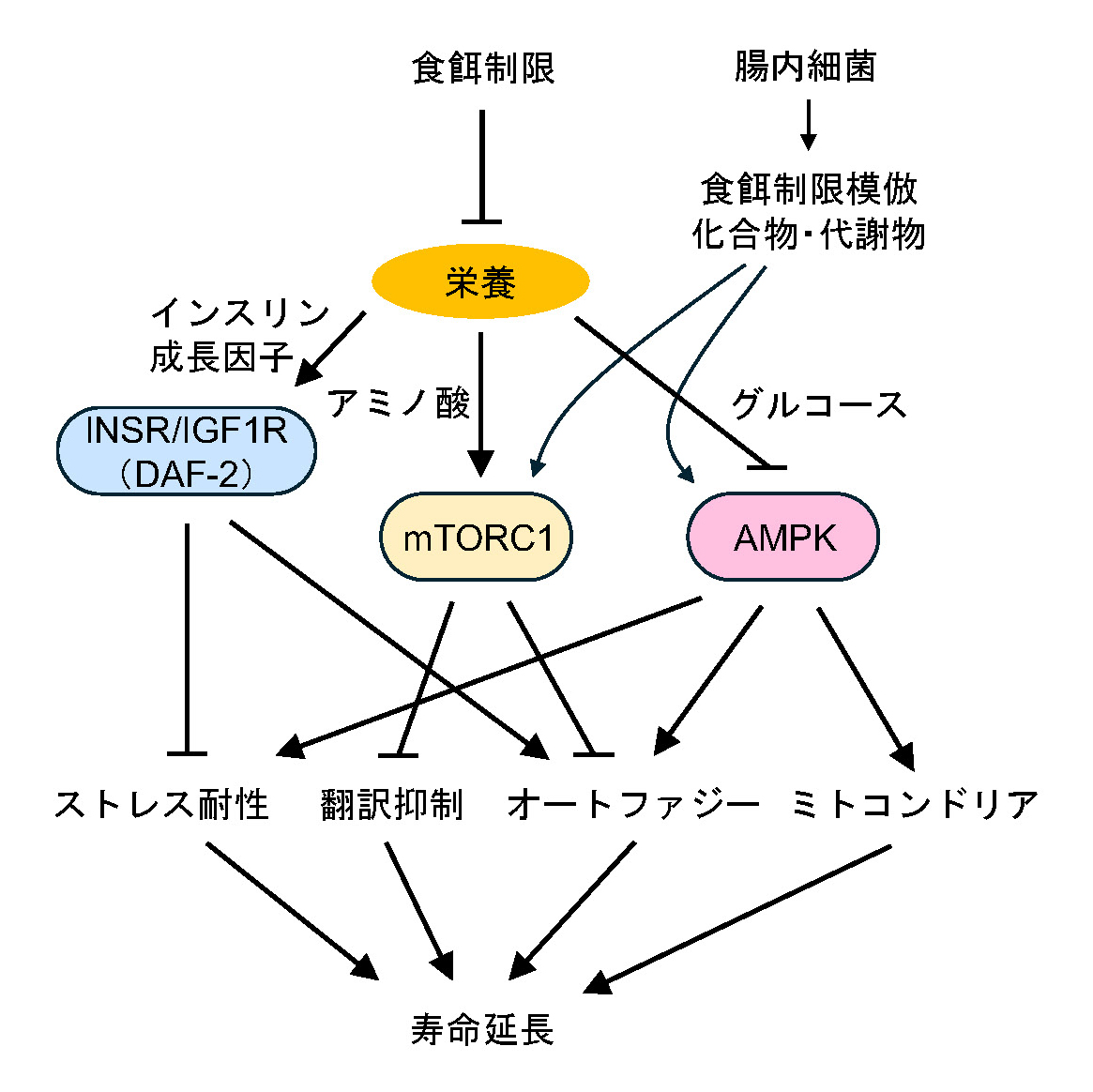
最近の研究では、寿命を調節する分子として「mTOR」や「AMPK」と呼ばれるタンパク質が注目されています。これらは細胞が栄養やエネルギーの状態を感知し、その状況に応じて体全体の代謝や成長を調節するスイッチのような役割を持っています。
免疫抑制剤ラパマイシンの標的因子としても知られているmTORは、栄養がじゅうぶんにあるときに活性を持ち、細胞の成長や増殖を促進するタンパク質複合体ですが、食餌制限をするとこのmTORのはたらきが抑制されます。その結果、オートファジーの活性化やストレス耐性の獲得などによって、細胞が長く健康状態を保てるようになります。
一方、AMPKは食餌制限などで細胞内のエネルギー通貨として知られるATPが不足したときに活性化し、細胞が無駄なエネルギーを消費しないようにはたらきかけます。線虫を使った研究では、AMPKが活性化することでミトコンドリアのはたらきを調整し、寿命を延ばすことが確認されています。
近年、mTORやAMPKの活性を調節して寿命を延ばす化合物や代謝物が報告されています。これらは食餌制限を行わなくても、同様に寿命延長の効果をもたらすため、健康寿命を延ばす新しいアプローチとして注目されています。また、腸内細菌が産生する代謝物がmTORやAMPKのはたらきを間接的にコントロールし、老化を遅らせる可能性も報告されています。この腸内細菌と代謝物の関係性は、線虫に限らずヒトにも共通する現象であると予想されています。
しかし、mTORやAMPKがどのように老化を抑制するかについてはまだじゅうぶんに分かっていません。最近の研究では、mTORによって活性化する機能の中にも、寿命延長に関与する役割があることが分かってきました。このことから、寿命調節分子がどのように寿命を制御するのか、そのしくみを詳細に明らかにしていくことが重要です。線虫という小さな生物から得られる知見が、いつか有望なアンチエイジング法をもたらし、私たちの健康寿命を延ばしてくれるかもしれません。
参考資料
1)George L Sutphin and Matt Kaeberlein著「Measuring Caenorhabditis elegans Life Span on Solid Media」、2009年 J. Vis. Exp., 12: 1152、doi: 10.3791/1152
2)Cynthia Kenyonら著「A C. elegans mutant that lives twice as long as wild type」、1993年 Nature, 366: 461–464、doi: 10.1038/366461a0
3)Pankaj Kapahiら著「Dietary restriction and lifespan: Lessons from invertebrate models」、2017年 Ageing Res. Rev., 39: 3-14、doi: 10.1016/j.arr.2016.12.005
4)T Keith Blackwellら著「TOR Signaling in Caenorhabditis elegans Development, Metabolism, and Aging」、2019年 Genetics, 213: 329-360、doi: 10.1534/genetics.119.302504
5)Kathrine B Dall and Nils J Færgeman著「Metabolic regulation of lifespan from a C. elegans perspective」、2019年 Genes Nutr., 14: 25、doi: 10.1186/s12263-019-0650-x
6)Caroline Heintz and William Mair著「You Are What You Host: Microbiome Modulation of the Aging Process」、2014年 Cell, 156: 408-411、doi: 10.1016/j.cell.2014.01.025
7)Takafumi Ogawaら著「Nutrient control of growth and metabolism through mTORC1 regulation of mRNA splicing」、2024年 Mol. Cell, 84: 4558-4575.E8、doi: 10.1016/j.molcel.2024.10.037
監修者
水沼 正樹
広島大学大学院統合生命科学研究科生物工学プログラム健康長寿学研究室 教授
小川 貴史
広島大学大学院統合生命科学研究科生物工学プログラム健康長寿学研究室 助教
研究室HP
https://namihei.hiroshima-u.ac.jp
©2026 虫の集い(線虫研究者コミュニティ)「2. 線虫を用いた寿命測定と抗老化研究」CC BY
3. 老化で起こる体の変化
損傷と修復のバランス
老化とは、加齢とともに個体や組織、器官の機能が低下することです。線虫では老化によって運動能力の低下や、消化管の機能不全、さらには個体の死が起こります。
ではなぜ機能低下が起こるのでしょうか。組織や器官はタンパク質をはじめとする多くの部品から作られた、とても複雑な精密機械のようなものです。この、タンパク質や、脂質、糖、核酸などの部品が時間とともに損傷することが、老化につながります。
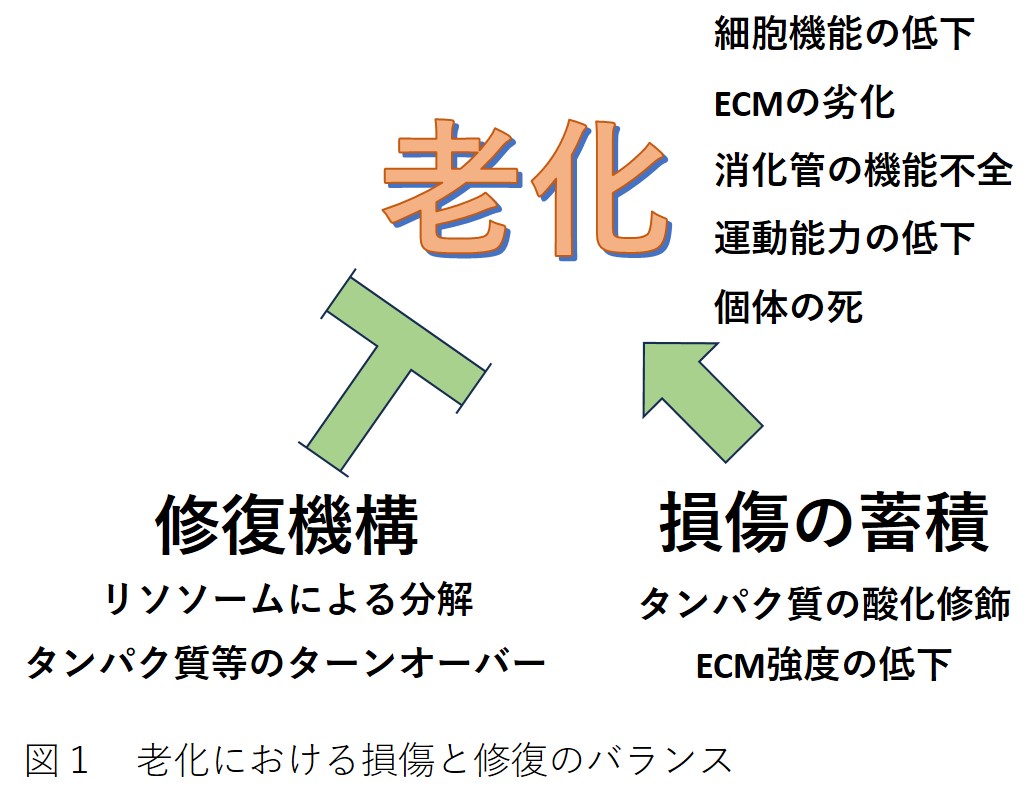
一方で、正常な機能を保つために部品の入れ替えも行われており、損傷した部品は分解されて新たな部品を作る材料となります。加齢とともに損傷が増えると、損傷した部品の分解も活発化します。しかし、加齢に伴う損傷箇所の増加が、修復機構の能力を上回ると、損傷が蓄積し、個体や組織、器官の機能が低下していきます。また、線虫C. elegansの成虫では生殖巣以外には幹細胞がなく、成虫での体細胞の入れ替わりがないため、分化した細胞の機能低下が直接老化につながります。
このように、加齢とともに体に起こる変化には、損傷の蓄積による変化と、損傷修復機構が活性化するために起こる変化の、少なくとも2種類が挙げられます(図1)。
変化は確率的に起こる
C. elegansの寿命は研究室内では平均約20日程度です。成虫になって5日程度で消化管の機能が低下し始め、1週間から10日程度で体長が短くなり運動能力が低下し始めます[1]。形態的な変化を電子顕微鏡などを用いて詳しく調べた研究では、加齢に伴う損傷は確率的に起こること、筋肉や表皮、腸に比べて、神経系では加齢に伴う形態的な変化が少ないことがわかっています[2]。
また、組織を取り囲むコラーゲンを主成分とする細胞外マトリックス(ECM)も、加齢と共にその構成成分が変化すること[3]、細胞外マトリックスの強度が加齢とともに低下すること[4]も知られています。このように、細胞と細胞外マトリックスが共に加齢による影響を受けます。ヒトでは加齢に伴って起こる現象が年齢と共に変化します。線虫でも加齢に伴い起こる形態変化や死亡率が、老化のステージによって異なることが報告されています[5]。
修復の入り口 リソソームの活性化
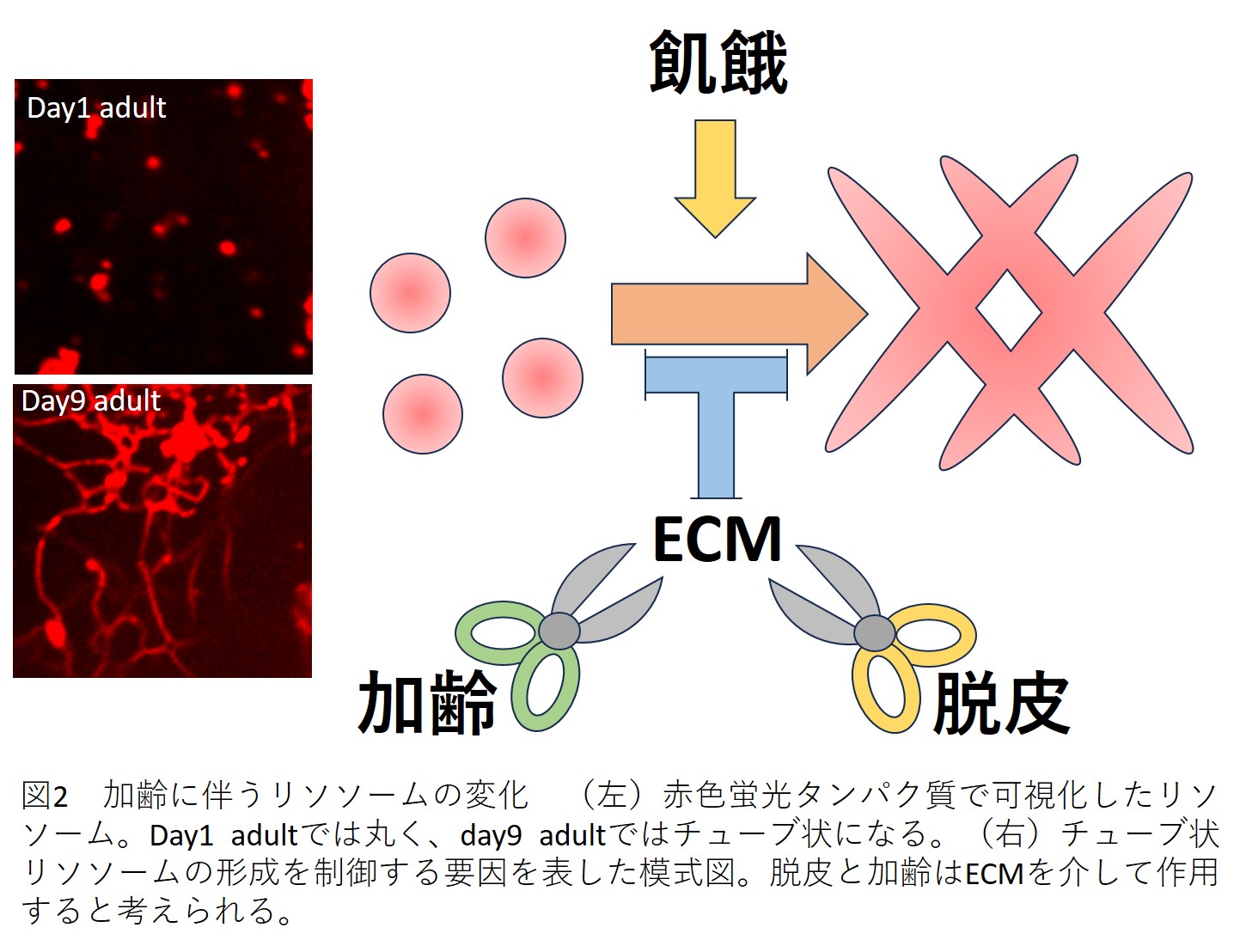
加齢に伴い損傷した部品(タンパク質、脂質、糖、核酸など)を分解する細胞内小器官はリソソームです。リソソームは各種分解酵素を含んだ丸い形をした構造で、主に不要になったものの分解を行います。
線虫ではリソソームの形が加齢とともに、丸い形からチューブ状へとダイナミックに変化していきます[6](図2)。この変化は、長寿の変異体では遅く、短命の変異体では早く起こることも知られています。
なぜチューブ状リソソームが形成されるのかについては、同調してリソソーム全体の活性を高めるためではないか、表面積を増やしてより多くの老廃物を受け入れるためではないか、などの説がありますが[7]、その意義はわかっておらず今後の研究が待たれます。
チューブ状のリソソームは脱皮や飢餓状態でも増加します[7, 8]。面白いことに、飢餓によるチューブ状リソソームの増加は、飢餓を経験していない子や孫にまで受け継がれ、寿命の延長へとつながります[7]。また、脱皮や老化では、コラーゲンやコンドロイチンを含む細胞外マトリックスが、チューブ状リソソームの形成を抑えることがわかっています[8, 9]。このようにチューブ状リソソームが老化と関係することは間違いありませんが、単純にその増減が長寿につながるわけではないようです。
老化による筋肉の機能低下 サルコペニアモデル
老化に伴う筋肉の機能低下はサルコペニアと呼ばれます。C. elegansの体壁筋は、ヒトの骨格筋と同じく、交互に並んだアクチンフィラメントとミオシンフィラメントが並行に移動することで力を生み出します。
筋肉の構造が似ていることと、老化に伴う筋肉の機能低下という現象が共通していることから、C. elegansはサルコペニアモデルとして使われています。
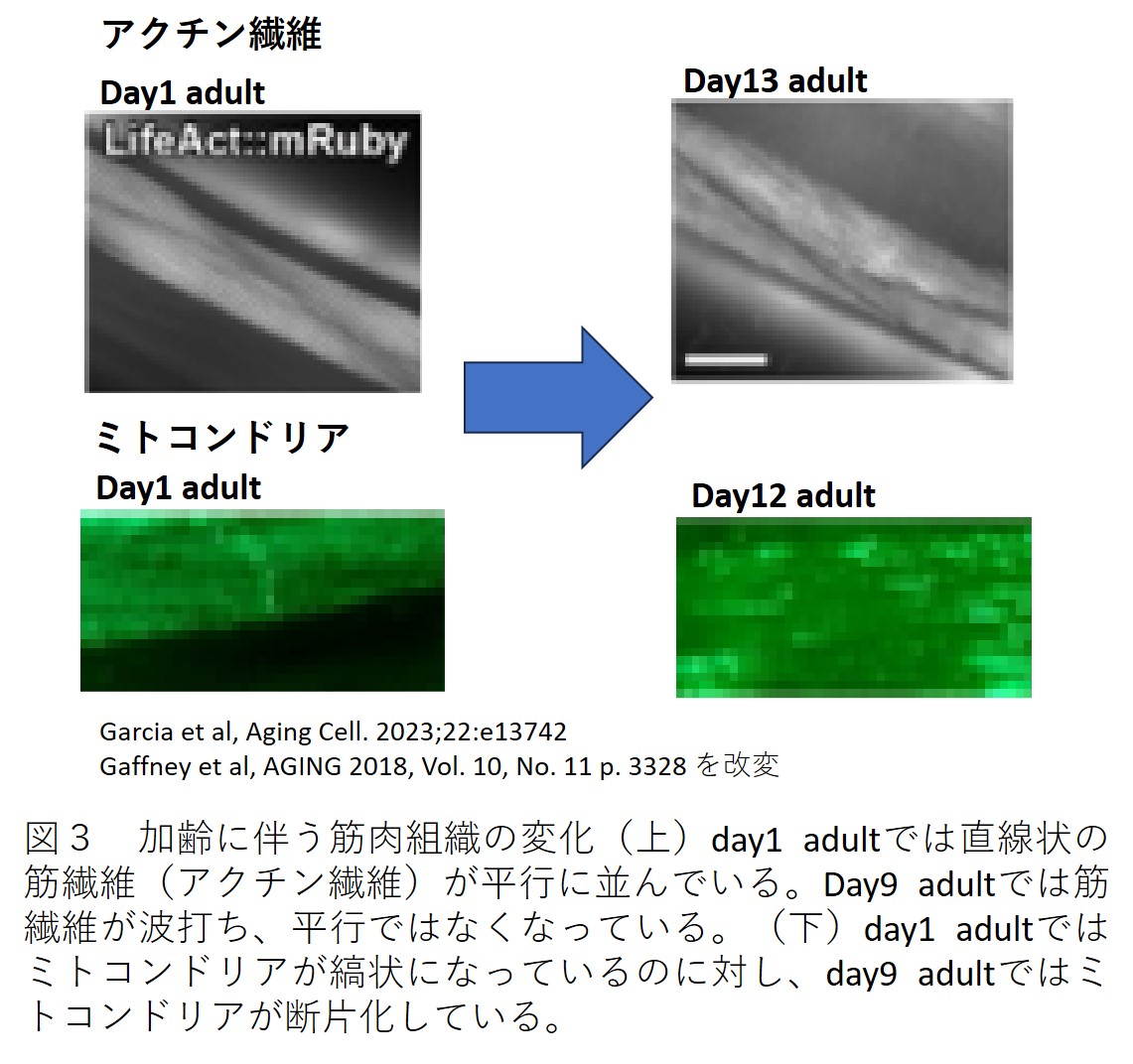
成虫になって10日ほどすると、アクチンフィラメントの構造に異常が見られるようになります[10](図3)。また筋肉を動かすためには、エネルギーとなるATPが大量に必要となります。筋肉ではATPを作るミトコンドリアが筋繊維に沿って縞状のネットワーク構造をとります。この筋肉のミトコンドリアは加齢とともに断片化することが知られています[11]。
このように、C. elegansの筋肉では加齢とともに筋繊維の構造そのものと、エネルギーを供給するミトコンドリアに異常が生じます。アクチンフィラメントの異常よりも、ミトコンドリアの断片化の方がより早く起きるため、ミトコンドリアの断片化が加齢に伴う筋力低下の主な原因であるという説があります。少なくとも、アクチンフィラメントの異常とミトコンドリアの断片化がC. elegansにおけるサルコペニアの主な原因であると考えられます。
参考資料
1)Shibata, Y., et al., Endogenous chondroitin extends the lifespan and healthspan in C. elegans. Sci Rep, 2024. 14(1): p. 4813.
2)Herndon, L.A., et al., Stochastic and genetic factors influence tissue-specific decline in ageing C. elegans. Nature, 2002. 419(6909): p. 808-14.
3)Teuscher, A.C., et al., Longevity interventions modulate mechanotransduction and extracellular matrix homeostasis in C. elegans. Nat Commun, 2024. 15(1): p. 276.
4)Essmann, C.L., et al., Mechanical properties measured by atomic force microscopy define health biomarkers in ageing C. elegans. Nat Commun, 2020. 11(1): p. 1043.
5)Zhao, Y., et al., Two forms of death in ageing Caenorhabditis elegans. Nat Commun, 2017. 8: p. 15458.
6)Sun, Y., et al., Lysosome activity is modulated by multiple longevity pathways and is important for lifespan extension in C. elegans. Elife, 2020. 9.
7)Villalobos, T.V., et al., Tubular lysosome induction couples animal starvation to healthy aging. Nat Aging, 2023. 3(9): p. 1091-1106.
8)Miao, R., et al., An ECM-to-Nucleus Signaling Pathway Activates Lysosomes for C. elegans Larval Development. Dev Cell, 2020. 52(1): p. 21-37 e5.
9)Shibata, Y., et al., Endogenous chondroitin extends lifespan by inhibiting VHA-7-mediated tubular lysosome formation. Sci Rep, 2024. 14(1): p. 29651.
10)Garcia, G., et al., Large-scale genetic screens identify BET-1 as a cytoskeleton regulator promoting actin function and life span. Aging Cell, 2023. 22(1): p. e13742.
11)Gaffney, C.J., et al., Greater loss of mitochondrial function with ageing is associated with earlier onset of sarcopenia in C. elegans. Aging (Albany NY), 2018. 10(11): p. 3382-3396.
監修者
柴田 幸政
1971年生まれ。愛知県出身。名古屋大学大学院博士課程修了。McGill 大学、理化学研究所CDB、関西学院大学をへて、現在は北京脳研究所(CIBR)勤務。いろいろな分野に興味があり、現職では「老化のメカニズム」を研究している。分子生物学会で「ECMと老化」のシンポジウムを企画する。線虫研究の未来を創る会2023のメインオーガナイザーを務める。
©2026 虫の集い(線虫研究者コミュニティ)「3. 老化で起こる体の変化」CC BY
4. 神経・行動の老化
行動の老化
線虫は寒天プレートの上を上手に動き回るだけでなく、えさに向かって効率的に移動してそれを食べ、排便まで行います。たった302個の神経細胞でそれらの様々な行動を行えるのは驚きです(項目3参照)。しかし、成虫(生殖可能な個体)になってから加齢が進んでいくと、しだいにこれらの行動ができなくなっていきます1)。
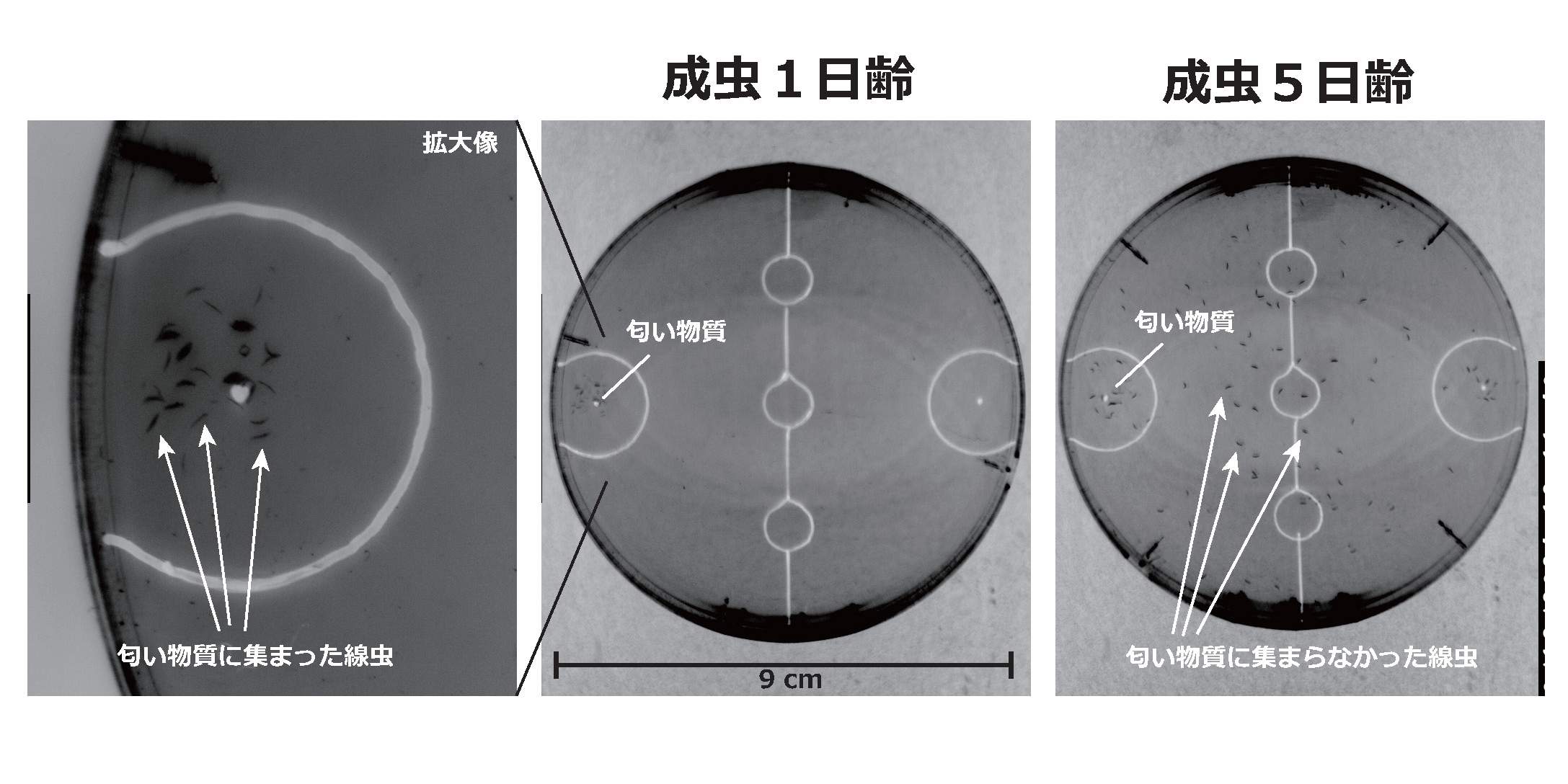
たとえば、成虫になってから23℃で4日程度飼育した線虫では、運動機能の低下はあまり見られませんが、えさの匂いに向かう化学走性行動(挿絵)や、えさと温度の連合学習などの、比較的複雑な行動ができなくなります。
さらに加齢が進んで成虫10日目ごろになると、寒天培地上での移動速度が低下したり、水中でのむち打ち運動の回数が減少したりします。また、えさを食べるために口を動かすポンピング行動や、排便の頻度も下がります。このような運動機能の低下は、筋肉と神経細胞のはたらきに欠陥が生じることによって起こると考えられます。
神経細胞の老化
線虫の行動が老化する原因のひとつとして、神経機能の低下があげられます。脳全体の活動を見てみると、若い線虫では神経細胞が興奮と抑制のバランスを保って活動していますが、加齢した線虫ではこのバランスが崩れてしまうようです2)。個々の神経細胞に着目すると、たとえば、匂い物質を感知する神経細胞において、匂いへの応答性が低下する場合があります3)。一方、加齢に伴って神経細胞が過剰に活性化してしまい、連合学習行動を阻害する例も知られています4)。
加齢が進むと、神経細胞の機能に加えて形も変化します。たとえば神経細胞がのばしている突起がふくらんだり、余計な枝分かれができたりします5)。しかしながら、神経細胞の多くは加齢しても死ぬことはなく、形の変化も筋肉などに比べると軽微です。
では、神経細胞はどのように老化して行動の変化を引き起こすのでしょうか?
線虫を用いた研究により、個体の寿命を制御するメカニズムは徐々に明らかになりつつありますが(項目4-2参照)、神経細胞の老化のメカニズムについてはまだまだ多くの謎が残されています。
寿命研究における成果の蓄積と、神経細胞や行動の研究における線虫の利点をいかして、今後さらに研究が進むことが期待されます。
参考資料
1)James J. Collinsら著、「The measurement and analysis of age-related changes in Caenorhabditis elegans」、2007年、Wormbook、doi/10.1895/wormbook.1.137.1
2)Gregory S Wirakら著、「Age-associated changes to neuronal dynamics involve a disruption of excitatory/inhibitory balance in C. elegans」、2022年、eLife、11:e72135、doi: 10.7554/eLife.72135
3)Sarah G Leinwandら著、「Circuit mechanisms encoding odors and driving aging-associated behavioral declines in Caenorhabditis elegans」、2015年、eLife、4:e10181、doi.org/10.7554/eLife.10181
4)Chun-Liang Panら著、「Genetic analysis of age-dependent defects of the Caenorhabditis elegans touch receptor neurons」、2011年、PNAS、108 (22) 9274-9279、doi.org/10.1073/pnas.1011711108
監修者
野間 健太郎 1982年香川県生まれ。京都大学 大学院博士課程修了。現在、名古屋大学准教授として、行動老化の遺伝的メカニズムの研究を行っている。
研究室HP
https://nomatode.com
©2026 虫の集い(線虫研究者コミュニティ)「4. 神経・行動の老化」CC BY
5. 線虫で神経の病気を調べる
神経疾患の研究に線虫を使えるの?
ここでは、線虫C. elegansを使って、病気、特に神経疾患がどのように引き起こされるのかを調べて、見つかった発見をヒトの病気の治療に役立てようとする研究について紹介します。
線虫を神経疾患のモデルとして使用する利点は、扱いが簡便であることと、世代交代が速いことで、このため遺伝子操作や薬剤の効果を迅速に評価することができます。また、線虫の神経系は比較的単純でありながら、ヒトの神経系と多くの共通点を持つため、特定の神経疾患の基礎的なメカニズムを解明するのに非常に有用です。
たとえば、ヒトのアルツハイマー病やパーキンソン病、筋萎縮性側索硬化症(ALS)などの神経変性疾患の研究に線虫はよく用いられています。その理由は、疾患の原因となるタンパク質が見つかっていて、そのタンパク質を線虫の神経細胞に導入することで、ヒトと同じように神経細胞が死んだり神経機能が失われたりすることがわかっているからです。その一方で、限界もあり、統合失調症やうつ病など、ヒトに特有の複雑な行動や感情に関連する疾患の研究に線虫を用いるのは難しいでしょう。
神経変性疾患と線虫
神経変性疾患では、原因となるタンパク質が異常に集まってできる凝集体が観察されます。原因タンパク質は疾患によってさまざまで、たとえばアルツハイマー病ではアミロイドベータやタウなど、ALSではTDP-43などの原因タンパク質が凝集体を作ります。こうした凝集体が形成されると、神経細胞の中でいろいろな異常が引き起こされます。線虫を使った研究で、この凝集体が引き起こす異常に関わる遺伝子が見つかり、疾患のメカニズムが調べられてきました。
それでも、まだまだわかっていないことはたくさんあります。たとえば、近年、細胞の中でタンパク質が「水に浮かぶ油」のように球状に集まる現象(液-液相分離)が神経変性疾患と関連することが注目されていますが、この現象がどのように神経変性疾患を引き起こしているのかについては不明な点がまだ多く残されています。また、老化が神経変性疾患の発症の引き金となっていることは間違いありませんが、それが液-液相分離とどのように関係するのか、詳しいメカニズムはわかっていません。
線虫には、体が透明で神経内部を簡単に観察することができる、寿命が短く老化の過程を数日で調べることができる、という他の生き物にはない利点があります。神経変性疾患のメカニズムの理解において、線虫を用いた研究がこれからも重要な役割を果たすことでしょう。
参考資料
1)Zbindenら著 「Phase Separation and Neurodegenerative Diseases: A Disturbance in the Force」、2020年 Developmental Cell, 55(1): 45-68、doi: 10.1016/j.devcel.2020.09.014
2)白木賢太郎著 「相分離生物学」、2019年 東京化学同人
監修者
新海陽一
1983年福岡県生まれ。九州大学大学院理学府博士課程修了。製薬企業での勤務経験を経て、現在、産業技術総合研究所・研究グループ長として「液-液相分離に着目した神経変性疾患の制御・早期診断」の研究を行っている。
研究室HP
https://staff.aist.go.jp/yoichi-shinkai/
©2026 虫の集い(線虫研究者コミュニティ)「5. 線虫で神経の病気を調べる」CC BY
6. 切断された神経が再生する仕組みを線虫で探る
ヒトのからだには、神経とよばれる長い繊維が隅々まで走っており、それが脳からの「筋肉を動かせ」という指令を送ったり、熱い・冷たい・痛いなどの感覚信号を脳に送ったりする働きをしています。ところが、ケガなどで神経繊維が切断されてしまうと、それができなくなります。その結果、体を動かそうとしても動かない(運動障害)、熱い・冷たい・痛いなどの感覚が感じられない(感覚障害)などの障害が生じます。神経切断による障害として最も一般的に知られているのは脊髄損傷です。脊髄は神経の束が通っている場所で、損傷により神経繊維が切断されると、損傷部位より下の感覚が失われ、動かすこともできなくなります。そしてその状況はほとんど改善することなく一生続くとされています。
一方、体の部分によっては、切断された神経が再生されることもわかっています。たとえば、指を完全に切断された場合、病院で切断された指をつなぐ手術を行います。その時に骨や血管、腱などと共に”神経をつなぐ”手術を行うと、つないだ直後は動かなかった指が、数ヶ月以上経つと動くようになることがしばしばあります。手術では神経繊維そのものではなく、神経繊維が入っている管をつないでいるのですが、手術後時間が経つとその中を神経繊維が伸びて神経回路が再形成されることで、動くようになります。これを神経再生と呼びます。
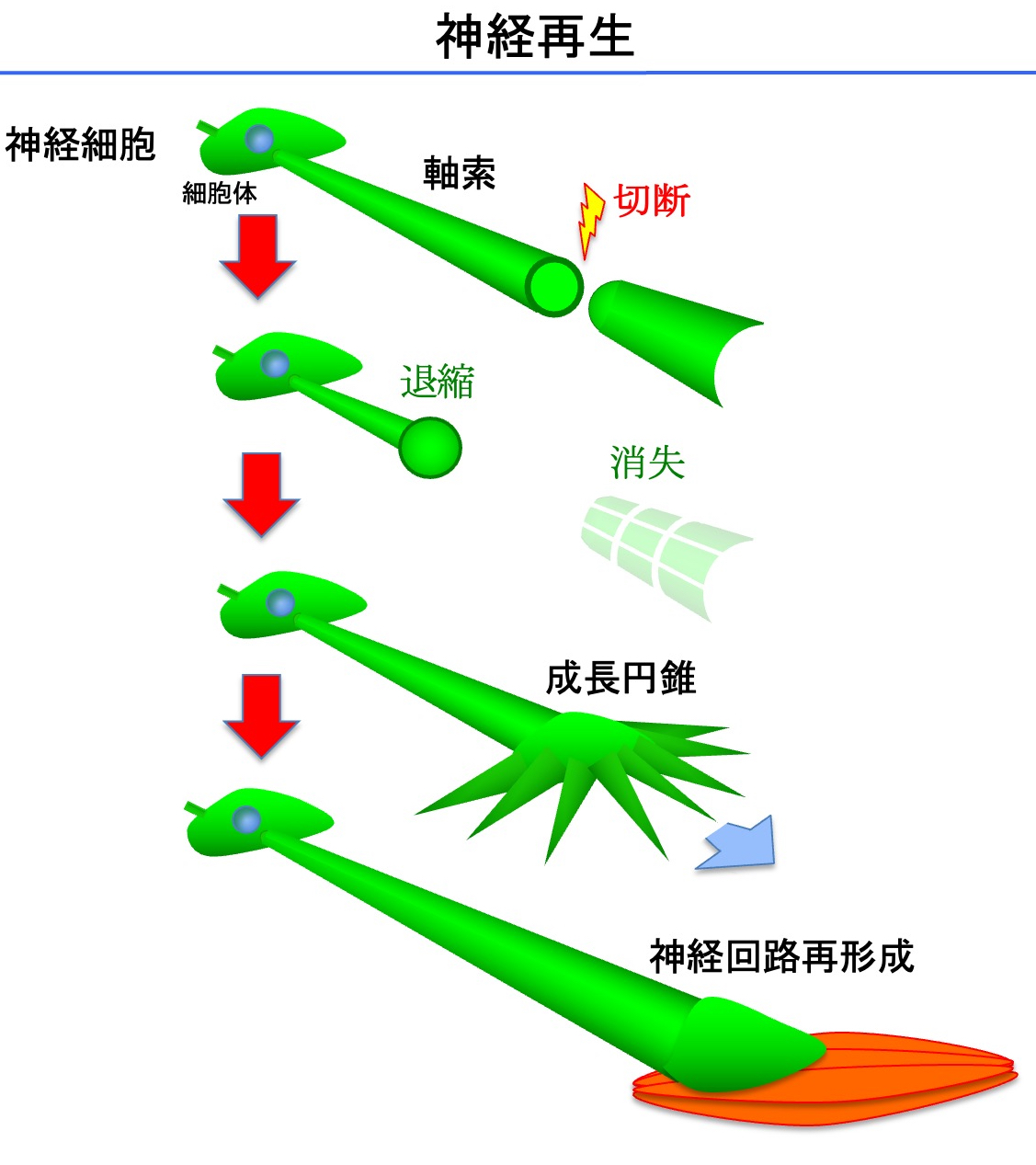
神経再生を細胞レベルで見てみましょう(図)。神経は神経細胞からなり、神経細胞は軸索と呼ばれる神経繊維を持っています。軸索を切断すると、細胞体とつながっている側の軸索は退縮して先端に丸い構造ができ、つながっていない側の軸索は消失します。その後、しばらくすると軸索先端が「成長円錐」という手のような構造に変化して、それが前進することで軸索が伸び、最終的に標的に再結合します。これが細胞レベルで見た神経再生になります。
神経再生はからだのいろいろな部分で起きますが、脳や脊髄などの中枢神経では起きません。中枢神経で神経再生が起きないのは、中枢神経を損傷しても他の神経で起こるような再生が始まらないからなのですが、その違いの原因を知るためには神経再生のしくみをまず理解することが必要です。しかし、哺乳動物を用いた研究では1回の実験に短くても数週間、長ければ年単位の時間がかかるという問題があります。
実は神経再生は哺乳動物だけではなく、無脊椎動物も含めたさまざまな動物で普遍的に起きる現象であることが近年わかってきています。モデル生物である線虫でも、神経繊維をレーザーで切断すると、数時間以内に再生が開始します。そこで、実験が容易で再生も早い線虫を用いて神経再生のしくみを解明するという研究が世界中で始まり、これまでにさまざまな遺伝子の関与がわかっています。その中のいくつかは哺乳動物でも同様に神経再生に関わっていることから、線虫を用いた神経再生の研究が、ヒトの神経再生治療にも役立つのではないかと期待されています。
監修者
久本 直毅(名古屋大学大学院理学研究科)
©2026 虫の集い(線虫研究者コミュニティ)「6. 切断された神経が再生する仕組みを線虫で探る」CC BY
7. 感染モデルとしての線虫
細菌感染モデル
線虫C. elegansは、多様な生命現象のモデル生物として用いられてきたが、感染モデルとして用いられたのは、筆者の知る限りでは1999年に報告された緑膿菌感染に関する研究が初めてである (1-3)。緑膿菌は水回りなどの環境に広く存在する細菌であり、健康な人に対してはあまり病原性を示さないが、免疫機能の低下した人などへの感染(日和見感染という)の原因菌として問題になる。緑膿菌を与えると、通常の育成プレート上では数日で、条件によっては数時間で線虫は死に至ることがわかった(1,2)。「腸チフスのメアリー」のように、無症状の健康保菌者が多くの人に知らずに感染させる例もあるチフス菌に関する研究では、マウスでの病原性が強いネズミチフス菌がそのモデルとして長年研究に用いられてきたが、ネズミチフス菌は線虫にも致死性の病原性を発揮することがわかった (4)。ちなみに、緑膿菌やチフス菌はグラム陰性菌(グラム陰性菌と陽性菌は細胞壁の構造などの違いによりグラム染色という染色法で染め分けることができる)に属するが、グラム陽性菌としては、腸球菌、肺炎球菌、黄色ブドウ球菌が線虫に対して致死性の病原性を発揮することが示された (5)。
真菌・ウイルス感染モデル
真菌感染については、常在菌としてヒトの粘膜や皮膚に存在しており、ときに膣炎などの日和見感染症を引き起こすカンジダなどに関する研究がある。カンジダ属真菌は線虫の腸管内に蓄積し、バイオフィルムや菌糸形成などによる致死性の病原性を発揮することが報告された (6)。
ウイルス感染系としては、2005年にFlock House virus (FHV)というウイルスの複製ゲノムを体内で作る線虫の作製が報告されたものの、ウイルス粒子が作られるには至らなかった(7)。線虫C. elegansに感染するウイルスとしては、腸管細胞に感染し、腸管の異常を引き起こすOrsay virusなどが報告されている (8)。
線虫の有用性とこれからの展望
このように、線虫はさまざまな病原体の感染モデルとして用いられている。緑膿菌感染応答などに関わるMAPK経路は高等動物(哺乳類)においても免疫応答(炎症応答)に関わることが知られており、線虫をモデルとして病原体に対する応答を調べることの有用性は高いと考えられる。病原体感染の予防や治療につながるよう、線虫を用いた感染モデルのさらなる活用を期待したい。
参考資料
1)中台(鹿毛)枝里子、線虫を利用した腸内細菌研究、2023年 腸内細菌学雑誌、38:9-19
2)Mahajan-Miklos S, Tan MW, Rahme LG, Ausubel FM. Molecular mechanisms of bacterial virulence elucidated using a Pseudomonas aeruginosa-Caenorhabditis elegans pathogenesis model. 1999年 Cell. 96:47-56.
3)Tan MW, Mahajan-Miklos S, Ausubel FM. Killing of Caenorhabditis elegans by Pseudomonas aeruginosa used to model mammalian bacterial pathogenesis. 1999年 Proc Natl Acad Sci U S A. 96:715-720.
4)Aballay A, Yorgey P, Ausubel FM. Salmonella typhimurium proliferates and establishes a persistent infection in the intestine of Caenorhabditis elegans. 2000年 Curr Biol. 10:1539-542.
5)Garsin DA, Sifri CD, Mylonakis E, Qin X, Singh KV, Murray BE, Calderwood SB, Ausubel FM. A simple model host for identifying Gram-positive virulence factors. 2001年 Proc Natl Acad Sci U S A. 98:10892-897.
6)Breger J, Fuchs BB, Aperis G, Moy TI, Ausubel FM, Mylonakis E. Antifungal chemical compounds identified using a C. elegans pathogenicity assay. 2007年 PLoS Pathog. 3:e18.
7)Lu R, Maduro M, Li F, Li HW, Broitman-Maduro G, Li WX, Ding SW. Animal virus replication and RNAi-mediated antiviral silencing in Caenorhabditis elegans, 2005年 Nature. 436:1040-1043.
8)Felix MA, Ashe A, Piffaretti J, Wu G, Nuez I, Belicard T, Jiang Y, Zhao G, Franz CJ, Goldstein LD, Sanroman M, Miska EA, Wang D. Natural and experimental infection of Caenorhabditis nematodes by novel viruses related to nodaviruses, 2011年 PLoS Biol. 9:e1000586.
監修者
中台(鹿毛)枝里子
1977年九州生まれ。東京大学大学院博士課程修了。東京女子医大、大阪公立大などを経て、現在、京都大学教授として「老化や感染の仕組み」の研究を行っている。
研究室HP
https://www.kagenakadailab.com
©2026 虫の集い(線虫研究者コミュニティ)「7. 感染モデルとしての線虫」CC BY NC