線虫はどんな生き物なの?
線虫はどんな生き物なの?
目次
Illustrated by Hiroko Uchida
「線虫」と聞くと、回虫やぎょう虫、アニサキスといった寄生生物たちをイメージするかもしれません。大きな分類ではこれらも線形動物(Nematoda)の仲間ではありますが、私たちはその中でも寄生性をもたないエレガンス線虫(Caenorhabditis elegans)やその近縁種を用いた研究に取り組んでいます
エレガンス線虫はわずか959個(ヒトは約37兆個)の細胞からなる多細胞生物でありながら、私たちと同様に神経系(脳)や生殖腺を有する、立派な動物の仲間です。脳を介して外界の環境を記憶・学習し、また交配によって多様な子孫を残すことができます。
とはいえなぜ線虫を研究するのでしょうか?それは私たち(Homo sapiens)自身の体のつくりや脳の働きを理解するためにほかなりません。たとえば生物の遺伝のしくみはエンドウ豆・大腸菌・ウイルスといった、実験室で取り扱いやすい対象の研究を通じて解き明かされてきました。同様に実験室で取り扱いやすい動物としての線虫を研究することで、動物としての私たちについて理解を深めたい。それが本コミュニティ(虫の集い)の共通理念です。
遠いようで近い線虫の研究を通じて何がどこまでわかってきたのか、またこれからどのようなことを解き明かそうとしているのか、本HP全体を通じて少しでも伝われば嬉しく思います。
監修者
池田 宗樹 1989年東京都生まれ。名古屋大学大学院博士課程修了。現在、カリフォルニア大学サンフランシスコ校ポストドクトラルフェローならびに日本学術振興会特別研究員として、線虫における高次知覚や認知、意識経験などの研究可能性について模索している。
©2026 虫の集い(線虫研究者コミュニティ)「序論」CC BY
1. 線虫とは
(1)「線虫」とは何か
「線虫」と聞くと線形動物門に属する動物一般を思い浮かべるかもしれませんが、このHPを運営する「虫の集い」では、主に土壌自活線虫Caenorhabditis elegans(略称C. elegans シー・エレガンス)のことを指します。
C. elegansは、その名の通りエレガントな虫で、体長約1mmの細長く透明な体をもっています。個体差がほとんどなく、光学顕微鏡で959個の体細胞をひとつひとつ同定できます。寒天培地上で育てた大腸菌をえさとして、簡単に飼うことができます。
雌雄同体と雄がいて、1匹の雌雄同体は自家受精を行なって約300個の卵を産み、卵は約3日で成虫になってまた産卵します。様々な変異体を分離でき、雄を使うと交雑ができるので遺伝学実験が可能です。
世界中にC. elegansを研究するグループがあり、隔年に集会を開いて研究発表や交流を行なっています。C. elegansに関する情報を集めたサイト(Wormbase, Wormatlas)、オンラインの教科書(Wormbook)、変異体の蒐集と配布を行うセンター(CGC)もあります。このように、線虫C. elegansは優れた「モデル生物」として科学に貢献しているのです。
(2)何のための線虫C.elegans研究か
世界中の研究者は、何のために線虫C. elegansを使って研究をしているのでしょうか。それは、「生命とは何か」という、人類のもつ根本的な謎に、自然科学の方法を使って答えるためです。
古代ギリシャの哲学者アリストテレスは、「生命(プシュケー)とは生物の働き(栄養摂取・感覚・運動・欲求・理性など)をつかさどる原理である」、と言いました。その後、近世になって「仮説を立てて検証する」という自然科学の方法が現れて、生命の研究は着実に進歩し、19世紀には細胞・進化・遺伝子という全生物に共通の基盤が発見されるに至りました。
さらに20世紀に入ると、情報とシステムをキーワードとして、DNAの遺伝情報から生物の働きがどのように生じるかを分子レベルで解明するようになります。その中でC. elegansは発生や行動のメカニズムを解明するための研究材料として採用され、他の分野も含めて、生物の謎をいくつも解明してきました。線虫で正しいことの多くは、基本的にヒトでも正しいのです。線虫C. elegans研究は今後も発展し、生物の素晴らしさを明らかにすることが期待されています。
監修者
桂 勲 1945年神奈川県生まれ、東京大学大学院博士課程修了。現在、国立遺伝学研究所名誉教授、総合研究大学院大学名誉教授。
©2026 桂勲「1. 線虫とは」CC BY
2. 線虫の体と性
(1)線虫の体
線虫(Caenorhabditis elegans)とは世界中に生息している小さな生物です。体は筒状で1mmの長さしかないため、研究で扱いやすいという利点があります。わずか1千弱の細胞しかないものの、神経系、筋肉系、消化系、外皮系、生殖系の組織があり、体が透明であるため、単純な顕微鏡でこれらの細胞を観察できます。
神経系は302個の細胞からなり、その大部分は原始的な脳のように頭に集結しています。頭から尾まで、腹と背に沿って運動神経系がつながっています。運動用の筋肉は筒状の体の内面に4分円のように頭から尾まで一様についています。口にあたる筋肉質の「咽頭」で細菌を砕いて食べ、体長のほとんどを占める腸で消化します。尾には肛門があり、排出を促す筋肉もついています。体の外面は皮細胞が分泌するタンパクから構成されるクチクラという殻で覆われています。これらの組織はヒトと比べると小さいものの、その基本的な機能と構成様式は共通しています。
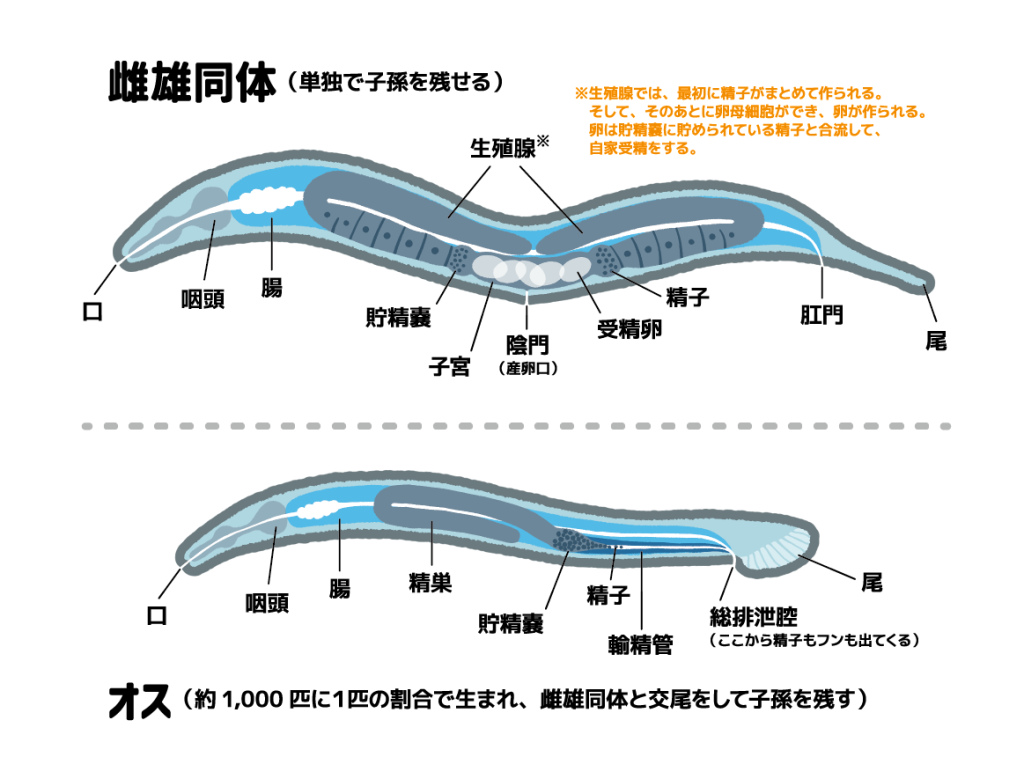
(2)線虫の性
線虫には雌雄同体と雄と2つの性があります。雌雄同体には産卵と交尾のための外陰部があり、体内には卵子と精子を作る生殖腺があります。雄は尾に交尾のためのヒレがあり、精子を作る生殖腺があります。
雌雄同体の場合、成虫になる寸前に精子が作られ、生殖腺に保存されます。成虫になった後、より大きい卵子が作られ、保存された精子と、または交尾からの精子と受精します。

雌雄同体は成虫に至るまでに作りだした精子によって約300の子を産みますが、交尾した場合は約1000の子を産むことができます。線虫の性別はX染色体の数によって決められ、X染色体が2つの場合は雌雄同体、1つの場合は雄になります。
よって、雌雄同体が作る精子は全てXを持ち、雌雄同体の子しか産みません。雄が作る精子のうち半分はX染色体を持ち、もう半分は性染色体を持たないため、交尾した個体の子は雌雄同体と雄が1:1の割合になります。
参考資料
1) Ann K.Corsiら著 「A Transparent window into biology: A primer on Caenorhabditis elegans」、2015年 WormBook, ed. The C. elegans Research Community, WormBook, doi/10.1895/wormbook.1.177.1, http://www.wormbook.org.
監修者
スノー・アンドリュー ブリティッシュコロンビア大学大学院細胞・発生生物学プログラム所属。現在、博士課程学生として水元公大研究室に所属し、線虫のシナプスパターン形成の研究をしている。
水元 公大 神戸大学大学院博士課程修了。現在、ブリティッシュコロンビア大学准教授としてシナプスのパターン形成や神経発生に関与しているシグナル経路の研究をしている。。
©2026 スノー・アンドリュー「2. 線虫の体と性」CC BY
3. 線虫研究の歴史
(1)始まりはシドニー・ブレナー

シドニー・ブレナーは、20世紀を代表する分子生物学者です。彼は、1950年代に、DNA2重螺旋構造を解明したことで知られるフランシス・クリックらとともに、遺伝暗号の解読に取り組み、大腸菌やバクテリオファージなどの単細胞生物やウイルスを研究対象として、遺伝子からタンパク質へと遺伝情報が伝達される「セントラルドグマ」を確立しました。
その後、ブレナーはより複雑な生命現象を対象とした新しい生物学の創生を目指しました。当時、彼は、解明すべき課題として、「多細胞生物の体を形づくるしくみ」や「神経系が情報を処理するメカニズム」などを考えていました。こうした課題を解明するための多細胞生物モデルには何を使えばよいでしょうか?
「神経系での情報処理を明らかにするには、神経細胞がどのように接続しているのか、を明らかにする必要がある。神経細胞の接続様式を解明するには、電子顕微鏡を使って微細な構造を観察する必要がある。電子顕微鏡で観察することができる対象は、非常に小さい。」こうしたことから、ブレナーは新たに取り組むモデル生物は、「遺伝学的解析が可能」で、「世代時間が短く」、「研究室環境で容易に飼育ができる」ということに加えて、「体が小さい」という性質を備えているべきであると考えました。
こうした性質を備えた生物として、土壌に住む線虫に注目し、Caenorhabditis elegans (体長1mm)を新たなモデル生物として位置付け、研究を開始しました。
(2)神経の配線図を決める
線虫は、全身の神経がどこでどのように接続しているのかという、いわば「配線図」が初めて完全に明らかにされた生物です。この歴史的な偉業を成し遂げた中心人物として、ジョン・ホワイトとニコル・トムソンが挙げられます。彼らはブレナーの研究グループに加わり、神経配線図を明らかにするプロジェクトに取り組みました。
このプロジェクトでは、線虫をきわめて薄い切片にスライスし、1枚ずつ電子顕微鏡で撮像して、どの神経細胞とどの神経細胞がどこでどのように接続しているかを解明していきました。これは、たとえて言えば、一本のキュウリを2万枚の輪切りにし、全ての輪切り断面の写真を撮って、2万枚の写真が空間的につながるように位置を合わせながら、キュウリ内部の微細な構造を観察する、といった非常に気が遠くなるような作業です。

トムソンは電子顕微鏡のスペシャリスト、ホワイトはエンジニアであったことから、彼らの専門知識がこの偉業の達成に大きく役立ちました。この研究事例は、今で言う異分野融合によるブレイクスルーと言えます。ブレナーは、のちに「科学を切り拓くのは、いつも、分野外から参入した人たちだ(I’ve always found that the best people to push science forward are those who come from outside it)」という言葉を残しています。
(3)細胞系譜(細胞の家系図)を決める
線虫は、受精卵から成虫に至るまでのすべての細胞分裂が明らかにされている唯一の多細胞生物です(2025年現在)。受精卵からどのような細胞分裂が、いつ、どこで起こり、どの細胞が最終的にどのような細胞(神経細胞、筋細胞、生殖細胞など)に分化するのか、といういわば「細胞の家系図」が明らかとなっています。これは、神経の配線図を決定した研究と同じく、膨大な時間と労力の上に結実した偉業です。
この研究から、細胞の家系図は、個体間で不変であり、「線虫の成虫は、959個の細胞から構成されている」ことが明らかとなりました。この偉業を成し遂げた中心人物は、ジョン・サルストンとボブ・ホロビッツです。彼らは、生きた線虫を顕微鏡下で直接観察し、すべての細胞の細胞分裂を追跡しました。特にサルストンは、線虫胚(受精卵)が孵化するまでの間に558個の細胞が生じることを突き止めました(線虫は孵化後、幼虫の段階で細胞分裂を繰り返し、成虫までに959個の細胞をもつようになります)。
この線虫胚の観察実験を例えるとするならば、こねて丸めた1つのパン生地に次々と仕切りが生じ、全体の大きさを変えずに558個の区画に仕切られていく様子を観察して、どの区画がどういった系譜から生まれたかを完全に追跡する、ということになります。さらに厄介なことに、このパン生地は、一定の時間が経つと(筋細胞が生じて分化が進むと)、自律的に体動を始めてしまいます!
サルストンは、細胞系譜を報告した論文の中で、「われわれが報告した細胞系譜にエラーがないと考えるのは望みすぎであろう」と自らの仕事への警鐘を書き残しています。しかしながら、サルストンが決定した細胞系譜に対するホロビッツの信頼は厚く、のちに、「ジョンが間違えることはありえない」という言葉を残しています。実際に、細胞系譜の完全な記述(1983年)から40年以上が経った現在においても、線虫の細胞系譜は当時の姿から書き変わっていません。
参考資料
1) Errol C. Friedberg著 「SYDNEY BRENNER A Biography」、2010年 Cold Spring Harbor Laboratory Press 2) John G. White著 「Getting into the mind of a worm—a personal view」、2013年 WormBook, ed. The C. elegans Research Community, WormBook, doi/10.1895/wormbook.1.158.1, http://www.wormbook.org.
監修者
中野 俊詩 1976年東京都生まれ。マサチューセッツ工科大学大学院博士課程修了。現在、名古屋大学講師として線虫の発生・休眠・行動・意思決定の研究を行っている。
©2026 虫の集い(線虫研究者コミュニティ)「3. 線虫研究の歴史」CC BY
5. 線虫の研究とノーベル賞
(1)線虫の基礎研究:ブレナー、サルストン、ホービッツ
線虫C. elegansについて、初めて基礎的な研究を行ったのはイギリスのシドニー・ブレナー(S. Brenner)で、1960年代のことでした。著名な分子生物学者であったブレナーは、動物の発生や神経系の解析にふさわしい動物として、線形動物門の動物である線虫が良いと考え、多数の線虫を飼育観察した結果、C. elegansを選びました。
ブレナーは、まず変異誘導剤EMSを用いてなんらかの異常を示す変異体を多数分離し、それらを用いて遺伝子地図を作成しました(線虫遺伝学の確立、1974年論文発表)。つぎに、体細胞の約3分の1を占める神経細胞からなる神経系の微細構造をホワイトらと共に解析しました(1986年論文発表)。さらに、イギリス人のサルストン(J. E. Sulston)、アメリカ人のホロビッツ(H. R. Horvitz)と共にC. elegansの全細胞の生成過程(細胞系譜)を明らかにしました(1977年、1983年論文発表)。
これらの業績に対して、2002年上記3人にノーベル生理学・医学賞が授与されました(「器官の発生及びプログラム細胞死の遺伝的制御に関する発見」)。

(2)RNA干渉の発見:ファイアとメロ
アメリカ人のファイア(A. Z. Fire)は、留学先であるイギリスのケンブリッジ大学の分子生物学研究所で線虫の研究を行いました。そこで、線虫にDNAを注入して遺伝子を発現させる「形質転換」という技術を確立しました(1986年論文発表)。アメリカに帰国後、1986年からカーネギー発生学研究所の研究員となり、線虫に特定の遺伝子を導入し、発現させる目的で、運び屋(ベクター)として利用できるプラスミド(環状DNA)を作成しました。

次に、発現を抑えたい標的遺伝子のメッセンジャーRNA(mRNA)と相補的な核酸(アンチセンス核酸)に関連した研究を行い、アメリカ人のメロ(C. Mello)と共に、2本鎖RNAによる特定の遺伝子の強力な発現抑制の現象とその機構を発見しました。この現象はRNA干渉と呼ばれ、生物界でかなり普遍的な現象であることが明らかになりました。これらの業績により、ファイアとメロは2006年にノーベル生理学・医学賞を受賞しました(「RNA干渉、または2本鎖RNAによる遺伝子発現の抑制、の発見」)。
(3)GFPの利用:チャルフィー
アメリカ人のチャルフィー(M. Chalfie)は、英国ケンブリッジ大学分子生物学研究所の博士研究員を経て1982年にアメリカに戻り、コロンビア大学で線虫の機械的刺激(接触)の変異体の研究を続けていました。彼は1989年にGFP(Green Fluorescent Protein)と呼ばれる緑色の蛍光を発するタンパク質の存在を知り、これを線虫内での特定の遺伝子発現の可視化に使いたいと考えました。
GFPはアメリカで研究をしていた日本人の下村修により、オワンクラゲから分離・同定されたタンパク質で、ウッズホール海洋研究所のプラッシャーにより、そのmRNAの配列をDNAに転換したcDNA(相補的DNA)が作られていました。チャルフィーはそれをもらい、線虫の機械感覚に関与する遺伝子の転写開始信号(プロモーター)とGFPを結合したプラスミドを作成し、線虫に導入しました。すると、見事に線虫の機械感覚ニューロンのみが緑色蛍光を発したのです。
チャルフィーはこの業績により、下村修、GFPの改変を行ったチェン(R. Y. Tsien)と共に2008年ノーベル化学賞を受賞しました(「緑色蛍光タンパク質(GFP)の発見と発展」)。ちなみに、チャルフィーのGFPについての研究期間はわずか2週間程度だったそうです。
(4)マイクロRNA:ラブカン、アムブロ
共にアメリカ人であるラブカン(G. Ruvkun)とアムブロ(V. Ambros)は、線虫においてマイクロRNA(microRNA)の実体とその機能の研究を精力的に行いました。マイクロRNAは、タンパク質をコードしていない小さいRNAで、線虫においては140以上の遺伝子から発現され、発生・行動・代謝・環境変化に対する行動などを調節しています。このようなマイクロRNAの発見について、この2人は2024年のノーベル生理学・医学賞を受賞しました。
監修者
大島 靖美 1940年神奈川県生まれ。東京大学大学院博士課程修了。米国カーネギー発生学研究所博士研究員、九州大学理学部教授などを経て、現在は九州大学名誉教授。主な著書に『線虫の研究とノーベル賞への道: 1ミリの虫の研究がなぜ3度ノーベル賞を受賞したか』『動物はいつから眠るようになったのか? ―線虫、ハエからヒトに至る睡眠の進化』『400年生きるサメ、4万年生きる植物: 生物の寿命はどのように決まるのか』などがある。
©2026 虫の集い(線虫研究者コミュニティ)「5. 線虫の研究とノーベル賞」CC BY
6. 医療・産業界への応用
(1)GFPを生物利用する突破口としてのC. elegans
GFP(Green Fluorescent Protein)はクラゲ由来の蛍光タンパク質で、多くの人に知られています。もともとは下村修博士がクラゲから精製したタンパク質の性質を調べ、それをプラッシャー(D. C. Prasher)博士がクローニングしたものですが、チャルフィー(M. Chalfie)博士が線虫のトランスジェニック体でニューロンの生体染色を行ったことで、生命科学研究に応用できることが初めて示されたのです。その後、多くの研究者がいろいろな生物種において同様の実験を行った結果、「光るクラゲ」は研究者のみならず、誰もが知る存在になりました。
チェン(R. Y. Tsien)博士グループの論文には、GFPにアミノ酸置換を導入することで光特性が変化することが記載されています。その後、GFPの蛍光特性変異体を始めとして、他の蛍光タンパク質の活用も盛んになりました。GFPを他の蛍光タンパク質と融合したり、GFPタンパク質にセンサー機能を持つドメインを追加するなどの方法で、多くの生体内センサーが創り出されました。
これらは線虫に限らず、他のモデル生物や培養細胞でも利用できるため、遺伝子工学的に作成した高機能な蛍光タンパク質をバイオテクノロジー企業が販売したり、研究者がAddgene(https://www.addgene.org)などの企業に委託して提供したり、といったしくみに成長しています。線虫で突破口を開いた技術が、その後、広範な生物種の研究に影響を及ぼした一例といえます。
(2)ヒトの疾患の理解に応用できる突破口としてのC. elegans
C. elegansは、個体の形態学的な記載がある、細胞系譜や細胞の機能が明らかになっている、生活環が短い、飼育が容易、ゲノム解析が進んでいるなど、モデル生物としてのメリットがたくさんあります。初期のC. elegans研究では、これらの特性はもっぱら生物学的な知識の蓄積に役立てられていました。しかし、モデル生物として確立し、研究者数が多くなってからは、C. elegansを「ヒトがより良く生きていくためのツール」として使う研究者が増えてきました。
たとえば、人類にとって重要かつ患者数が多い疾患として知られているアルツハイマー病、パーキンソン病は、脳の神経細胞の変性によって発症すると言われています。これらの病気はヒトの老化に伴って発症しますが、C. elegansは寿命が短いがゆえに老化に関係する疾患の解析がしやすいため、盛んに利用されています。
線虫は実験モデルとしては有用ですが、それだけで医療や産業に使うには困難が伴います。少なくとも外見上は構造や臓器構成がヒトと似ておらず、マウスなどの哺乳類実験モデルと同じアプローチはできません。
上述のように、線虫では生物学的な知見取得やゲノム解析が先行し、ヒトよりも数年早く、1998年に全ゲノム解読が完了しました。その際、構造や機能の面でヒトと類似性が高いと思われる遺伝子がたくさん発見され、分子細胞レベルでは線虫とヒトがよく似ていることがわかりました。
その中でも、マイクロRNAは、線虫の発生生物学解析で初めて発見された代表例です。マイクロRNAはその後、ヒトゲノム上にも多数存在していることが分かり、線虫と類似の作用を持っていること、その発現変化がヒトの疾患と重要な関係をもつことが知られています。2024年にはその業績でアムブロ(V. Ambros)とラブカン(G. Ruvkun)にノーベル生理学医学賞が授与されています。
ヒトのマイクロRNAが疾患のメカニズムに関わっているとする研究論文が多数発表されているだけでなく、現在、マイクロRNAを測定することで癌の診断が可能、というところまで進んでおり、遺伝子検査ビジネスも始まりそうです。先駆的な仕組みの解明が医療・産業に応用されることはよくあることで、線虫も例外ではありません。
参考資料
1) Shimomura O著 「Structure of the chromophore of Aequorea Green Fluorescent Protein」、1979年 FEBS Letters, 104:220-222
2) Prasher DCら著「Primary structure of the Aequorea victoria green-fluorescent protein」、1992年 Gene, 15;111(2):229-33. doi: 10.1016/0378-1119(92)90691-h
3) Chalfie Mら著 「Green fluorescent protein as a marker for gene expression」、1994年 Science, 11;263(5148):802-5. doi: 10.1126/science.8303295
4) Heim Rら著 「Wavelength mutations and posttranslational autooxidation of green fluorescent protein」、1994年 Proc. Natl. Acad. Sci. USA, 91, 12501-12504.
5) Lee RCら著 「The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14」、1993年 Cell, 3;75(5):843-54, doi: 10.1016/0092-8674(93)90529-y.
6) Wightman Bら著 「Posttranscriptional regulation of the heterochronic gene lin-14 by lin-4 mediates temporal pattern formation in C. elegans」、1993年 Cell, 3;75(5):855-62, doi: 10.1016/0092-8674(93)90530-4.
7) Matsuzaki Jら著 「Prediction of tissue-of-origin of early stage cancers using serum miRNomes」、2023年 JNCI Cancer Spectr, 3;7(1):pkac080, doi: 10.1093/jncics/pkac080.
監修者
三谷 昌平 1958年鳥取県生まれ。東京大学医学部医学科卒業、医師。2024年、東京女子医科大学名誉教授、日本歯科大学生命歯学部客員教授、2025年4月からは東京女子医科大学学長。
©2026 虫の集い(線虫研究者コミュニティ)「6. 医療・産業界への応用」CC BY