線虫から生まれた新技術
線虫から生まれた新技術
目次
Illustrated by Hiroko Uchida
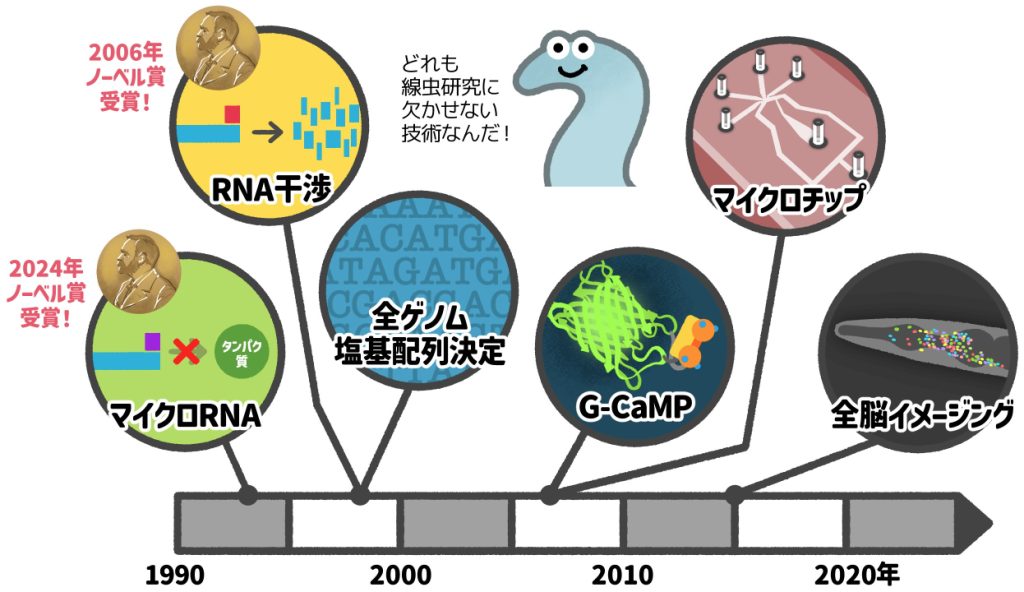
線虫を対象とした生命科学研究の進展は、研究者・技術者の専門知識やアイディアから生まれた革新技術によって支えられてきました。こうした技術の中には、線虫以外の生物を対象としたさまざまな分野の研究に波及し、なくてはならない技術として定着したものが数多くあります。
その中から、1982年に多細胞生物で初めて線虫で実現した全ゲノム塩基配列決定(5-1)、遺伝子発現のコントロールを可能とする重要なツールであり、2006年と2024年にノーベル生理学・医学賞を受賞したRNA干渉(RNAi)とマイクロRNA(miRNA)(5-2)、生物学的プロセスを可視化する強力なツールであるG-CaMP(ジーキャンプ)(5-3)、線虫の脳のすべての神経細胞の活動の変化を顕微鏡で測定可能にした全脳イメージング(5-4)、線虫実験・解析のためのマイクロチップ(5-5)について、周辺情報をふまえて解説します。
監修者
鈴木 芳代(国立研究開発法人量子科学技術研究開発機構 高崎量子技術基盤研究所)
研究室HP
https://www.qst.go.jp/site/qabiotech/
©2026 虫の集い(線虫研究者コミュニティ)「序論」CC BY
1. 全ゲノム塩基配列決定
全ゲノム塩基配列の決定
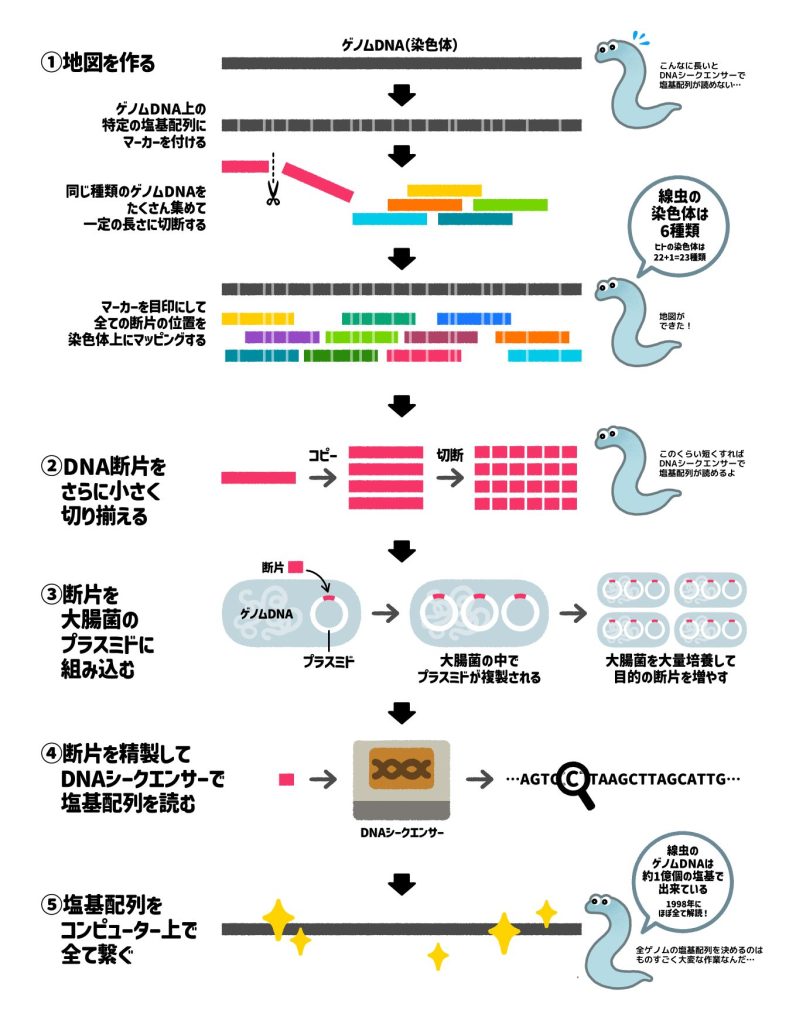
コールソン(Coulson)らは、線虫から高純度なゲノムDNAを抽出し、細かくランダムに切断して一定の範囲の長さをもつDNA断片を作成し、コスミドベクター※1に挿入し、ゲノムDNAライブラリー※2を完成させました。次に、ライブラリー中の各クローンの特徴的パターン(フィンガープリント)を比較して、重複する領域を検出することでクローンどうしの位置関係を明らかにしました。こうして作成された、ある程度の長さの領域をカバーするクローンのグループを、「コンティグ」といいます。表現型解析で同定された既存の変異体遺伝子の遺伝地図を参照しながら、得られたコンティグを染色体上に割り当てていくことにより、ゲノム物理地図が作成されました。
全ゲノム配列は、英国サンガーセンターと米国ワシントン大学にて、それぞれのコスミドをさらに細かい断片にサブクローニングしてから塩基配列解析を行う「階層的ショットガン法」によって決定されました。コスミドのみでは解読できない領域が多数残るため、より大きなDNA断片をクローニングできる「人工酵母染色体」を使って補完しました。その結果、1998年12月に、多細胞生物では初めて、全ゲノム塩基配列が決定されました。
※1. コスミドベクター:ベクターとは「(遺伝子の)運び屋」を意味し、挿入されたDNAの断片を運ぶ役割をもつ環状のDNAで、コスミドベクターはプラスミドベクターよりも大きな断片を運ぶことができる
※2. ゲノムDNAライブラリー:適当な大きさに切断したゲノムDNAをベクターに組み込み、大腸菌や酵母細胞の中で保管したもの
Illustrated by Hiroko Uchida
ACEDB(A C. elegans database)の開発
リチャード・ダービン(Richard Durbin) と ジーン・ティエリー・ミーグ(Jean Thierry-Mieg)は、線虫ゲノムプロジェクトで生じる膨大なデータを整理・共有する線虫ゲノム解析データベースシステムACEDB(A C. elegans database)を開発しました(1989年)。ACEDBのデータはオブジェクト指向で構造化されており、遺伝子、染色体、マーカー、表現型などが各オブジェクトとして管理されています。そのため、各オブジェクト間の関係性が明示され、直感的なデータ解析が可能となっています。
ACEDBは、線虫研究を加速させるだけでなく、ACEDBのオブジェクト指向データモデルは、現代のゲノム解析データベースの設計にも大きな影響を与えました。現在、ACEDBはより進化したオンラインデータベースWormBase(https://wormbase.org/)に統合されています。
参考資料
1)飯野 雄一(編), 石井 直明(編) 線虫 究極のモデル生物 2002年 シュプリンガー・ジャパン
2) Eeckman FH, Durbin R (1995) ACeDB and macace Methods Cell Biol. 48: 583–605. doi:10.1016/s0091-679x(08)61405-3
3)Coulson A, Sulston J, Brenner S, KarnToward J (1986) Toward a physical map of the genome of the nematode Caenorhabditis elegans. Proc Natl Acad Sci U S A Oct;83(20):7821-5. doi: 10.1073/pnas.83.20.7821.
監修者
伊藤 將弘
立命館大学 生命科学部 生命情報学科
研究室HP
https://www.ritsumei.ac.jp/lifescience/bioinfo/ito/
©2026 虫の集い(線虫研究者コミュニティ)「1. 全ゲノム塩基配列決定」CC BY
2. GFPとG-CaMP
GFPとは
緑色蛍光タンパク質(Green Fluorescent Protein: 略してGFP)は、オワンクラゲという海洋生物から発見された光るタンパク質です。オワンクラゲはその名の通り、お椀を逆さにしたような形をしており、刺激を受けると体の周りが美しい緑色に光ります。下村脩博士は「クラゲがなぜ光るのか」という純粋な疑問から研究を始め、1962年に大量のオワンクラゲからGFPを精製することに成功しました。
GFPは238個のアミノ酸からなる円筒形の構造を持ち、その中心にある発色団と呼ばれる部分が青い光を吸収し、緑色の光(蛍光)を放出します。このように、光のエネルギーを吸収して別の色の蛍光を放出するタンパク質を蛍光タンパク質と呼びます。
ここで、オワンクラゲのGFPの蛍光とホタルの光との違いについて説明します。ホタルの光は「化学発光」と呼ばれ、発光基質とそれを触媒する酵素との化学反応によって生じます。一方、GFPは光を当てるだけで蛍光を発し、酵素や基質を必要としません。この特性により、GFPは生物学の研究において非常に便利なツールとなっています。

Illustrated by Hiroko Uchida
GFPを使って生きた細胞を「視る」
GFPを使えば生き物に害を与えずに、細胞や細胞内の分子の動きを生きたままリアルタイムで観察することが可能です。1990年代には、GFPの蛍光を目印として生き物の中の特定の細胞やタンパク質を観察する方法が開発されました。最初に試されたのが、線虫という小さな動物です。線虫は体全体が透明であり、生きたまま体内の構造や個々の細胞を直接観察できます。マーティン・チャルフィ博士は遺伝子工学を利用して、GFPを作る遺伝子を線虫に組み込み、生きた線虫の中で触覚(さわった感覚)の神経細胞だけを緑色に光らせることに世界で初めて成功しました(1)。GFPを目印に特定のたんぱく質が細胞内でどのように局在しているかを観察し、時間とともに変化する様子を追跡できます。また、GFPは遺伝子発現のマーカーとしても利用され、特定の遺伝子が働く場所やタイミングを調べることもできます。最近、緑色の他にも、赤色蛍光タンパク質などさまざまな色の蛍光タンパク質が開発され、複数の細胞やタンパク質を同時に解析することも可能になりました。現在、GFPは生命科学や医学の研究のさまざま分野で利用されています。GFPの発見と応用によって、下村博士、チャルフィー博士、チエン博士は2008年にノーベル化学賞を受賞しました。GFP実験は、高校や大学で行われる夏の学校や特別プログラムでも広く採用されており、その視覚的な魅力と応用可能性は、最先端技術と科学への興味を引き出す素晴らしい題材となっています。
G-CaMPとカルシウムイオンのイメージング
カルシウムイオン(Ca2+)は、神経の活動や筋肉の収縮、ホルモンの分泌など、私たちの体で多くの重要な役割を果たしています。これらのプロセスはすべて、細胞内Ca2+濃度の微細な変化によって調節されています。そのため、Ca2+濃度の変化をリアルタイムで観察する(イメージングする)ことは、生命現象や病気を理解する上で非常に重要です。G-CaMP(ジーキャンプ)は、細胞内のCa2+濃度をイメージングするために中井淳一博士らによって開発されたGFPベースのカルシウムセンサーです(2)。このセンサーは、改変されたGFP(cpGFP)、カルモジュリン(CaM)、およびミオシン軽鎖キナーゼ(M13)を組み合わせた構造を持っています。Ca2+がカルモジュリンに結合すると、Ca2+・カルモジュリン複合体がM13と結合し、cpGFPの立体構造を変化させて蛍光が明るくなります。つまり、神経や筋肉が活動してCa2+濃度が高くなるとG-CaMPが明るく光るようになる仕組みです。この技術は神経科学の分野で特に利用されており、動物の神経系の働きを生きたまま「視る」ことができるのです。例えば、線虫は好きな温度や化学物質がありますが、それらの刺激に対する感覚神経回路の応答や、行動に関連する神経活動を詳細に解析できます。
このように、GFPとG-CaMPはさまざまな生物学的プロセスを可視化し、生命科学研究において強力なツールとなっています。
参考資料
1)Chalfie M, Tu Y, Euskirchen G, Ward WW, Prasher DC. Green fluorescent protein as a marker for gene expression. Science. 1994 Feb 11;263(5148):802-5. doi: 10.1126/science.8303295. PMID: 8303295.
2) Nakai J, Ohkura M, Imoto K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nat Biotechnol. 2001 Feb;19(2):137-41. doi: 10.1038/84397. PMID: 11175727.
監修者
安藤 恵子
島根県生まれ、岡山大学理学部卒業、同大学院博士課程修了。東北大学歯学研究科准教授。線虫モデルを用いて細胞内の物流システムや神経系での神経伝達物質の分泌を担う遺伝子の研究、および関連する疾患モデル動物の開発に取り組んでいる。
©2026 安藤恵子「2. GFPとG-CaMP」CC BY
3. RNA干渉とマイクロRNA
RNA干渉とマイクロRNA
RNA干渉(RNAi)経路やマイクロRNA(miRNA)経路は、小さなサイズのRNAを使って遺伝子の発現をコントロールするもので、生き物が生きていくために重要な役割を担っています。線虫(C. elegans)研究者は、これらの研究のパイオニアであり、2006年にはアンドリュー・ファイアー(Andrew Fire)とクレイグ・メロー(Craig Mello)がRNA干渉に関する発見で、2024年にヴィクター・アンブロス(Victor Ambros)とゲイリー・ラヴカン(Gary Ruvkun)がマイクロRNAに関する発見で、それぞれノーベル生理学・医学賞を受賞しました。
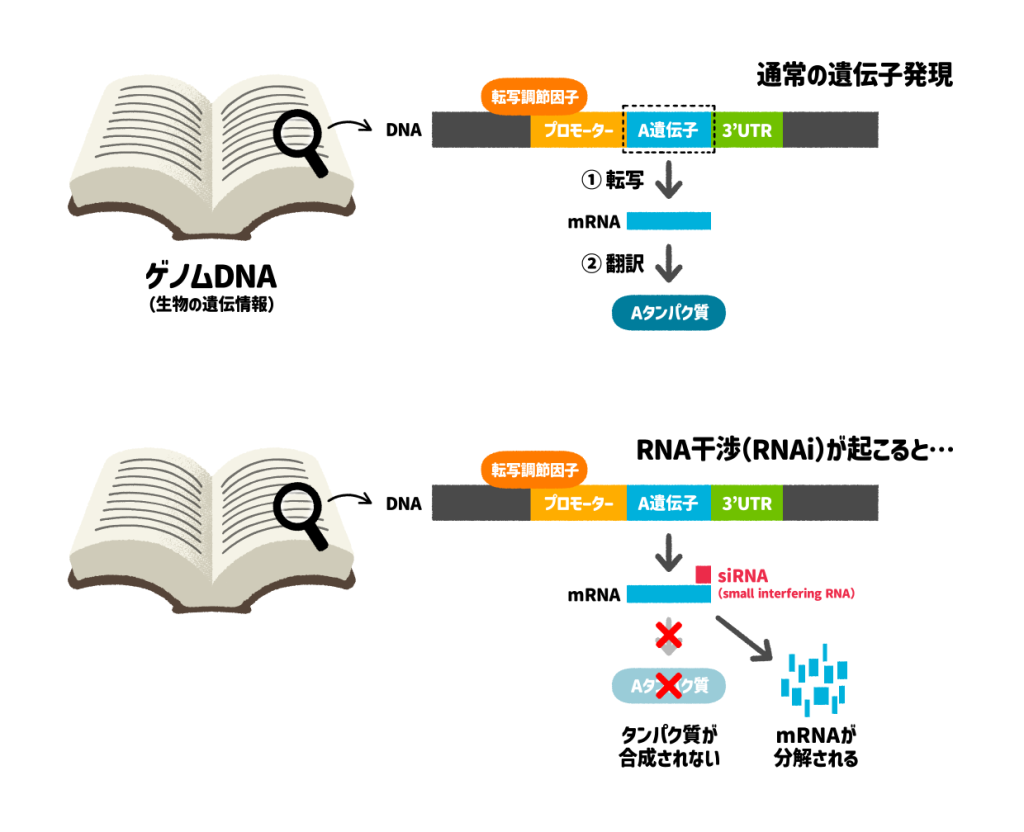
生き物の遺伝情報は、DNAという分子に書き込まれており、適切なタイミングと場所で遺伝情報の一部がメッセンジャーRNA(mRNA)にコピーされ(転写)、その情報をもとにタンパク質が作られます(翻訳)。遺伝情報をもとにタンパク質が作られることを遺伝子発現といいます。
この「DNA→mRNA」のプロセスでは、主に転写因子というタンパク質が促進や抑制の制御を行っていますが、RNA干渉やマイクロRNAのシステムは、「mRNA→タンパク質合成」のプロセスを妨げることにより、遺伝子の発現を抑制(サイレンシング)しています。
Illustrated by Hiroko Uchida
RNA干渉
RNA干渉は、small interfering RNAs (siRNAs)という短い二本鎖RNAが、相補的な配列をもつターゲットRNAに結合し、そのターゲットRNAを分解するシステムです。siRNAは基本的に外来で、RNA干渉は、外来のウイルスやDNA上を動き回る能力をもつ遺伝子(transposable elements)などから生体を防御する役割を担っていることがわかってきています。
RNA干渉は、1998年に初めて発表されて以降、研究対象となるだけでなく、生物学の重要なツールとして大活躍しています。たとえば、ある特定の遺伝子の発現を抑えるとどうなるのかを見たいときには、狙った遺伝子DNAから転写されるmRNAの配列にあわせてsiRNAを人工的に合成し、細胞や個体に取り込ませることにより、その遺伝子の発現を人為的に抑えること(ノックダウン)ができます。
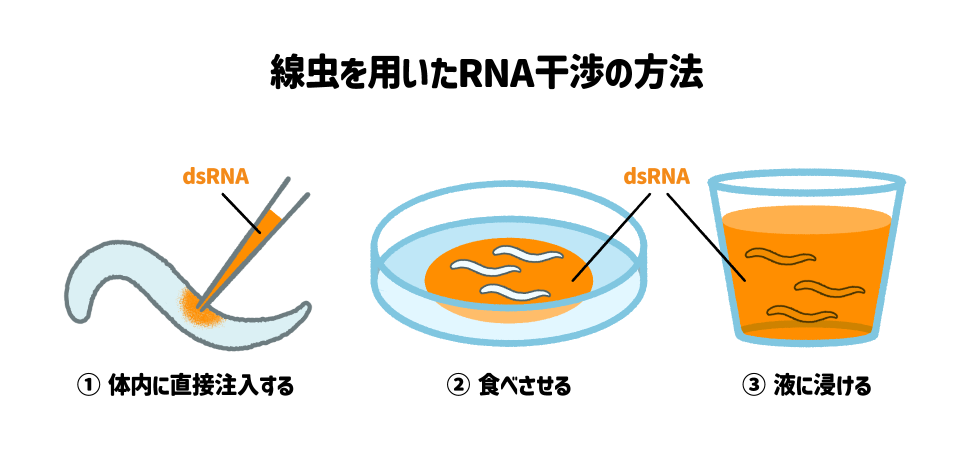
線虫の研究では、siRNAの前段階のdsRNA(double-stranded RNA)を使いますが、dsRNAを①注射する、②食べさせる、③含ませた液体に浸ける、といった方法で取り込ませることができ、RNA干渉の効果は世代を超えて引き継がれることがわかっています。
Illustrated by Hiroko Uchida
マイクロRNA
マイクロRNAは、DNAに書き込まれた遺伝情報をもとに短い一本鎖RNA分子として作られ、酵素反応により成熟し、相補的な配列をもつターゲットmRNAを分解したり、タンパク質への翻訳を妨げます。初めて発見されたマイクロRNAの遺伝子(lin-4)とそのターゲットmRNAの遺伝子(lin-14)は、線虫の成長に異常を示す遺伝子変異体の解析から発見されました。変異体とは、遺伝子の一部に傷をもつ個体です。線虫は、遺伝子を操作して生命現象の謎を解明する遺伝学的解析に大きな強みをもちます。
この研究は、lin-4遺伝子がタンパク質ではなくRNAとしてlin-14遺伝子の発現を制御しているという驚きを与えました。その後の研究から、さまざまなマイクロRNAが発見され、発生や成長の時期や組織にあわせて適切なタイミングと場所で遺伝子発現をコントロールすること、ヒトを含むさまざまな生物で発生や疾患に関与することが示されてきています。
RNA干渉やマイクロRNAは、医療の分野でも注目されてきています。従来用いられてきた化合物やタンパク質を用いた治療の多くでは、病気のもとになるタンパク質をターゲットとしていますが、RNA干渉やマイクロRNAのシステムを応用すれば、原因タンパク質を作らせない治療法が期待できます。とはいえ、本来のターゲットだけに作用するか、副作用はないか、世代をこえた影響はないか、など課題も多く、今後ますますの研究の発展が期待されます。
参考資料
1)Sydney Brenner著 「The genetics of Caenorhabditis elegans」、1974年 Genetics, 77: 71-94、doi: 10.1093/genetics/77.1.71
2)R.C. Lee, R.L. Feinbaum, V. Ambros著 「The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14」、1993年 Cell, 75: 843-54、doi: 10.1016/0092-8674(93)90529-y
監修者
坂口 愛沙
©2026 虫の集い(線虫研究者コミュニティ)「3. RNA干渉とマイクロRNA」CC BY
4. 線虫における全脳イメージング
全脳イメージングとは?
ヒトの脳は、約1500 cm3の大きな構造で、その中に1000億個を超える数の神経細胞がネットワークをつくって、情報処理を行っています。その全体のはたらきは、fMRI(磁気共鳴機能画像法)で知ることができます。この手法では、脳全体を小さな領域(最も小さくて約1 mm3)にわけて、それぞれの血流や酸素代謝を測定することによって、脳の領域ごとの活動を推測していますが、それでも神経細胞ひとつずつの活動を調べることはできません。しかし、もし0.01 mm程度の大きさの神経細胞のすべてについて個別に活動を計測できれば、実際の情報処理のようすを知ることができます。線虫の「脳」にあたる頭部の中枢神経系は、約180個の神経細胞が、太さが髪の毛くらい(直径0.05 mm)で長さが0.25 mmくらいの小さな領域にまとまっています。線虫では、この特徴を活かして、「全脳イメージング」と呼ばれる方法で、脳の全ての神経細胞をひとつずつ測定することができるのです。
この大きさなら、顕微鏡で高倍率の対物レンズを使えば、脳全体の神経細胞をひとつずつ観察できます。神経細胞のはたらきを個別に明らかにするためには、その一つ一つの活動の変化を測定する必要があります。神経細胞は、主に電気信号を伝えているので、神経細胞の活動を測定するためには、電気信号と電極を使って測定する方法(電気生理学)が昔から使われてきました。しかし、線虫の脳はとても小さいので、それぞれの神経細胞の電気信号を直接測定することはできません。そこで、顕微鏡を使ったカルシウムイメージングという方法を使います。神経細胞内のカルシウムイオン濃度は、細胞外に比べておよそ10万分の1以下の濃度しかありませんが、神経細胞が活動するときには、約100倍カルシウムイオン濃度が上昇します。、カルシウムイオンに反応して蛍光が強くなるカルシウムイオンタンパク質センサーを用いると、神経細胞のカルシウムイオン濃度(≒神経の活動)を測定することができます。したがって、カルシウムイオンタンパク質センサーを全ての神経細胞で作らせることによって、脳の全ての神経細胞の個別の活動の変化を顕微鏡で測定することができるようになります。これが全脳イメージングです。
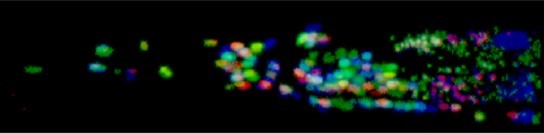
コロンビア大学ホバート教授らが開発したNeuroPALを用いて、神経細胞毎に異なる蛍光を発しているので、それぞれの細胞を区別できる。(青木・石原 未発表)
線虫の全脳イメージングってどうやるの?
線虫の脳を顕微鏡で観察するためには、高倍率のレンズを使います。しかし、高倍率のレンズでは、とても薄い領域(つまり面)にしかピントが合いません。神経細胞は、ブドウの房のように、3次元的に広がって存在しているので、ひとつの面だけを観察しても「全脳」をみることはできません。そこで、手前から奥まで、ピントが合う位置を少しずつずらしながら、観察することになります。また、神経の活動の変化は速いので、それに合わせて高速に観察する必要があります。そのために、高速かつ正確(0.001秒で0.001mm)に対物レンズを動かすことができる特別な顕微鏡を使います(図2)。
このような顕微鏡では、1秒間に100枚以上の写真を撮ることができます。線虫の脳全体を観察するためには、20-30ヶ所のピントの位置で撮影することが必要ですので、それぞれの神経細胞を1秒間に3-5回ずつ撮影することができます。この撮影を5分間行ったとすると、線虫の神経細胞の画像は3万枚にもなります。

線虫の全脳イメージングの画像から神経活動を知るには?
3万枚にもなる画像からそれぞれの神経細胞の活動の変化を知るためには、AIの助けが必要です。まず、線虫の神経細胞をひとつひとつ見分ける必要があります。次に、線虫は撮影中にも動くので、動いている神経細胞を追いかける必要があります。そのうえで、それぞれの神経細胞の明るさを測定します。この明るさは、細胞内のカルシウムイオン濃度を反映しているので、それぞれの神経細胞の活動の変化がわかります。つまり、神経細胞の数(約180個)の5分間の活動変化(毎秒3回としても900個の点になります)のグラフを得ることができます(図3)。
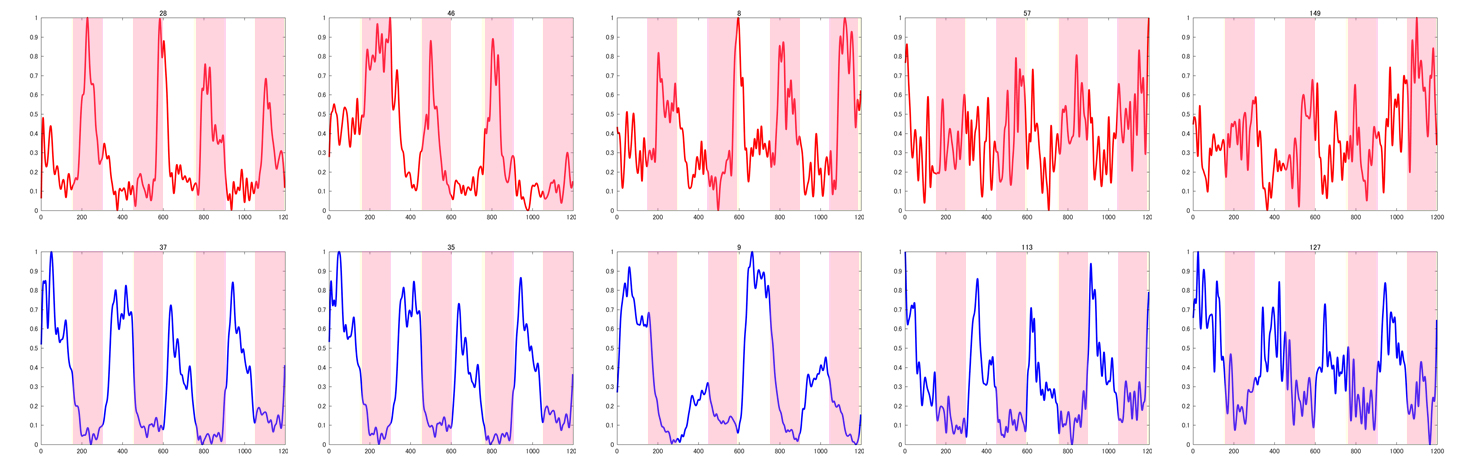
ピンクの領域で刺激を与えている。上段は、刺激時に神経の活動が上昇している神経細胞の例。下段は、刺激時に神経の活動が低下している神経細胞の例。(村上・石原 未発表)
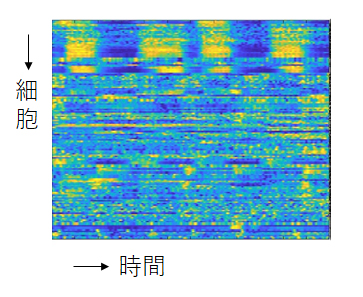
縦に神経細胞が並んでいて、横方向に時間経過があらわされています。クラスタリングという手法によって、類似の活動パターンを示す神経細胞毎に並んでいます。(村上・石原 未発表)
線虫の全脳イメージングからわかること
こうして得られた約180個のグラフには、線虫の脳での情報処理が、理論上はすべて含まれているはずです。しかし、これらの折れ線グラフを見ているだけでは、そのしくみはわかりません。ここでもAIの助けが必要になります。例えば、同じような活動をしている神経細胞を分類する(クラスタリングと呼びます)とか神経細胞同士の情報の流れを推定するなどです。また、特定の動きをしているときの神経の活動の変化がよく似ていることもわかってきています。しかし、わかることはまだまだたくさんあるはずです。線虫の脳の働きを理解するためには、コンピューターを使う人間の能力が追いついていないのが現状です。
参考資料
1)Yemini et al.著 NeuroPAL: A Multicolor Atlas for Whole-Brain Neuronal Identification in C. elegans 2021年 Cell 184,272-288 doi: 10.1016/j.cell.2020.12.012.
監修者
石原 健
1963年東京都生まれ。東京大学大学院博士課程修了。博士(理学)。九州大学教授として、「線虫における情報処理の仕組み」を研究している。
©2026 虫の集い(線虫研究者コミュニティ)「4. 線虫における全脳イメージング」CC BY
5. 線虫実験・解析のためのマイクロチップ
マイクロチップとは
マイクロフルイディクス(マイクロ流体力学)では、1~数100ミクロン(µm)の幅の流路に化学物質や生体試料などを流し、化学反応や液体の挙動などを調べます。このためのデバイスとして開発されたのがマイクロ(流体)チップで、ポリジメチルシロキサン(Polydimethylsiloxane:PDMS)やガラス、樹脂などを母材とした基板の上に、微小な流路が作られています。
2000年代からこのマイクロチップを生物実験にも応用しようとする試みが盛んになり1)、マイクロチップを用いた線虫行動試験(線虫行動アッセイ)2)や生体信号計測3)、線虫組織観察4)などのためのマイクロチップが開発されました。生物実験解析用のマイクロチップとしては、透明であることや自家蛍光が少ないこと、酸素透過性が高いことなどが求められるため、これらの性質を備えつつ、化学的に安定で加工性に優れているシリコーン樹脂の一種であるPDMSを母材とするものが広く普及しています。
行動チップと嗅覚チップ(2)
線虫は、極めて小さいため、刺激を加えたときの神経活動を計測することが困難でしたが、2007年に線虫の神経活動と行動を可視化するための「行動チップ」と「嗅覚チップ」という2つのマイクロチップが開発されました。
行動チップの中央には、幅が徐々に狭くなるマイクロトラップが作られており、その両端に、線虫の入口と出口となる穴がそれぞれ設けられています(図1)。線虫は1匹ずつマイクロトラップに投入され、入口を加圧することでトラップ内に押し出され、最も細い幅のところで圧縮されて止まります。頭部と尾部は、厚みがトラップよりも小さいため、圧縮されず、自由に動かすことができます。
トラップされた線虫は、寒天プレート上を這うときと同様の正弦波を発生させ、頭部から尾部へ、尾部から頭部へと波を伝えていくため、この波を観察することで運動パターンを評価することができます。行動チップを使うことで、情報処理を担う介在ニューロンの活動を、線虫の運動パターンと相関させて調べることができるようになりました。
嗅覚チップは、マイクロトラップと化学物質送達システムとを備えています(図2)。線虫がマイクロトラップにセットされると、鼻の先端がトラップを流れる溶液の中に突き出るため、鼻の先端にある化学受容体繊毛は常に水流にさらされることになります。嗅覚チップの化学物質送達システムは、刺激溶液(チャネルA)と対象となる標準の溶液(チャネルB)を線虫の鼻に送ります。
機械的、浸透圧的、化学的刺激に反応する感覚ニューロンであるASHニューロンにG-CaMPが発現するようにした上で、嗅覚チップを使って高浸透圧刺激にさらされたときのASHニューロン内のカルシウム反応を調べた実験では、継続的な反応が認められ、高浸透圧溶液の除去に対してもカルシウムレベルの一時的な上昇で反応することなどが明らかになりました。
2つのマイクロチップを使った神経反応モニタリングを通して、これまで知られていなかったニューロン特性を明らかにしたこの研究がひとつのきっかけとなり、線虫実験・解析用マイクロチップの開発が加速し、複雑化、高精度化が進んでいます。
エレクトロファリンジオグラム計測用マイクロチップ(3)
線虫の神経筋機能を非侵襲的に測定する機能を持たせたマイクロチップが開発され3)、薬剤の生体影響などを調べる化学スクリーニングに応用されています。このマイクロチップは、電極を取り付けた微小流路で構成されており、線虫の咀しゃくと嚥下を担う咽頭の筋肉および神経細胞からポンピング運動(摂食)中に放出される電気信号であるエレクトロファリンジオグラム(Electropharyngeograms:EPGs)を記録できます。
このEPG記録用用マイクロチップを用いることで、既知の抗線虫薬(化学農薬)の急性効果を検出したり、特定の薬剤耐性突然変異株を野生型と識別することが可能になりました。植物寄生性線虫の防除研究や各種疾病に対する創薬研究へのさらなる応用が期待されています。
線虫保定用マイクロチップ(4)
麻酔薬を使わずに線虫の動きを抑える保定専用のマイクロチップが開発され4)、覚醒状態の線虫の組織の観察や特定の組織を狙った量子ビーム照射などに活用されています。線虫保定用マイクロチップには、線虫(C. elegans)の成虫の体の幅に相当する50 µmまたは60 µmの直線状のマイクロチャネル(溝)が作られており、チャネルに線虫を収容することで、麻酔薬を使わずに良好な状態で動きを抑えることができます(動画1)。
動画1: 線虫をWorm Sheetに収容保定する方法の紹介動画
参考資料
1)Xiaojuan Zhang, Jiadi Sun, Xiao Yuan, Xin Lu, Xiulan Sun, Advances in C. elegans behavior research with microfluidic devices and its future prospects in the evaluation of exogenous pollutants. TrAC Trends in Analytical Chemistry, 136, 116195 (2021).
2)Nikos Chronis, Manuel Zimmer, Cornelia I Bargmann, Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nature Methods volume 4, pages727–731 (2007). https://www.nature.com/articles/nmeth1075
3)Janis C. Weeks, Kristin J. Robinson, Shawn R. Lockery, William M. Roberts, Anthelmintic drug actions in resistant and susceptible C. elegans revealed by electrophysiological recordings in a multichannel microfluidic device. International Journal for Parasitology: Drugs and Drug Resistance, 8(3), 607-628 (2018). DOI:https://doi.org/10.1016/j.ijpddr.2018.10.003
4)Michiyo Suzuki, Tetsuya Sakashita, Yuya Hattori, Yuichiro Yokota, Yasuhiko Kobayashi, Tomoo Funayama, Development of ultra-thin chips for immobilization of Caenorhabditis elegans in microfluidic channels during irradiation and selection of buffer solution to prevent dehydration. Journal of Neuroscience Methods, 306: 32-37 (2018). DOI: 10.1016/j.jneumeth.2018.05.025
監修者
鈴木 芳代
静岡県生まれ、広島大学学校教育学部卒業、同大学院工学研究科博士課程後期修了、QST量子バイオ技術応用プロジェクトリーダー/上席研究員。線虫の超高度な放射線耐性や嗅覚などの優れた機能の研究と実験方法の改良・開発、植物寄生性線虫の防除技術の開発に取り組んでいる。
©2026 虫の集い(線虫研究者コミュニティ)「5. 線虫実験・解析のためのマイクロチップ」CC BY NC