これまでの研究成果(慢性炎症)
慢性炎症は生活習慣病とがんに共通する基盤病態
超高齢化社会の到来により、肥満症や糖尿病を中心とする代謝性疾患あるいは動脈硬化や心臓病などの循環器疾患に代表される生活習慣病の予防・診断・治療に対する取り組みの重要性はますます大きくなっています。これらの慢性疾患は、先進国のみならず発展途上国も含んで全世界的に急増しており、世界保健機構(WHO)は、生活習慣病や癌などを総称して「非感染性疾患(non-communicable disease: NCD)」と定義し、医学・保健衛生上の新たな重要課題と位置付けています。近年、これらの慢性疾患に共通する基盤病態として「慢性炎症」が注目されています。従来、異なる機序により発症すると考えられていた多くのNCDにおいて、慢性炎症として捉えることができる細胞あるいは組織の応答が共通に認められ、NCDでは持続する炎症反応により臓器機能不全がもたらされると考えることができます。また、多くのNCDの特徴として、加齢とともに有病率が上昇するため、老化と慢性炎症の関連も強く示唆されています(炎症老化)。
炎症は内的・外的ストレスに対する代表的な生体防御反応であり、本来は保護的・適応的な応答です。微生物感染や創傷などにより誘導される「急性炎症」は、発熱・発赤・疼痛・腫脹の典型的な徴候を呈する典型的な生体防御反応であり、一過性であることが多く、炎症反応のピークを越えると収束し、健常状態が回復されます。一方、NCDにおいて認められる「慢性炎症」は多くの場合、明らかな急性炎症の特徴を示さないままに低レベルの炎症反応が年余にわたって持続・遷延化します。このくすぶるような軽度の炎症反応の持続は、組織機能の変調と障害のみならず、長期的には線維化などの組織リモデリングにより不可逆な臓器の機能不全をもたらすことになります。しかしながら、どのようにして炎症反応が誘導され、また収束しないまま持続するのか、またどのように組織機能を障害し、不可逆的な組織リモデリングを引き起こすのか、その分子機構については多くが未解決です。
私達は慢性炎症の役割について、特に生活習慣病を中心に研究を進めてきました。ここではその一部をまとめています。
①肥満は脂肪組織における炎症を誘導する
私たちはKLF5が心血管系と代謝系の両者で機能することから、代謝組織の変化に興味を持ちました。特に脂肪組織の肥満にともなう変化に興味を持ったのですが、脂肪組織が大きな脂肪細胞を中心として作られているため、組織の構築を維持したまま観察することが非常に難しく、特に三次元構築を理解することが難しいことに気づきました。そこで、新たに生きている脂肪組織をそのまま観察する手法を開発しました。この手法で脂肪組織を観察することによって、肥満においては脂肪新生(adipogenesis)と血管新生(angiogenesis)が密接に関連して生じることを初めて見いだしました(Diabetes, 2007;56:1517-1526)。このメカニズムをadipo-/angiogenic cell clustersと名付けました。肥満の時には、さらにマクロファージの浸潤や、マクロファージによる死んだ脂肪細胞の貪食、組織構築の改変など、慢性炎症と捉えられる変化が生じていることが分かりました。
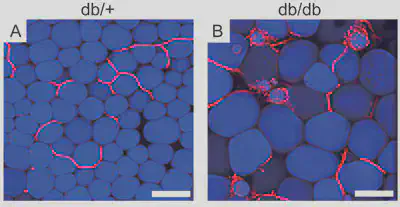
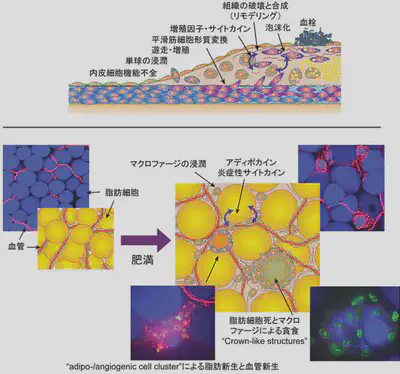
このように私たちの研究結果は、内臓脂肪が肥満すると活発な慢性炎症が引き起こされることを明確にしました。そこで、次にどのようなメカニズムによって炎症が惹起されるかを検討しました。高脂肪食による肥満の経過の中で、脂肪組織の間質に集まる細胞を詳細に検討したところ、CD8陽性T細胞が、マクロファージの集積に先駆けて増加することを見いだしました(Nat Med)。さらにCD8+ T細胞によって引き起こされる脂肪組織の炎症は全身の糖代謝へも強い影響を及ぼすことを見出したました。
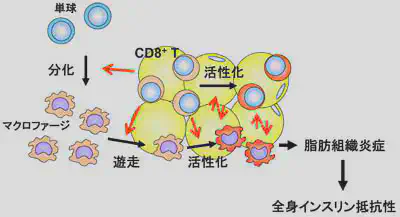
内臓脂肪組織は、このように肥満によって容易に炎症が活性化する特徴を持っています。このような免疫細胞の活性化は、脂肪組織の機能維持に重要な役割を持っていると推察されますが、その意義はまだ明らかではありません。一方、多数の免疫細胞が存在する脂肪組織でも定常状態では炎症が起きないように制御されています。このような炎症制御に制御性T細胞が必要なことが示されていますが、我々は新たにB細胞が抗炎症性サイトカインIL-10を分泌して炎症制御を行っていることを見出しました。このB細胞は定常状態からIL-10を分泌していることから我々はnatural regulatory B cellsと名付けました。B細胞のIL-10を欠くマウスでは、健常状態でも脂肪組織炎症が活性化されることから、B細胞は脂肪組織の恒常性維持に必須と考えられます。
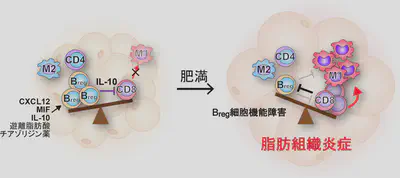
②2型糖尿病は慢性炎症性疾患である
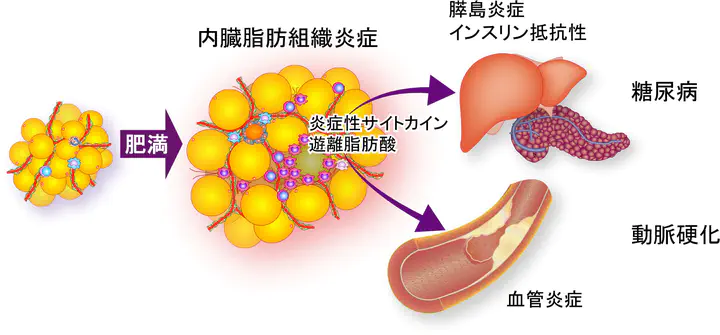
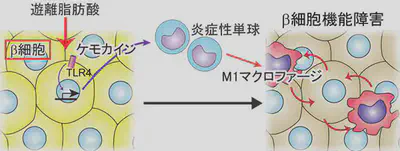
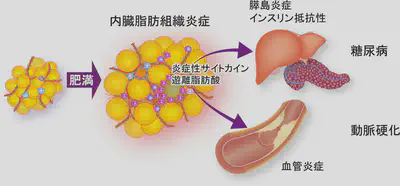
メタボリックシンドロームで注目されたように、内臓肥満は動脈硬化性疾患や2型糖尿病の重大なリスク要因です。それでは、内臓肥満はどのようにしてこのような生活習慣病を増加させるのでしょうか?上記したように、内臓脂肪の肥満は、脂肪組織での炎症を惹起します。 炎症は脂肪細胞での脂肪の分解を促し、脂肪組織からの遊離脂肪酸の放出を増加させることが知られています。そこで私たちは、遊離脂肪酸に注目しました。ヒトやマウスでは血中の主要な遊離脂肪酸は、長鎖の飽和脂肪酸であるパルミチン酸です。パルミチン酸を直接マウスに 持続投与する方法を開発したところ、通常の血中濃度の2倍程度にパルミチン酸濃度を増加させるだけで、14時間という短時間の間に膵β細胞(インスリン分泌細胞)の機能が障害されることが分かりました。このメカニズムを調べたところ、パルミチン酸が膵島に炎症を引き起こすことが重要なことが明らかとなりました。 つまり、膵β細胞はパルミチン酸をTLR4という受容体で感知します。その結果、CCL2等のケモカインを発現します。このケモカインに応じて膵島にマクロファージが集まります。集まってきたマクロファージはβ細胞とさらに相互作用することにより活性化し、炎症を進めますが、同時にβ細胞を障害することが分かりました。このようなマクロファージによるβ細胞の障害は、db/dbマウスやKKAyマウスと呼ばれる2型糖尿病のモデルマウスでも生じていました。つまり、膵島の炎症がβ細胞の機能障害に重要であることが明らかとなりました。
2型糖尿病では膵β細胞機能障害とインスリン抵抗性が主要なメカニズムです。以前より慢性炎症がインスリン抵抗性を誘導することが知られていました。従って私たちの結果は、2型糖尿病の主要な発症メカニズムの両方に慢性炎症が密接に関わっていることを明らかとしました。 つまり、2型糖尿病は慢性炎症性疾患と考えることができます。
③動脈硬化と骨髄由来細胞
平滑筋細胞の起源については未だに明確でないところがあり、特に病態では既に存在する平滑筋細胞に加えて、血管内に存在する前駆細胞、血管内皮細胞、骨髄由来細胞が平滑筋細胞に分化することが示唆されてきました。これらの研究では、平滑筋細胞に分化した根拠として、平滑筋aアクチン(SMα-actin、Acta2)の発現を挙げているのですが、平滑筋aアクチンの発現は平滑筋細胞に特異的ではなく、活性化した線維芽細胞(筋線維芽細胞)等の細胞に広く発現が見られます。例えば、培養線維芽細胞として汎用されているNIH/3T3細胞でも平滑筋αアクチンの発現が見られます。

そこで、より平滑筋特異性の高い平滑筋ミオシン重鎖(SM-MHC, Myh11)をマーカーとして解析するために、マウスSM-MHC特異的モノクローナル抗体(従来から広く使われているSigma等のSM-MHC抗体はマウスでは動きません。新しい抗体は協和メデックス、ヤマサより販売しています。Clone KM3669)と、SM-MHC遺伝子にLacZ遺伝子をノックインした平滑筋インディケーターマウスを作製しました。
まず、平滑筋αアクチンのインディケータマウスを用いて解析してみると、従来から報告されているように確かに骨髄由来細胞はマウス大腿動脈のワイヤー傷害モデルでSMα-actinを発現する細胞になることが確かめられました。共焦点顕微鏡を用いてZ-stackを撮像することによって、骨髄由来細胞で平滑筋αアクチンが発現するマーカー(EGFP、緑)と平滑筋αアクチンの免疫染色シグナル(赤)が同一細胞内に認められることが確認できています。
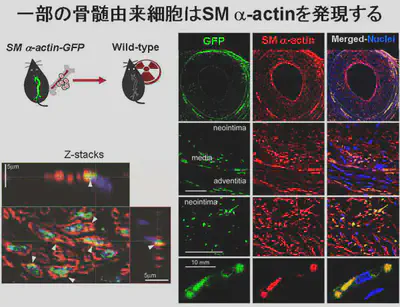
それでは、これらの細胞は何なのでしょうか?平滑筋αアクチンを発現する骨髄由来細胞の形質を調べたところ、炎症性単球のマーカーが発現していることが分かりました。また骨髄の炎症性単球を移植すると、血管壁で平滑筋αアクチンを発現するようになることも分かりました。つまり、myeloid系の細胞(炎症性単球ないしは炎症性単球とマーカー発現が少なくとも一部共通する細胞)が平滑筋αアクチンを発現する形質を獲得することが分かります。また、これらの細胞が多数存在している領域では、炎症性サイトカインやMMPの発現が高いことから、血管壁にリモデリングに寄与している可能性が高いと考えています。この結果も、単球・マクロファージ系の細胞の多彩な機能を示すものです。
非常に興味深いことに、最近逆に平滑筋細胞がマクロファージ遺伝子の一部を発現するように変化することも報告されていますOwens GK et al.。
④慢性腎臓病、心不全、リンパ浮腫、がん
慢性炎症が生活習慣病やがんに広く寄与することから、我々もこれまでに様々な組織での慢性炎症の研究を進めてきました。一部については他の項目を参照ください。