時計遺伝子Bmal1によるマクロファージ制御
従来マクロファージの炎症刺激に対する応答については、急速な応答(数時間まで)が中心に解析されてきており、NF-κBを中心とするシグナル経路が鍵となることが明らかにされています。一方で、刺激後半日〜1日以降の遺伝子発現では、急性期に誘導されたものの一部の抑制と共に、新たな遺伝子群の発現も認められるようになります。このような比較的遅いレスポンスについてはそのメカニズムがよくわかっていませんでした。
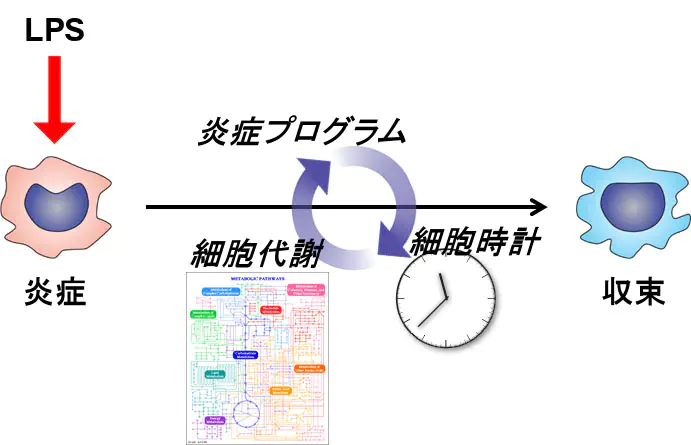
私たちは、細胞時計が時間に応じた遺伝子発現制御に寄与しているのではないかと仮説を立て、時計遺伝子Bmal1の機能について解析しました。その結果、Bmal1欠損によって、多くの遺伝子の時間的な発現が異常を呈することを見出しました。ChIP-seqによってエピゲノム解析を行ったところ、Bmal1欠損はNF-κB p65のエンハンサー結合には影響しないで、エンハンサー活性を変化させることを見出したました。つまり、NF-κB制御のレイヤーを加えることがわかりました。また、興味深いことに、マクロファージではBmal1は多数の炎症関連遺伝子の制御領域に結合が認められましたが、その結合領域は肝臓でのBmal1の結合領域とは大きく異なっており、細胞特異的な作用が示唆されます。
マクロファージの時間的な応答には、細胞内での脂質代謝が重要なこともわかっています。Oishi Cell Metab 2017このように、マクロファージの時間的な機能制御には、炎症プログラムと細胞時計、細胞代謝の制御プログラムの接続が重要と考えられます。