| 笹井ラボでは、骨格筋の萎縮や肥大のメカニズムを組織・細胞・分子レベルで解明し、その成果を臨床応用につなげることを目指しています。 | Sasai Lab has been challenging to elucidate molecular and cellular mechanisms which are working in skeletal muscle atrophy and hypertropy. And also, our progressions will lead to any "translations for clinical applications", we have been expecting. | ||
|
いわゆる“筋トレ”により骨格筋が肥大し、筋力が増強されることは経験的によく知られています。しかも“重い負荷”を用いると効果的です。 逆に、長期臥床、ギプス固定等にともなう不使用により筋は萎縮し、筋力が低下します。 |
Muscle is hypertrophied and enhanced in own contraction-force generation by strengthening exercises, f.e. resistance training. In those cases, "heavy-loading" is effective. In contrast, muscle is atrophied and weakened by its disuse, f.e. prolonged immobility, cast immobilization etc. |
||
 |
|||
|
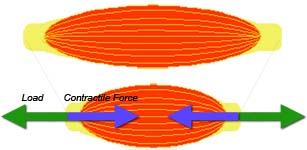
これらは使用・不使用した筋で顕著です。よって適切な強さの抗力(力学的負荷)にたいして、筋が収縮し十分な力を発揮することが、筋の組織量や収縮力の維持・向上に重要であると考えられます。実際に、重力が極小となり抗力も極小となる宇宙に滞在すると、日常的にある程度の運動をしていても骨格筋は萎縮します。 |
Such phenomenons are observed mainly in used or disused muscles. Thus strong muscle contractions against heavy resistive loads must be very important for the preservation and the improvement of the muscle contractile function as well as morphology. In fact, during a spaceflight, microgravity leads to muscle atrophy despite daily strength training; the load must be lower than needed. |
||
 |
|||
|
つまり「力学的負荷に対して筋を収縮させる」という本質にかかわるメカニズムの解明が、安全かつ効果的な運動方法や条件を策定することに大きく貢献するものと信じています。まだ運動方法や条件について十分に確立したというには至っていないと考えます。 |
Thus we believe that the clarification of essential mechanisms, which respond to the muscle contraction against the resistance, contributes to understand which exercises are proper or how to design programs for those exercises. Many of those still remain unknown in this day. |
||
|
“力学的負荷に対して”という点から、我々は筋に加わる力学的刺激(機械刺激)に関連するメカニズムに注目しています。今のところ、マウスを用いた個体実験系と、鶏胚およびマウス骨格筋に由来する培養細胞実験系を併用してメカニズム解明に取り組んでいます。 |
Consequently we are interested in molecular and cellular mechanisms which respond to mechanical stress in skeletal muscles. We have promoted our researches using rodents (mice, rat), as living individual subjects, and cell cultures from chick or mouse muscles, as cell culture models. |
||
|
マウス実験系:廃用性萎縮の "in vivo" モデルとして、"尾部懸垂マウス"を用いています。マウスは通常4つ足歩行ですが、尾で吊り下げることで後肢を免荷します。1〜2週間で後肢筋が萎縮します。さらに運動療法も行います。不使用や運動が、組織・細胞、細胞シグナル、あるいは遺伝子発現におよぼす効果を検証します。 |
 |
Mouse Tail-suspension (TS) model: This model has been used as an "in vivo" model of the disused muscle atrophy. Tail-suspension (TS) carries out the unloading against hind limbs, and their muscles will be atrophied by 1-2 weeks TS. Moreover we have given those mice some exercises during or after TS. Then we have detected effects of disuses or exercises on tissue and cell morphology, cell-signals, or gene-expressions in muscles. |
|
|
培養細胞実験系:メカニズムを、細胞・分子レベルで詳細に解明するための "in vitro" モデルです。鶏胚やマウスから採取した筋芽細胞を初代培養します。数日の培養で、いわゆる"横紋"や自発的な収縮が観察でき生体の筋線維に似た筋管(細胞)になります。例えば、機械刺激による筋肥大モデルでは、筋管に周期的ストレッチを3日間加えると肥大します。それにともない筋管内に含有する筋タンパク質も増えます。 |
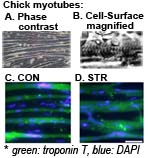 |
Cell culture models: These have been used as "in vitro" models for the verification in detail at the cellular and molecular level on target mechanisms. Myoblasts are prepared from chick embryo or mouse muscles and cultured. Over a few days, cell fusions arise in cultures and myoblasts transform to myotubes like muscle fibers; striated appearance and spontaneous contraction are observed. For instance, such myotubes became hypertrophied by a cyclic stretching for 3 days and their sarcomeric proteins accumulated; a model for hypertrophy induced by mechanical stress. |
|
|
臨床研究:ヒト筋萎縮にたいする電気刺激の活用について、 2019年より大学院生を中心に展開してます。 |
Clinical studies: The project on applications of electrical stimulation for human muscle atrophy has been progressed since Apr.2019; grad students have been working on. |
||