H-8.
非定型奇形腫瘍
/ ラブドイド
腫瘍
Atypical teratoid/rhabdoid tumor (AT/RT)
1.概要(総論)
脳・脊髄に発生する極めて悪性度の高い腫瘍です。
男児に多く、中枢神経系のあらゆる部位に発症し、INI-1 (hSNF5/SMARCB1/BAF47) 遺伝子の不活性化が認められることが特徴です。
◆ 医療者向け ◆
Atypical teratoid/rhabdoid tumor (AT/RT)は2000年から正式にWHO分類に取り入れられました(参考文献:1)。
WHO分類ではグレード4と最も悪性度が高い胎児性腫瘍に分類されています。2005-2008年の全国脳腫瘍統計では乳幼児の脳腫瘍に占める率が6.9%、
乳児では10%でした(参考文献:2)。
当初は乳児のテント下(後頭蓋窩)腫瘍として認識され、発症年齢の平均は2歳ですが、年長児やAYA世代。若年成人発生の報告もあり、
テント上の発生数の方がやや多いとされます(参考文献:3,4)。
未熟な神経上皮性細胞の増殖のみならず、上皮性、間葉系、グリア系、神経細胞系など多彩な分化傾向を示し、急速に増大する腫瘍です。
AT/RTは22q11.2上に存在するINI-1 (hSNF5/SMARCB1/BAF47) というがん抑制遺伝子の両アレルでの不活化(欠失または変異)をほぼ全例で認めることが
分子遺伝学的特徴です(参考文献:5)。
また、頻度は稀ですがINI1 (hSNF5/SMARCB1/ BAF47) 遺伝子変異の代わりにBRG1 (SMARCA4) というがん抑制遺伝子の異常により発生することも報告されています。
これらのがん抑制遺伝子は、ATP依存性SWI-SNFクロマチンリモデリング複合体の構成因子で、細胞の増殖や分化に関与する種々の遺伝子の発現を制御しているため、
これらの異常が腫瘍の発生と関連しています。
WHO2016分類ではAT/RTの診断には、このどちらかの遺伝子異常を証明することが必須となりました(参考文献:6)。
病理組織がAT/RTの特徴を有していても、INI1の免疫染色が陽性(遺伝子異常がなく蛋白が発言している状態)でBRG1 (SMARCA4) の遺伝子異常が検査されていない場合は、
CNS embryonal tumor with rhabdoid featuresの病名となります(参考文献:7)。
Rhabdoid tumor predisposition syndrome (ラブドイド腫瘍素因症候群) は、がん抑制遺伝子のINI-1 (hSNF5/SMARCB1/ BAF47) またはBRG1 (SMARCA4)
の異常により発生する常染色体優性遺伝の疾患ですが、孤発(両親からの遺伝ではない)例の方が多いとされます。
ラブドイド腫瘍素因症候群に発生するAT/RTはより発症年齢が低くて予後不良です。また、ラブドイド腫瘍素因症候群ではAT/RT以外に腎・軟部組織の悪性
ラブドイド腫瘍など様々な腫瘍が発生することが報告されています(参考文献:8)。
【参考文献】
- Kleihues P, Cavenee WK: World Health Organization Classification of Tumours. Pathology & Genetics, Tumours of the nervous system, p123-148, IARCPress, Lyon, 2000.
- Brain Tumor Registry of Japan (2005-2008). Neurol Med Chir (Tokyo). 57(Suppl 1): 9-102. 2017.
- Hilden JM, et al., Central nervous system atypical teratoid/rhabdoid tumor: results of therapy in children enrolled in a registry. J Clin Oncol. 222: 2877-2884, 2004.
- Ostrom QT, et al. The descriptive epidemiology of atypical teratoid/rhabdoid tumors in the United States, 2001-2010. Neuro Oncol. 16: 1392-1399, 2014.
- Biegel JA. Molecular genetics of atypical teratoid/rhabdoid tumor. Neurosurg Focus. 20: E11, 2006.
- Louis DN, et al. World Health Organization Histological Classification of Tumours of the Central Nervous System. International Agency for Research on Cancer, France. 2016.
- Louis DN, et al., The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol. 131: 803-820, 2016.
- Nemes K, et al., Rhabdoid Tumor Predisposition Syndrome. In: GeneReviewsR [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2020. 2017 Dec 7.
2.症状
腫瘍に関連する症状は、年齢や腫瘍が発生した部位によって異なりますが、急速に大きくなる腫瘍であるため、
症状の進行も早いです。
頭痛、嘔吐があり、特に起床時に症状が悪化します。眼の位置のずれ、フラつきなどが起こります。
乳幼児では、不機嫌でよく嘔吐し、「お座り」や「つかまり立ち」や「歩行」が難しくなります。
乳児では頭囲が母子手帳の成長ラインよりも早く大きくなります。
腫瘍内へ出血が起こると急激に症状が悪化します。
◆ 医療者向け ◆
後頭蓋窩に発生した場合には頭痛、嘔吐、意識障害などの水頭症の症状で発症し、フラつきなどの小脳失調症状を呈します。
脳幹や脳神経が圧迫され、眼球運動障害が起こります。
Morning headacheが特徴ですが、発生頻度が低い疾患であるため、当初は嘔吐下痢症などが疑われ診断が遅れてしまうことは珍しくありません。
乳児では水頭症などの頭蓋内圧亢進を併発した場合、頭囲拡大が起こります。
腫瘍内に出血しやすく、出血が起こると急激に症状が悪化します。水頭症を長期間放置すると、視力低下から失明に至ります。
大脳や脊髄に発生した場合,部位に応じた症状が起こります。
3.検査・診断
MR検査が最も有用ですが、実際に調子が悪くなって受診した時に、鎮静の必要性や検査の予約待ちなどを理由に数週間先の検査予約となることがあります。
でも、起床時に頭痛、嘔吐がある場合や明らかに症状が進行性に悪化している場合は、まずCT検査を受けたほうが良いかもしれません。
本当にAT/RTのような悪性腫瘍が存在する場合は、放射線被曝のデメリットよりも早期診断のメリットが上回ります。
確定診断は切除した腫瘍の病理組織診断で行われます。他の悪性脳腫瘍との鑑別は困難なことが多いため、
AT/RTが疑われる場合にはINI-1の免疫組織染色を行い、腫瘍細胞がINI-1陰性になることでAT/RTと診断されます。
◆ 医療者向け ◆
腫瘍の局在や性状、播種(脳脊髄液を介した転移)の有無などを診断するためにはMR検査が最も有用です。AT/RTの画像の特徴としては、
出血を合併しやすい(T2 star強調画像で強い低信号を伴う)こと、正中から外れた部位に存在すること、周辺に嚢胞を伴いやすいこと、
細胞密度が高く拡散強調画像で高信号を呈することなどが挙げられます(参考文献:2,3)。
上衣腫と同じように脳槽を埋め尽くす進展形式で,拡散強調画像で高信号であれば、AT/RTを示唆します(参考文献:4)。
初発時から30〜40%と高率に髄液播種を伴うため、脊髄のMR検査も必要です。
病理組織学的に典型的とされるラブドイド細胞とは、核小体の明瞭な偏在する核と好酸性細胞質と好酸性円形の封入体様構造を有する細胞です。
ラブドイド細胞の出現頻度は症例によって異なり、ほとんど見られないこともあるなど不均一な腫瘍でもあるため、
HE染色だけで診断することは難しいことが多いです。
髄芽腫やprimitive neuroectodermal tumor様の要素は2/3の症例に認められ、以前はこれらの腫瘍や脈絡叢乳頭癌と診断されていた例が多かったと考えられています。
稀にependymoblastic rosettesも出現すると報告されています(参考文献:1)。
淡染細胞や空胞状の細胞も認められ、細胞境界が明瞭なことや、核分裂像と核異型が多く観察され、壊死も認められることが特徴です。
間葉系要素は紡錘形細胞が密に束状に配列して増殖します。
免疫染色ではepithelial membrane antigen, α-smooth muscle actinが陽性で、
glial fibrillary acid protein、 cytokeratin、 synaptophysin、 neurofilament proteinなども陽性となることが多いです(参考文献:1)。
INI1の免疫染色にて、腫瘍内の血管壁細胞や間質の核が陽性の状態で、腫瘍細胞の核が陰性となることで確定診断します。図に、AT/RTの画像と病理像を示します。
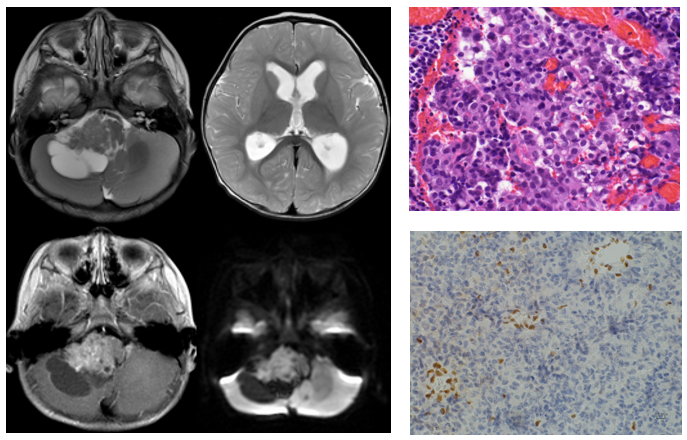
上段:T2強調画像、下段左:ガドリニウム造影後T1強調画像、下段右:拡散強調画像
嘔吐と不機嫌、つかまり立ちができなくなった症状で発症した11カ月男児のAT/RT。小脳橋角部に発生し水頭症を伴う実質部が造影される腫瘍。
拡散強調画像では淡い高信号で、腫瘍周囲に多数の嚢胞を伴っている。HE染色(右上)では、ラブドイド細胞は目立たないが、
小型で異型性の強いN/C比の高い細胞が密集して増殖しており、腫瘍細胞の核はINI1免疫染色(右下)で陰性である。
【参考文献】
- Louis DN, et al. World Health Organization Histological Classification of Tumours of the Central Nervous System. International Agency for Research on Cancer, France. 2016.
- Koral K, et al., Imaging characteristics of atypical teratoid-rhabdoid tumor in children compared with medulloblastoma. AJR Am J Roentgenol. 2008 Mar;190(3):809-14. doi: 10.2214/AJR.07.3069.
- Jin B, Feng XY. MRI features of atypical teratoid/rhabdoid tumors in children. Pediatr Radiol. 43: 1001-1008, 2013.
- Takayasu T, et al., Advantages of high b-value diffusion-weighted imaging for preoperative differential diagnosis between embryonal and ependymal tumors at 3-T MRI. Eur J Radiol. 101: 136-143, 2018.
4.治療
水頭症が高度な場合、腫瘍摘出の前に水頭症の手術(ドレナージ、第三脳室底開窓術)が計画されることもあります。
手術では腫瘍の全摘出を目指しますが、腫瘍が重要な脳神経や血管を巻き込みやすく、出血しやすい腫瘍のため全摘出は困難または不可能なことが多く、
合併症のリスクも高いため、治療経験の豊富な施設での治療が望ましいといえます。
手術だけでは高率に再発する悪性腫瘍であるため、化学療法や放射線治療を行います。
以前は、長期生存が望めない疾患であり無理な治療は考えない、という場合もありましたが、
化学療法や放射線治療の進歩により少しずつ治療成績が改善しています。
化学療法の有効性は明らかですが、最適な治療レジメンは確立していません。
放射線治療もAT/RTに対して有効で、全脳・全脊髄照射と局所照射を組み合わせるのが一般的です。
一方、乳幼児では放射線治療後の放射線障害が強く発生するため、放射線治療を行うタイミングは難しい問題です。
◆ 医療者向け ◆
AT/RTの標準治療として、確立されたものはありません。
早期の手術が望ましいですが、水頭症に対して神経内視鏡を用いた第三脳室底開窓術や脳室ドレナージを先行させることも検討されます。
AT/RTは頭蓋内圧の変動だけで出血することもあり、神経内視鏡による生検術は止血困難でリスクが高いことを認識する必要があります。
AT/RTを手術で全摘出できた場合は、腫瘍が残存した場合と比較して生存期間が延長する可能性があるため(参考文献:1)、
可能であれば全摘出を目指しますが、実際には困難または不可能なことが多いです。
手術摘出率に関しては否定的な報告もあり、AT/RTは脳神経や重要な血管を巻き込みやすく手術による合併症リスクも高いため、
最大限の安全な範囲での摘出を行うという考え方が一般的です(参考文献:1)。
出血も多い一方で乳幼児では循環血液量が少ないため、手術後の合併症リスクも高くなります。
化学療法は多剤併用で行うことが一般的です。AT/RTに対する標準的なレジメンは確立されていませんが、
以前は髄芽腫に準じた化学療法が行われており、治療成績が不良でした。
最近では横紋筋肉腫などの肉腫に対する化学療法、末梢血幹細胞移植を伴う大量化学療法を行うことで、生存期間の延長効果が示されており、
長期生存できる可能性が増しています。
脳脊髄液腔内に直接抗がん剤のメトトレキサートを注入する髄注化学療法は、播種の多いAT/RTにおいて
治療成績を向上させるために必要な治療と考えられています(参考文献:1)。
放射線治療もAT/RTに対して有効で、生存期間の延長効果が示されています。しかし、CD133という幹細胞のマーカーが多く発生している
AT/RTでは放射線治療の効果が低くなると報告されるなど、放射線に感受性が高い腫瘍ではないと考えられています(参考文献:2)。
全脳・全脊髄照射と局所照射を組み合わせることが一般的です。通常の分割照射で、局所には50〜56グレイ、
全脳・全脊髄には23.4〜36グレイが照射されます。
乳幼児発生のAT/RTでは放射線治療を行うタイミングを決定することは難しい問題です。
乳幼児期を過ぎるまで待機してから局所照射と全脳・全脊髄照射を行うこともあります。
播種を伴っていない乳幼児では局所照射が検討されますが、効果が証明されているわけではありません。
全脳・全脊髄照射を行う場合、長期の晩期障害を軽減するために陽子線治療も選択肢となりますが、
予後不良な本疾患では陽子線を無理に選択するよりは、タイミングよく通常の放射線治療を行うべきかもしれません。
AT/RTは腫瘍の拡がりの影響なのか陽子線治療による放射線障害のリスクが他の腫瘍よりも高い可能性が報告されています(参考文献:3)。
【参考文献】
- Biswas A, et al., Atypical teratoid/rhabdoid tumors: challenges and search for solutions. Cancer Manag Res. 8: 115-125, 2016.
- Chiou SH, Kao CL, Chen YW, et al. Identification of CD133-positive radioresistant cells in atypical teratoid/rhabdoid tumor. PLoS One. 3: e2090, 2008.
- Kralik SF, Ho CY, Finke W, Buchsbaum JC, Haskins CP, Shih CS. Radiation necrosis in pediatric patients with brain tumors treated with proton radiotherapy. AJNR Am J Neuroradiol. 36: 1572-1578, 2015.
5.予後
再発率が高く、播種がある場合や全摘出できないような腫瘍だった場合には極めて予後が不良で、
早期に再発して症状が悪化します。
症状は腫瘍の部位により異なりますが、播種再発が多くなります。進行すると生命の危険な状態となります。
治療が奏功して腫瘍再発がない場合でも、治療前からの症状、治療中に発生した症状は、治りにくいものが多く、
症状の推移予測については担当医から説明を受けてください。
長期生存できた場合も強い治療を行ったことが原因となった、さまざまな晩期障害(通常は5年以上経過して発生する後遺症)
が発生してくるリスクがあります。晩期障害は必ず起こるわけではありませんが、早期に発見して治療を開始することにより、
重症にならなかったり改善したり、克服できるものもあります。
長期フォローアップ外来などに通い、定期的な診察、検査を受け、再発や晩期障害の有無を確認してもらってください。
症状,病状によっては必要な社会福祉制度を利用して、生活の質を落とさないようにしましょう。
◆ 医療者向け ◆
多くが診断後半年以内に再増悪し、生存期間の中央値はだいたい13ヵ月前後と予後は極めて不良です(参考文献:1)。
乳幼児の髄芽腫に準じた治療では2年後に生存している患者さんは3割に満たない状況でした。しかし、
近年は手術・化学療法・放射線治療による集学的治療が進歩したことにより予後の改善が報告されています。
再発形式は、局所と脳脊髄液腔内播種が多く、稀に遠隔転移があります(参考文献:1)。
また、治療が成功して長期生存できても、放射線治療や大量化学療法を行ったことが原因となった晩期障害が発生してきます。
具体的には疲れやすさ、低身長、脱毛、間脳下垂体や甲状腺からのホルモン分泌不全、てんかん、高次脳機能の発達障害、
学習障害、うつ状態などの精神的不安定さ、妊孕性低下、脳血管障害、海綿状血管腫の発生、 髄膜腫やグリオーマなどの二次性腫瘍の発生などが挙げられます。
これらについてはチーム医療・多職種連携で対応する必要があります。
【参考文献】
- Biswas A, et al., Atypical teratoid/rhabdoid tumors: challenges and search for solutions. Cancer Manag Res. 8: 115-125, 2016.





