H-3.
びまん性
橋膠腫
Diffuse Intrinsic Pontine glioma DIPG
1.概要(総論)
小児にできる脳腫瘍の中で、脳幹の橋に発生する悪性で予後(今後の病状についての見通し)のとても悪い腫瘍です。
小児、特に5歳から9歳に多くみられます。
世界保健機関(WHO)の分類では、diffuse midline glioma、 H3 K27M-mutantといい、
4段階に分けられている悪性度のグレード(1と2が低悪性、3と4が悪性で、4は癌になります)では、グレード4となります。
Histone H3-K27Mという遺伝子に変異を持っています。遺伝子変異ヒストンH3が80%くらいにみられます。
視床、橋、脊髄に発生します。
◆ 医療者向け ◆
びまん性橋膠腫 Diffuse Intrinsic Pontine glioma (DIPG)は、脳幹部の橋に発生する予後不良な腫瘍です。
小児脳幹部腫瘍は、本邦における2005年〜2009年の全国脳腫瘍統計調査(参考文献:1)では、成人例をふくめた脳幹部膠腫全体の43.5%を占めます。
米国では年間約300の新規症例があり(参考文献:2,3)、発生率は人口10万人あたり1〜2例となっています。男児が多く、
DIPGの発生年齢のピークは6〜9歳で(参考文献:4)、脳腫瘍の子供たちの主な死因です。
脳幹部、特に橋に発生するため、通常外科的切除の適応にはならず、主に放射線療法での治療となります。放射線療法の効果は一時的なものです。
この腫瘍に有効な化学療法剤はなく、生存期間中央値は1年未満です。
DIPG患者の転帰を改善するために、様々な新しい薬剤が試され、数々の臨床試験が行われていますが、現在までのところ、有意な結果は得られていません。
分子レベルでは、最近の進歩により、DIPGのほぼ80%でH3K27M変異が特定され、2016年の世界保健機関(WHO)によるびまん性正中神経膠腫H3K27M変異、
グレードIVの脳幹腫瘍となりました(参考文献:5)。
【参考文献】
- Brain Tumor Registry of Japan (2005-2008). Neurologia medico-chirurgica 2017;57:9-102.
- Pellot JE, De Jesus O. Diffuse Intrinsic Pontine Glioma. StatPearls. Treasure Island (FL): StatPearls Publishing
Copyright©2020, StatPearls Publishing LLC., 2020. - Fisher PG, Breiter SN, Carson BS, et al. A clinicopathologic reappraisal of brain stem tumor classification. Identification of pilocystic astrocytoma and fibrillary astrocytoma as distinct entities. Cancer 2000;89:1569-1576.
- Chen J, Lin Z, Barrett L, Dai L, Qin Z. Identification of new therapeutic targets and natural compounds against diffuse intrinsic pontine glioma (DIPG). Bioorganic chemistry 2020;99:103847.
- Williams JR, Young CC, Vitanza NA, et al. Progress in diffuse intrinsic pontine glioma: advocating for stereotactic biopsy in the standard of care. Neurosurgical focus 2020;48:E4.
2.症状
目の動きの障害(眼球運動障害、瞼が閉じなくなるような顔の動きの障害(顔面神経麻痺)などの脳神経症状がみられます。
手・足のマヒ、歩くときにふらつく、転倒するなどの症状があります。飲み込みにくくなる場合や声が出にくくなる場合があります。
頭痛、吐き気・嘔吐を伴う時には緊急性がある場合があります。
症状の悪化するスピードは早く、数週間で進行する場合もあります。脳幹は血圧、呼吸、意識等、生命活動にとって重要な働きがある神経が集まっていて、
脳幹に腫瘍などの障害があれば、命にかかわることがあります。
◆ 医療者向け ◆
DIPGの三徴は索路徴候、小脳徴候、および脳神経障害となっています(参考文献:1)。
症状は、外転神経麻痺、顔面神経麻痺、聴覚障害などの脳神経症状や、片麻痺などの錐体路障害、失調、構音障害などの小脳症状を引き起こします。
臨床経過は急速に悪化します。
水頭症は症例の10%未満で発生し、水頭症が発生している場合は、治療しないと昏睡状態となり死に至る可能性があります(参考文献:2)。
【参考文献】
- Donaldson SS, Laningham F, Fisher PG. Advances toward an understanding of brainstem gliomas. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2006;24:1266-1272.
- Schroeder KM, Hoeman CM, Becher OJ. Children are not just little adults: recent advances in understanding of diffuse intrinsic pontine glioma biology. Pediatric Research 2014;75:205-209.
3.検査・診断
MRI検査にて脳幹部の橋というところに白く腫れたように見える像が特徴です。
造影剤を使ったMRIではほとんど造影されませんが、一部造影される症例もあります。進行に伴い造影されるようになってくる場合があります。
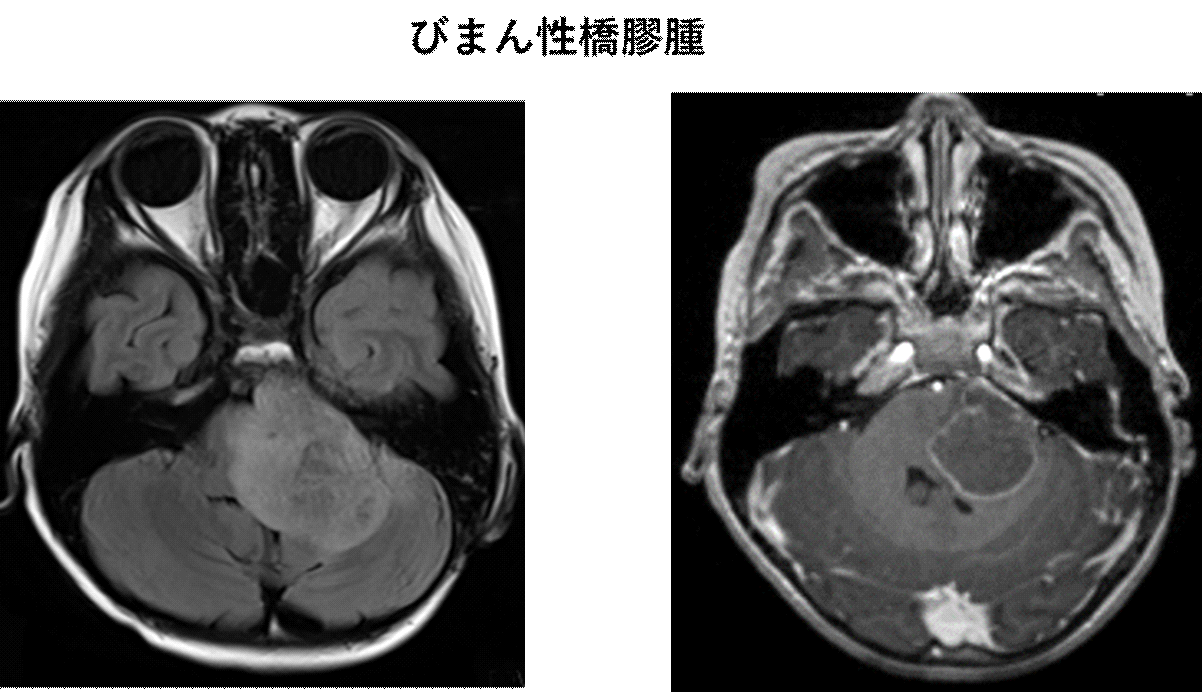
左:FLAIR画像 右:Gd造影T1強調画像
この腫瘍を発見した場合、多くは画像のみで診断しますが、必要な場合は手術により組織を確認します。
ただ、手術による合併症のリスクがありますので、原則は画像診断となります。生検(腫瘍の一部を採取すること)して、
組織が取れた場合は遺伝子診断ができる場合もありますが、今のところ診断のみとなっています。
◆ 医療者向け ◆
MRIT2強調画像またはFLAIR画像で、脳幹橋の部位にびまん性に高信号域を認めます。
Gd造影MRIでは通常、増強効果がほとんどありませんが、造影される場合もあります。多くは画像のみで診断しますが、
必要な場合は手術により組織を確認します。
ただ、手術による合併症のリスクがありますので、原則は画像診断となります。
生検して、組織が取れた時は遺伝子診断ができる場合もありますが、今のところ診断のみとなっています。
ヒストン変異はDIPGの多くに存在します。リジンがメチオニンに置換されるH3K27M変異は、H3.1をコードするHIST1H3BやH3.3をコードする
H3F3A遺伝子に生じます(参考文献:1,2)。
ACVR1 (Activin A receptor, type I)遺伝子変異はDIPGの約20%で同定され、H3.1変異に生じる場合が多いです(参考文献:3)。
PDGFRA (Platelet-derived growth factor receptor A)増幅はヒストンH3.3変異と同時に生ずる場合がおおく、
組織学的分類にかかわらず臨床的悪性度が高いといわれています(参考文献:4,5)。
【参考文献】
- Wu G, Diaz AK, Paugh BS, et al. The genomic landscape of diffuse intrinsic pontine glioma and pediatric non-brainstem high-grade glioma. Nature Genetics 2014;46:444-450.
- Srikanthan D, Taccone MS, Van Ommeren R, Ishida J, Krumholtz SL, Rutka JT. Diffuse intrinsic pontine glioma: current insights and future directions. Chinese neurosurgical journal 2021;7:6.
- Buczkowicz P, Hoeman C, Rakopoulos P, et al. Genomic analysis of diffuse intrinsic pontine gliomas identifies three molecular subgroups and recurrent activating ACVR1 mutations. Nat Genet 2014;46:451-456.
- Castel D, Philippe C, Calmon R, et al. Histone H3F3A and HIST1H3B K27M mutations define two subgroups of diffuse intrinsic pontine gliomas with different prognosis and phenotypes. 2015;130:815-827.
- Khuong-Quang D-A, Buczkowicz P, Rakopoulos P, et al. K27M mutation in histone H3. 3 defines clinically and biologically distinct subgroups of pediatric diffuse intrinsic pontine gliomas. 2012;124:439-447.
4.治療
1)手術
この腫瘍を発見した場合は、多くは画像のみで診断しますが、必要な場合は手術により組織を確認します。
造影領域を認める場合、外側に伸びてくるような場合には手術となることがありますが、手術による合併症のリスクを考える必要があります。
2)放射線治療
一日1.8〜2.0グレイ(Gy)を毎日、計54Gy前後を行います。放射線治療で多くの場合は症状が一時的に軽減します。
3)化学療法
現時点ではDIPGに対して有効とされる抗がん剤治療はありません。
放射線治療にテモダール(経口抗がん剤)等の化学治療(抗がん剤治療)を併用した場合も、
ほとんどその効果に差はなく、副作用その他の患者への負担を考えると、現在のところ放射線のみの単独治療がもっとも望ましい治療法とされています。
◆ 医療者向け ◆
1) 外科的治療:
画像のみで診断がつく場合は、基本的には画像で診断します。
手術する場合は、定位的生検術や開頭腫瘍生検術を行います。組織が取れた場合は、採取された検体で組織診断、遺伝子診断を行います。
治療中、経過観察中に水頭症を併発する場合があり、水頭症がある場合は脳室−腹腔シャント術を行います。
ただ、シャントは腫瘍の進行が早く、播種などですぐに閉塞することもあり、シャントを修復する必要がある場合があります。
2)放射線治療:
一日1.8〜2.0グレイを毎日、計54Gy前後を行います(参考文献:1)。放射線治療で多くの場合は症状が一時的に緩和されます。
3)化学療法:
現時点では、びまん性橋膠腫に対して有効とされる抗がん剤治療はありません。
放射線治療にテモダール等の化学治療(抗がん剤治療)を併用した場合も、ほとんどその効果に差はなく、
副作用その他の患者への負担を考えると、現在のところ放射線のみの単独治療がもっとも望ましい治療法とされています。
他に、ステロイドは脳幹部の腫れが強くなって症状が悪化してきたとき使用する場合があり、一時的に症状が軽快します。
世界では、テモゾロミド、カペシタビン、ゲムシタビン、チロシンキナーゼ阻害剤、幹細胞移植を含むさまざまな全身療法のいくつかの臨床試験が進行中ですが、
DIPG症例の生存率を高めることを証明したものはありません(参考文献:2)。
【参考文献】
- Gallitto M, Lazarev S, Wasserman I, et al. Role of Radiation Therapy in the Management of Diffuse Intrinsic Pontine Glioma: A Systematic Review. Advances in radiation oncology 2019;4:520-531.
- Vitanza NA, Monje M. Diffuse Intrinsic Pontine Glioma: From Diagnosis to Next-Generation Clinical Trials. Current treatment options in neurology 2019;21:37.
5.予後
治療してもおよその生存期間は、10ヶ月から1年くらいです。
橋グリオーマの子供たちが1年くらいのうちに死亡する確率は、50%程度です。
◆ 医療者向け ◆
効果的な治療法がないため、DIPGの予後は非常に悪く、小児脳腫瘍の主な死因となります。
診断後、生存期間の中央値は通常9か月です。2年以上生存する症例はわずか10%です(参考文献:1)。
【参考文献】
- Rashed WM, Maher E, Adel M, Saber O, Zaghloul MS. Pediatric diffuse intrinsic pontine glioma: where do we stand? Cancer metastasis reviews 2019;38:759-770.





