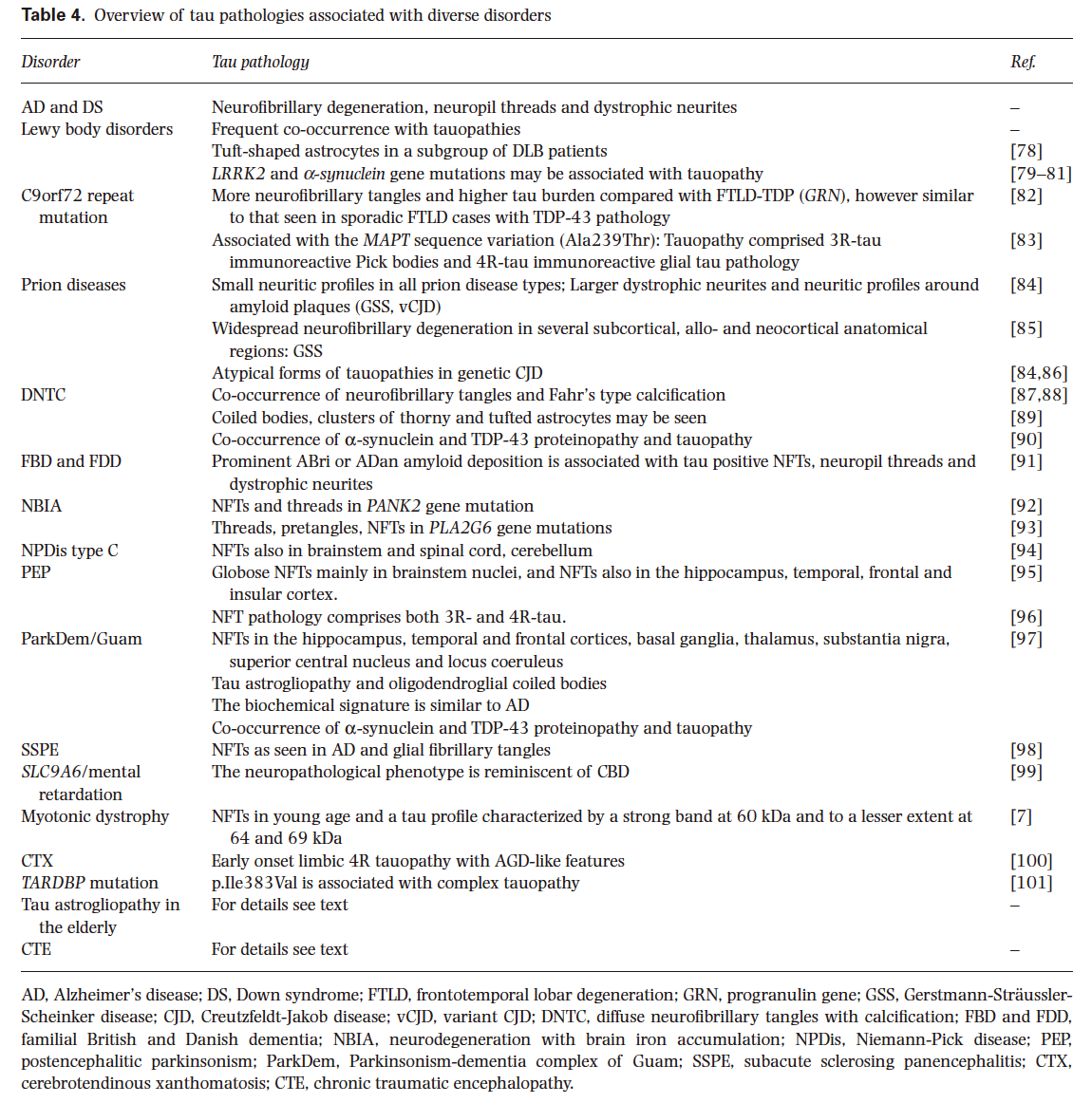
tauopathy
タウオパチーは、臨床的、形態学的、生化学的に不均一な神経変性疾患であり、脳内に異常なタウ蛋白質が沈着することで特徴づけられる。神経病理学的表現型は、解剖学的領域、細胞型、および病理学的沈着物中のタウのアイソフォームに基づいて区別される。タウオパチーの分類は、現代の前頭側頭葉変性症の分類と重複している。神経病理学的表現型には、Pick病、進行性上核麻痺、皮質基底核変性症、嗜銀性グレイン病、 primary age‐related tauopathy(以前はneurofibrillary tangle‐only dementiaと呼ばれていた)、および最近特徴づけられたglobular glial tauopathyと呼ばれるものがある。微小管関連蛋白質タウをコードする遺伝子の変異は、17番染色体に関連する前頭側頭型認知症やパーキンソン病と関連している。さらに、多様な病因を有する更なる神経変性疾患が、タウ病変と関連している可能性がある。このように、タウ病理やタウオパチーのスペクトラムは、従来議論されてきた疾患形態を超え拡大している。その意義を理解するためには、より詳細な学際的研究が必要である。
はじめに
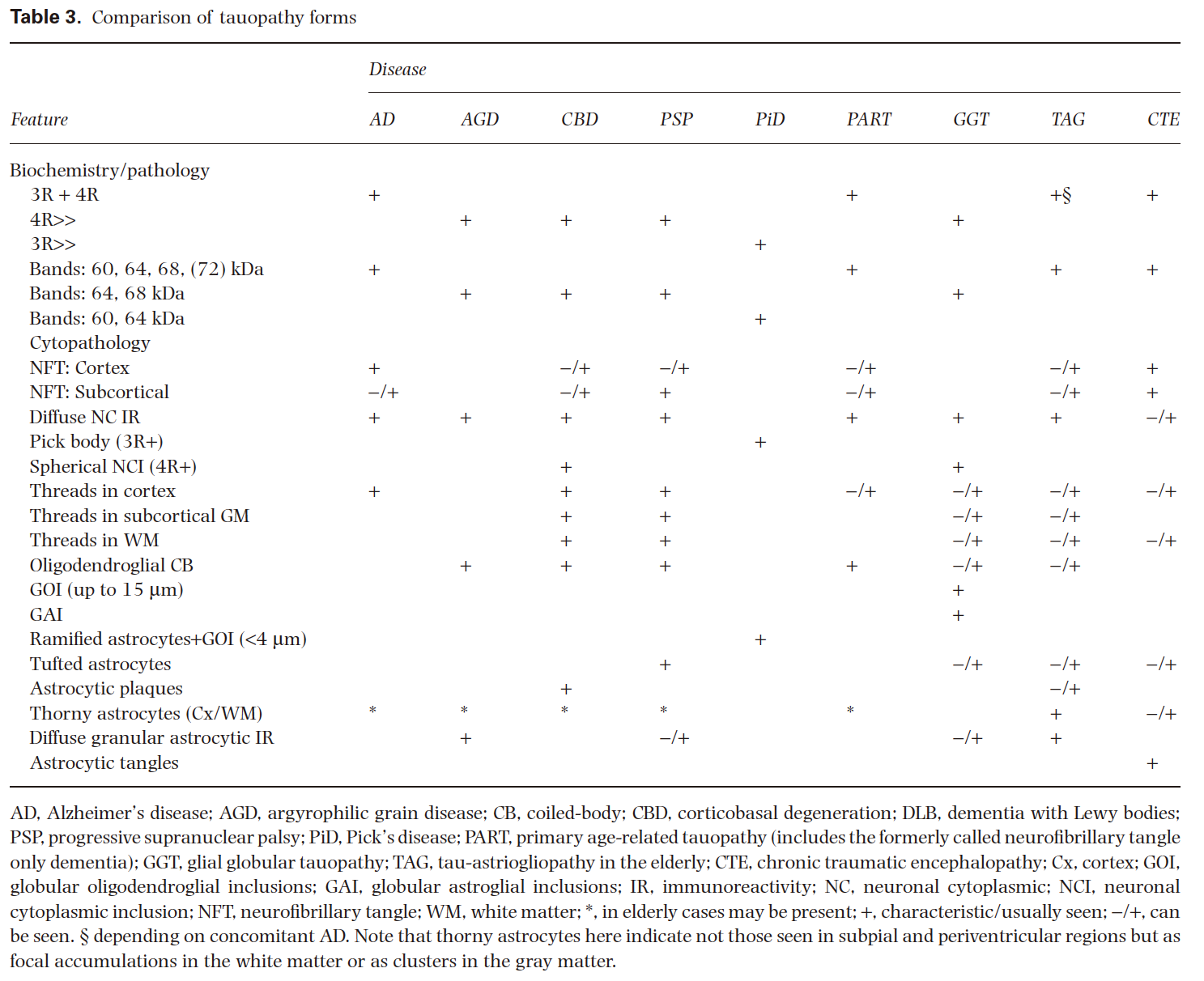
タウオパチーは、臨床的、形態学的、生化学的に不均一な神経変性疾患であり、脳内に異常なタウ蛋白質が沈着することで特徴づけられる。神経病理学的表現型は、解剖学的領域、細胞型、および病理学的沈着物中のタウのアイソフォームに基づいて分類される。原発性タウオパチーの分類は、前頭側頭葉変性症の分類と重複している。神経病理学的表現型は、ピック病(PiD)、進行性核上麻痺(PSP)、皮質基底変性(CBD)、嗜銀性グレイン病(AGD)、 primary age‐related tauopathy(原発性加齢性タウオパチー、PART)、以前はneurofibrillary tangle‐only dementia(NFT-dementia)として知られていた、および globular glial tauopathy(球状グリア性タウオパチー、GGT)である。微小管関連タンパク質タウ(MAPT)をコードする遺伝子の変異は、17番染色体に関連する前頭側頭型認知症やパーキンソニズムと関連している。さらに、多様な病因を有するいくつかの神経変性疾患がタウ病理と関連している可能性がある。これらのうちのいくつかは、他のタンパク質がその発症に中心的な役割を果たしているため、二次性タウオパチーとして知られている。アルツハイマー病(AD)は、神経細胞のタウ病理を示す主要な神経変性疾患の一つであるが、アミロイドβ(Aβ)の沈着を特徴としているため、ここでは詳細には触れない。本レビューの目的は、診断的な側面に焦点を当てて、タウ症の神経病理学の現在の概念を概観することである。
タウオパチーの基礎
微小管関連蛋白質タウは微小管に結合し、微小管の重合を促進する。軸索輸送や神経細胞の維持に重要な役割を果たしているが、樹状突起では生理的役割を果たしており、グリア細胞では低レベル発現している。また、タウの非微小管内局在も報告されている。ヒト成人脳では、17q21番染色体上に位置するMAPT遺伝子からの代替スプライシングにより、6つのタウのアイソフォームが発現している。MAPT遺伝子の変異は、病理学的なタウ蛋白質の蓄積に関連した遺伝性疾患につながる。これまでに40以上の変異が報告されている。
352から441アミノ酸までのタウのアイソフォームは、エクソン2、3および10の代替スプライシングによって生成されます。6つのアイソフォームは、N末端部分に29-アミノ酸または58-アミノ酸インサートの有無、および31または32アミノ酸の3つ(3R)または4つ(4R)のタンデムリピート配列の有無によって異なる。これらのリピート領域は、タウと微小管との相互作用を媒介する結合ドメインである。正常なヒトの脳では、3Rと4Rのアイソフォームが同程度のレベルで発現している。タウオパチー患者のタウフィラメントは、3Rまたは4R-タウ、またはその両方から構成されており、タウ症の生化学的不均一性を反映している。さらに、タウの構成は、現在のタウ症の分子分類の基礎となっている
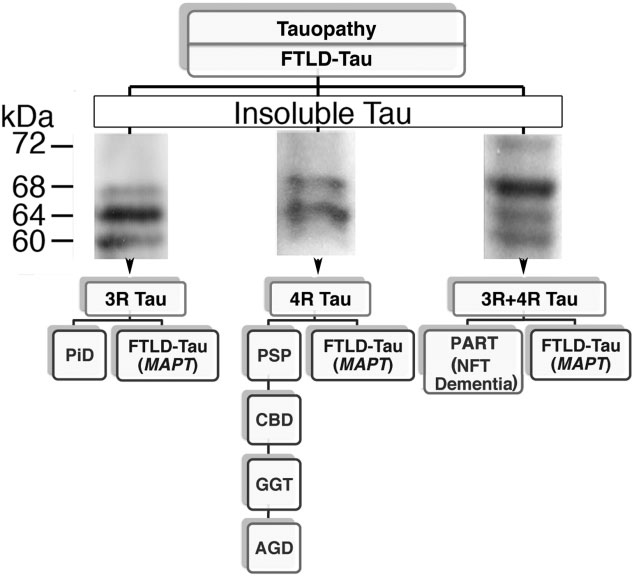
図1 タウ症の分子分類(FTLD-Tau)およびウェスタンブロッティングで観察された不溶性タウの主なパターン。PiD、Pick病;PSP、進行性上核麻痺;CBD、皮質基底変性症;AGD、嗜銀性グレイン病;GGT、球状グリア性タウオパチー;PART、原発性加齢性タウオパチー。
疾患におけるタウの最も重要な翻訳後修飾は過剰なリン酸化であり、これは機能的に重大な影響を及ぼす。少なくとも8残基でリン酸化されている過剰リン酸化タウとは対照的に、正常なタウは、2つまたは3つの残基がリン酸化されている。タウのリン酸化は、微小管の安定性と軸索輸送、樹状突起の位置とシナプスの維持、形質膜での細胞のシグナル伝達、細胞のストレス因子からのDNA保護とタウの放出に作用する。タウのさらなる翻訳後修飾は、N末端およびC末端の切断、アセチル化、グリコシル化、酸化的および硝酸化傷害、トランスグルタミネーション、脱アミド化、タウオリゴマーの形成などがある。形態学的および生化学的研究のほとんどは、リン酸化エピトープとタウのアイソフォームに焦点を当てているが、未知のタウの修飾が、神経病理学的診断および生体内のバイオマーカーに重要である可能性がある。実際、最近、タウのアセチル化はADに関連したタウ病理や、PiD、GGT、PSP、CBD、慢性外傷性脳症(CTE)、分類不可能な4Rタウ病理を含むいくつかのタウ病には存在するが、AGDに関連したタウ病理には存在しないことが報告されている。アセチル化がタウの毒性を加速させる可能性があり、アセチル化の欠如が、AGDが非進行性内側側頭葉病理の理由であるかもしれない。
孤発性タウオパチーに関連する臨床症状
神経変性疾患では、別の疾患が同じ解剖学的領域に影響を及ぼすことが一般的である。疾患の進行中、より多くの解剖学的領域が影響を受け、複雑な症状が生じてくる。臨床症状は、影響を受ける神経系によって決定され、分子病理学的背景を明確に反映しているわけではない。したがって、タオパチーだけでなく、他の構造変化タンパク質[α-シヌクレイン、 (TAR)DNA‐binding protein 43 (TDP-43)、fused in sarcoma (FUS)、プリオンタンパク質、Aβなど]と関連した他の形態の神経変性疾患も、同様の臨床症状を示すことがある。つまり、神経病理医が臨床情報を読むと、いくつかの疾患が予想される。但し、特定のタオパシーを示唆するような症状は存在する。多くの歴史的報告が遺伝子解析を欠いており、疾患の定義が異なっていることから、各疾患の典型的な発症年齢を示すことは困難です。例えば、PiD、PSP、CBDおよびGGTは初老期疾患と考えられていたが、最近の研究では高齢者でも発症する。
タオパシーのほとんどは、特にPiD、PSP、CBDおよびGGTは、進行性失語症を含む前頭側頭型認知症(FTD)の臨床的特徴と関連する。FTDはしばしば錐体外路運動障害や運動ニューロン病(MND)を合併する。PSPの古典的な臨床症状は、リチャードソン症候群またはPSP症候群(すなわち、Steele–Richardson–Olszewski syndrome)と呼ばれている。しかし、PSP型の病態は、臨床的な皮質基底核症候群(CBS)または失語症を伴うことがある。さらに、脳幹優位型PSPは、臨床的にはPSP-P(ここでPはパーキンソン病を意味する)、または歩行凍結を伴う純粋なアキネジアを呈する。症例によっては進行性小脳性運動失調を示すこともある。一方、CBD型の病態は、主にCBSと関連し、リチャードソン症候群、posterior cortical atrophy syndrome(後皮質萎縮症候群)、AD類似の認知症、まれに小脳運動失調を呈することがある。PiDは、FTDの臨床表現型の症例に最も頻繁に認められる。まれにPiD神経病理は、ADに類似した無気力症候群の症例に見られる。AGDの臨床的側面に関するいくつかの研究では、進行性の認知機能の低下、尿失禁、記憶障害、攻撃性や気性の悪さを伴う人格の変化が報告されている。まれに、突出した異常行動や攻撃性、失語症は、FTDの疑いが高くなる。後者では、見当識障害が頻繁に発生し、抑うつや偏執的な考えが観察されることもある。大脳辺縁系優位型のADと比較して、PART(NFT-dementia)症例は通常、発症年齢が高く、疾患期間が短い。PSP(またはCBS)と皮質脊髄路変性症、または、パーキンソン病とMNDとの関連についての記述があるが、これらの症候群は現在、GGTの神経病理学的グループに含まれている。
タウオパチーの遺伝的側面
タウオパチーの特徴付けのための重要なステップは、MAPTの遺伝子解析である。MAPTの変異は、PiD、PSPおよびCBDの神経病理学的表現型と関連している可能性があり、特徴的な形態を示すこともある。MAPT遺伝子のextended haplotype (H1/H2) は孤発性タオパチーにおいて興味深いものである。H1ハプロタイプおよびH1/H1遺伝子型の遺伝は、PSPの危険因子として認識されている。H1cサブハプロタイプはPSPの追加リスクをもたらす。H1ハプロタイプまたはH1cサブハプロタイプもまた、CBDのリスク増加をもたらす。このハプロタイプはPiDとは関連していない。PSPやCBDと同様に、MAPTのH1/H1遺伝子型の頻度は、AGDやNFT認知症でも高くなる傾向があります。GGTでは9例中8例(日本から1例)でH1/H1遺伝子型が認められ、さらに1例でH1/H2が認められた。
アポリポタンパク質E対立遺伝子(APOE)においては、 APOEε4保因者状態について、AGDでは、ADよりも低い。 さらに、AGDではε2対立遺伝子の発生率が高い。 APOEε4キャリア状態は、辺縁型優性型ADと比較してNFT認知症では低く、 GGTでは、主にε3対立遺伝子が観察される。
タウオパチーの検索方法
光学顕微鏡的検索
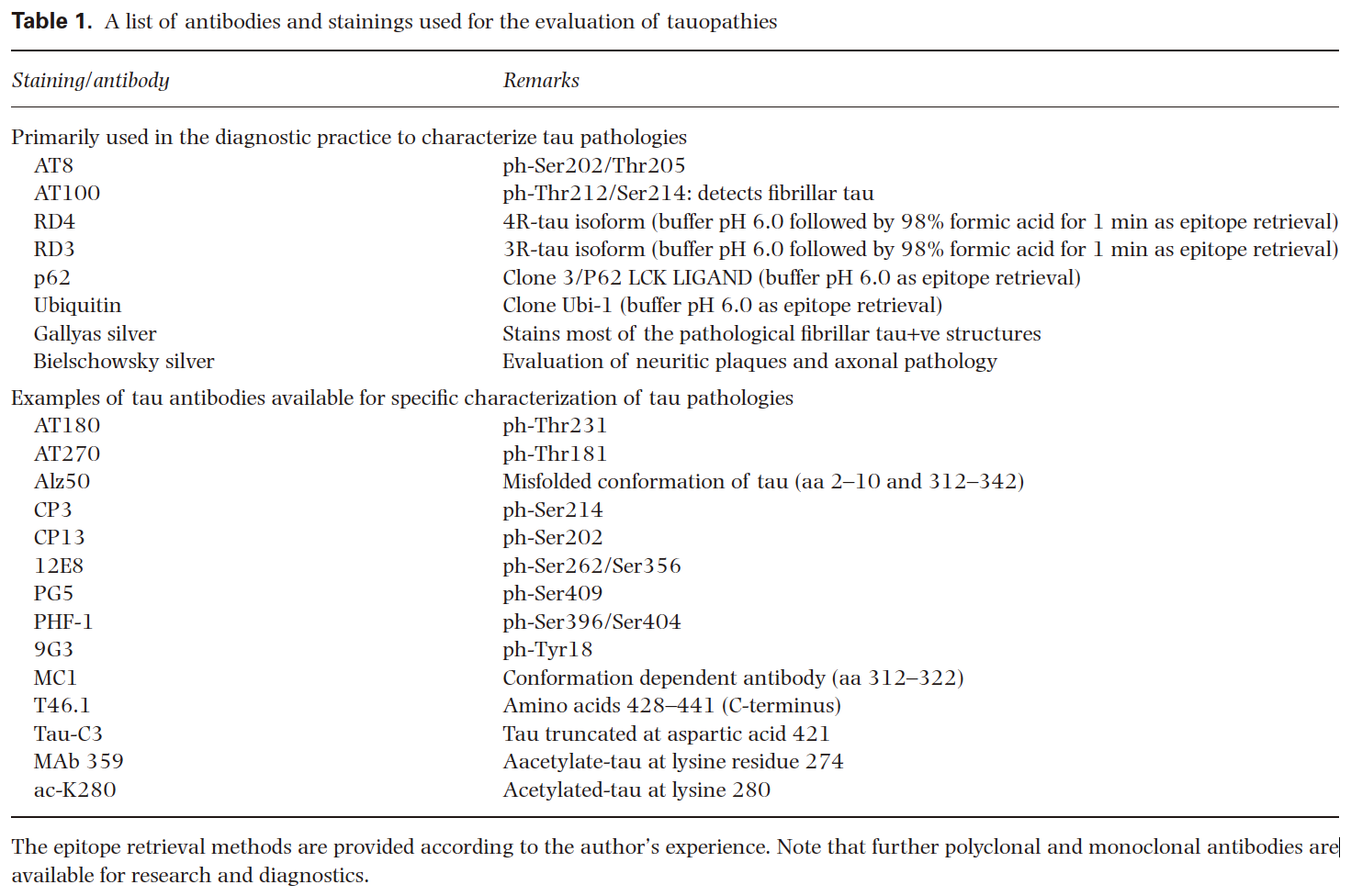
神経病理学的診断法では、高リン酸化タウの検出とタウアイソフォームの分析が最も重要である。免疫組織化学に使用することができるいくつかのよく特徴づけられた市販の抗体があります。これらには、リン酸化依存性抗体;分断されたタウに対する抗体;または構造変化に対する抗体が含まれる。重要なことは、リン酸化部位が解剖学的に異なる場合があり、その一時的分布もまたタウオパチーにより異なる場合がある。このことは、異なるリン酸化タウ抗体が、同じ脳内でも異なった病理像を呈することがあり、これは、診断上重要である。最も広く使用されているリン酸化タウ抗体はAT8(Ser202/Thr205)である;本レビューでは、特に指定がない場合、AT8抗体で見られる免疫染色パターンをタウ免疫反応性と呼ぶ。タウアイソフォーム特異的(RD3およびRD4)モノクローナル抗体も利用可能である。タウの病理学的特徴付けに有用なその他の染色には、銀染色(Belschowsky、Bodian、Gallyas、Campbell-Switzer)、チオフラビン-S染色、およびユビキチンまたはp62の免疫染色が含まれる。Gallyasの銀染色とAT100免疫組織化学(すなわちThr212/Ser214)は、病理学的タウ沈着物が糸状性であるかどうかを調べることができる。銀染色は、技術の難しさと標準化されたプロトコルの欠如によって妨げられてきた。診断法としては、ユビキチンやp62/sequestome-1免疫組織化学がこれらの銀染色に取って代わられている。また、AT8を用いたタウ免疫反応性は、他の染色法(すなわち、銀染色やp62/ユビキチン免疫染色)で見られる反応性よりも上回ることに留意しなければならない。診断や研究で使用されている抗体および染色は、Table 1 に要約されている。これらの抗体のいくつかは、ホルマリン固定の長さに応じて、特定の前処理を必要とすることがある。
電子顕微鏡的検索
サルコシル不溶性タウ分散フィラメント製剤やカルノフスキー(グルタルアルデヒド/パラホルムアルデヒド)固定脳サンプルは、免疫金電子顕微鏡を用いた検査を含め、超構造的に検査することができる。フィラメントの形態は、対をなすらせん状フィラメント、直線状フィラメント、管状またはねじれたリボン状構造として観察される。
イムノブロット法
イムノブロット法による凍結脳サンプルの検査方法は、可溶性・不溶性タウと脱リン酸化タウのバンディングパターンの評価から成り立つ。不溶性タウのパターンは、(I)60、64、68 kDaのメジャーバンド(例:ADやNFT-認知症)、(II)64、68 kDaのバンド(例:4R優勢タウ症、AGD、PSP、CBD、GGT)、および(III)60、64 kDaのバンド(例:3R優勢タウ症、PiD)である(図1)。72 kDaのマイナーバンドは、通常、パターンIに関連している。MAPT遺伝子の変異に関連したタオパチーは、パターンとアイソフォームの優勢のいずれかを示す可能性があります。異常なタウの異なるタンパク質分解処理がPSPとCBDで行われていることが示唆され、免疫ブロッティングによって検出可能である。
タウ病理の形態学的所見
神経病理学的評価を開始する前に、リン酸化タウ(特にAT8抗体)またはアイソフォーム特異抗体の免疫組織化学を用いて見られる免疫反応性構造の細胞内分布に精通していなければならない(図2および Table 2)。ニューロンに関連するタウ免疫反応性には、(i) プレタングル、(ii) 神経原線維変化 (NFT)、(iii) ピック小体、(iv) 球状細胞質内小胞体、(v) ジストロフィックニューライト、(vi) スレッドおよび (vii) グレインが含まれる。これらの構造は、種々の銀染色またはユビキチン/p62免疫反応性を示す。例えば、プレタングルは、ユビキチン化NFTへの発達の初期段階を表すと考えられている。老人斑発生によるNFT形成の階層的モデルが提案されている。これは、老人斑に関連したジストロフィー性神経突起が特定の順序で生じ、老人斑のタウ免疫反応性は発生部位により異なる可能性がある。2-5µmの円形、タウ陽性老人斑突起は、通常は嗜銀性はないが、ユビキチンおよびp62免疫染色で陽性であり、非疾患脳ではアミロイド斑を伴わずに観察される。
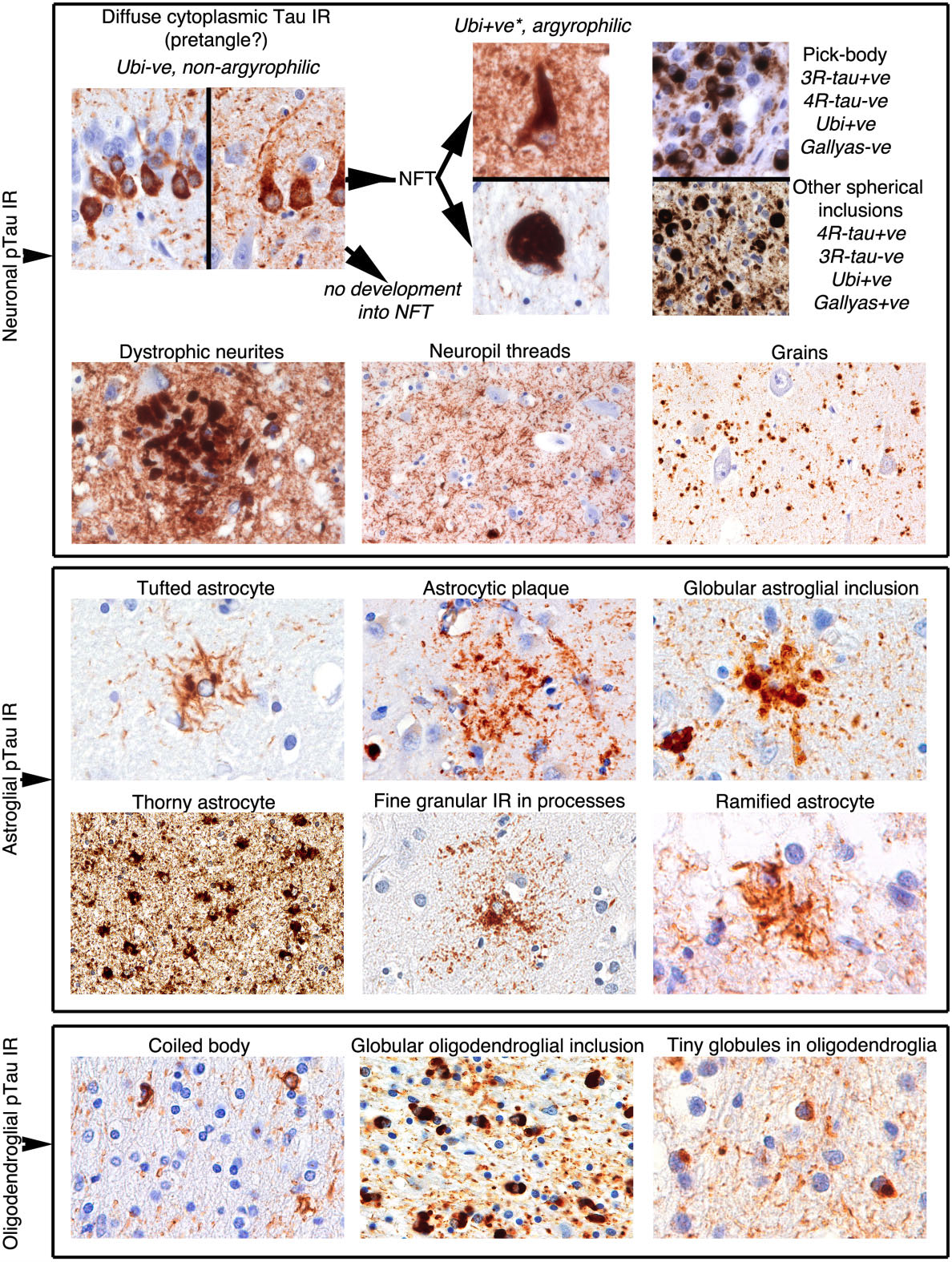
図2 神経細胞、星状膠細胞、乏突起膠細胞におけるTau (AT8) 免疫組織化学 Ubi, ubiquitin or p62; NFT, neurofibrillary tangle; IR, immunoreactivity; * in some diseases (e.g. PSP) subcortical NFTs are not consistently Ubi+ve.
アストロサイトは様々なタウ免疫反応性を示す。房状アストロサイト(PSP)とアストロサイトプラーク(CBD)の鑑別が最も重要である。さらに、タウ免疫反応性物質(AT8)として、とげ状および球状アストログリア封入体(GAIs)が存在する。さらに、側頭葉の高齢者では、アストロサイト突起に沿ったびまん性のタウ免疫陽性顆粒が観察される。同様の突起は、しばしばAGDにおけるbush‐like astrocytes と呼ばれている。これらのアストロサイトは非嗜銀性であるため、線維性タウ凝集に先行している過剰リン酸化タウと考えられる。ramified astrocyteは、偏在した核とガリアス陽性の分岐した太い突起を持つ細胞を指し、PiDにおけるタウ陽性アストロサイトに使用されていた。興味深いことに、PiDのアストロサイトは3R-タウ陽性であるが、PSPの原形質アストロサイトの一部にも3R-tauが含まれており、また、PiDの極少数のアストロサイトに4R-tauが含まれていた。アストロサイトにおけるタウリン酸化部位,構造変化,タウの切断およびユビキチン化は,タウオパチーの種類によって異なっていた.
オリゴデンドロサイトにおけるタウ(AT8)免疫反応構造物には、コイル小体と球状オリゴデンドログリア封入体(GOI)が含まれる。GOI(通常はオリゴデンドログリア核より大きく、最大15μm)はGGTの特徴です。いくつかのGOIは球状の外観を示しています。PiDでは、白質中に球状封入体(オリゴデンドログリア核より小さい, 2-3μm)が見られることに注意しなければならない。コイル小体は一貫して4R-tau免疫反応性であるが、GGTのGOIやPiDの球状介在物には3R-tauも含まれていることがある(表2)。

タウオパチーの特徴的な神経病理学的所見
PiD
3R-tau免疫反応性を有する神経細胞内ピック小体が特徴的である(図3a)。ピック小体の電子顕微鏡観察では、オスミウム親和性顆粒構造と小胞状構造を持つフィラメント状物質が観察される。タウフィラメントは、15~18 nmの直径のstraight tubulesと22~24 nmの直径のtwisted filamentsによって特徴づけられる。また、このような構造を持つ神経細胞は、歯状回の顆粒細胞、海馬、皮質領域によく観察されるが、皮質下にも見られる(図3b)。大脳皮質に残っている神経細胞の一部はバルーン化しており、ピック細胞と呼ばれている。いくつかの生化学的研究は、PiDにおける4R-tau病理を示唆しているが、4R-tauの存在は、ほとんどの場合、付随する神経原線維変性の存在や嗜銀性顆粒の存在によるものである。稀に、タウ免疫陽性のramified astrocytesとオリゴデンドロサイトの球状封入体(2-3μm)が認められる。タウ免疫反応性(AT8)では、ニューロピルの「シナプス様」免疫染色が観察される(図3c)。
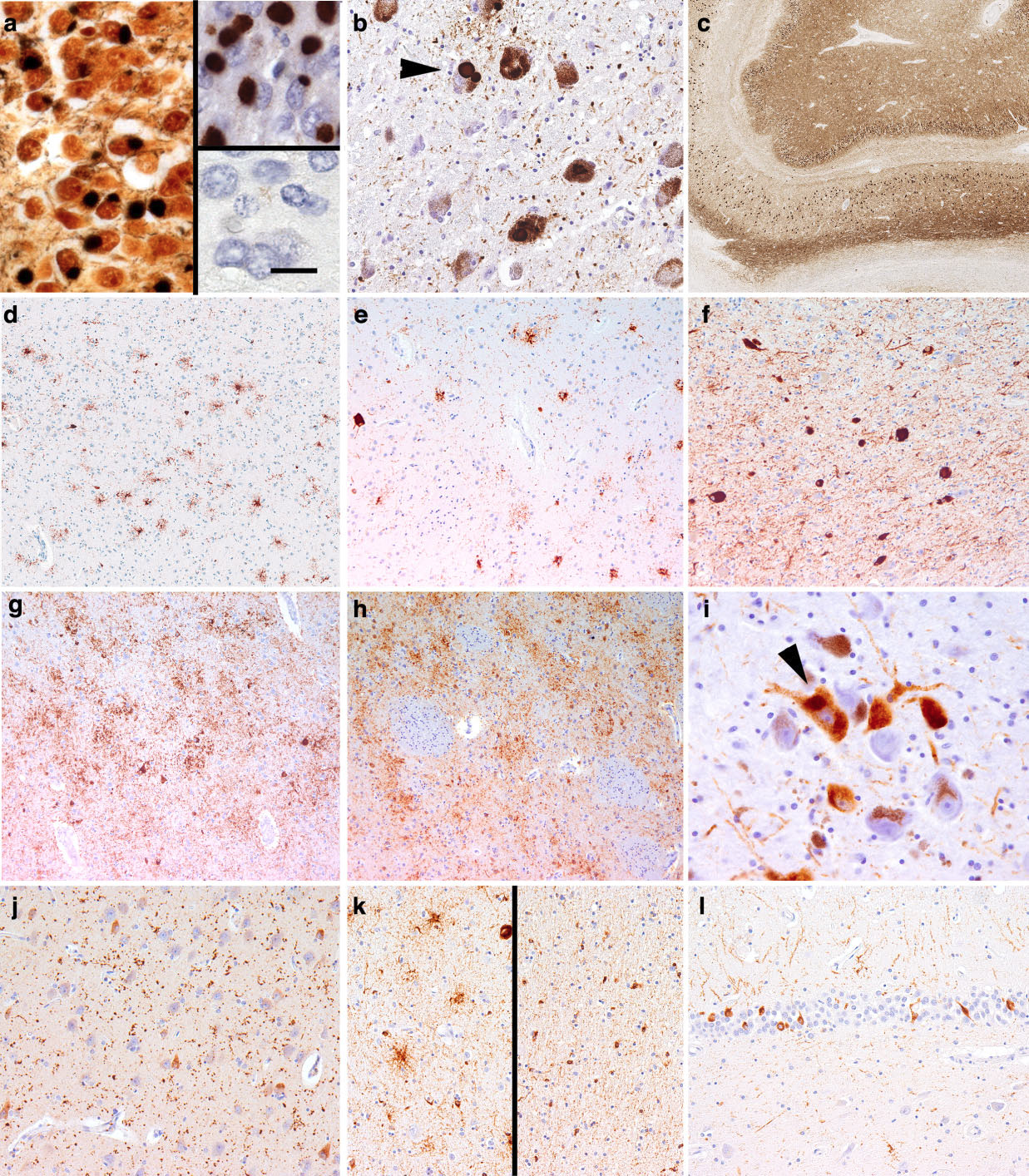
図3 タウオパチー(I)の病理組織学的所見。(a) 歯状回のピックボディ(PB)はBielschowsky染色では嗜銀性であり、3R-tau(右上写真)に陽性、4R-tau(右下写真)は陰性である。 (b) 青斑核のPBs。(c) びまん性シナプス様染色性(海馬AT8免疫染色)。進行性核上性麻痺の前頭皮質(d)、尾状核(e)および中脳辺縁部(f)におけるタウ(AT8)免疫反応。前頭皮質(g)、線条体(h)および黒質(i)におけるタウ(AT8)免疫反応。大脳皮質基底核変性症の前頭皮質(g)、線条体(h)および黒質(i、球状皮質基底核小体)におけるタウ(AT8)免疫反応。嗜銀性グレイン病における4R-tau陽性嗜銀性グレイン(j)と扁桃体bushy astrocytic profiles(k、左)、海馬白質オリゴデンドログリアのコイル小体(k、右)、さらに、主に歯状回の顆粒細胞層の細胞は、びまん性の細胞質タウ免疫反応性を示す(l)。aのbarは、aは10μm、bとiは50μm、cは200μm、d-hは100μm、j-lは30μmを示す。
PSP
マクロでは、視床下核および脳幹被蓋の萎縮、および黒質の脱色素が認められる。光学顕微鏡的特徴は皮質下、特に視床下核、基底核、脳幹のNFTであり、それらは房状アストロサイトと関連しており、オリゴデンドログリアのコイル小体、neuropil threadsと同様に4R-tauに対して免疫反応性であり、3R-tauに対しては陰性である(図3d-f)。電顕では、15~18nmのstraight filamentsが認められ、NFTでは14nmのstraight tubulesが密に集積している。グリア細胞ないには管状構造とstraight filaments が観察される。PSPのかなりの臨床的および病理解剖学的不均一性がある。PSPの神経病理学的特徴は、リチャードソン症候群の臨床的特徴を確実に予測することはできない。Williamsと共同研究者らは、初期には、淡蒼球-ルイ体-黒質系が影響を受け、その後、大脳基底核、橋核、歯状核が侵され、その後、前頭葉と頭頂葉が侵され、最後に他の新皮質領域と小脳が侵される。
CBD
CBDでは、非対称性の局所的皮質萎縮と黒質の脱色素がマクロで観察される。神経病理学的基準によれば、CBDにおけるガリアス/タウ陽性病変は、神経細胞内封入体、白質および灰白質のthreads、コイル小体およびアストロサイト斑である。これらはすべて4R-tauに対して免疫反応性であり、3R-tauに対しては陰性である。CBDの病理診断に最低限必要な所見は、皮質および線条体のタウ陽性の神経細胞およびグリア病変、特にアストロサイト斑(図3g,h)およびthread様病変である。小さなNFTや球状封入体(皮質基底小体とも呼ばれる)も見られる(図3i)。超微細構造検査では、20-24 nmのtwisted ribbonsを認める。管状構造とamorphous profilesは、アストロサイトで見られ、オリゴデンドログリアではtwisted tubulesが見られる。大脳皮質ではBallooned achromatic neuronesが認められることがあるが、CBDの特異性は高くない。最近の研究では、PSPとCBDは病態の分布によって臨床症状が異なる疾患スペクトラムであることが示唆されている。一般的に、CBDでは神経細胞のタウの病理が前脳に影響を与えるのに対し、PSPでは主に後脳構造に影響を与える。遺伝的背景と生化学的特徴の類似性にもかかわらず、PSPでは皮質下のNFTsの存在と一緒にアストログリアのタウ病理学的特徴が異なるため、CBDとPSPの神経病理学的な鑑別が可能である。このことは、これら2つの疾患が異なるタウの病態と関連している可能性を示唆する。
AGD
AGDの神経病理学的特徴には、迂回回の萎縮、海馬および扁桃周囲白質(図3k)におけるプレタングルおよびオリゴデンドログリアのコイル小体と関連する内側側頭葉構造における嗜銀性および4R-tau免疫陽性顆粒(図3j)の存在がある。 Bushy astrocytic profilesは、主に扁桃体で観察される(図3k)。TolnayとClavagueraは、診断に不可欠な特徴として、主病変が嗜銀性グレインであることを提案した。老人斑の数は少なく、NFTのBraak期はIとIIIの間で変化する。AT8免疫染色で検出可能な顆粒は、もともと嗜銀性グレインとして記述されていたため、AGDと呼ばれるようになった。年齢に関連したタウ陰性神経突起を区別すべきであるが、p62およびユビキチンの免疫染色もまた、グレインの検出に有用である。AGDに関連した病理学的所見(グレイン、びまん性神経細胞タウ免疫反応性、グリアタウ病理学的所見)は、ステージ分けが可能である。I期では、迂回回と吻側CA1が主病変で、扁桃体と外側視床下部に軽度病変を持つ、II期ではCA1がより広範囲に影響を受け、さらに歯状回(神経性タウ免疫反応性)(図3l)と支脚もタウ病理を認める。さらにIII期では、CA2/3、視床下部、側頭前野、帯状体、島回、眼窩前頭前野、側座核、中隔核が侵され、第IV期では大脳新皮質、脳幹へ拡がる。III期では、扁桃体のバルーンニューロンと迂回回を中心とした皮質浅層の海綿状変化が認められる。嗜銀性グレインは年齢依存性で、高齢者の脳では頻繁に併発する病理学的所見である。嗜銀性グレインの存在は認知症の閾値を低下させる可能性が示唆されている。
Primary age‐related tauopathy
内側側頭葉に軽度から中等度のAD型神経原線維変性を有するが、Aβプラークを欠く患者は、いくつかの研究で報告されており、ほとんどがNFT-dementiaと呼ばれている。病理組織学的特徴は、海馬と内側側頭葉に限局したghost tanglesを含むNFTsである(図4a,b)。これらの症例は通常、NFTsのBraak病期分類によりIV期までの病期に分類される。サルコシル抽出画分の電顕像では、主にpaired helical filamentsが見られる。歯状回顆粒細胞とCA4領域の神経細胞はまた、タウ免疫反応性を示すことがある(図4c)、この特徴は、ゴーストタングルとともに、AD関連神経病理学的変化としては進行したBraak病期で認められる。神経細胞のタウ病理は、基底核、黒質、青斑核、側座核で観察される。また、約10%の症例で海馬硬化症が認められる。最近示唆された大脳辺縁系優位型のADと比較して、Braak NFT期は低く、PART(NFT-dementia)では明らかにAβ斑が少ないか、あるいは全くない。
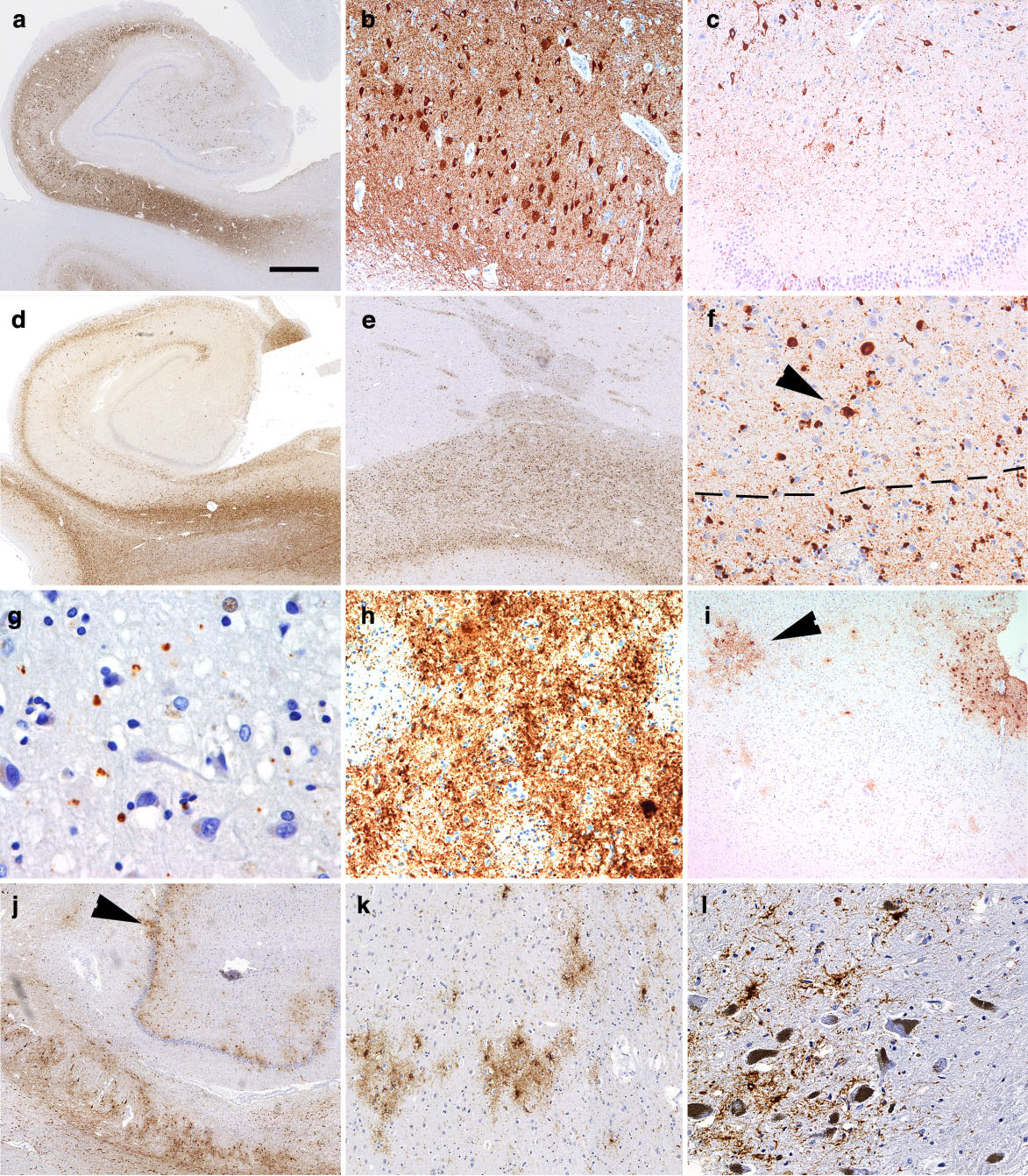
図4 タウ症における病理組織学的所見(II)。(a)原発性加齢性タウオパチー(PART、以前はNFT-dementiaとも呼ばれていた)における海馬におけるタウ免疫反応、(b)PARTにおけるCA1領域だけでなく、CA4領域および歯状回顆粒細胞(c)におけるNFTs、(d)海馬では、白質はglobular glial tauopathy(GGTⅠ型)に関与している、大脳基底核(e)では、前頭葉基底核白質と内包にタウ沈着が見られる。GGTの皮質-皮質下の接合部におけるタウ病理の分布に注意(f;矢印は神経のタウ免疫反応性プロファイルを示し、破線は白質の境界を示す)。遺伝性クロイツフェルト・ヤコブ病(ここではE200K変異)では、より顕著な神経細胞性および糸状の病理が見られる(ここでは大脳基底核のh)。初期の慢性外傷性脳症では、脳溝の深部の小血管(矢印)や前頭皮質軟膜下領域(i)でタウ病変が強調される。高齢者の脳におけるタウ病理のパターンは、歯状回(矢印)とCA領域(j)における顕著なthorny astrocytic profiles (棘状星細胞突起)が観察される。基底核(ここでは側座核、k)と黒質(l)における棘状星細胞のクラスタが見られるケースがある。aのバーは、aとdのbarは300μm、b、cとfは100μm、eとjは200μm、gは30μm、hとkは30μm、iは150μm、lは50μm。
GGTs
前頭葉・側頭葉または前頭前回は萎縮する。 嗜銀性(Gallyas)4R-tau陽性球状オリゴデンドログリアおよび非嗜銀性(Gallyas)4R-tau陽性球状アストログリア封入体(GOIおよびGAI、 globular glial inclusionsと呼ばれる)が観察される(図4d,e)。電顕では、GOIは、粒状物質と直径8~9 nmの無秩序に配向したフィラメントとして観察される。GOIのGallyas染色は、多発性萎縮症(MSA)で見られるグリア細胞質封入体(GCIまたはPapp-Lantos body)に非常に類似しているが、GGTのGOIとは異なり、それらはα-シヌクレイン免疫反応性である。神経細胞のタウパソロジーは、主に4R-タウアイソフォームを中心に構成され、細胞質はびまん性に免疫反応性と、球状または小さなNFTs様の封入体(図4f)である。タウ病理の解剖学的分布は、臨床症状と相関している。少なくとも3つのサブタイプが提案されており、I型は、前頭葉側頭葉優位に障害されGOIsが白質に認められる。II型は、解剖学的には運動野と皮質脊髄路のより限定的な病変にGOIやGAIを伴う(他の領域ではPSP様の形態学的特徴が見られる)。これらの前頭葉側頭葉、運動野、皮質脊髄路の病変を持ち、皮質領域に多数のGAIが見られる症例がIII型である。GGTは稀であるが、最近の研究では、高齢者でもAD型の病態に関連して観察される可能性がある。
Overlapping features of primary tauopathies
大脳辺縁系における嗜銀性グレインの存在は、PSP、CBD、PART、またはADの進行段階で頻繁に見られる。歯状回顆粒細胞と同様にCA1を避けて、CA2/3領域における神経細胞タウ病理は、4Rタウオパチーで頻繁に見られる。これらの特徴は、AD症例における随伴病理としてのAGDの疑いを高めるのに有用である。実際、AGDの併発は海馬におけるタウ免疫反応の分布パターンを修飾する。
他のタウオパチー
多様な病因を持つ他の多くの疾患がタウ病理と関連している(表4、図4g,h)。神経病理学的表現型がよく知られた疾患と一致しないタウ症の症例の報告が時折ある。これらの報告のいくつかでは、遺伝学的解析が欠落している。最近、4R優勢なタウオパチーが報告された。これは海馬硬化症と歯状顆粒細胞内に多数の細胞質内封入体を有していた。わずかに好塩基性で嗜銀性(Bodian’s法とGallyas-Braak法)封入体は、4Rタウ陽性で3Rタウ陰性であった。
Chronic traumatic encephalopathy (CTE)
CTEは、反復性の軽度外傷によって引き起こされる進行性の神経変性である。それは通常、反復的な外傷後8~10年後に開始され、高リン酸化タウの広範な沈着によって特徴付けられる。ウェスタンブロットでの検索では、可溶性と不溶性のタウがADのそれと区別できない。タウ病理学的には、NFTとastrocytic fibrillary depositsを認める。CTEは、タウ病理の特徴的な分布と細胞パターンによって他のタウオパチーと区別できる。小血管周辺および脳溝の深部にタウ病理が強調され(図4i)、視床下部や脳室周囲では、アストロサイト性タウ病理が顕著にみられることがある。CTEにおけるタウ陽性アストロサイトは、アストロサイトNFTsを形成することがある。CTE患者を対象とした最近の包括的な研究では、烏距皮質は比較的保持され、前頭前野、側頭前野、頭頂前野の病変が進行し、4つの病期が考えられている。進行と共に、NFTsは大脳皮質下の構造と脳幹核に多く見られるようになる。まれにCTE型の病態がPSPのような原発性タウポパチーの特徴と関連していることもあり、診断上の課題となっている。
加齢脳のタウ病理
老年期の脳では、老人斑や嗜銀性グレインを伴うか否かを問わず、NFTsが最も頻度の高い変化であるる。また、PSPの臨床的症候がなくても、高齢者ではPSP様病理が見られることもある。リン酸化タウ(AT8)免疫組織化学により、さらなるタウ病理を明らかにした。残念ながら、これらをどのようにグループ化するか、あるいはその臨床的関連性についてのコンセンサスは未だ確定されていない。しかしながら、タウアストログリオパチーは一般的な所見である。 Thorn‐shaped astrocytes(とげ状アストロサイト)は、非特異的な二次性タウ陽性アストロサイトと考えられている。ヒトの内側側頭葉では、主に脳室周囲と視床下部の局在において、Thorn‐shaped astrocytesよく観察される。ADを対象とした系統的な研究では、約30%の頻度で、加齢とともに増加することが明らかになり、Thorn‐shaped astrocytesはADの病理とは無関係であると結論づけられた。Munoz と共同研究者は、進行性失語症と AD 病理の可能性のある進行性失語症症例において、前頭葉-側頭葉-頭頂葉皮質と皮質下白質の argyrophilic thorny astrocyte clusters(ATACs)を報告した。タウアストログリオパチーは、高齢者の認知症を持つ症例で報告されており、高齢者の脳の神経病理学的変化のスペクトラムとして考えられている。その研究では、タウアストログリオパチーの病変分布が内側側頭葉に限局、皮質下層構造や黒質や延髄に拡ろがるかに基づいて4つのグループに分けた(図4j-l)。タウアストログリオパチーはNFTとの関連はなく、CTEのような脳溝深部に強調されることもなかった。タウ病理の程度は臨床症状と相関していた。興味深いことに、これらの高齢者の症例の中には、内側側頭葉を越えて拡大したTDP-43病理が頻繁に認められたものがあった。この点で、TARDBP変異TDP-43プロテインオパチーにも同様のタウ病理が認められたという報告は興味深い。AT8陽性アストロサイトの形態は、微細な顆粒状(Gallyas陰性)から、腫脹した胞体と棘状の外観を示すもの(部分的にGallyas陽性)まで様々であった。MunozもAD症例で報告しているが、重要なことは、棘状アストロサイトは、高齢者の脳、特に白質に多数局所的に蓄積する。この点で、高齢CBD2症例で皮質下白質アストロサイトのタウ病理が報告されたことに注目すべきである。最後に、レビー小体型認知症やごく少数の加齢脳後頭側頭回に房状アストロサイトが報告されている。さらに、Beachらは、海馬硬化症で、房状、トゲ状、線維状、原形質状のとタウアストログリオパチーを報告している。まとめると、これらの報告はかなりの重複がある。最近の研究では、海馬での分布を数学的に解析し、グリアのタウ病理の分子病理学的評価を行った結果、軟膜下や脳室周囲に限局しない高齢者のタウアストログリオパチーは、実際別個の存在である可能性があるという概念を支持するものである。したがって、これら種々の記述は、異なる用語で説明されている類似の病態のスペクトラムまたはステージを表している可能性が高い。アストログリアに4R-tau免疫反応性が存在するにもかかわらず、生化学的検索では3Rと4Rのアイソフォームが混在していることが示されているが、これはおそらく免疫ブロッティングのために準備されたホモジネートにAD関連の神経病理学的変化が混入したためであろう。さらなる研究で、コンセンサスとガイドラインが作成が必要である。
タウオパチーの診断アプローチ
最初のステップは、基本的なルーチン染色および髄鞘染色に基づく病理組織学的変化の評価である。これには、血管病変、神経細胞脱落やグリオーシス(GFAP免疫染色)、好塩基性線維構造やバルーン化ニューロン(α-B-クリスタリン免疫染色が有用)などの神経細胞の変化を記載する。これに続いて、リン酸化タウ(AT8を推奨)免疫染色の評価を行う。免疫反応性をスコア化し、免疫染色パターンの解剖学的マッピングを行い、タウ病理の解剖学的分布(海馬、大脳辺縁系または新皮質優勢 vs 大脳基底核、視床、視床下部または脳幹優勢)および白質の病変に注意する。AT8および他のリン酸化タウ抗体(AT100、ユビキチン、p62)やガリアス銀染色を用いて、線維状またはユビキチン化されていない病理学的構造の存在を確認する。最後に、免疫ブロッティング検索やフィラメント構造の超微細構造の検索を行い、MAPT遺伝子の遺伝学的解析をコンサルトする。
解剖学的病変を考慮し、タウオパチーのスクリーニングは、外側膝状体レベルの海馬や、扁桃体および大脳基底核のブロックをAT8免疫染色する。タウオパチーのAT8免疫反応パターンとして、海馬のsubregions/layersに疾患特異的なホットスポットがあり、タウオパチーを併発している症例(ADや他のタウオパチーを伴うAGD)ではAT8発現がシフトしている可能性がある。したがって、PSP、CBD、PiDおよびGGTにおける海馬のタウ病理は、初期のAD関連の変化(海馬におけるBraakステージ)と区別することができる。タウオパチーの診断評価のためのアプローチは、図5にまとめられている。特に顕著なタウ病理が観察される症例では、MAPT遺伝子変異の存在を考えるべきである。
すべてのタウオパチー症例において、追加の病理学的マッピングが推奨される。大脳辺縁系に限局したTDP-43 proteinopathy は、AGDや稀にCBDやPSPなどで報告されているが、PiDでは殆ど報告されていない。TDP-43 proteinopathy は通常、海馬、扁桃体、側頭葉皮質に発現し、まれに皮質下に発現することがある。 AGDのグレインに類似したいくつかの特徴的なTDP-43陽性構造物や、CBDのアストロサイト斑に類似した花冠状に配列した threadsが認められることがある。α-シヌクレイン陽性レビー小体の存在は、様々な疾患で観察され、大部分が脳幹に限局する。タウオパチーでは扁桃優位型の二次性α-synucleinopathyが認められることがある。PSPにおけるタウ症の存在はレビー小体の分布を有意に変化させないため、レビー小体病理はPSPとは独立した疾患過程である可能性が高い。タウとα-シヌクレインの共局在はAD症例では扁桃体と嗅球で報告されているが、レビー小体を有するPSP黒質では、4R-タウとα-シヌクレインの共局在はまれであった。α-シヌクレインをコードする遺伝子の変異もまた、タウ病理と関連している可能性がある。興味深いことに、α-シヌクレインとタウは、封入体の存在に比例して共局在している。まれに、PSPは、α-synucleinopathy MSAまたはプリオン病との関連がある. 非常にまれに、認知症を伴うパーキンソン病でPiD病理が見られることがある。
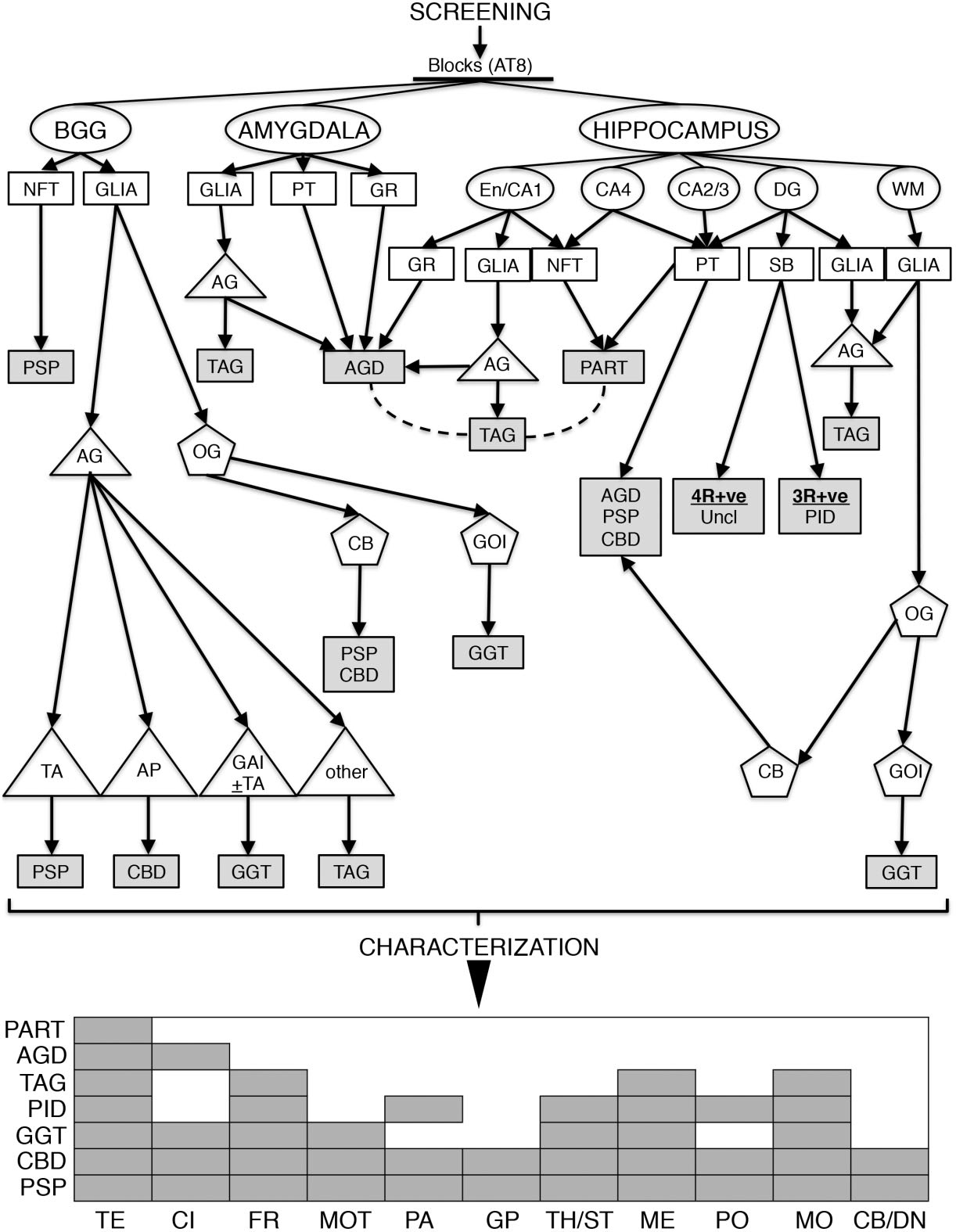
図5 タウ症を評価するための費用対効果の高い診断戦略のアルゴリズム。神経細胞脱落とグリオーシスのマッピングに続いて、タウオパチーのスクリーニングはAT8免疫組織化学的に、大脳基底核(BGG;尾状核と側座核、被殻)、扁桃体(嗅内野皮質)と海馬(外側膝状体レベルで下側頭回を含む)のブロックを対象とする。BGGでは、NFTとグリア病理を評価する。グリアにおけるタウ免疫組織化学で、房状アストロサイト(TA)、アストロサイト斑 (AP)、globular astroglial inclusion (GAI)、トゲ状アストロサイトやアストロサイトの突起のタウ陽性微細顆粒を含むアストログリア(AG)と、コイル小体 (CB)、globular oligodendroglial inclusion (GOI) を含むオリゴデンドログリア (OG)の形態を区別すべきである。扁桃体では、とげ状アストロサイトのクラスターやタウ陽性微細顆粒、プレタングル (PT) およびdendritic grain‐type (GR)神経細胞を評価する必要がある。下側頭回と嗅内野皮質 (EN)、支脚、海馬CA1領域では、グレインやNFT、とげ状アストロサイトのクラスターやタウ陽性微細顆粒に、歯状回 (DG)では、プレタングル、 spherical bodies (SB;3Rあるいは4R免疫反応性)、とげ状アストログリアを注意して観察する。最後に、白質では、とげ状アストロサイトまたはタウ陽性OGを観察する。これらのタウ免疫反応は、ある種のタウオパチーを示唆しているかもしれないが、まれなヴァリアントの検出を含めた正確な特徴付けのためには、さらに解剖学的な病変の系統的なマッピング(画像の下の方に灰色のボックスとしてまとめられている)が必要である。すべての検索領域で、AD関連神経病理学的変化を示唆するアミロイド斑との関連があるdystrophic neuritesに注意する。予期せぬ量のNFT様変化やアストロサイトのタウ病理、あるいは脳溝深部におけるこれら病変(側副溝を含む海馬)は、慢性外傷性脳症を疑わせる。点線は疾患間の重複を示す。AGD, argyrophilic grain disease; CBD, corticobasal degeneration; GGT, globular glial tauopathy; PART, primary age-related tauopathy (NFT-dementia); PID, Pick's disease; PSP, progressive supranuclear palsy; TAG, tau-astrogliopathy in the ageing brain; Uncl, unclassifiable tauopathy。解剖学的領域は以下の通り。TE、側頭葉皮質; CI、前帯状回皮質; FR、前頭葉皮質; MOT、運動野; PA、頭頂葉皮質; GP、淡蒼球; TH/ST、視床および視床下核; ME、視蓋・被蓋および黒質を含む中脳; PO、橋; MO、延髄; CB/DN、小脳皮質、白質および歯状核。
結論
本レビューは、タウ病理およびタウオパチーの実体のスペクトラムが、PiD、PSP、CBDおよびAGDという疾患形態を超えて拡大していることを示している。細胞間伝達の概念はタウオパチーの病態の重要な側面であるように思われるため、タウオパチーの異なるパターンはタウ種の違いとして解釈される可能性がある。このような理由から、解剖学的領域におけるタウ病変の詳細な記述が極めて重要である。実際には、いくつかの症例は、既存の診断基準に従って分類されていない場合がある。タウ病理の費用対効果の高いスクリーニングのためには、海馬、扁桃体、大脳基底核が良い選択である。重要なことは、AD関連タウ病理と考えられても、さらなる検索を除外してはいけない。タウ病変の珍しい形態は、遺伝的要素、例えばMAPTや他の遺伝子座との関連性を疑うべきである。タウ病変のスペクトルとその意義を理解するためには、学際的な研究が必要である。
参考文献:G. G. Kovacs. Neuropathology of tauopathies: principles and practice. Neuropathology and Applied Neurobiology 2015;41:3–23