学会員論文紹介
近著論文の解説
血管内圧と周囲基質の硬さの力学的バランスによる血管新生の制御機序
花田保之 西山功一
対象論文
- Biomechanical control of vascular morphogenesis by the surrounding stiffness
- Yasuyuki Hanada, Semanti Halder, Yuichiro Arima, Misato Haruta, Honami Ogoh, Shuntaro Ogura, Yukihiko Shiraki, Sota Nakano, Yuka Ozeki, Shigetomo Fukuhara, Akiyoshi Uemura, Toyoaki Murohara, Koichi Nishiyama
- Nature Communications 2025 Jul 28;16(1):6788.
- DOI:10.1038/s41467-025-61804-z
Profile著者プロフィール

宮崎大学医学部血管動態生化学、名古屋大学循環器内科

宮崎大学医学部血管動態生化学
論文サマリー
血管新生は、既存の血管から新しい血管が出芽して伸長し、新しい血管網が形成される現象です。この現象は、発生の段階で重要なのはもちろん、悪性腫瘍や炎症などの病態にも深く関与することが知られています。一方で、血流に伴う力学的な刺激は、血管の生理機能や心血管疾患と深く関わることが以前からよく知られています。近年、力学的な刺激が血管新生にも影響を与えることが、少しずつ分かってきました。本研究グループも最近、日本医科大学の弓削進弥助教(現講師)、福原茂朋教授らのグループとの共同研究で、創傷後の血管修復時の血管新生が、主に静脈側から起こり、動脈側からはほとんど起こらないことを明らかにしました(Nat Commun 2022; 13(1):2594、当学会学会員論文紹介ページ)。その機序として、内腔圧上昇による血管壁の伸展が、内皮細胞のメカノセンサー分子BARタンパク質によって感知され、これにより内皮細胞の移動が抑制されることで、動脈側からの血管伸長が抑制されることがわかりました。
血管新生においては、血管が伸びるだけでなく、ほぼ同時期に管腔構造が形成されて血管らしい形態が形作られます。管腔が形成されると血流による血管内圧が付加されるため、血管壁が伸展して血管伸長に影響を及ぼす可能性が考えられます。そこで本論文は、正常な血管新生が進むなかで、上述の機序が血管伸長と管腔形成をどのように統合・調整しているのかを明らかにすることを主題としました。
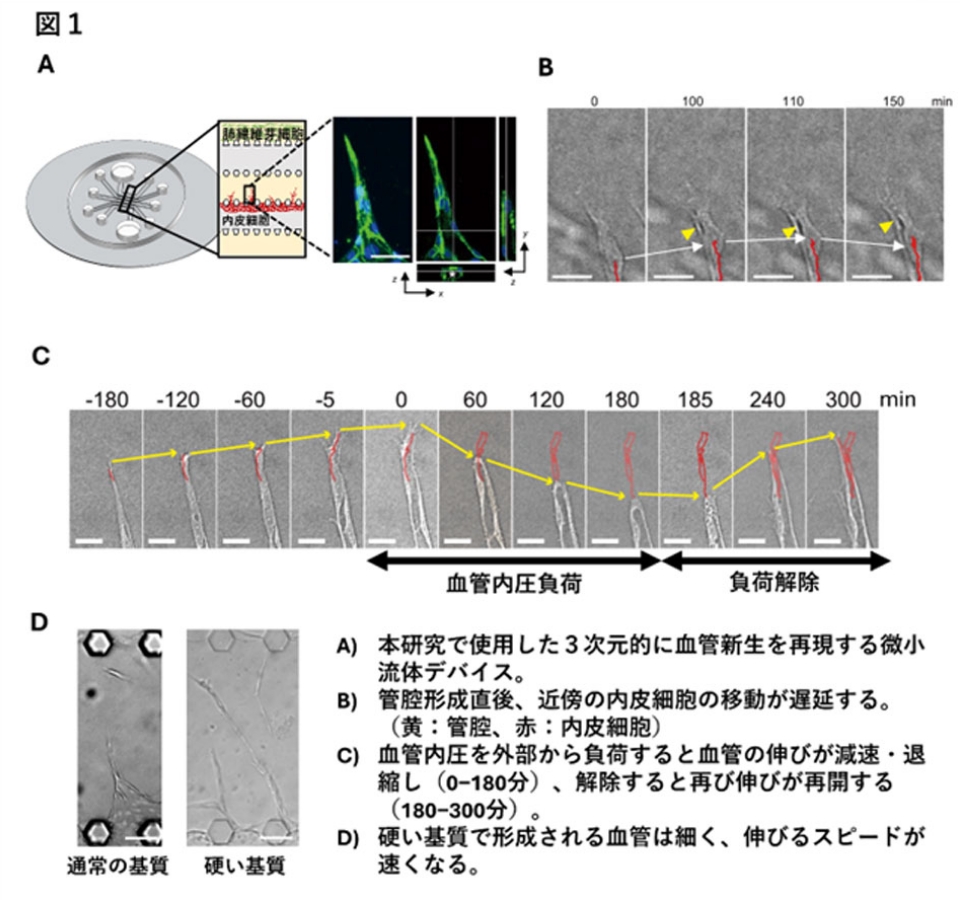
血管伸長と管腔形成の関係性を明らかにするため、独自の微小流体デバイス(図1A)を用いて3次元的に血管新生を再現し、タイムラプス観察する実験系を構築しました。これにより、血管伸長、管腔形成、内皮細胞の移動を同時に観察することが可能になりました。この観察によって、管腔が形成され拡張した直後に、その近傍の内皮細胞の移動が減速し、血管伸長が遅延することが明らかになりました(図1B)。また、微小流体デバイスの流路を通じて、人為的に血管内圧を増減して血管を拡張・解除すると、それに連動して、内皮細胞の動きと血管伸長が遅くなったり、再加速したりすることが示されました(図1C)。微小血管の拡張性は、血管の周囲の硬さに依存することが既に理論的に示されています。この知見に基づき、微小流体デバイス内で、血管周囲の基質(フィブリン・コラーゲンゲル)を、架橋酵素であるトランスグルタミナーゼによって硬化させて血管新生を再現したところ、硬い基質内では血管が細く保たれ、内皮細胞の血管伸長方向への移動が促進し、血管の伸長が速くなることがわかりました(図1D)。これらの結果から、管腔形成後の血管拡張に伴う力学的バランスの変化(血管壁伸展の増加)により、血管の伸びが遅くなるという因果関係が明らかになりました。
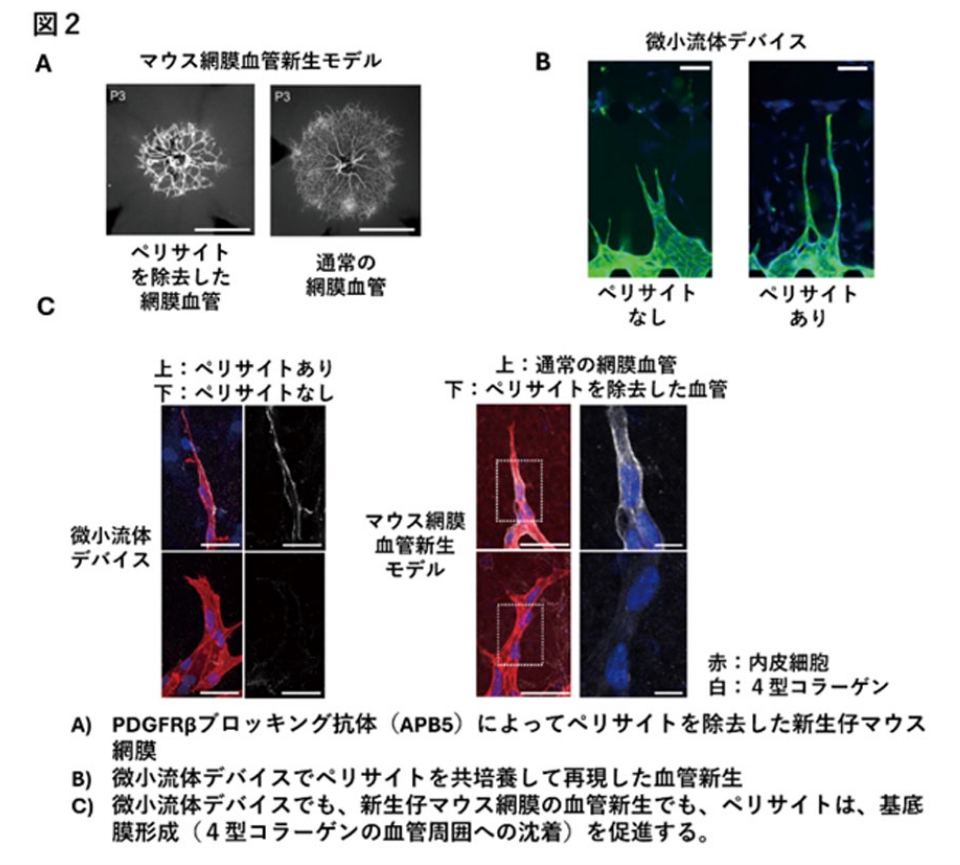
以上で示された血管伸長と管腔形成に伴う血管拡張の関係性が、実際の生体内でどのように制御されているのかを明らかにするため、本研究ではペリサイトに着目しました。新生仔マウス網膜でPDGFRβに対するブロッキング抗体を用いてペリサイトを除去すると、血管の伸長が遅延し、血管が拡張した形態をとることがわかりました(図2A)。逆に、微小流体デバイスで内皮細胞とペリサイトを共培養して血管新生を再現すると、内皮細胞のみでの血管新生と比較して、血管は細く保たれて、血管伸長が速くなることがわかりました(図2B)。このとき、血管の拡張性は低下しており、新生血管近傍の基質が硬くなっていることが、血管拡張性測定試験およびParticle tracking microrheologyを用いた基質の非接触的な物性測定によって明らかになりました。さらに、ペリサイト共在下では、4型コラーゲンを主とした血管基底膜の形成が促進しており、この基底膜形成の促進が、新生血管の力学的な補強の役割を果たして、過剰な血管拡張を抑えていることがわかりました(図2C)。
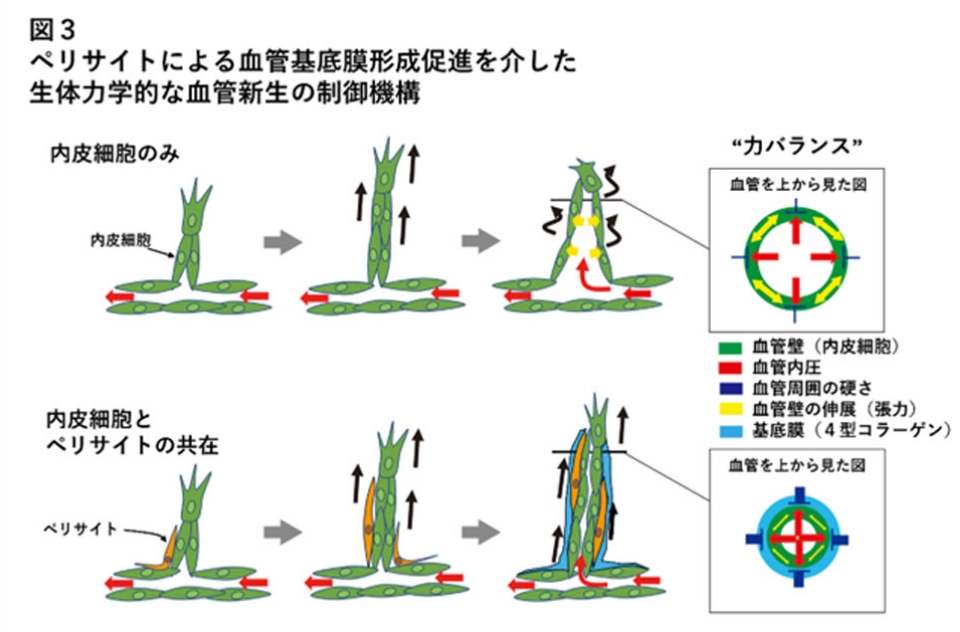
以上の結果から、本研究は、「管腔形成に伴う血管拡張が血管周囲基質の硬さによって適切に制御されて、血管伸長がスムーズに行われる」という血管新生の新たな生体力学的制御機構を明らかにしました。また、ペリサイトが血管基底膜の形成を促進して、この仕組みを利用することで血管新生を制御していることもわかりました(図3)。
今回明らかにした機序は、血管にとどまらず他の器官の組織形成においても、組織周囲の基質の力学的特性に着目することの重要性を示唆するものです。また、腫瘍組織のような不適切に起こる血管新生が関連する疾患や、虚血が関与する疾患において、血管内外の力学的バランスを、周囲基質の硬さや血管内圧を制御することで、血管新生そのものを制御し、治療に結びつける新たな治療戦略の創生を期待させるものです。
著者コメント
上述の通り、本研究は、日本医科大学の弓削先生、福原先生のグループとの共同研究で明らかにした、「創傷治癒時の血管新生が内腔圧上昇によって抑制され、さらにその機序は、内腔圧上昇に伴う血管壁伸展張力の上昇が内皮細胞の移動を抑制することによって起こる」という発見に基づいて始まりました。この機序が、より生理的な血管新生においてどのような意義を持つのかという問いが本研究の出発点でした。一方で、今回の論文の共著者でもある名古屋市立大学の植村明嘉先生が、新生仔マウス網膜においてペリサイトを除去すると、血管形成に遅れが生じ、血管が拡張した形態をとるという知見を報告されていました(J Clin Invest 2002; 110(11):1619)。これらの事実から、血管新生における血管伸長と血管の太さには何らかの関連があるのではないかという仮説が浮かび上がりました。そして、血管壁にかかる張力をより定量的に考えられないか、という疑問を抱くにいたりました。古い教科書(「レオロジー ―生物レオロジー―」 岡小天著 裳華房 1974)を紐解くと、既にこれについて考えた先人がおり、血管径と壁張力の関係を理論的に考察して導いたシンプルな式(岡の式)が紹介されていました。この考察から、血管壁にかかる張力が、血管内圧の変化そのものよりも血管の拡張性の影響を、より直接的に受けるようだという感触を得て、管腔形成直後に血液が流入した瞬間の血管の拡張性が、血管伸長に影響を及ぼすのではないかという考えにいたりました。
その後、微小流体デバイス上で再現した血管新生のタイムラプス観察が可能になり、血管拡張と、その直後の血管伸長の遅延を直接評価することができました。次に問題になったのが、血管の拡張性がどのように決まるのかという疑問でした。これについても既に先人がいました。再び古い教科書(「Biomechanics: mechanical properties of living tissues」 Y.C. Fung著 Springer-Verlag 1993)を紐解くと、微小血管の拡張性は、大血管と異なり周囲基質の硬さに依存するという力学モデルを著者自身が約60年前に提唱していました。このモデルから、新生血管の周りの硬さに着目するという考えにつながりました。
このように、本研究は、直接お世話になった先生方の知見を基盤とするとともに、遠い先人たちの思考の足跡を助けにして進んだもので、「巨人の肩の上に立つ」という言葉を実感させるものとなりました。共著者の先生方をはじめ、熊本大学国際先端医学研究機構(IRCMS)時代に、研究をサポート・ディスカッションしてくださったスタッフの皆様に、この場をお借りして御礼申し上げます。

宮崎大学医学部血管動態生化学

熊本大学国際先端医学研究機構(IRCMS)血管新生研究室
活用したデータベースにかかわる
キーワード
血管新生
生体力学
多細胞動態


