学会員論文紹介
近著論文の解説
Bivalent-histone-marked immediate-early gene regulation is vital for VEGF-responsive angiogenesis.
Y Kanki, M Muramatsu, T Minami, et.al.
対象論文
- Bivalent-histone-marked immediate-early gene regulation is vital for VEGF-responsive angiogenesis.
- Y Kanki, M Muramatsu, T Minami, et.al.
- DOI: https://doi.org/10.1016/j.celrep.2022.110332
論文サマリー
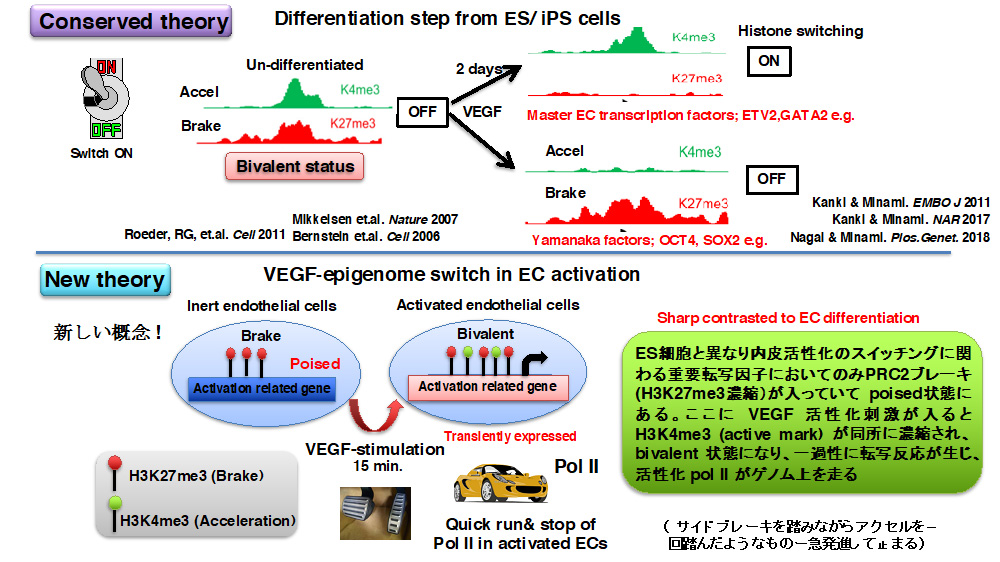
エピゲノム制御とは全ての細胞活動の源となる遺伝情報(ゲノム)をいつ、どのように、どれくらい読み取るか(転写するか)を調節することです。私たちの身体にはポリコーム(PRC)やトリソラックス(TRX, MLL 複合体)というエピゲノム調節複合体が正確に働いて、手足、骨の位置などの基礎組み (body planning) がなされます。またゲノムはヒストンというタンパクで廻りを取り囲まれコンパクトに収納されています。このヒストンの端(ヒストンテール)のリジン残基やアルギニン残基にメチル基やアセチル基などの修飾が生じることでこの部分の遺伝情報の読み取り(RNA ポリメラーゼII による転写)を活性化させるか(アクセル入れるか)、抑制するか(ブレーキかけるか)をコントロールすることがわかっています。典型的な PRC1(canonical PRC1) によってヒストン H2A の119番目のリジン残基にユビキチン修飾 (H2AK119Ub)が入るとヒストンが凝集し、また典型的な PRC2 によってヒストンH3 のリジン27番目にメチル基が3つはいると (H3K27me3)、転写にブレーキがかかります。一方、トリソラックス複合体 (COMPASS-複合体、MLL1-4) によってヒストンH3 のリジン4番目にメチル基が3つはいると (H3K4me3) 今度は転写が活性化され(Pol II にエンジン・アクセルがかかり)、遺伝情報から機能性タンパクが作られると認識されています。私たちの全ての細胞はこのエピゲノム調節(ヒストンコードの読み取り)によって正常に分化し、増殖し、生きていると考えられます。この転写のアクセルとブレーキのバランスは細胞のいる微小環境によって適切に調節されます。特に一番最初にES やiPS 細胞(未分化幹細胞)が分化するとき(個体発生の源)には、それを担うタンパクを転写して誘導する司令塔因子(転写因子)山中4因子などもアクセルとブレーキの共存(Bivalent)状態を経て、正常に調節されます。特にこの調節はダイナミックにおこるので、時間分解能をあげて詳細に調べられてきました。
さて、私たちはこのヒストンの動きが血管内皮細胞が増殖するときにどうなるか、内皮細胞増殖因子 (VEGF) を入れて、時間を追って、詳細に特に、H3K4me3, H3K27me3, H2AK119Ub, Pol II などの抗体を用いてそのヒストン修飾が全ゲノムのどこにどのタイミングに起こっているかをデータベース化してみました (ChIP-seq 解析)。その結果、未分化幹細胞の分化スイッチに使われる転写因子群とは異なり、完全に分化した内皮細胞では増殖に関わる一番最初に必要なタンパクの誘導を急いで担う即時型(急性期応答)転写因子群(Early growth response (Egr) などが有名です))に限って上述したヒストンが bivalent 状態になっていることに気づきました。
即時型転写因子はパッと誘導されて、すぐに誘導が終息されないと、過剰な増殖までも誘導し、細胞ががんになったり、変になって自分で死んだり(アポトーシス)します。我々のヒストンデータベースではこれら即時型転写因子群は増殖刺激を受けるまでは常にブレーキ (PRC2 によるH3K27me3) がかかっており、刺激15分後で今度はアクセル(MLL3/4-PTIP によるH3K4me3)も同時にかかってきて、丁度転写の本体である Pol II がこのタイミングでだけこれらのゲノムにやってきていました。一方刺激が60分もたつと、今度は強いブレーキ (canonical PRC1 によるH2AK119Ub) がかけられて、強烈に抑制されます。この動きはこれら即時型転写因子群がどのようにして刺激に応答し、適切に増殖をコントロールするのかを如実に反映するものでした。
しかしここで大きな壁にぶつかりました。PRC2 によってブレーキがかかっているのに、アクセルが同時にきても転写されるということが本当にありえるのか?(解明に5年以上かかりました)。既存の ES/iPS 細胞の分化スイッチでは刺激48時間くらいのタイムスパンで山中4因子はアクセルからブレーキに、GATA2,ETV2 などの血管内皮分化誘導転写因子はブレーキからアクセルにスイッチすることでコントロールされています (Minami, et.al. 過去報告)。しかし、終末分化した内皮細胞の増殖スイッチでは、H3K27me3ブレーキが残っていながらもH3K4me3 アクセルがこれに同時にのっかかるというヒストンマークが生じています。H3K27me3 の既定概念と合いません。
そこで、最近見出された non-canonical PRC1 の存在を考えてみました。これは、PRC2 修飾の前にクロマチン上にやってきて、最後は canonical-PRC1 に引き継がれると考えられています。即ち、noncanonical PRC1-PRC2-canonical PRC1 の順番で内皮即時型転写因子群のゲノム領域にはやってきているのではないかと思いました。更にnon-canonical PRC1 は大部分canonical PRC1 と構成タンパクを共有しつつも、場合によってPRC1と逆の機能即ち転写アクセル機能を発揮します(PRC1 のジョーカーcard、嘘つき PRC1 ともいえます)。実際 PRC1 機能を反映する H2A119Ub の内皮即時型転写因子群のゲノム領域での濃縮度合いを見てみると、VEGF 刺激0分、60分と高度に濃縮されているにも関わらず、VEGF 刺激15分だけこの濃縮ブレーキがなくなっていました。丁度 Pol II がこれら内皮即時型転写因子群のゲノム領域の転写を行うタイミングだけです。また興味深いことに神経が伸長する場合では、non-canonical PRC1 のうち、コアタンパクが PCGF5 で出来ている PRC1.5 がこの逆説的な転写誘導を行うことが Nature に報告されています。では内皮細胞が伸長する血管新生におけるnoncanonical PRC1 の実体は何なのか。siRNA を用いたスクリーニングを行ったところ、pcgf5 ともっとも類似したファミリーである pcgf3 から構成される PRC1.3 がこの内皮細胞での即時型転写因子群のゲノム領域のブレーキを解除する役者であることが判明しました。(既存概念の打破)
さて、今度は Pol II を呼び寄せるトリソラックスは何なのかという問題です。 PRC1.3 により、PRC2 のブレーキを解除してもアクセルがないと、転写(pol II によるエンジン)はかかりません。トリソラックス複合体のコアタンパクは共通でこれがないと、細胞は増殖できないので、この複合体のアクセサリータンパクに着目してこれらの siRNA ノックダウンスクリーニングを行いました。その結果トリソラックス複合体のうち MLL3/4 のクロマチン修飾をガイダンスする PTIP だけが、分化内皮での VEGF 刺激での増殖に関わっていることを見出しました。
これまで私たちは VEGF 刺激での内皮増殖、炎症を伴う血管新生に特徴付けられる早期のシグナルは、VEGF受容体からのカルシウム流入 - calcineurin-NFAT の核内移行とそれに伴う下流転写誘導とダウン症因子 (DSCR)-1 による的確な調節が鍵となることを証明してきました。これは想定していなかったことですが、エピゲノム解析から見出した PTIP タンパクは内皮細胞では NFAT と複合体を形成しており、VEGF 刺激に伴って、NFAT が支配する内皮即時型転写因子群のゲノム領域に PTIP を呼び寄せて、MLL3/4 にてアクセル (Pol II)による転写を走らせていることもわかりました。即ち、もともとPRC2 によるブレーキがかかっているが、VEGF 刺激によって即時型転写因子群のゲノム領域に PRC1.3 の働きでもってブレーキを一時的に解除し、その場所に NFAT-PTIP によってアクセル本体 (MLL3/4 による H3K4me3 ヒストンマーキング)を呼んでくることで PolII がそのゲノム上を転写することがわかりました。例えると、車がサイドブレーキをかけながらアクセルペダルを踏むことで一過性に急発進するようなイメージです。私はこれを VEGF-episwitch と名付け、論文上で示しました。
ちなみに、実用化至上主義の世の中ですのでこんなエピゲノム解析で何に使えるのかと問われます。臨床の観点では、血管内皮細胞の増殖は炎症、血管新生に繋がり、がんや慢性炎症(生活習慣病)の病態そのものに関与してくることがわかっています。そこで血管新生を止める抗血管新生療法たるものが取り入れられ、抗がんや加齢黄斑変性症などに使われていますが、正常な血管内皮にも悪影響を及ぼす場合が多く、多くの制限があります。今回のVEGF-episwitch に着目して、PRC1.3 のコアタンパク PCGF3 を内皮細胞特異的に欠損したマウスやがんを植え付けた担がんマウスの血管にPTIP の内皮発現を抑制するようなモデルを作った場合、胎生期の血管新生 (Developmental angiogenesis) には一切影響を与えず、NFAT 活性化を介する主に炎症を伴う病的な血管新生 (pathological angiogenesis) のみを阻害し、がん増殖も遅延させることが出来ました。
著者コメント
筆頭著者の神吉さんとこの論文の骨子となる Bivalent 修飾が内皮活性化にもあることを見出したのは、遙か8年前です。その頃は内皮 ENCODE 計画も出始めで、急いでデータ固めて出せれば良かったのですが、南の熊大への異動(研究場所がない、場所作ってすぐ地震で壊れた)、村松さんの離脱、あげくには筆頭著者のコロナ感染(死にそうだったそうです(今だから言えますが))と紆余曲折ありました。共著の久保田先生にはもうちょっとhigh インパクトのにしたらとアドバイス受けましたが、ウンチクいえる筆頭著者が間近にいない環境下、やや網羅解析手法が時代遅れになっていることもあり、こういう結果になりました。課題はこれから若手を育てていくことです。ピペットマン初めて触る学部生ばかりだと疲弊しますので、是非熊本で血管研究という方、来てください。

活用したデータベースにかかわるキーワード
VEGF-epigenomics
bivalent 修飾
NFAT


