コクラン共同計画とハンドサーチマニュアル
廣瀬美智代
廣瀬美智代
ver. 1.0 2002.2.19
廣瀬美智代.コクラン共同計画とハンドサーチマニュアル.In: 中嶋 宏(監修),津谷喜一郎,山崎茂明,坂巻弘之(編).EBMのための情報戦略−エビデンスをつくる,つたえる,つかう−.中外医学社,2000: pp. 94-104. より、著者、出版社の了解を得てupした。
コクラン共同計画 The Cochrane Collaborationは,システマティックレビュー systematic reviewを行うために,臨床試験の網羅的な情報収集に 努めている.既存の生物医学系のデータベースによる文献の検索のみでは不十分であるためさまざまな活動を行っている.ハンドサーチはその 一つである.コクラン共同計画の New England Cochrane Center (NECC), Providence Officeがハンドサーチのコーディネーションを担当し, ハンドサーチされる雑誌の登録リストを管理し,ハンドサーチの結果をまとめる作業をしている(http://www.cochrane.org/necchome.htm) 1).
ハンドサーチの作業は言語に依存する部分が多い.そこで,日本語雑誌のためのハンドサーチマニュアルを英文のHandsearch Manual (http://nihs.go.jp/acc/cochrane/hsmpt1.htm)2)を基に,作成した.
本マニュアルはコクラン共同計画に限らずとも,さまざまな目的でランダム化比較試験を収集する際にも役立つものである.
1.ハンドサーチの背景
ハンドサーチとは,ランダム化比較試験 randomized controlled trial(RCT)の論文を漏れなく確認するために,論説や短報などを含めて, 雑誌を1ページ1ページ,人による手作業で計画的に検索することである.
ヘルスケアに関するRCTの情報を収集するために,現在の電子的な方法だけでは収集できない情報を補うために,各種の情報源,主に 生物医学雑誌を手でめくって必要な情報を収集するのである.
ヘルスケアあるいは医療情報は今や膨大な量にのぼり,医療関係者,患者,政策立案者にとって,すべて読むというのは不可能である. この情報の洪水の中で,医療関係者は従来,こうした情報を集めた総説や解説に頼ってきた.
(1)エビデンスに基づく医療
エビデンスに基づく医療 evidence-based medicine(EBM)という言葉が1991年に初めて用いられてから,「エビデンス」に対する関心が急速に 高まった.EBMでは「エビデンス」とは,人に用いられた臨床研究の結果を指している.今日の情報技術 information technology(IT)の発展に 伴い,「エビデンス」を求める医療関係者,患者,政策立案者は,まず,電子的にこの「エビデンス」を調べようとする.すなわち,生物医学雑誌の 書誌事項等を含んだデータベースを検索するのである.
(2)ランダム化比較試験とシステマティックレビュー
ランダム化比較試験(RCT)は,ヘルスケアの効果を評価するためには最も優れ,エビデンスの強い研究デザインである.複数のRCT がある場合であっても,それらを統合し,「エビデンス」としてまとめてつたえるのに有用なのが,「システマティックレビュー」である.
(3)システマティックレビューをつくる
RCTのシステマティックレビューをつくるには,まず,データを収集しなければならない.偏らず,見逃しがないように,できるだけ多くの研究を 集める.しかし,公表されているRCTの研究論文を「耳を揃えて」集めるのは,とても難しいことがわかってきた.電子データベースは書誌事項と 抄録を含んでいるが,こうした電子データベースを検索しても必要な文献を見逃してしまうことがある.Dickersinら3)によれば, 英語で作成されているあるデータベースでRCTを電子的に検索したところ,みつけられたのは目的の文献の半数に過ぎなかった.
もともとそのデータベースに入っていなかったものもあったが,データベースに入っていながら見逃されていたRCTの文献は,インデックスが 適切でなかったために検索されなかったのである.
さらに言えば,公表されないRCTが存在することもある.
このようにRCTによる「エビデンス」が入手しにくい,ということは,ヘルスケアの開発・方向性・進歩・診療にあたって,誤った方向にいく可能性が ある.
システマティックレビューにあたっての問題には以下があげられる.
- 世界で最初のRCTが1948年に報告されて以来,約50年間に蓄積されたRCTの何割かはレビューの対象になっていない.
- レビューに用いられるRCTのバイアスに払われるべき注意がなされずに,適切にレビューされていないことがある.
- 日本で行われたRCTに関しては,日本語で公表された研究論文は英語のデータベースに含まれているものが少ないので,海外から日本の
RCTを探しても多くは見逃されている.そのため,日本で行われたRCTの多くは海外の研究者がシステマティックレビューを行う際に検討対象に
なっていない.
- 公表されていないRCTの研究の情報を収集する努力を含めて,ヘルスケアに関するRCTの研究論文をすべて探し出すことは大変な労力を 要する.
ヘルスケアのRCTを電子的に検索するには,生物医学雑誌の書誌情報のデータベースが用いられる.
従来用いられてきたもので代表的なものがMEDLINEである.MEDLINEは米国医学図書館(NLM)が作成しており,公共のリソースとして インターネットでも無料で提供されている.しかし,MEDLINEは約4,300誌をカバーするものであり,世界で約3万と推測される医学雑誌全体を カバーしているわけではない.またMEDLINEにおけるindexing作業も完全なものではない.
そこでコクラン共同計画はCENTRALを作成することとなった.RCTを集めたデータベースであり,The Cochrane Library(CD-ROMとインターネット で提供されている)に収載されている.コクラン共同計画は,英語文献に限らず,国際的にRCTの収集を行っているが,各国で電子的検索または ハンドサーチによってみつけ出されたRCTやCCTの書誌情報をCENTRALに掲載している.
コクラン共同計画の国際的なRCTの収集作業によってRCTと判定されたもののうち,すでにMEDLINE収録の書誌情報については,MEDLINE の書誌情報にRCTの情報をNLMが書き加えるretaggingの作業が1996年から行われている(第4章-3.情報源の改良へむけて,69頁参照).
このように,RCTをCENTRALに国際登録することにより,「エビデンス」を求める人やレビューをする人がRCTを探し出す負担を軽減することが できる.
2.何をハンドサーチするのか
ハンドサーチの目的は,生物医学文献のうち,ヘルスケアに関して公表されているRCTすべてを探し出すことである.
(1)選択する基準
ヘルスケアのRCTを国際登録ランダム割付する基準を,表6-1に示す.
RCTとは,ランダム割付けrandom allocation,ランダム化randomizationを用いて,医学的介入(薬,外科手術,検査,看護,教育,サービスなど) を行う群とコントロール群に分け,評価を行う臨床試験の方法である.
つぎの4点が重要である.
- 人に介入する比較研究であること.
- 研究を人に実施する前に,どういう介入をするか,前もって決めてある(「前向き」の研究)こと.
- 1つ以上の介入を含む研究であり,その他の方法と比較していること.
- 参加する人(被験者)をどの群にするか(割付け)は,ランダムであること,すなわち,どの群にするか故意に選択していないこと.
表6-1 ヘルスケアの公表されたRCTをコクラン共同計画に国際登録する基準
(http://www.nihs.go.jp/acc/cochrane/hsmpt1.htm#Appendix_l)4)
| 最も重要な方針(overarching principle): |
| ヘルスケアのRCTの報告を可能なかぎり多く,国際登録に含めるようにすること.試験をみつけ出すために文献検索を行う者は,報告を
含めるか疑問がある場合には含めるようにすること.ただし,RCTを行った可能性を記載しただけの文献は含めないこと. レビューにある報告を入れるか判断するのはレビューアである.国際登録の目的は,レビューに入れる可能性のある試験を可能な限り レビューアに提供することであり,報告が立派であるとか国際登録に含めるのが適切かを決めることではない. |
| 適格基準(eligibility criteria): |
| 対象となる報告とは,発表年代にかかわらず,少なくとも2種類のヘルスケア(治療,患者教育,検査法や検査技術,予防的介入など)を
比較した研究であり,生体または生体の一部や器官となるもの(移植腎など)に関するものである.死体,抜いた歯,細胞などに関するものは
対象としない. 国際登録に含める適格性は,試験の治療への割付けがランダム化であるかまたはランダムを意図した方法であるかによって決まる. 用いられた方法の質に関する判断や著者が記載した方法通りに実施したかは,国際登録に含める適格性を決めるものではない. 試験を国際登録に含めるのは,得られた情報に基づいて,以下のように判断される時である. ・試験において,個人(またはその他の単位)を,明らかにあるいは可能な限り事前に複数のヘルスケアのうちのひとつに割付ける方法が,さらに, ・被験者/患者と評価者が受けた介入の内容を知らないという,二重盲検法 double blindingまたは二重遮蔽法 double maskingを用いて,ひとつ または複数のアウトカムを評価した場合には,本文中にランダム化とはっきり記載していなくても,その試験はランダム化の可能性,または準 ランダム化として,国際登録に含める. |
*訳者の追加による.
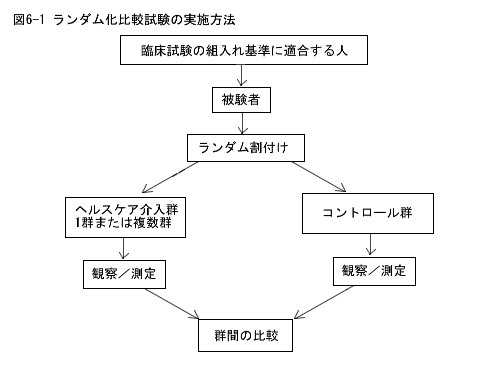

(2)RCTとCCT
広義のRCTは,ランダム割付けの確かさによって,さらに二分される.著者が研究中の比較群間の割付けを「ランダム割付けで行った」あるいは, 「ランダム化」に類する表現で記述していれば,「ランダム化比較試験」randomized controlled trial(RCT)と分類する.もし,はっきりと記述がない 場合にはRCTである確かさは低くなる.
ランダム割付けを,コイン投げ,くじ引き,曜日,誕生日,カルテ番号,交互などの準ランダム化 quasi-randomizationの方法によって行ったと 記述していれば,「比較臨床試験」controlled clinical trial(CCT)と分類する.「比較臨床試験」は「準ランダム化比較試験」 quasi-randomized controlled trialとも称され,後者の方が日本語としてはわかりやすい.
「臨床試験」clinical trialという言葉はここでは広い意味で用いている.人について行われる前向きの臨床研究のことである.RCTまたは CCTであれば人が患者でなくて健常人でも,介入が医療そのものでなくても,ヘルスケアの介入の評価に関連した情報を含んでいることがある ので,登録に含める.
研究の試験デザインの「質」と実施がうまくいっているかを評価するのはシステマティックレビューをする作業の一部である.しかし,ハンドサーチ を担当する際には,RCTあるいはCCTと分類するために研究の質を評価する必要はない.
個々の文献をシステマティックレビューに入れるかどうかは,システマティックレビューをする人が決める問題である.
3.ハンドサーチの方法
ハンドサーチをする人は,特定の雑誌を特定の号について,サーチする.担当した雑誌については,RCTの研究をもれなく探し出すために, 表紙から後表紙まですべてサーチしなければならない.
ハンドサーチをサポートするための日本語のホームページが開設されている(http://jhes.umin.ac.jp).関連する文献が収載され,他のホーム ページへのリンクがはられている.
(1)ハンドサーチの登録
ハンドサーチの作業が重複しないように,登録用紙(http://www.cochrane.org/srch.htm#form)5)を用いて登録する.e-mail ないしfaxで送付する.先の日本語のホームページからもリンクされている.
(2)用意するもの
ハンドサーチする雑誌とその目次のコピー
筆記用具
(3)キーワードと関連語句
担当する雑誌に掲載されている個々の記事を,研究論文だけでなく,投稿文,短報,総説もすべてを対象に,順に読んでいく.個々の記事は 試験の研究デザインを示すキーワードと関連する語句を探して,RCTまたはCCTをみつける.
RCTの採用基準(表6-1)にあう試験の論文に一般的にみつけることができる語句を以下にあげる.
ただし,これら語句がみつかったからといって,RCTとは限らない.RCTかCCTかの判定よりも,重要なのは,RCTあるいはCCTを漏れなく (感度sensitivity高く),探し出すことである.
この他の用語も含めて,詳細については,巻末の基本用語集に示した.
a.ランダム化,または無作為化 randomization
被験者を2つ以上の群にランダムに割付ける方法.各群の背景因子が均等にバランスがとれるように,乱数表を用いたり,コンピューターで 発生させた乱数などを用いて割付けること.通常は割付け表 randomization listをまず作成し,それに従って割付ける.「ランダム割付け」「無作為 割付け」random allocationともいう.
日本では,従来「無作為割付け」という言葉が「故意でなく」割付ける,という意味で,用いられることがあったが,日・米・EU三極医薬品規制調和 国際会議(ICH)で合意された「臨床試験のための統計的原則」で日本では1998年よりrandomizationに「ランダム化」の訳語を用いている.
ランダム化により複数群に割付けられたものが,ランダム化比較試験である.この方法を用いた試験は,「ランダム化臨床比較試験」「無作為化 臨床比較試験」「ランダム化比較試験」「無作為化比較試験」「ランダム化試験」「無作為化試験」「ランダム試験」「無作為試験」などと記載される.
「ラテン方格」により割付けた,と記載されていれば,ラテン方格は乱数表やコンピューターで作成されて割付け表を構成するため,試験デザイン はRCTである.
b.準ランダム化 quasi-randomization
ランダム化に準じた割付け方法.すなわち,コイン投げ,くじ引き,曜日,誕生日,カルテ番号,交互,などを割付け方法として用いる.こうした方法 では,両群の背景因子のバランスが崩れる可能性もあり,選択バイアスが入りやすいので「準ランダム化」と称され,エビデンスのレベルは低くなる. 「偽ランダム化」pseudo-randomizationとよばれることもある.この方法を用いた試験は「比較臨床試験」controlled clinical trial(CCT),または, 「準ランダム化比較試験 quasi-randomized controlled trial」である.
日本の論文で,準ランダム化,準無作為化,偽ランダム化,偽無作為化などの記載があることはまれである.
c.比較試験または研究 comparative trial or comparative study
1つ以上の介入群をコントロール群と比較する研究を指す.比較試験は必ずしもランダム化されているとは限らないが,RCTやCCTはすべて 比較試験である.
「比較試験」「比較研究」「XとYの有効性の比較」などと記載される.コントロール群として同時対照 concurrent control, 歴史対照 historical control,文献対照 literature controlなどが用いられる.
なお,ランダム化のコンセプトの入っていない「比較試験」を広い意味で「比較臨床試験」controlled clinical trial(CCT)と呼ぶことも以前はあった. 先の「準ランダム化」を用いたCCTと混同しないよう,内容から判断する.
d.二重盲検または遮蔽 double blinding or masking
「二重盲検」あるいは「一重盲検」single blindingという言葉が用いられる時にはRCTであることを前提にして行われていることが多い.この他に 「三重盲検」triple blindingもある.
日本では「盲検」の語句を記載しても「ランダム化」(無作為化)と記載していないことがある.「二重盲検試験」の多くは正確には「二重盲検 ランダム化比較試験」と表現されるべきものである.試験の方法の項を読んで,実際の割付け順序 sequenceの作成方法を確認するのが望 ましいが,通常行われる医薬品の「二重盲検法」は,その基本となる割付け表を乱数表やコンピューターでつくるため,RCTとしてよい.
「盲検」の語句の代わりに,「遮蔽」(マスキング)が用いられることもある.
e.コンシールメント concealment
日本でいう薬剤の「割付け」は3つの意味を持つ.第1は割付け表 randomization listの作成である.例えば「APPAPA」などとランダムの 順序 random sequenceがつくられる(generate).第2は,試験薬とコントロール薬の「割付け作業」である.割付け表にしたがってラベルを貼り, 番号順にそろえる.第3は,実際の患者に試験薬ないしコントロール薬が投与される(random assign)ことである.
ここで,第1の割付け表作成から実際の患者への投与まで,割付けの順序,すなわち割付け表を「伏せて」おくことを「コンシールメント」 concealment(隠蔽)という.コンシールメントが保たれないと,意図的あるいは無意識に割付け順序がくずれ,選択バイアスの原因となる. 二重盲検法を用いた時には通常コンシールメントは保たれていると判断してよい.
f.クロスオーバー cross over
「クロスオーバー(法)」「交叉(交差)法」などと記載されることがある.2回以上の介入が定められた順序で同一の被験者に行われる試験デザイン である.最初の介入がランダムに割付けられていたら,RCTである.
g.プラセボ placebo
「プラセボ」「プラシーボ」「偽薬」などと記載される.
プラセボを使用している場合は,二重盲検ランダム化比較試験であることが多い.盲検(遮蔽),あるいはランダム化(無作為化)の記載が ないか,確認すること.
h.封筒法 「封筒法により割付けた」と記載されることがある.
「A法(A薬)」または「B法(B薬)」と書いた紙を1枚ずつ入れた封筒を前もって用意し,被験者への割付けはこの用意された封筒を順次,開封し, その指示に従うものである.
「封筒法により無作為に割付けた」と記載されていればRCTであると判断する.「無作為に割付け」の語句がない場合,割付け表がランダム 割付けによって作成されていると記載されていればRCTであると判断する.この記載がない場合には原則としてCCTとする.著者や コントローラー,統計アドバイザーなどの関係者から「ランダム化」が確認できればRCTとする.
なお,実際には,開封時に封筒の中の紙の指示が守られない場合がある.
i.「ランダム割付け」と「ランダム抽出」「ランダム選択」の違い
「ランダム(無作為)抽出」random samplingは,大勢の集団から被験者をランダム(無作為)に選び出すことである.これは,試験のために 被験者をどちらの介入にランダム(無作為)に割付ける(random allocation)こととは全く異なることである.
時に,「どちらの介入にするかをランダム(無作為)に選んだ」という意味に「ランダム(無作為)に選択」したと記載されていることがある.著者は 「ランダム(無作為)割付け」の意図で用いている可能性がある.しかし,「ランダム(無作為)に選択」という記載のみではRCTとは判定しないことと する.RCTと判定するにはランダム割付けが行われていることを示す記述が必要である.
(4)論文全体を読む必要はない
ハンドサーチをするためには,生物医学雑誌の論文全文を通して読む必要はない.
題と要旨あるいは抄録を読むと,ヘルスケアのRCT国際登録に登録すべき試験かどうかわかることが多い.試験デザインの定義にしたがって, RCTまたはCCTと分類するために必要な情報がある部分を,その論文の中から探し出して読めばいいのである.
また,ハンドサーチをするときには,試験デザインの質や実施の方法が適切であるかどうかを評価する必要はない.
(5)生物医学雑誌に掲載される論文の構成
生物医学雑誌には,研究論文の他に,総説,論説,短報なども掲載されている.
生物医学系の雑誌は,投稿規程において,題,要旨,緒言,方法,結果,考察,謝辞,文献といった構成を要請しているものが多い.また 構造化抄録 structured abstractを採用するものも多くなってきた.しかし,このとおりとは限らず,雑誌,年代によりさまざまである.CONSORT 声明に従って編集されている雑誌では,RCTを見い出しやすい.
(6)CONSORT声明
ハンドサーチを行うと,その論文がRCTかCCTかあるいはいずれでもないか迷うことが多い.これは日本のみならず,世界的な問題である. 個々の医師などが論文のエビデンスを判定する際,またシステマティックレビューを行うときに,これは大きな問題となる.これを解決し,さらに RCT論文の質を高めるために,1996年に,CONSORT声明が作成された.
論文を投稿する時に,チェックリストを用い必要な21の項目がどこに書かれたかを記し,重要な情報の欠損を防止するものである.表6-2 にその日本語訳を示す(http://www.sphere.ad.jp/cont/CONSORT_Statement/menu.html 6)).表題中にRCTの語句を入れたり, 割付けの詳細が記載されている.また,CONSORT声明には臨床試験の各ステージでの例数を示すフローチャートが含まれる.CONSORT 声明を用いた雑誌のリストも公表されているので,一度目を通され,直接雑誌中のRCT論文をみてみられるとよい.
日本においては,2000年4月現在「臨床評価」誌のみが,このCONSORT声明を採用しているが,さらに広く採用されることが望ましい.
|
表6-2 CONSORT声明によるRCT論文を投稿する際のチェックリスト6) 本チェックリストは、著者、編集者、査読者が、RCT論文中に必要な情報が入っていることを確認するためのものである. 第1著者名 論文タイトル名
1) Begg C, Cho M, Eastwood S, et, al. Improving the quality of reporting of randomized controlled trials: The CONSORT Statement. JAMA 1996; 276(8): 637-9. [津谷喜一郎, 小島千枝, 訳. 無作為化比較試験の報告の質を改善する 方法CONSORT声明. JAMA<日本語版> 1997年7月号: 74-7] にもとづき一部加筆修正した。英文は、 http://jama.ama-assn.org/info/auinst_pchk.html。 2) 1998年2月5日にICHで合意されたStatistical Principles for Clinical Trials と、その日本版として1998年11月30日に厚生省より発表された「臨床試験のための統計的原則」 にもとづき、randomized controlled trial は「ランダム化比較試験」と訳した。 津谷喜一郎・熊井智子作成 CONSORT checklist in Japanese [pdf版] ver. 2.1 (20 Apr. 2000)
|
関連する文献とwebsite
1) ニューイングランドコクランセンター プロビデンス オフィス
New England Cochrane Center Providence Office
http://www.cochrane.org/necchome.htm(2000年8月1日確認)
2) ハンドサーチマニュアル(コクラン共同計画作成,英文)
Handsearch Manual
http://www.nihs.go.jp/acc/cochrane/hsmpt1.htm(2000年8月1日確認)
3) Dickersin K, Scherer R, Lefebvre C. Identifying relevant studies for systematic
reviews. BMJ 1994; 309: 1286-91.
4) ヘルスケアの公表されたRCTをコクラン共同計画に国際登録する基準
Criteria for registering studies with the Cochrane Collaboration's International
Register of Published RCTs of Health Care. In Handsearch Manual
http://www.nihs.go.jp/acc/cochrane/hsmpt1.htm#Appendix_1(2000年8月1日確認)
5) ハンドサーチ登録用紙
Handsearch Registration Form
http://www.cochrane.org/srch.htm#form(2000年8月1日確認)
6) 津谷喜一郎,熊井智子.CONSORT声明によるRCT論文を投稿する際のチェックリスト
http://www.sphere.ad.jp/cont/CONSORT_Statement/chk_Jap.html(2000年8月1日確認)