尿素サイクル異常症概説
(Urea Cycle Disorders Overview)
GeneReviews著者: Nicholas Ah Mew, MD, Brendan C Lanpher, MD, Andrea Gropman, MD, Kimberly A Chapman, MD, PhD, Kara L Simpson, MS, CGC, Urea Cycle Disorders Consortium, and Marshall L Summar, MD.
日本語訳者: 江田 肖(瀬戸病院遺伝診療科),櫻井晃洋(札幌医科大学附属病院遺伝子診療室)
GeneReviews最終更新日: 2015.4.9. 終更新日: 2016.10.16.
原文 Urea Cycle Disorders Overview
要約
疾患の特徴
尿素サイクル異常症(urea cycle disorders; UCD)の原因は,タンパク質や窒素原子を含む分子の分解により生成される,余剰窒素の代謝機能障害である。尿素サイクルの最初の4つの反応に関与する酵素(CPSI,OTC,ASS,ASL)のいずれか,もしくは補 因子生成酵素(NAGS)の重度な欠損や完全 な喪失により,生後数日中にアンモニアや代謝前駆体の蓄積が生じる。重度な尿素サイクル異常症の新生児は,出生時には正常 だが,その後急速に 脳浮腫及びそれに伴う嗜眠, 哺乳障害,過換気または低換気,低体温,痙攣,神経学的異常姿勢,昏睡を発症する。より軽度な(もしくは部分的な)尿素サイクルに関与する酵素の欠損およびアルギナーゼ(ARG)の欠損では、生涯にわたって、ほかの病気やストレスによって、アンモニア蓄積が誘発される可能性がある。これらの疾患において、血中アンモニア濃度の上昇および関連症状は軽微であるため、生後数ヶ月もしくは数年を経過した後,初めて症状を認めることもありうる。
診断・検査
尿素サイクル異常症の診断は,臨床的,生化学的,分子遺伝学的検査に基づく。血漿アンモニア濃度が150μmol/Lを超え,アニオンギャップおよび血糖値が正常である場合,尿素サイクル異常症を強く疑う。血漿アミノ酸定量分析が特定の尿素サイクル異常症の鑑別診断に用いられる。尿素サイクル異常症の確定診断は、分子遺伝学的検査もしくは酵素活性測定によって行われる。すべての尿素サイクル異常症は分子遺伝学的検査による診断が可能である。
臨床的マネジメント
対症療法: 重度な急性高アンモニア血症:血漿アンモニア濃度の降下を目的とする透析および血液濾過、迂回代謝経路による余剰窒素排出を目的としたアルギニン塩酸塩や窒素除去剤の経静脈投与、体内窒素量減少を目的とした24~48時間のタンパク質制限、炭水化物と脂質によるカロリー補給、水分過剰を予防するには、静脈内輸液および心臓昇圧剤を投与し、生理学的安定を保つ。
初期症状の予防: 長期的マネジメント:高アンモニア血症を予防するためのタンパク質制限食、特別な調合乳の使用、経口窒素除去剤の使用。
二次合併症の予防: 呼吸器系と消化器系疾患のリスクを最小限に抑えるために、定期的予防接種、マルチビタミンとフッ化物の補給、および適切に消毒剤を使用すること。
経過観察: 代謝異常症の治療経験のある医師による定期 診察。
回避すべき薬剤/環境: バルプロ酸(Depakote)、長期的絶食や飢餓状態、ステロイドの静脈内投与、大量なタンパク質やアミノ酸の急速投与。
リスクのある血縁者における評価: リスクのある血縁者を発症前に診断することは、食事制限やほかの処置によって、高アンモニア血症の予防につながる。
遺伝カウンセリング
CPS1欠損症・ASS1欠損症・ASL欠損症・NAGS欠損症・ARG欠損症は常染色体劣性遺伝形式をとる。OTC欠損症はX連鎖の遺伝形式をとる。家系内の病的変異が事前に同定されていれば、患者の血縁者に 対する保因者 診断、またはリスクのある妊娠における出生前診断は、可能である。
疾患の定義
尿素サイクルは
- アルギニン、オルニチンおよびシトルリンの唯一の内因性供給源である;
- タンパク代謝による余剰窒素を除去する主要機構である;
- アデノシン一リン酸(AMP)のような含窒素代謝複合体を代謝する主要機構である;
- 尿素サイクルに働く酵素はリン酸産物経路(ASSおよびASL)にも関与する。
尿素サイクルは下記(図1)から構成される。
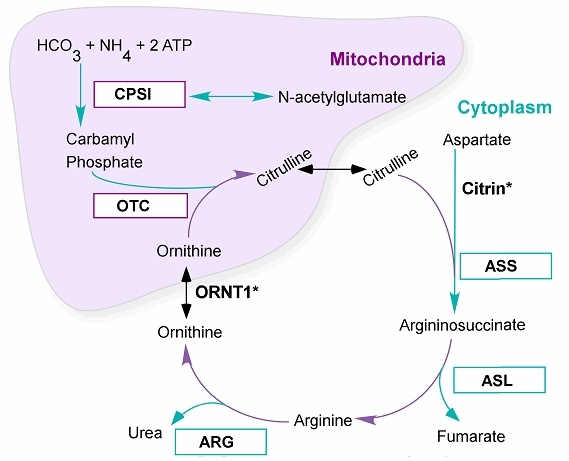
図1 尿素サイクル(鑑別診断の項を参照)
- 5つの触媒 酵素:
- CPS1:カルバミルリン酸シンターゼⅠ
- OTC:オルニチントランスカルバミラーゼ
- ASS1:アルギニノコハク酸シンターゼ
- ASL:アルギニノコハク酸リアーゼ
- ARG:アルギナーゼ
- 1つの 補因子:N-アセチルグルタミン酸シンターゼ(NAGS)
尿素サイクル異常は、尿素サイクルに働く6つの酵素(CPS1, OTC, ASS1, ASL, ARGおよびNAGS)のいずかに先天的欠損が原因である。
尿素サイクルには2つのトランスポーターも関与する(詳細は鑑別診断の項)。これらのトランスポーターに異常がある場合、高アンモニア血症が生じる。
- 2つのトランスポーター:
- オルニチントランスロカーゼ(ORNT1)
- シトリン
特定の尿素サイクル異常症(触媒作用を持つ酵素の異常)
NAGS欠損症 いくつかのNAGS欠損による罹患者の報告がある 。NAGSを欠損すると、CPS1は不活化状態のままであるため、NAGS欠損症の症状はCPS1欠損症に類似する[Caldovic et al 2003]。
カルバミルリン酸シンターゼI欠損症(CPS1欠損症) CPS1欠損症は尿素サイクル異常症において、最も重篤である。CPS1完全欠損の場合、新生児期に急速に高アンモニア血症を発症する。救命された小児は慢性的高アンモニア血症を繰り返すリスクを伴う。
オルニチントランスカルバミラーゼ欠損症(OTC欠損症) 男性におけるOTC欠損症はCPS1欠損症と同様に重篤である。女性保因者の約15%は生涯にわたって高アンモニア血症を発症し,その多くは長期的医療管理が必要とされる。最近では、明らかな高アンモニア血症のない女性保因者に も脳の実行機能障害 が確認されている。
I型シトルリン血症(ASS1欠損症) ASS1欠損症による高アンモニア血症は極めて重篤である。ASS1欠損症の患者は,一部の余剰窒素を尿素サイクルの中間生成物へ組み入れることができるため、ほかの尿素サイクル異常症より治療が若干容易である。
アルギニノコハク酸尿症(ASL欠損症) ASL欠損症は新生児期に急性高アンモニア血症を発症する。ASL欠損は、全ての余剰窒素が尿素サイクルに取り組まれた後に起きる。一部の患者は慢性肝腫大とトランスミラーゼ高値を生じる。肝生検では、腫大した肝細胞が見られ、時間が経過すると、線維 化 をきたすこともある。しかし、これらの原因は不明である。長期昏睡状態を経験しなかった患者でも、顕著な発達障害を合併すると報告されている[Summar 2001, Summar & Tuchman 2001, Nagamani et al 2012]。
アルギナーゼ欠損症(高アルギニン血症;ARG欠損症) ARG欠損症は通常急性高アンモニア血症を発症しない。しかし、一部の早期発症の患者はより重度な症状が見られる[Jain-Ghai et al 2011]。患者は進行性痙攣に加え,振戦・運動失調・舞踏病アテトーゼが見られ、成長にも影響される[Cederbaum et al 2004]。
尿素サイクル異常症の臨床所見
尿素サイクル異常症の重症度は、異常酵素の代謝経路における場所および酵素欠損の程度に左右される。
酵素の重度な欠損もしくは完全喪失 尿素サイクルにおける最初の4つの酵素(CPS1, OTC, ASS1およびASL)または 補因子(NAGS)の重度な欠損もしくは完全 喪失は、生後数日の間にアンモニアやほかの代謝前駆体の蓄積を引き起こす。
アンモニアを除去するための代替経路がないため、完全な尿素サイクル異常は急速なアンモニア蓄積および関連症状をもたらす。新生児の肝機能は未熟であるため、尿素サイクル異常が強く現れる。酵素完全欠損の患者は通常新生児期に完成した臨床像が見られる [Pearson et al 2001, Summar 2001, Summar & Tuchman 2001]。尿素サイクル異常の新生児は出生時に正常に見えるが、その後急速に脳浮腫や嗜眠、 哺乳障害、過換気または低換気、低体温症、発作、神経学的姿勢、および昏睡などの関連症状が現れる。
新生児は通常出生1~2日後に退院するため、尿素サイクル異常は自宅に戻ってから発症し、家族や主治医はすぐに気付かない場合がある。また、哺乳障害、低い深部体温 を伴う体温調節機能の喪失および傾眠のような高アンモニア血症による初期症状は小児において非特異的である[Summar 2001]。
症状は傾眠から無気力と昏睡に進行する。異常な姿勢と脳症の多くは中枢神経系の腫大と脳幹圧力の程度に影響される[Summar 2001]。高アンモニア血症の新生児の約50%は発作を伴うが、明白な臨床症状を認められない場合もある。頭蓋縫合が 閉鎖した患者は、アンモニア上昇が原因とする脳浮腫による急速な神経機能低下のリスクが高い。脳幹に影響を及ぼす高アンモニア血症に続き、過換気は高アンモニア血症の発症初期に良く見られ、その結果、呼吸器系アルカローシスになる。脳幹圧力の上昇によって、過換気と呼吸停止が起きる。
迅速な診断と治療によって、高アンモニア血症新生児の予後はここ数十年に劇的に改善された[Summar 2001, Summar & Tuchman 2001, Enns et al [2007] (full text), Summar et al [2008], Tuchman et al [2008], and Krivitzky et al [2009]]。しかし、高アンモニア血症は患者の知的発達 に影響する唯一の 要因ではない。特異的に、ASL欠損症の患者は高アンモニア血症による知的障害は見られる[Ah Mew et al 2013].
軽度(または部分的)尿素サイクル酵素欠損 において、アンモニアの蓄積は生涯にわたって、病気や手術、長期絶食、休暇中もしくは周産期などのストレスによって誘発され、血中アンモニア濃度の上昇をもたらす。軽度な患者において、高アンモニア血症は通常、それほど重篤ではなく、症状も新生児期に発症する尿素サイクル異常症の患者より軽度である。酵素部分欠損の患者において、最初に確認される臨床的エピソードは数ケ月または数年遅れることがある。臨床症状は特定の尿素サイクル異常症と多少異なるが、高アンモニア血症のほとんどは、食欲不振、嘔吐、嗜眠および行動異常に特徴を付けられる[Gardeitchik et al 2012]。睡眠障害、妄想、幻覚および精神症状が生じることもある。脳波(徐波
EEGパターンは高アンモニア血症の期間中に見られ、その後、MRIで特異的脳萎縮を認められる。
尿素サイクルの最後の酵素欠損(ARG) ARG欠損症による高アルギニン血症は比較的に軽度であるが、神経学的症状を伴う。また、新生児の高アンモニア血症の報告もある(アルギナーゼ異常症の項を参照 )。
尿素サイクル異常症の神経学的側面 アンモニアは 種々の 機序、主に脳浮腫 を介して脳損傷を引き起こす。脳浮腫におけるアンモニア、グルタミン酸およびグルタミンの具体的な働きはまだ研究中であるが、脳内のアクアポリン系および、水とカリウムの恒常性に影響すると考えられている[Lichter-Konecki 2008, Lichter-Konecki et al 2008, Albrecht et al 2010]。
乳幼児期 の急性高アンモニア血症による損傷は、低酸素虚血性発作または脳卒中に類似する。一般的に、ラクナ梗塞および白質破壊 がよく見られる。
慢性高アンモニア血症はイオン濃度や神経伝達物質、代謝物の輸送、ミトコンドリア機能およびα‐ケトグルタル酸/グルタミン酸/グルタミン比における異常を引き起こす。
痙攣発作は急性高アンモニア血症ではよく見られ、脳損傷から生じ る。最近の知見によれば、無症候性の発作は急性高アンモニア血症に一般的であり、これらによる脳代謝に及ぼす影響 に注意すべきである。(注: CPS1機能を影響するバルプロ酸は避けるべきである。マネジメント、回避すべき薬剤/環境の項を参照 )。
新しい神経画像技術は非侵襲的に、神経損傷のタイミング、程度、回復可能性と推定機序に関する情報を提示し、臨床的および神経認知転帰を予測するための補助材料として使用できる[Gropman 2010, Bireley et al 2012, Gunz et al 2013]。
一般的な神経画像の限界:
- 肉眼で見える程度の損傷しか検出できない。通常、この場合では症状はすでに現れている。
- MRI所見は臨床的変化に遅れることがある。
磁気共鳴分光法(MRS)、拡散テンソル画像(DTI)および機能的磁気共鳴画像(fMRI)のような高度な画像解析は、損傷のパターンや種類に関する追加情報の詳細を提供し、尿素サイクル異常症に見られる様々な神経学的問題を明らかにする。
- MRS OTC欠損症において、グルタミンの上昇およびミオイノシトールの減少のような、高アンモニア血症に起因する脳損傷の生化学的マーカーは1H MRS上で定量的に測定することができる。
- DTI
- 尿素サイクル異常症において、DTIは通常、帯状束に影響を与える白質損傷のパターンを示す。帯状束は作業記憶力と注意力に関与する経路の基礎となる主要な線維束である。
- アルギナーゼ欠損症において、DTIはさらに低下した線維密度を示す。その所見は、本症に見られる痙攣性両側麻痺による脳損傷の皮質脊髄路における好発部位を反映する。
- fMRI 知的発達が正常とされる遅発性OTC欠損症患者において、その多くは作業記憶力と注意力が必要な仕事をする際に、fMRIでは変化した神経回路が見られる。
歴史的に、高アンモニア血症新生児の予後は悪いと考えられていた[Brusilow 1995]。しかし、新しいプロトコルで治療を受けた患者を対象としたNIH主催の縦断的研究からの最近のデータでは、患者IQはそれほど深刻ではない範囲にあった。
表1. 尿素サイクル異常症の3~16歳児の認知と適応
| 年齢群 | 3~5歳 | 6~16歳 | |||
| 発症年齢 | 新生児期1 (n=5) |
遅発性2 (n=7) |
新生児期1 (n=8) |
遅発性2 (n=39) |
|
| WASI/WPPSI-III3複合スコア4(SD) | |||||
| 評価 | ・言語性IQ | 81.3 (16.6) | 101.7 (24.4) | 72.9 (14.3) | 94.3 (21.7) |
| ・実行性IQ | 77.7 (15.0) | 95.6 (17.4) | 74.4 (11.7) | 89.5 (20.4) | |
| ・総合性IQ | 77.7 (16.3) | 99.6 (22.6) | 71.4 (12.8) | 94.1 (22.0) | |
| ABAS-II5一般的な適応複合4(SD) | |||||
| 73.2 (31.2) | 91.4 (23.6) | 66.0 (17.9) | 84.4 (21.6) | ||
- 生後1ヵ月以内に発症
- 生後1ヵ月以降の発症もしくは家族歴による診断
- Wechsler Abbreviated Scales of Intelligence / Wechsler Preschool and Primary Scale of Intelligence, 3rd Edition
- 認知および適応における群別に臨床的有意差
- Adaptive Behavior Assessment System, 2nd Edition
高アンモニア血症は尿素サイクル異常症における脳損傷の主な原因と考えられているが、一酸化窒素産生系への悪影響なども関与する可能性がある[Nagamani et al 2012]。その例として 、CPS1欠損症やOTC欠損症の新生児の高アンモニア血症はASS欠損症やASL欠損症より重度であるにもかかわらず、知的発達は同程度である[Ah Mew et al 2013]。
尿素サイクル異常症の確定診断
症状のある患者にお ける本症の診断は、臨床的、生化学的および分子遺伝学的データに基づく。
家族歴
神経学的徴候と本症を示唆する症状を持つ血縁者(特に子ども)に注意し、3世代の家族歴を聴取すべきである。血縁者に関連する情報は、それらの血縁者を直接に検査するか、もしくは生化学的検査、分子遺伝学的検査および検死結果を含む医療記録を参照することによって、入手する。X連鎖遺伝形式の家族歴はOTC欠損症を示唆する。
身体検査 身体検査では、6つの尿素サイクル異常症の特徴を見られなくても、結節性裂毛症はASL欠損症、下肢の進行性痙縮はアルギナーゼ欠損症を示唆する所見である。
検査
図2の手順は高アンモニア血症新生児の診断の参考となる。血漿アンモニア濃度が150µmol/Lを超え,アニオンギャップ・血中グルコース濃度が正常な場合,UCDを強く疑う[Summar & Tuchman 2001]。
図2.高アンモニア血症の新生児における診断手順
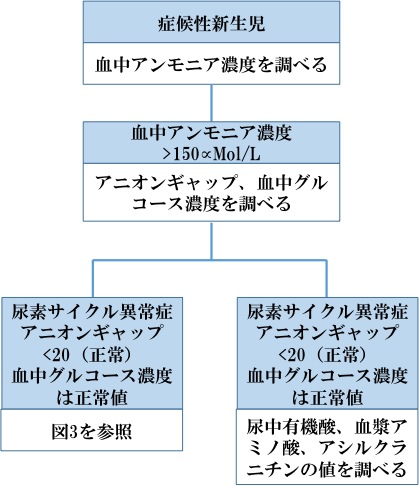
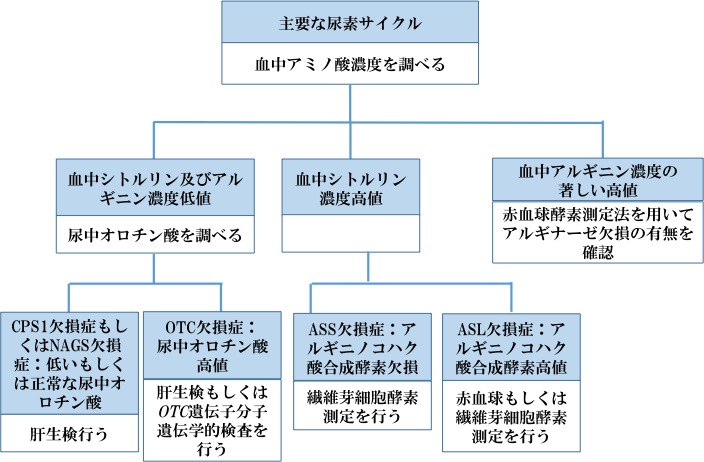
図3は特定の尿素サイクル異常症を鑑別するための推奨診断検査である。
血清アンモニア濃度の上昇は、ほとんどの尿素サイクル異常症において、最初に確認される異常値である。
血漿アミノ酸定量分析 は、 暫定診断に至るために使用される。(肝臓が完全に成熟していないため、新生児はたいてい小児や成人の患者と異なったアミノ酸濃度を呈する。)
- シトルリンは尿素サイクル上流酵素(OTC及びCPS1)の生成物であり、下流酵素(ASS1, ASL, ARG)の基質でもあるため、血漿シトルリン濃度は、欠損酵素は尿素サイクル経路の上流もしくは下流の鑑別に有用である。
- 血漿シトルリンは,新生児発症型CPS1欠損症とOTC欠損症においては皆無または極微量が見られ,遅発型では低値から低正常値となる。
- ASS欠損症において、血漿シトルリン濃度が10倍に上昇する。
- ASL欠損症において、シトルリン濃度の上昇(~2-5倍)はより軽度であるが、尿中と血中アルギニノコハク酸(ASA)高値を伴う。ASAは通常尿中と血中では検出されない[Summar 2001, Summar & Tuchman 2001]。
- 血漿アルギニン濃度は、ARG欠損症以外のすべての尿素サイクル異常症において、低値である。ARG欠損症においては、血漿アルギニン濃度は5~7倍の上昇が見られ、ARG部分欠損においては、正常値の場合もある。
注:血中のグルタミン、アラニンとアスパラギン濃度は老廃窒素の蓄積を示し,濃度上昇がよく見られる。
尿中オロト酸の測定はCPSI欠損症とOTC欠損症の鑑別に利用される。尿中オロト酸はOTC欠損症では顕著に上昇し,CPSI欠損症では正常値または低値である。
注:尿中オロト酸排泄はアルギニン血症(ARG欠損症)とシトルリン血症I型(ASS欠損症)においても上昇することがある.
分子遺伝学的検査 は6つの尿素サイクル異常症の診断、保因者検査および出生前診断に利用される(表2を参照)。分子遺伝学的検査は酵素活性測定に代わって、確定診断の検査となっている。
表2
尿素サイクル異常症:分子遺伝学的情報
| 疾患名 | 遺伝子 | タンパク名 | OMIMでのリンク |
|---|---|---|---|
| カルバミルリン酸シンターゼI 欠損症 | CPS1 | カルバミルリン酸シンターゼ | |
| オルニチントランスカルバミラーゼ欠損症 | OTC | オルニチンカルバモイルトランスフェラーゼ | |
| ASS欠損症 (シトルリン血症1型) |
ASS1 | アルギニノコハク酸シンターゼ | |
| ASL欠損症 (アルギニノコハク酸尿症) |
ASL | アルギニノコハク酸リアーゼ | |
| アルギナーゼ欠損症 | ARG1 | アルギナーゼ-1 | |
| NAGS欠損症 | NAGS | N-アセチルグルタミン酸シンターゼ |
酵素活性 分子学的検査から有用な情報を得られなかった場合、下記の疾患は酵素活性測定 によって診断できる。
- CPS1欠損症、OTC欠損症もしくはNAGS欠損症:肝生検
- ARG欠損症:赤血球
- ASS1欠損症およびASL欠損症: 線維芽細胞
新生児スクリーニング
項目が拡大した最近のタンデム質量分析法 による 新生児スクリーニングパネルは、ASS1欠損症、ASL欠損症およびアルギナーゼ欠損症による濃度異常を検出できる。しかしながら、これらの疾患におけるスクリーニング検査の感度と特異度は不明である。一部の新生児スクリーニング検査プログラムは、OTC欠損症および上流尿素サイクル異常症の適用を検討している。
尿素サイクル異常症の新生児スクリーニング検査に関する注意事項:
- 現在、CPS1欠損症、OTC欠損症およびNAGS欠損症を確実に検出することができない。
- 新生児スクリーニング検査は高アルギニン血症(例えば、アルギナーゼ欠損症)を検出できるものの、すべての症例を確実に検出することは期待できない。
- 新生児スクリーニングによって検出できる尿素サイクル異常症においても、検査結果を得られる前に発症することが多いため、医療従事者側の高いレベルの臨床的判断が必要となる。
鑑別診断
ほかに、肝機能障害を伴う多くの疾患においても高アンモニア血症が発症し,その症状は尿素サイクル異常症と類似する。最も頻度が高くかつ重要な鑑別疾患としては,肝臓のウイルス感染と(肝硬変による)血管短絡がある。
肝臓および胆道疾患
- 単純ヘルペスウイルス感染
- 肝臓血管短絡
- 胆道閉鎖
- 急性肝不全
薬剤
- バルプロ酸
- シクロホスファミド
- 5-ペンタン酸
先天性代謝異常
- 有機酸血症(例えば、プロピオン酸血症およびメチルマロン酸血症)(メチルマロン酸血症の章を参照)
- チロシン血症1型
- ガラクトース血症
- ミトコンドリア異常症(ミトコンドリア異常症の章を参照)
- 脂肪酸酸化障害(MCAD欠損症の章を参照)
- シト リン欠損症(注を参照)。シト リン欠損症の3つの表現型は、シトルリン血症II型(CTLN2)、成長障害や脂質異常症(FTTDCD)および、新生児肝内胆汁うっ滞を引き起こすシト リン欠損症(NICCD)である。
- 高オルニチン血症-高アンモニア血症-ホモシトルリン尿症(HHH)症候群(注を参照)
- 炭酸脱水酵素VA欠損症
注:尿素サイクル異常症コンソーシアム(希少疾患臨床研究ネットワーク[RDCRN]コンソーシアムの1つ)を含む一部の専門家は、シトルリン欠損症とHHH症候群を尿素サイクルにおけるトランスポーター異常として考えている。よって、尿素サイクル異常症は8つの疾患となる(6つの酵素欠損症と2つとトランスポーター異常)。
頻度
尿素サイクル異常症の頻度は少なくとも35,000出生あたり1人と推定される。部分的(酵素活性)欠損はさらに多いとも考えられる.
表3 尿素サイクル異常症の推定頻度
| 尿素サイクル異常症 | 推定頻度 |
|---|---|
| NAGS欠損症 | >1 :2,000,000 |
| CPS1欠損症 | >1:1,300,000 |
| OTC欠損症 | >1:56,500 |
| ASS1欠損症 | >1:250,000 |
| ASL欠損症 | >1:218,750 |
| ARG欠損症 | >1:950,000 |
遺伝カウンセリング
「遺伝カウンセリングは個人や家族に対して遺伝性疾患の本質,遺伝,健康上の影響などの情報を提供し,彼らが医療上あるいは個人的な決断を下すのを援助するプロセスである.以下の項目では遺伝的なリスク評価や家族の遺伝学的状況を明らかにするための家族歴の評価,遺伝学的検査について論じる.この項は個々の当事者が直面しうる個人的あるいは文化的、倫理的な問題に言及しようと意図するものではないし,遺伝専門家へのコンサルトの代用となるものでもない.」
遺伝形式
CPSI欠損症・ASS欠損症・ASL欠損症・NAGS欠損症・ARG欠損症は常染色体劣性の遺伝形式、OTC欠損症はX連鎖の遺伝形式をとる。
血縁者のリスク-常染色体劣性遺伝形式
発端者の両親
- 罹患者の両親は必然的にヘテロ接合体であり,1つの変異アレルを持つ。
- ヘテロ接合体(保因者)は無症候である。
発端者の同胞
- 罹患者の同胞は25%の確率で罹患者,50%の確率で無症候性保因者となり,25%の確率で罹患者 でも保因者でも ない。
- リスクのある同胞が非罹患の場合,保因者 である確率は2/3である。
- ヘテロ接合体(保因者)は無症候である。
発端者の子
- 罹患者の子は必然的にヘテロ接合体(保因者)であり,1つの変異アレルを持つ。
血縁者のリスク-X連鎖遺伝形式
男性発端者の両親
- 罹患男性の父親は非罹患で,また保因者でもない。
- 2人以上の罹患者が家族にいる場合,罹患者の母親は絶対保因者である。
- 罹患した子ども を1人以上 もち、且つほかに罹患している血縁者がおらず、その母親の白血球DNAにOTC病的変異を検出できない場合、母親は生殖配列細胞モザイクである。生殖配列細胞モザイクによるOTC欠損症は報告されている[Bowling et al 1999]。しかし、OTC欠損症における生殖配列細胞モザイクの頻度は分かっていないため、一般的な生殖配列細胞モザイクの頻度3~4%を用いる。
- 家族に罹患男性が1名しかいない場合、その母親が保因者もしくは、その罹患者は新規突然変異と考えられる。新規突然変異の場合、その罹患者の母親は保因者ではない。Haldaneの法則(例えば、2/3の症例は両親から受け継ぎ、1/3の症例は新規突然変異である)はX連鎖致死性疾患に用いられる。この法則は、生殖配列細胞の変異率は性別に関わらず、同等に起きると推測する。しかし、Tuchman et al [1995]らの研究は、生殖配列細胞におけるOTC遺伝子変異率は女性(80%)のほうが男性(7%)より圧倒的に高いと結論 付けた。また、罹患者が1人しかいない家系において、罹患者は男性の場合、両親から変異アレルを受け継いだ症例の割合は9/10(もしくはもっと高い)、罹患者は女性の場合、その割合は約2/10である。注:これらのデータは、サンプルサイズがより大きい研究では再現されていない。
女性発端者の両親
- OTC欠損症の女性は新生突然変異による場合と,両親のいずれかからOTC変異を受け継いだ場合の両方が存在する。
- 家系図分析により女性発端者が家族内唯一の罹患者と判明した場合,両親に分子遺伝学的検査を勧めるのは妥当である。
発端者の同胞 発端者同胞のリスクはその両親の遺伝学的情報に基づく。
- 母親が保因者である場合,妊娠する度に、50%の確率で子に変異アレルを伝える。
両親のいずれかから変異アレルを受け継いだ場合、男性は発症するが、女性は発症するもしくは発症しない、両方の可能性がある(女性発端者の子の項を参照)。
- 女性発端者の父親がOTC変異アレルを持っている場合、その発端者の女性同胞は全員同じ変異アレルを受け継ぐが、男性同胞は変異アレルを受け継がない。
- 発端者は 孤発例(例えば、家系内の唯一の発症例)であり、かつ発端者母親の白血球DNAにOTC変異アレルを検出されなければ、発端者同胞のリスクは低い。しかし、母親の生殖系列モザイクの可能性が残るため、一般集団よりリスクが高い。
男性発端者の子
- 以前、OTC欠損症の男性は生殖可能な時期まで生存出来ない、もしくは衰弱のため生殖能力を持たないと考えられていた。しかし、出生時の発症前治療や肝臓移植後の救援療法の改善によって、男性患者の生殖は可能となった。
- 遅発性または軽症の男性患者において、生存および生殖は可能である。その場合、OTC変異アレルは女児全員へ伝わり,男児には伝わらない。女性における表現型の発現範囲は様々である。
女性発端者の子
- OTC病的変異を有する女性は妊娠するたびに、50%の確率で変異アレルを子へ伝える。
- 変異を受け継いだ男児は罹患する。変異を受け継いだ女児は関連症状を発症するもしく発症しない両方の可能性がある(ほかの血縁者の項を参照)。
ほかの血縁者 発端者の母方叔母(伯母)はOTC病的変異を持っている可能性があり、彼女(達)の子は性別によって、変異アレルを受け継ぎ、発症するリスクがある。
保因者診断
分子遺伝学的検査 家系内におけるOTC病的変異が同定されていれば、分子遺伝学的検査による保因者検査は可能である。
家系内におけるOTC病的変異が同定されていなければ、リスクのある女性血縁者の保因者情報を得るために連鎖解析は有用である。
注:分子遺伝学的検査は、新規突然変異によるOTC病的変異の発端者を確認することができる。検査から得た情報は、ほかの血縁者の遺伝学的リスクを決定するには有用である。
アロプリノール負荷 家系内おけるOTC病的変異が同定できない場合、アロプリノール負荷試験(OTC欠損症の章の中に、診断の項を参照)は女性血縁者がヘテロ接合体であるかどうかを決定するには有用である。
遺伝カウンセリングに関連した問題
早期な診断と治療を目的とし、リスクのある血縁者を評価するための情報を得るには、マネジメントとリスクのある血縁者における評価の項を参照すること。
OTC欠損症
- 高アンモニア血症と神経学的障害を認められた女性保因者の多くは、肝臓内の 偏ったX染色体不活性化が原因であると推測されている[Yorifuji et al 1998]。高アンモニア血症のリスクは妊娠中と分娩後に特に高い。保因者において、バルプロ酸や副腎皮質ステロイドなどの薬剤は高アンモニア血症を誘発することがある。
- 早期発症の重篤なOTC欠損症男性の家系に比較して、遅発性家系における女性保因者での発症リスクはるかに低い[McCullough et al 2000]。
- 保因者女性は高アンモニア血症がなくても、認知機能試験に異常値がでることがある[Gyato et al 2004]。
家族計画
- 妊娠前に、遺伝学的リスクや保因者分類を決定し、出生前検査の可能性を議論するのは望ましい。
- 若い成人(罹患者、保因者、もしくは保因者や罹患者になるリスクのある血縁者)に遺伝カウンセリング(子の潜在的リスクと生殖に関する選択肢を含む)を提供するのは適切である。
DNAバンク
」DNAバンクは主に白血球から調製したDNAを将来の使用のために保存しておくものである。検査法や遺伝子,変異あるいは疾患に対するわれわれの理解が進歩するため,罹患者のDNAを保存することは考慮すべきかもしれない。
出生前診断と着床前遺伝子診断
分子遺伝学的検査
家系内罹患者における病的変異が同定されていれば、リスクのある妊娠における出生前検査、または着床前遺伝子診断は選択肢として可能である。
家系内における病的変異が分子遺伝学的検査で同定されていなければ、連鎖解析を考慮する。
リソース
- 先天代謝異常症患者登録制度
http://www.jasmin-mcbank.com/ - 全国尿素サイクル異常症患者と家族の会
http://ameblo.jp/nucda/ - シトルリン血症の会
http://www.h6.dion.ne.jp/~goldgene/index.html - 難病情報センター
http://www.nanbyou.or.jp/entry/4732
臨床的マネジメント
初診後の評価
尿素サイクル異常症患者の疾患の範囲および治療のニーズを確立するために、下記の評価方法 が推奨されている。
- 神経機能全般に対する神経学的評価
- 画像研究で検出できるような 脳損傷の程度を評価 するためのMRI
- 治療効果を評価追跡するための血清アンモニア濃度と血漿アミノ酸分析
- 肝臓全体の状態を評価するための,凝固試験を含む肝機能検査
- 臨床遺伝相談
尿素サイクル異常症患者おける疾患の程度は、神経症状発症の速さ、脳 への影響の度合および血清アンモニア濃度の範囲によって推測することができる。
症状に対する治療
急性症状に対する治療
診断 が確定した後の治療は,それぞれの尿素サイクル異常症に合わせて行うべきである[Summar 2001 (full text), Summar & Tuchman 2001 (full text)]。新生児に対する治療は専門施設の代謝専門医と協力しチーム体制で行うべきである。急性期の治療は以下のものが主流である。
余剰窒素を迂回代謝経路により排出させる薬理学的治療法(表4を参照)
- 窒素捕捉剤療法(フェニル酢酸ナトリウムと安息香酸ナトリウム)は緊急処置時に静脈内投与、長期管理時に経口投与をする。
- 欠損 している尿素サイクル中間体は診断に応じて 補充する必要があり、これらにはアルギニン(静脈内注入)、および/またはシトルリン(経口製剤)を含む。
注:末梢静脈からのアルギニン塩酸の 投与を繰り返すと 重度な皮膚壊死が生じるため、継続的注入の場合、中心静脈注射が必要である。
- フェニル酢酸ナトリウムと安息香酸ナトリウムは、末梢静脈注射はできるが、中心静脈が望ましい。
- NAGS欠損症患者とCPS1欠損症患者の一部は、N-アセチルグルタミン酸補充として アナログ分の子カルバミルグルタミン酸(Carbaglu®) を投与することで、臨床症状が改善され、NAGS欠損症をにおいて、ほぼ治癒することができる。この化合物は米国で利用が可能で、初発症状から明確な診断のできない患者の初期治療計画にも追加すべきである。成人及び小児の場合、2~4回に分けて、100mg/kg/日~250mg/kg/日を投与する。現在唯一利用できる剤形は経口剤であるが、緊急時に経鼻胃/空腸チューブによる投与が必要である。
血漿アンモニア濃度を正常な生理的レベルまで 迅速 に降下させる 血中アンモニア濃度の上昇による毒性を考えると、確定診断がなくても、早急に正常値までの降下 が必要である。血漿アンモニア濃度を迅速に下降させるための最善策は透析である。ほかの方法は患者の状態と医療環境によるが、一般的には、個々の患者にとって最善な選択肢は、治療チームが最も熟知し、且つ最も早く提供できる方法である。
- 最も迅速な方法は血液ポンプによる透析であり,血液透析装置を稼動させるために 体外型人工肺(ECMO)のポンプを使用する。
- 他の方法には,血液濾過(動脈‐静脈,静脈‐静脈のどちらも)と血液透析が挙げられる.これらは体外 型人工肺(ECMO)による透析よりも備えられてい る可能性が高い。注:腹膜透析は急性高アンモニア血症に対する効果が比較的に 小さいため、一般的には推奨しない。
- 血漿アンモニア濃度が150μmol/L以下に下がれば透析を中止することが多いが、その判断基準は代謝疾患専門医による臨床的評価により様々である。高アンモニア血症を再発し、更なる透析が必要となること もしばしばである。
表4 静脈内アンモニア除去治療の手順
| 疾患 | 患者 体重 |
輸液成分 | 用量 | 投与 | |||
|---|---|---|---|---|---|---|---|
| フェニル酢酸ナトリウム & 安息香酸ナトリウム1,2 |
アルギニン塩酸注入 10%2 |
フェニル酢酸ナトリウム | 安息香酸 ナトリウム |
アルギニン塩酸 | |||
| CPS & OTC | 0-20 kg | 2.5 mL/kg | 2.0 mL/kg | 250 mg/kg | 250 mg/kg | 200 mg/kg | 負荷量3 維持量4 |
| ASS & ASL | <2.5 mL/kg | <6.0 mL/kg | <250 mg/kg | <250 mg/kg | <600 mg/kg | ||
| CPS & OTC | >20 kg | 55 mL/m2 | 2.0 mL/kg | 5.5 g/m2 | 5.5 g/m2 | <4000 mg/m2 | |
| ASS & ASL | 55 mL/m2 | 6.0 mL/kg | 5.5 g/m2 | 5.5 g/m2 | 12000 mg/m2 | ||
- 投与前に、フェニル酢酸ナトリウム/安息香酸ナトリウムを滅菌ブドウ糖で10%に希釈しなければならない。
- 希釈前
- >90-120分
- >24時間、アルギニン注射は150mg/kg/hを超えない
炭水化物、脂肪および必須アミノ酸によるカロリー代謝 透析または血液濾過を受けている患者において、経腸栄養の過剰投与を避けながら、異化状態を解決するために、以下の栄養サポートを導入する必要がある。
- 必須アミノ酸が欠乏すると、タンパク質異化および窒素放出が生じるため、完全なタンパク制限は12~24時間を超えてはならない。頻繁に(多くは毎日)血漿アミノ酸濃度の定量的評価は、過剰な窒素を供給することなく、必須アミノ酸を適切なレベルに維持することによって、最適な栄養管理が可能である。急性症状の患者は必須アミノ酸欠乏症になっているか、もしくは急速にその状態に陥るかであるため、必須アミノ酸を適切なレベルに保つことは異化状態を反転させるには必須である。
- 経腸栄養 が望ましい。しかし、患者の臨床 状態が不安定で、経腸栄養が不可能な場合、静注(完全非経口栄養) が選択肢となる。経腸栄養の不耐性による更なる必須アミノ酸の欠乏は避けなければならない。
- 入院時の経鼻胃/空腸チューブを設置すれば、必須アミノ酸、乳児用製剤およびカルバミルグルタミン酸(N-アセチルグルタミン酸誘導体)のような 補因子の輸液を投与することができる。
- 低用量のインスリンの継続的注入を行いながらの 適切量の炭水化物含有液の継続的注入 を含む、異化作用に対抗する治療法は多数ある。しかし、本症の患者はグルコースまたはインスリンに対する感受性が高いため、注意が必要である。
神経学的障害のリスクの低減
- 経静脈投与(10%デキストリンとその4分の1量の生理食塩水)による生理学的安定の維持
- 必要に応じて、過剰輸液を回避しながらの心昇圧剤を投与
- 急性症状によく見られる無症候性発作は、治療が可能である。しかし、各治療法が脳代謝における影響は次のように考えられている。
- 深沈静(例えば、ペントバルビタール誘発性昏睡)は、脳代謝需要を減らすために使用されているが、その有用性は証明されていない。
- 高アンモニア血症における神経保護を目的とする低体温の有用性は、まだ研究中である。
注:長期的高アンモニア血症性昏睡および重度な神経学的障害の患者において、上記のすべての治療法における相対的リスク対ベネフィトについて、考慮すべきである。
臨床症状の長期治療
窒素負荷の減少を目的とするタンパク質制限。
- 通常の乳児は体重に対し、1.2~2gのタンパク質/kgが必要である。一般的に、必要とされるタンパク質の半分は必須アミノ酸の提供源となり、残りの半分はタンパク質として働く。
- 青年および成人は、 小児に比較すると、必要とするタンパク質の量は少ない。
- タンパク質制限は治療の中心であるが、異化を引き起こす極端の低タンパク食は、高タンパク負荷と同様に悪い影響を与える。アミノ酸測定による細心な観察 が必要である。
窒素除去剤の使用 は窒素処理の代替ルートを提供する。
- フェニル酪酸は腸内 でフェニル酢酸ナトリウムに変換される。フェニル酢酸ナトリウムはさらに肝臓 でグルタミン酸と結合し、フェニルアセチルグルタミンを作る。フェニルアセチルグルタミンは腎臓から排泄される。
フェニル酪酸はフェニル酢酸ナトリウムとグリセロールフェニル酪酸の両方から得られるが、グリセロールフェニル酪酸の ほうが味が良いため、経口摂取の患者に好まれる [Diaz et al 2013, Smith et al 2013]。
- 安息香酸ナトリウムは、肝臓 でグリシンと結合し、馬尿酸を作る。馬尿酸は腎臓から排泄される。
シトルリンやアルギニンの迅速な補充 は欠損酵素が上流または下流にあるかによって、必要となる場合がある。尿素サイクル上流の酵素欠損症は、最初に200mg/kgのアルギニンを静注し(表4を参照)、血漿アルギニン濃度を75パーセンタイルに維持できるように調整する。注:これらの化合物は主に腸から排出されるため、アルギニンまたはシトルリンのいずれかは肝移植後でも必要とされる場合がある。
- シトルリン(尿素サイクル上流の異常に対し)は、アスパラギン酸を取り込むことによって、 窒素分子をひとつ余分に尿素サイクルに取り込むとの利点がある。
- アルギニンの過剰投与による血漿アルギニン濃度が非常に高い場合、長期的な神経学的問題を引き起こすと考えられている。これらの神経学的問題はARG欠損症に見られるものと類似する。
カルバミルグルタミン酸 (Carbaglu®) はNAGS欠損症および治療反応性のあるCPS1欠損症の患者において、CPS1酵素を正常もしくは正常に近い機能まで改善できる。
肝移植
- 重篤な尿素サイクル異常症患者において、肝移植は更なる高アンモニア血症を予防するための最も有効な方法である。肝移植の意思決定を影響する要因には、神経損傷および肝障害(ASL欠損症において)の程度を含む[Perito et al 2014]。
- ASS欠損症もしくはASL欠損症において、肝移植後に、高アンモニア血症およびタンパク質の摂取の許容性が改善される。しかし、ASSおよびASL酵素は遍在的に発現するため、現時点で一酸化窒素生成系のようなほかの経路との相互作用から、ほかに長期的な生理学的問題についてはまだ不明である。
初期症状の予防
高アンモニア血症を予防するには、タンパク制限食、特別な経口調合乳の使用と、窒素除去薬剤を経口投与と同時に必須アミノ酸を注意深く補充することが中心となる(臨床症状の治療の項を参照)。
二次合併症の予防
過度なタンパク/アミノ酸制限は、アンモニアの再蓄積および成長不良を引き起こす主な原因である[著者の個人的な意見]。胃瘻管栄養は、タンパクの摂取量を自己制限する患者における栄養不良を回避するために役立つ。
その他
- ホームケアを通じて呼吸器や消化器疾患のリスクを最小限にする
- 定期的に予防接種を受ける
- マルチビタミンやフッ化物の補給
- 解熱薬の適正使用(アセ トアミノフェンに比べ、イブプロフェンが望ましい)
サーベイランス
以下の措置は適切である。
- すべての患者に対し、尿素サイクル異常症に経験のある医師による定期観察:
- 来院回数と定期観察の頻度は患者の年齢や重症度によって決める。
- 治療および栄養補給の有効性を判断するために、すべての患者における長期的発達評価を考慮すべきである。
- 著しい内出血を伴う大規模な骨折もしくはほかの外傷の後に、高アンモニア血症のモニタリングを行う。
回避すべき物質と環境
以下は回避または使用禁忌とされるべきである。
- 酵素CPS1機能に影響するおそれのあるバルプロ酸(Depakote®)
- 長期にわたる空腹や飢餓
- ステロイドの静脈内投与
- タンパク質やアミノ酸の大量摂取
- 過度なタンパク質制限
- 病気
- 骨折や重度な挫傷
- 脱水
- すべての生理学的もしくは心理学的ストレス(例えば、誕生日、パーティ、結婚式、試験)
リスクのある血縁者における評価
罹患者の血縁者に対し、できるだけ早期に診断をするために(症状が現れる前に)、食事療法などの措置による迅速な介入によって、高アンモニア血症の予防に繋がるとのメリットから、罹患者の血縁者に評価することは適切である。
- 家系内における病的変異が分かった場合、分子遺伝学的検査はリスクのある血縁者の診断に利用できる。
- 家系内の病的変異が分からなかった場合、適切な生化学的検査はリスクのある血縁者の診断に利用できる。
遺伝カウンセリングを目的とするリスクのある血縁者に関する問題は遺伝カウンセリングの項を参照する。
研究中の治療法
NIHが資金を提供する尿素サイクル異常症コンソーシアムは、専門家による診断、尿素サイクル異常症の治療および臨床的・治療的研究を行っている。
広範囲な疾患の臨床試験に関する情報はClinicalTrials.govを参照する。
その他
マンニトールは尿素サイクル異常症関連脳浮腫の治療に効果がないと考えられている。
更新履歴
- Gene Review著者:Marshall L Summar, MD
日本語訳者:山口悠(信州大学医学部医学科),櫻井晃洋(信州大学医学部附属病院遺伝子診療部)
GeneReview最終更新日:2005.8.11 日本語訳最終更新日:2007.7.11 -
GeneReviews著者: Nicholas Ah Mew, MD, Brendan C Lanpher, MD, Andrea Gropman, MD, Kimberly A Chapman, MD, PhD, Kara L Simpson, MS, CGC, Urea Cycle Disorders Consortium, and Marshall L Summar, MD.
日本語訳者: 江田 肖(瀬戸病院遺伝診療科),櫻井晃洋(札幌医科大学附属病院遺伝子診療室)
GeneReviews最終更新日: 2015.4.9. 終更新日: 2016.10.16. (in present)