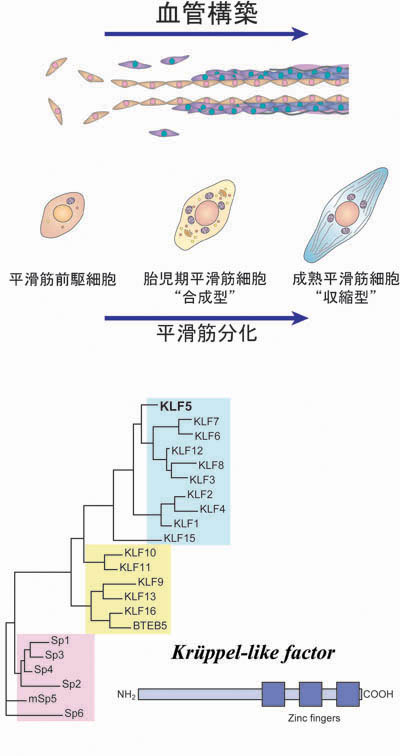
①心血管病におけるKLF5 私たちは血管平滑筋細胞が血管病変を形作るのに重要なことに着目し、平滑筋細胞の機能を司る分子メカニズムの研究を続けてきました。平滑筋細胞は、骨格筋細胞や心筋細胞とは異なり、いったん高度に分化した後も、様々な刺激に応じて性質(形質)を変えます。これを形質変換(phenotypic modulation)といいますが、血管病のでき方を理解するためには平滑筋細胞の形質変換、また形質変換とは裏腹の変化である分化の分子メカニズムを知ることが大事です。
平滑筋形質変換とKLFファミリー転写因子
平滑筋細胞が形質変換を起こしたときに発現が増える胎児型平滑筋ミオシン重鎖遺伝子SMembの解析から(Biochem Biophys Res Commun. 1997;239:598-605)、この遺伝子の発現を制御する転写因子として同定したのがKLF5/BTEB2です(Circ Res. 1999;85:182-191)。KLF5はKrüppel型転写因子ファミリー(KLF)と呼ばれる転写因子群の一つです。KLFは特徴的な構造を持った転写因子群であり、個体の発生、細胞分化あるいは癌を含む病態の形成に重要であることが知られています。KLF5は正常血管ではほとんど発現がみられませんが、予想したとおり、血管病では発現誘導されます。また、その発現がヒトの血管病と関連することも分かっています。
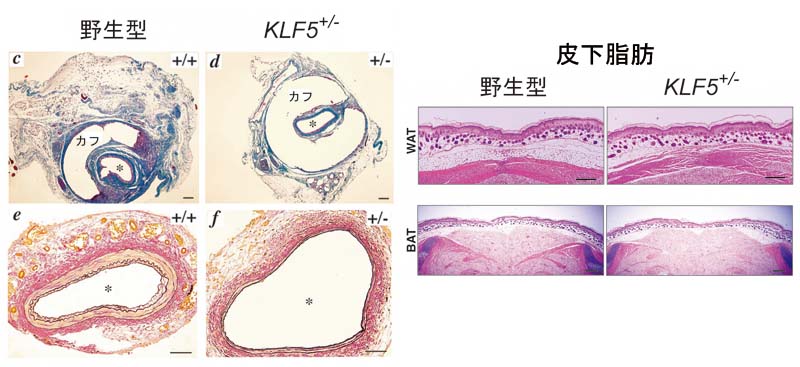
KLF5の機能をさらに明らかにするために、ノックアウトマウスを作りました(Nat Med. 2002;8:856-863)。一対のKLF5遺伝子の両方を欠いたホモ接合体ノックアウトマウスは胎児期に死んでしまうため、2本のKLF5遺伝子のうちの一つが残っているヘテロ接合体ノックアウトマウスを用いて解析を行いました。何もしない状態ではヘテロ接合体ノックアウトマウスの血管に著明な異常は認められませんでしたが、いったん血管に傷をつけると、その結果生じる病変(新生内膜)がほとんどできないことが分かりました。このことから、KLF5が傷害に対する血管の反応と病変形成に必須な鍵分子であることが分かります。KLF5は血管の組織構築を改変するのに重要なPDGF-Aなどのパラクライン因子の発現を制御するとともに、平滑筋形質変換を制御して病変形成を調節していると考えられます(Circ Res. 2005;97:1132-1141)。KLF5ヘテロ接合体ノックアウトマウスでは、各種の負荷による心臓の肥大や線維化も減弱しており、血管だけでなく心臓の組織構築の改変(リモデリング)に重要であることが明らかとなっています。
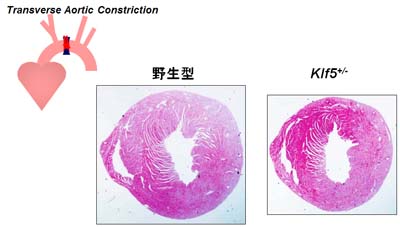
TACによる心肥大
KLF5ヘテロノックアウトマウス(Klf5+/-)の心臓に圧負荷を与えると心臓肥大の反応が著明に抑制されます。心臓肥大では個々の心筋細胞が大きくなる(肥大)します。そのため、心筋細胞でKLF5が重要と考えて、今度は心筋細胞だけでKLF5をノックアウトしたマウスを作り、同じようなTACを行いました。心筋細胞でKLF5が重要な働きを持っているのであれば、心筋肥大が抑制されるはずですが、期待に反して心筋肥大の程度はコントロールのマウスと差がありませんでした。
心筋細胞Klf5欠損
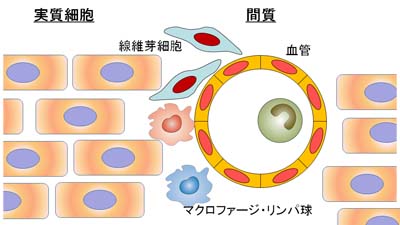
では、KLF5はどこで機能して、心筋肥大を制御しているのでしょうか?心筋(心臓の壁)は心筋細胞だけでできているのではありません。心筋細胞の間(間質)に、血管や、その他のいろいろな細胞が存在します。特に線維芽細胞は心筋中で心筋細胞についで数が多い細胞です。
心筋を構成する細胞
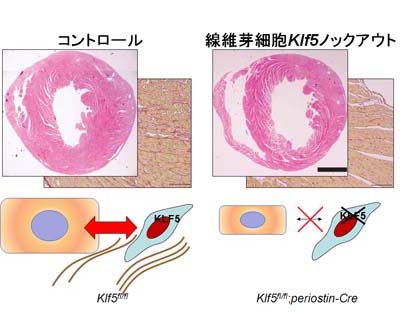
そこで、心臓線維芽細胞だけでKLF5を欠失するマウスを作り、TACを行いました。その結果は、線維化が抑制されるだけでなく心筋肥大も抑制されていました。そのメカニズムとしては、KLF5が線維芽細胞で心筋細胞を肥大させる働きを持つIGF-1等のパラクライン因子の産生を制御していることと考えられます。
線維芽細胞Klf5欠損は心肥大を抑制する
さらに重要なことに、圧負荷の程度を高くすると心臓線維芽細胞特異的なKLF5ノックアウトマウスでは心不全が生じてしまうことが分かりました。つまり、圧負荷というストレスに対して心臓が対応するためには、心筋細胞だけが働いているのではなく、心筋細胞と間質に存在する線維芽細胞や血管など多様な細胞が一緒になって対応していることが分かります。また、実質の細胞と間質に存在する細胞の相互作用は、炎症プロセスを進める原動力になります。実際、心筋の圧負荷への応答で認められる細胞の働きも炎症プロセスと捉えられる部分が多いようです。
②代謝疾患におけるKLF5 面白いことにKLF5ノックアウトマウスでは生後しばらく皮下脂肪 (白色脂肪組織)が薄く発達が悪い。この観察から、KLF5が脂肪細胞の分化を制御する転写因子ネットワークの重要な構成要素であることを見つけ出しました(Cell Metab. 2005;1:27-39)。心血管系の病気で重要な鍵分子として見つけ出したKLF5が代謝組織でも重要なことは驚きでした。私たちは、KLF5がさらに成体でも代謝ストレスに対する応答に重要であることを見いだしています。第3項でみるように肥満やメタボリックシンドロームを背景とする血管と代謝組織の変化には多くの共通点があります。私たちは、KLF5が血管と代謝組織の両方で機能して、メタボリックシンドロームにおいて血管と代謝組織の両方で同時に病気を進める重要な因子であると考えています。
血管と脂肪組織のKLF5
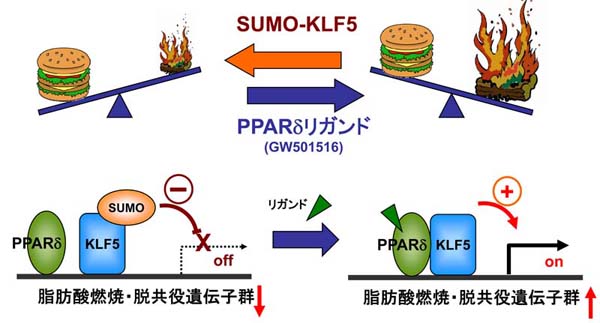
このアイデアを詳しく検討するために、私たちはKLF5ヘテロノックアウトマウスに高脂肪食負荷を与える実験をこないました。その結果、KLF5ヘテロノックアウトマウスはむしろえさをたくさん食べるのに太りにくく、メタボリックシンドロームを呈しにくいことを見つけ出しました(Nat Med)。このマウスでは基礎代謝が亢進しており、エネルギーを消費するために太りにくいと考えられます。このメカニズムについてさらに詳細に検討したところ、KLF5が骨格筋において脂肪酸燃焼や脱共役に関わる遺伝子群の発現を制御していることが分かりました。さらに、一種の翻訳後修飾であるSUMO化を受けたKLF5がこれらの遺伝子の発現を抑制すること、PPARdeltaリガンドの作用でSUMOが外れ、脱SUMO化したKLF5は今度は遺伝子の発現に必要であることが分かりました。つまり、KLF5のSUMO化が脂肪酸燃焼の分子スイッチのように働くことが分かりました。
KLF5は骨格筋脂肪燃焼の分子スイッチである
③慢性腎臓病におけるKLF5 慢性腎臓病(CKD)は、透析が必要な慢性腎不全の原因となるだけでなく、心不全や脳梗塞などの様々な生活習慣病のリスクとなるとともに、予後に大きく影響することが分かってきています。そのため、CKDのメカニズムを明らかにし、新たな予防法・治療法を開発することが強く求められています。疾病構造の変化に伴い、最近では透析の原因となる原疾患は、糖尿病や高血圧が増加しています。このようなCKD の原因疾患の変化とともに、その発症機序については慢性炎症が注目されるようになっています。尿細管間質領域の障害がfinal common pathwayとしてCKDの予後を規定する最重要な要因であることが知られていますが、尿細管間質領域の障害を生じる主要なメカニズムが慢性炎症で、線維化や尿細管の破壊などの組織構築のリモデリングを引き起こします
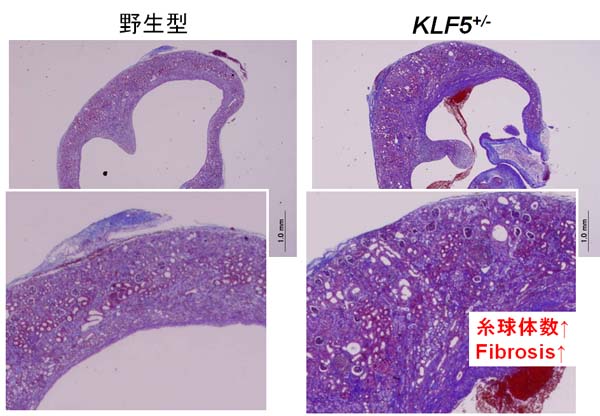
KLF5はマウスの腎臓では集合管上皮細胞だけに特異的に発現が認められました。KLF5ヘテロノックアウトマウス(Klf5+/-)にCKDのモデルである片側尿管結紮術(UUO)を施したところ、Klf5+/-で組織の破壊が著明に抑制されていました。ところが、線維化はなぜかむしろ増悪することが分かりました。
KLF5欠損による腎組織障害抑制
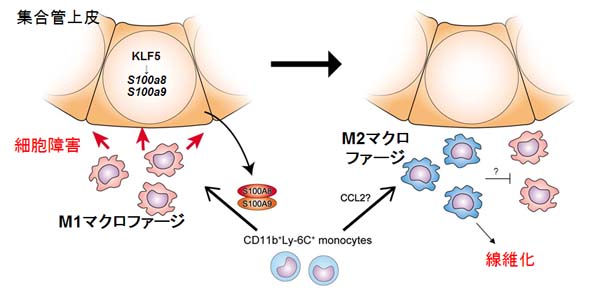
この分子機序を解析したところ、腎臓に障害が与えられると、集合管上皮でKLF5はS100A8とS100A9の発現を誘導すること、誘導されたS100A8/S100A9は腎臓にM1型マクロファージを集積させることが分かりました。M1型マクロファージは各種の炎症性サイトカインを分泌することによって、組織の破壊を進めるとともに、炎症を促進すると考えられます。時間がたつと、KLF5とS100の発現は低下し、マクロファージはM2型という性質を示すようになります。このM2型マクロファージは腎臓の線維化を進めることが分かりました。このように、集合管は腎臓の傷害に対する応答に必須であること、腎臓の病態を進める上で、マクロファージの機能(活性化の極性、polarity)の変化が重要であること、KLF5はこれらのプロセスを制御する鍵分子であることが明確となりました。
集合管上皮細胞のKLF5は初期炎症を制御する
このようにKLF5はメタボリックシンドローム、心血管病や慢性腎臓病で重要な働きをしているタンパクであることが明らかとなりました。
KLF5はこれらの疾患の治療法開発において魅力的な標的分子です。